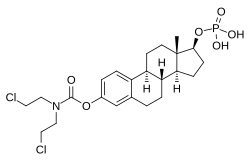
Эстрамустин фосфат - Estramustine phosphate
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Эмцит, Эстрацит |
| Другие имена | ЭМИ; Leo 299; NSC-89199; Ro 21-8837 / 001; Эстрадиол, нормустин фосфат; Эстрадиол 3-нормустин 17β-фосфат; Эстрадиол 3- (бис (2-хлорэтил) карбамат) 17β- (дигидрофосфат) |
| AHFS /Drugs.com | Монография |
| MedlinePlus | a608046 |
| Данные лицензии |
|
| Беременность категория |
|
| Маршруты администрация | Устно |
| Класс препарата | Химиотерапевтическое средство; Эстроген; Эстрогеновый эфир |
| Код УВД | |
| Легальное положение | |
| Легальное положение | |
| Фармакокинетический данные | |
| Биодоступность | 44–75% (как эстрамустин и эстромустин)[1] |
| Связывание с белками | • Эстрадиол: 98%[2] • Эстрон: 96%[2] |
| Метаболизм | Печень, кишечник[3][1][6] |
| Метаболиты | • Эстрамустин[3][1] • Эстромустин[3][1] • Эстрадиол[3][1] • Estrone[3][1] • Фосфорная кислота[3][1] • Нормюстин[4] |
| Устранение период полураспада | • EMP: 1,27 часа[5] • Эстромустин: 10–14 часов.[1] • Эстрон: 15–17 часов[1] |
| Экскреция | Желчь, кал (2.9–4.8%)[1][6] |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.023.193 |
| Химические и физические данные | |
| Формула | C23ЧАС32Cl2NО6п |
| Молярная масса | 520.38 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
Эстрамустин фосфат (EMP), также известен как эстрадиол нормустин фосфат и продается под торговыми марками Emcyt и Эстрацит, является двойным эстроген и химиотерапия лекарство, которое используется для лечения рак простаты у мужчин.[7][4][8][9][10][3][1][11][5][12] Принимается несколько раз в день устно или по инъекция в вену.[7][8][3][1][5][12]
Побочные эффекты EMP включают тошнота, рвота, гинекомастия, феминизация, демаскулинизация, сексуальная дисфункция, сгустки крови, и сердечно-сосудистый осложнения.[3][9][13] ЭМИ - двойная цитостатический и, следовательно химиотерапевтическое средство и гормональное противоопухолевое средство из эстроген тип.[1][3][14][5] Это пролекарство из эстрамустин и эстромустин с точки зрения его цитостатических эффектов и пролекарства эстрадиол в отношении его эстрогенный эффекты.[1][3] EMP оказывает сильное эстрогенное действие в типичных клинических дозировках и, следовательно, оказывает заметное антигонадотропный и функциональный антиандрогенный эффекты.[4][1][3][14]
EMP был введен для медицинского использования в начале 1970-х годов.[3] Он доступен в Соединенные Штаты, Канада, то объединенное Королевство, Другой Европейский странах и в других странах мира.[15][16]
Медицинское использование
EMP указывается в Соединенные Штаты, для паллиативное лечение из метастатический и / или прогрессирующий рак простаты,[6] тогда как в объединенное Королевство он показан для лечения неотзывчивых или рецидивирующий рак простаты.[17][5][1][10] Лекарство обычно предназначено для применения в случаях гормонорезистентного рака простаты, хотя его также использовали в качестве монотерапии первой линии.[3] Скорость отклика с ЭМИ при раке простаты считаются эквивалентными обычным высокие дозы эстрогена терапия.[18]
Из-за относительно серьезных побочных эффектов и токсичности EMP редко использовался при лечении рака простаты.[4] Это особенно актуально в западные страны сегодня.[4] В результате, а также из-за редких побочных эффектов модуляторы гонадотропин-рилизинг-гормона (Модуляторы GnRH) как лейпрорелин, От ЭМИ почти отказались.[3] Тем не менее, обнадеживающие результаты клинических исследований привели к возобновлению интереса к EMP для лечения рака простаты.[3]
EMP использовался в дозах от 140 до 1400 мг / день перорально.[19] Было обнаружено, что низкие дозы, такие как 280 мг / день, имеют сравнимую эффективность с более высокими дозами, но с улучшенным переносимость и пониженная токсичность.[4] Дозы 140 мг / день были описаны как очень низкие дозы.[20] EMP использовался в дозах от 240 до 450 мг / день внутривенно.[1]
ЭМП и другие эстрогены, такие как фосфат полиэстрадиола и этинилэстрадиол намного дешевле, чем более новые методы лечения, такие как модуляторы гонадолиберина, абиратерона ацетат, и энзалутамид.[4][21][22] Кроме того, эстрогены могут иметь значительные преимущества перед другими средствами андрогенная депривационная терапия, например, с точки зрения потеря костной массы и переломы, приливы, познание, и метаболический статус.[4][22]
ЭМИ использовался для предотвращения тестостерон вспышка в начале Агонист ГнРГ терапия у мужчин с раком простаты.[23]
| Маршрут / форма | Эстроген | Дозировка | |
|---|---|---|---|
| Устный | Эстрадиол | 1-2 мг 3 раза в день | |
| Конъюгированные эстрогены | 1,25–2,5 мг 3 раза в день | ||
| Этинилэстрадиол | 0,15–3 мг / день | ||
| Сульфонат этинилэстрадиола | 1-2 мг 1 раз в неделю | ||
| Диэтилстильбестрол | 1–3 мг / день | ||
| Диенестрол | 5 мг / день | ||
| Гексэстрол | 5 мг / день | ||
| Фосфестрол | 100–480 мг 1–3 раза в день | ||
| Хлортрианизен | 12–48 мг / день | ||
| Квадросилан | 900 мг / день | ||
| Эстрамустин фосфат | 140–1400 мг / день | ||
| Трансдермальный пластырь | Эстрадиол | 2–6x 100 мкг / день Мошонка: 1x 100 мкг / день | |
| Я или SC инъекция | Бензоат эстрадиола | 1,66 мг 3 раза в неделю | |
| Дипропионат эстрадиола | 5 мг 1 раз в неделю | ||
| Эстрадиола валерат | 10-40 мг 1 раз в 1-2 недели | ||
| Эстрадиола ундецилат | 100 мг 1 раз в 4 недели | ||
| Полиэстрадиолфосфат | Один: 160–320 мг 1 раз в 4 недели С устным EE: 40–80 мг 1 раз в 4 недели | ||
| Estrone | 2–4 мг 2–3 раза в неделю | ||
| IV инъекция | Фосфестрол | 300–1200 мг 1–7 раз в неделю | |
| Эстрамустин фосфат | 240–450 мг / день | ||
| Заметка: Дозировки не обязательно эквивалентны. Источники: См. Шаблон. | |||
Доступные формы
EMP доступен или был доступен в форме обоих капсулы (140 мг, 280 мг) для пероральное введение и водные растворы (300 мг) для внутривенная инъекция.[19][24][25][7]
Противопоказания
ЭМИ противопоказан при применении у детей, пациентов сверхчувствительный к эстрогенам или азотные горчицы, те, у кого язвенная болезнь (ан язва в пищеварительный тракт ), с тяжелыми нарушение функции печени, со слабым сердце мышца (также известен как миокардиальная недостаточность ) и те, у кого тромбоэмболические расстройства или осложнения, связанные с задержка жидкости.[17]
Побочные эффекты
В побочные эффекты ЭМИ в целом были описаны как относительно тяжелые.[3] Сообщалось, что наиболее частыми побочными эффектами ЭМИ являются: желудочно-кишечный побочные эффекты, такие как тошнота, рвота, и понос, с тошнотой и рвотой у 40% мужчин.[9][1] Они обычно бывают легкой или средней степени тяжести, а тошноту и рвоту можно контролировать с помощью профилактический противорвотное средство лекарства.[9] Тем не менее, в тяжелых случаях побочных эффектов со стороны желудочно-кишечного тракта при приеме ЭМИ может потребоваться снижение дозы или прекращение терапии.[1] Хотя сообщалось, что тошнота и рвота являются наиболее частыми побочными эффектами ЭМИ, гинекомастия (развитие мужской груди) было обнаружено у 83% мужчин, получавших ЭМП, а частота Эректильная дисфункция возможно, подобен или немного меньше, чем риск гинекомастии.[3] Как правило, феминизация, а гиноидное распределение жира, демаскулинизация, а импотенция встречается практически или почти у 100% мужчин, лечившихся высокие дозы эстрогена терапия.[13][26] Уменьшено сексуальная активность также сообщалось о мужчинах, получавших EMP.[1] Эти побочные эффекты связаны с высоким эстроген уровни и низкие тестостерон уровни.[1][3] Профилактическое облучение из грудь может использоваться для снижения частоты и тяжести гинекомастии с помощью эстрогенов.[13]
К серьезным побочным эффектам ЭМИ относятся: тромбоэмболический и сердечно-сосудистый осложнения, включая легочная эмболия, тромбоз глубоких вен, Инсульт, тромбофлебит, ишемическая болезнь сердца (ишемическая болезнь сердца; например, инфаркт миокарда ), тромбофлебит, и хроническая сердечная недостаточность с задержка жидкости.[9][1] ЭМИ вызывает сердечно-сосудистую токсичность аналогично диэтилстильбестрол, но в меньшей степени по сравнению с низкими дозами (например, 280 мг / день перорального ЭМП против 1 мг / день перорального диэтилстильбестрола).[3][27] Состояние рака простаты также увеличивает риск тромбоэмболии и сочетания с доцетаксел может также увеличить риск тромбоэмболии.[9] Мета-анализ из клинические испытания обнаружили, что общий риск тромбоэмболии при ЭМП составляет от 4 до 7% по сравнению с 0,4% для схем химиотерапии без ЭМП.[9] Тромбоэмболия - главный токсичность -связанная причина прекращение ЭМИ.[28] Антикоагулянт терапия лекарствами, такими как аспирин, варфарин, нефракционированные и низко-молекулярный вес гепарин, и антагонисты витамина К может быть полезно для снижения риска тромбоэмболии с помощью EMP и других эстрогенов, таких как диэтилстильбестрол и этинилэстрадиол.[9][29][4]
Неблагоприятный функциональные пробы печени обычно наблюдаются при ЭМИ, но тяжелые нарушение функции печени редко с лекарством.[1] Центральная нервная система побочные эффекты редко наблюдаются при ЭМИ, хотя увеличенные желудочки и нейронный пигментация сообщалось о обезьянах, получавших очень высокие дозы ЭМП (20–140 мг / кг / день) в течение 3–6 месяцев.[1] EMP не оказывает цитостатических эффектов в норме. мозг ткань.[1] У женщин, получавших EMP в клинических исследованиях, несколько случаев незначительного гинекологический кровоизлияния наблюдались.[1] ЭМП описывается как относительно хорошо переносимая цитостатическими противоопухолевыми препаратами и азотно-ипритными агентами, редко или совсем не ассоциируется со значительными гематологический токсичность такие как миелосупрессия (подавление костного мозга), желудочно-кишечная токсичность или другая более выраженная токсичность, связанная с такими агентами.[5][1][30] В отличие от большинства других цитостатиков, которые часто вызывают миелосупрессию, лейкопения (уменьшено лейкоцит count), и нейтропения (уменьшено нейтрофил count), EMP фактически производит лейкоцитоз (увеличение количества лейкоцитов) в качестве побочного эффекта.[31][32]
В небольшом исследовании низких доз с использованием 280 мг / день перорального ЭМП в течение 150 дней переносимость была значительно улучшена с желудочно-кишечным трактом. раздражение встречается только у 15% мужчин, и случаев тяжелой сердечно-сосудистой токсичности или тромбоза глубоких вен не было.[3][4] Кроме того, нет других побочных эффектов, кроме незначительных преходящих повышенные ферменты печени наблюдались.[3] Эти данные позволяют предположить, что более низкие дозы перорального ЭМП могут быть более безопасным вариантом, чем более высокие дозы для лечения рака простаты.[4]
Передозировка
Клинического опыта применения передозировка ЭМИ.[7] Передозировка EMP может привести к выраженным проявлениям известных побочных эффектов лекарства.[7] Нет конкретного противоядие при передозировке ЭМИ.[17] В случае передозировки промывание желудка следует использовать для эвакуации содержимого желудка по мере необходимости, и лечение должно быть симптом основанная и поддерживающая.[7][17] В случае опасно низкого количества красные кровяные клетки, белые кровяные клетки, или тромбоциты, цельная кровь может быть предоставлен по мере необходимости.[17] Печень Функцию следует контролировать при передозировке ЭМИ.[17] После передозировки ЭМИ гематологический и печеночный параметры следует продолжать контролировать не менее 6 недель.[7]
EMP использовался в высоких дозах до 1260 мг / день. устный маршрут и от 240 до 450 мг / день путем внутривенная инъекция.[3][1]
Взаимодействия
Сообщается, что EMP увеличивает эффективность и токсичность из трициклические антидепрессанты подобно амитриптилин и имипрамин.[17] Когда продукты, содержащие кальций, алюминий, и / или магний, такие как молочные продукты подобно молоко, различный еда пищевые добавки, и антациды, потребляются одновременно с ЭМИ, нерастворимый хелатный комплекс /фосфат поваренная соль между EMP и этими металлы могут образоваться, и это может заметно ухудшить поглощение и, следовательно устный биодоступность ЭМИ.[3][1][17] Может быть повышенный риск ангионевротический отек в тех, кто одновременно принимает Ингибиторы АПФ.[17]
Фармакология
Фармакодинамика
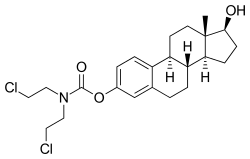

ЭМИ, также известный как фосфат эстрадиола и нормустина, представляет собой комбинированный эфир эстрогена и азотный иприт сложный эфир.[1][3][14] Это состоит из эстрадиол, эстроген, связанный с фосфат сложный эфир, а также сложный эфир Normustine азотная горчица.[1][3][14] Что касается его фармакодинамический эффекты, EMP - это пролекарство из эстрамустин, эстромустин, и эстрадиол.[1][3] Как пролекарство эстрадиола, EMP является эстрогеном и, следовательно, агонист из рецепторы эстрогена.[1][2] Сам ЭМИ имеет только очень слабый близость для рецепторов эстрогена.[1] Лекарство примерно на 91% выше молекулярный вес чем эстрадиол, из-за присутствия в нем C3 нормустина и сложных фосфатных эфиров C17β.[33][15] Поскольку EMP является пролекарством эстрадиола, его можно рассматривать как естественный и биоидентичный форма эстрогена,[14] хотя он обладает дополнительной цитостатической активностью за счет эстрамустина и эстромустина.[1][3]
ЭМИ действует двойным механизм действия: 1) прямая цитостатическая активность посредством ряда действий; и 2) как форма высокие дозы эстрогена терапия через рецептор эстрогена антигонадотропный и функциональный антиандрогенный эффекты.[1][3][14] Антигонадотропный и функциональный антиандрогенный эффекты ЭМИ заключаются в сильном подавлении гонадный андроген производство и, следовательно, уровни циркулирующих андрогенов, таких как тестостерон; значительно увеличился уровень глобулин, связывающий половые гормоны и, следовательно, уменьшенная доля свободных андрогенов в обращение; и прямое антиандрогенное действие на клетки простаты.[30][1][3][4][34][35][36] Индекс свободных андрогенов при пероральном ЭМП оказался в среднем в 4,6 раза ниже, чем при пероральном приеме ЭМИ. орхиэктомия.[35] Таким образом, терапия ЭМИ приводит к значительно более сильному андрогенная депривация чем орхиэктомия.[36] Метаболиты EMP, включая эстрамустин, эстромустин, эстрадиол и эстрон, было обнаружено, что они действуют как слабые антагонисты из рецептор андрогенов (ЕС50 = 0,5–3,1 мкМ), хотя клиническое значение этого неизвестно.[37][34][3][1]
Во время терапии ЭМП наблюдаются чрезвычайно высокие уровни эстрадиола и эстрона.[3][4] Эстрогенный метаболиты ЭМИ несут ответственность за его наиболее частые побочные эффекты и сердечно-сосудистый токсичность.[1] В некоторых публикациях ЭМП описывается как имеющий относительно слабый эстрогенный эффект.[5][30] Тем не менее, он показал, по существу, те же показатели и степень эстрогенных эффектов, таких как болезненность молочных желез, гинекомастия, сердечно-сосудистая токсичность, изменения синтез белка в печени, и подавление тестостерона, как высокие дозы диэтилстильбестрол и этинилэстрадиол в клинических исследованиях.[7][4][30][36][38] Представление о том, что ЭМП имеет относительно слабую активность эстрогена, могло быть основано на исследования на животных, которые обнаружили, что EMP имеет в 100 раз меньше утеротрофный эффекты, чем эстрадиол у крыс, и, возможно, также не принимали во внимание очень высокие дозы EMP, используемые клинически у людей.[38][39]
Механизм действия цитостатический Эффекты ЭМИ сложны и изучены лишь частично.[1] ЭМИ считается в основном митотический ингибитор, ингибирующие механизмы, участвующие в митоз фаза клеточный цикл.[1][4] В частности, он привязан к белки, ассоциированные с микротрубочками и / или в тубулин и производит деполимеризация из микротрубочки (Kd = 10–20 мкМ для эстрамустина), что приводит к остановке деление клеток в г2/ M фаза (в частности метафаза ).[1][4][40] Первоначально считалось, что EMP опосредует его цитостатические эффекты как пролекарство Normustine, а азотный иприт, и поэтому считалось алкилирующий противоопухолевый агент.[3][10][5][14] Однако последующие исследования показали, что EMP лишен алкилирующего действия и что влияние EMP на микротрубочки опосредуется интактным эстрамустином и эстромустином, при этом только нормустин или эстрадиол имеют лишь незначительные или незначительные эффекты.[1][3][41] Таким образом, уникальные свойства эстрамустина и эстромустина структуры, содержащий карбамат -сложный эфир связь, по-видимому, ответственны за цитостатические эффекты EMP.[1] В дополнение к антимитотическому действию, EMP также вызывает другие цитостатические эффекты, включая индукцию апоптоз, вмешательство в Синтез ДНК, ядерная матрица взаимодействие, клеточная мембрана изменения, индукция активные формы кислорода (свободные кислородные радикалы) и, возможно, дополнительные механизмы.[1][4] Было обнаружено, что ЭМИ радиосенсибилизирующий эффект при раке простаты и глиома клетки, улучшающие чувствительность к радиационная терапия также.[1]
Цитостатические метаболиты ЭМП накапливаются в ткани в селективный образом, например в рак простаты клетки.[5][1][4] Это может быть связано с наличием специфического белка, связывающего эстрамустин (EMBP) (Kd = 10–35 нМ для эстрамустина), также известного как простатин или белок секрета простаты (PSP), который был обнаружен при раке простаты, глиома, меланома, и рак молочной железы клетки.[1][4][42] Считается, что из-за своей тканевой селективности EMP оказывает минимальное цитостатическое действие в здоровых тканях, и его тканевая селективность может быть ответственной за его терапевтическую цитостатическую эффективность против клеток рака простаты.[5][4][1]
Первоначально EMP был разработан как пролекарство на основе двойного эфира эстрогена и нормустина в качестве противоопухолевого средства, алкилирующего азотистый иприт, которое из-за сродства к эстрогену часть для рецепторов эстрогена, будут выборочно накапливаться в тканях-мишенях эстрогена и, следовательно, положительны по рецепторам эстрогена опухоль клетки.[4][14][2] Следовательно, считалось, что EMP будет предпочтительно доставлять алкилирующую нормустиновую часть к этим тканям, что позволяет снизить цитостатические эффекты в здоровых тканях и, следовательно, улучшить эффективность и переносимость.[4] Однако последующие исследования показали, что существует очень ограниченный и медленный расщепление сложного эфира нормустина, и этот ЭМП лишен алкилирующей активности.[4][1][3][30] Кроме того, оказывается, что эстрамустин и эстрромустин могут преимущественно накапливаться в тканях-мишенях эстрогена не из-за сродства к рецепторам эстрогена, а из-за сродства к отдельным EMBP.[1][3]
Экстремально высокий, беременность -подобные уровни эстрадиола могут быть ответственны за лейкоцитоз (повысился лейкоцит count), что наблюдается у лиц, получавших EMP.[31][32] Этот побочный эффект отличается от большинства других цитотоксических агентов, которые вместо этого вызывают миелосупрессия (Костный мозг подавление), лейкопения (снижение количества лейкоцитов) и нейтропения (уменьшено нейтрофил считать).[нужна цитата ]
Антигонадотропные эффекты
Было обнаружено, что ЭМП в дозе 280 мг / день снижает уровень тестостерона у мужчин до кастрировать диапазон (до 30 нг / дл) в течение 20 дней и диапазон низкого кастрата (до 10 нг / дл) в течение 30 дней.[3] Точно так же доза EMP в 70 мг / день подавляла уровни тестостерона до кастрированного диапазона в течение 4 недель.[3]
Фармакокинетика
| Параметр | IV 300 мг | Перорально 420 мг |
|---|---|---|
| CМаксимум | 506 ± 61 нг / мл | 362 ± 38 нг / мл |
| ТМаксимум | 2,6 ± 0,4 часа | 2,2 ± 0,2 часа |
| т1/2 | 10,3 ± 0,95 часов | 13,6 ± 3,09 часов |
| AUC0–32 | 4.82 ± 0.62 | 2.88 ± 0.34 |
| Биодоступность | 100.0% | 43.7% ± 4.6% |
| Источники: [30] | ||
| Метаболит | Плазма | Соотношение |
|---|---|---|
| Эстрамустин | 20 000–23 000 пг / мл | 1:9.6–9.8 |
| Эстромустин | 191 000–267 000 пг / мл | |
| Эстрадиол | 4 900–9 000 пг / мл | 1:9.4–11.8 |
| Estrone | 71 000–85 000 пг / мл | |
| Источники: [30] | ||
На пероральный прием, ЭМИ быстро и полностью дефосфорилированный к фосфатазы в эстрамустин вовремя первый проход в желудочно-кишечный тракт.[1][4][5][43] Эстрамустин также частично, но значительно окисленный в эстромустин к 17β-гидроксистероид дегидрогеназы во время первого прохода.[5][1][12][44] Таким образом, ЭМИ достигает обращение как эстрамустин и эстромустин, и основной метаболит ЭМП - это эстромустин.[1][12] Ограниченное количество примерно от 10 до 15% эстрамустина и эстромустина дополнительно медленно вводится. метаболизируется через гидролиз из Normustine сложный эфир в эстрадиол и эстрон соответственно.[1][4][30] Этот реакция считается катализированный к карбамидазы, Хотя гены кодирующие ответственные ферменты не охарактеризованы.[1][45][46] Уровни циркулирующего нормустина, образованного из EMP, незначительны.[41][47] Релиз азотный иприт газ от нормустина через расщепление карбоновая кислота группа не было продемонстрировано и, похоже, не происходит.[40][30]
Устный биодоступность ЭМИ низкий, что связано с глубоким метаболизмом первого прохождения; в частности, дефосфорилирование EMP.[1] Биодоступность ЭМП при пероральном приеме, в частности, в виде эстрамустина и эстромустина, составляет от 44 до 75%, что свидетельствует о поглощение может быть неполным.[1] В любом случае существует линейная зависимость между пероральной дозой EMP и циркулирующими уровнями эстрамустина и эстрромустина.[1] Потребление кальций, алюминий, или магний при пероральном приеме ЭМП может заметно ухудшить его биодоступность из-за уменьшения поглощение из кишечника, и это может повлиять на его терапевтическую эффективность в низких дозах.[3][17]
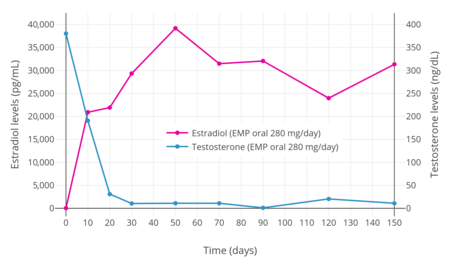
После однократного перорального приема 420 мг ЭМП у мужчин с раком простаты максимальный уровни эстромустина составляли от 310 до 475 нг / мл (475 000 пг / мл) и наблюдались через 2–3 часа.[1] Было обнаружено, что уровни эстрадиола при пероральном приеме ЭМИ в дозе 280 мг / день повышаются до очень высоких концентраций в течение одной недели терапии.[3] В одном исследовании уровни эстрадиола превышали 20 000 пг / мл через 10 дней, составляли около 30 000 пг / мл через 30 дней и достигли пика примерно 40 000 пг / мл через 50 дней.[3] Другое исследование показало более низкие уровни эстрадиола от 4900 до 9000 пг / мл во время хронической терапии пероральным приемом ЭМИ 560 мг / день.[30] Дополнительное исследование показало, что уровни эстрадиола составляют около 17000 пг / мл при пероральном приеме ЭМП 140 мг / день и 38000 пг / мл при пероральном приеме 280 мг / мл.[нужна цитата ] Сообщалось, что циркулирующие уровни эстрадиола и эстрона во время терапии ЭМП превышают нормальные уровни у мужчин более чем в 100 и 1000 раз соответственно.[4][30] Уровни эстрамустина и эстрадиола в кровотоке заметно ниже, чем у эстромустина и эстрона, соответственно, с соотношением примерно 1:10 в обоих случаях.[1][30] Тем не менее, уровни эстрадиола во время терапии ЭМП, по-видимому, аналогичны тем, которые наблюдаются в середине или в конце. беременность, которые варьируются от 5000 до 40000 пг / мл.[48] При пероральном приеме в кровотоке не наблюдается неизмененного ЭМИ.[1]
В фармакокинетика EMP отличаются от внутривенная инъекция.[1] После однократной внутривенной инъекции 300 мг EMP уровни EMP были выше, чем уровни его метаболитов в течение первых 8 часов.[1] Вероятно, это происходит из-за обхода метаболизма первого прохождения.[1] Однако через 24 часа после введения дозы неизмененный EMP больше не обнаруживался в кровотоке.[1] В оформление ЭМИ от плазма крови составляет 4,85 ± 0,684 л / ч.[1] В объемы распространения ЭМИ при внутривенном введении были небольшими; в модели с двумя отсеками объем распределения для центрального отсека составлял 0,043 л / кг, а для периферийного отсека составлял 0,11 л / кг.[1] В связывание с белками плазмы ЭМИ высока.[1] Эстрамустин накапливается в опухоль ткань, например рак простаты и глиома ткани, причем уровни эстрамустина в этих тканях намного выше, чем в плазме (например, в 6,3 и 15,9 раза, соответственно).[1] Напротив, уровни эстромустина в опухоли по сравнению с плазмой аналогичны (1,0 и 0,5 раза, соответственно).[1] Эстрамустин и эстромустин накапливаются в жировая ткань.[1]
В период полувыведения Эстромустина при пероральном приеме ЭМП составляло в среднем 13,6 часа с диапазоном от 8,8 до 22,7 часа.[1] Напротив, период полувыведения эстромустина при внутривенной инъекции составлял 10,3 часа с диапазоном от 7,36 до 12,3 часа.[1] Для сравнения, соответствующие периоды полувыведения эстрона составляли 16,5 и 14,7 часа для перорального и внутривенного введения, соответственно.[1] Эстрамустин и эстромустин в основном являются выделенный в желчь и, следовательно, в кал.[1][30] Считается, что они не выводятся из организма моча.[1]
Химия
EMP, также известный как эстрадиол-3-нормустин 17β-фосфат или как эстрадиол-3- (бис (2-хлорэтил) карбамат) 17β- (дигидрофосфат), представляет собой синтетический эстран стероидный препарат и производная из эстрадиол.[33][15] Это эфир эстрогена; в частности, EMP - это диэфир эстрадиола с C3 Normustine (азотный иприт –карбамат часть ) сложный эфир и C17β фосфат сложный эфир.[33][15] EMP предоставляется как натрий или меглумин поваренная соль.[33][15][24] EMP похож на соединение с другими эфиры эстрадиола такие как эстрадиол сульфат и эстрадиола валерат, но отличается наличием азотсодержащей части сложного эфира иприта.[33][15] Противоопухолевые средства связанных с EMP, хотя ни один из них не продавался, включают алестрамустин, атримустин, цитестрол ацетат, эстрадиол горчица, ICI-85966, и фенестрол.[33][15]
Из-за своего гидрофильный фрагмент сложного фосфатного эфира, EMP представляет собой легко вода соединение.[49][50][51] Это отличается от большинства других эфиров эстрадиола, которые жирная кислота сложные эфиры и липофильный соединения, которые не особо растворимый в воды.[2] В отличие от EMP, эстрамустин обладает высокой липофильностью, практически не растворим в воде и не являетсяионизируемый.[19] Фосфатный эфир EMP был включен в молекулу, чтобы увеличить ее растворимость в воде и позволить внутривенное введение.[7]
| Эстроген | Структура | Сложный эфир (ы) | Родственник мол. масса | Родственник E2 содержаниеб | logPc | ||||
|---|---|---|---|---|---|---|---|---|---|
| Должность (я) | Moiet (ы) | Тип | Длинаа | ||||||
| Эстрадиол | – | – | – | – | 1.00 | 1.00 | 4.0 | ||
| Эстрадиола ацетат | C3 | Этановая кислота | Жирная кислота с прямой цепью | 2 | 1.15 | 0.87 | 4.2 | ||
| Бензоат эстрадиола | C3 | Бензолкарбоновая кислота | Ароматическая жирная кислота | – (~4–5) | 1.38 | 0.72 | 4.7 | ||
| Дипропионат эстрадиола | C3, C17β | Пропановая кислота (×2) | Жирная кислота с прямой цепью | 3 (×2) | 1.41 | 0.71 | 4.9 | ||
| Эстрадиола валерат | C17β | Пентановая кислота | Жирная кислота с прямой цепью | 5 | 1.31 | 0.76 | 5.6–6.3 | ||
| Бутират бензоата эстрадиола | C3, C17β | Бензойная кислота, Масляная кислота | Смешанная жирная кислота | – (~6, 2) | 1.64 | 0.61 | 6.3 | ||
| Эстрадиола ципионат | C17β | Циклопентилпропановая кислота | Ароматическая жирная кислота | – (~6) | 1.46 | 0.69 | 6.9 | ||
| Эстрадиол энантат | C17β | Гептановая кислота | Жирная кислота с прямой цепью | 7 | 1.41 | 0.71 | 6.7–7.3 | ||
| Эстрадиола диенантат | C3, C17β | Гептановая кислота (×2) | Жирная кислота с прямой цепью | 7 (×2) | 1.82 | 0.55 | 8.1–10.4 | ||
| Эстрадиола ундецилат | C17β | Ундекановая кислота | Жирная кислота с прямой цепью | 11 | 1.62 | 0.62 | 9.2–9.8 | ||
| Стеарат эстрадиола | C17β | Октадекановая кислота | Жирная кислота с прямой цепью | 18 | 1.98 | 0.51 | 12.2–12.4 | ||
| Дистеарат эстрадиола | C3, C17β | Октадекановая кислота (×2) | Жирная кислота с прямой цепью | 18 (×2) | 2.96 | 0.34 | 20.2 | ||
| Эстрадиола сульфат | C3 | Серная кислота | Водорастворимый конъюгат | – | 1.29 | 0.77 | 0.3–3.8 | ||
| Эстрадиол глюкуронид | C17β | Глюкуроновая кислота | Водорастворимый конъюгат | – | 1.65 | 0.61 | 2.1–2.7 | ||
| Эстрамустин фосфатd | C3, C17β | Нормюстин, фосфорная кислота | Водорастворимый конъюгат | – | 1.91 | 0.52 | 2.9–5.0 | ||
| Полиэстрадиолфосфате | C3 – C17β | Фосфорная кислота | Водорастворимый конъюгат | – | 1.23ж | 0.81ж | 2.9г | ||
| Сноски: а = Длина сложный эфир в углерод атомы за жирные кислоты с прямой цепью или приблизительная длина сложного эфира в атомах углерода для ароматические жирные кислоты. б = Относительное содержание эстрадиола по весу (т. Е. Относительное эстрогенный воздействие). c = Экспериментальный или прогнозируемый коэффициент разделения октанол / вода (т.е. липофильность /гидрофобность ). Полученное из PubChem, ChemSpider, и DrugBank. d = Также известен как эстрадиол нормустин фосфат. е = Полимер из эстрадиолфосфат (~13 повторять единицы ). ж = Относительная молекулярная масса или содержание эстрадиола на повторяющуюся единицу. г = logP повторяющейся единицы (т. е. эстрадиолфосфата). Источники: Смотрите отдельные статьи. | |||||||||
История
EMP был первым синтезированный в середине 1960-х и был запатентованный в 1967 г.[40] Первоначально он был разработан для лечения рак молочной железы.[1] Идея EMP была вдохновлена поглощением и накоплением радиоактивно меченый эстрогены в ткани рака груди.[1] Однако первоначальные клинические результаты ЭМП у женщин с раком груди были неутешительными.[1] Впоследствии было обнаружено, что радиоактивно меченый EMP поглощается и накапливается в крысах. простата, и это открытие привело к тому, что лекарство было перепрофилировано для лечения рак простаты.[1][3] EMP был введен для медицинского использования при лечении этого состояния в начале 1970-х годов и был одобрен в Соединенные Штаты по этому показанию в 1981 г.[1][3][52] Первоначально EMP использовался для внутривенных инъекций.[30] Впоследствии был введен пероральный препарат, а от внутривенного препарата почти отказались в пользу перорального варианта.[30]
Общество и культура
Родовые имена
EMP предоставляется как натрий поваренная соль за пероральное введение, который имеет общие имена эстрамустин фосфат натрия (USAN ) и эстрамустин фосфат натрия (БАНМ, ЯНВАРЬ ), а как меглумин соль для внутривенное введение, имеющий общее название эстрамустин фосфат меглумин.[24][33][15][53][16] В INNM является эстрамустин фосфат.[33] Название эстрамустин фосфат является сокращением эстрадиол нормустин фосфат.[33][16] EMP также известен под его бывшими кодовыми названиями развития. Лев 299, Ro 21-8837, и Ro 21-8837 / 001.[33][15][16]
Фирменные наименования
EMP чаще всего продается под торговыми марками Estracyt и Emcyt, но также продается под рядом других торговых марок, включая Amsupros, Biasetyl, Cellmustin, Estramustin HEXAL, Estramustina Filaxis, Estranovag, Multosin, Multosin Injekt, Proesta, Prostamustin, и Сулопрост.[15][16][24]
Доступность
EMP продается в Соединенные Штаты,[54] Канада, и Мексика под торговой маркой Emcyt, тогда как лекарство продается под торговой маркой Estracyt в объединенное Королевство и повсюду Европа а также в Аргентина, Чили, и Гонконг.[15] Он был прекращен в ряде стран, в том числе Австралия, Бразилия, Ирландия, и Норвегия.[55]
Исследование
ЭМИ изучался при лечении других раки такие как глиома и рак молочной железы.[1] Было обнаружено небольшое улучшение качество жизни у людей с глиомой в течение первых 3 месяцев терапии.[1]
использованная литература
- ^ а б c d е ж г час я j k л м п о п q р s т ты v ш Икс у z аа ab ac объявление ае аф аг ах ай эй ак аль я ан ао ap водный ар так как в au средний ау топор ай az ба bb до н.э bd быть парень bg бх би Ъ bk бл бм млрд бо бп бк br bs bt бу bv чб bx к bz ок cb cc компакт диск ce ср cg Bergenheim AT, Henriksson R (февраль 1998 г.). «Фармакокинетика и фармакодинамика эстрамустинфосфата». Клин Фармакокинет. 34 (2): 163–72. Дои:10.2165/00003088-199834020-00004. PMID 9515186.
- ^ а б c d е Kuhl H (2005). «Фармакология эстрогенов и прогестагенов: влияние разных путей введения» (PDF). Климактерический. 8 Дополнение 1: 3–63. Дои:10.1080/13697130500148875. PMID 16112947.
- ^ а б c d е ж г час я j k л м п о п q р s т ты v ш Икс у z аа ab ac объявление ае аф аг ах ай эй ак аль я ан ао ap водный ар Китамура Т. (февраль 2001 г.). «Необходимость переоценки эстрамустинфосфата натрия (EMP) как варианта лечения для монотерапии первой линии при распространенном раке простаты». Int. Дж. Урол. 8 (2): 33–6. Дои:10.1046 / j.1442-2042.2001.00254.x. PMID 11240822.
- ^ а б c d е ж г час я j k л м п о п q р s т ты v ш Икс у z Иноуэ, Такахиро (2018). «Роль эстрамустинфосфата и других эстрогенов в резистентном к кастрации раке простаты»: 249–256. Дои:10.1007/978-981-10-7013-6_26. Цитировать журнал требует
| журнал =(Помогите) - ^ а б c d е ж г час я j k л м Перри С.М., Мактавиш Д. (июль 1995 г.). «Эстрамустин фосфат натрия. Обзор его фармакодинамических и фармакокинетических свойств, а также терапевтическая эффективность при раке простаты». Лекарства от старения. 7 (1): 49–74. Дои:10.2165/00002512-199507010-00006. PMID 7579781.
- ^ а б c «Дозировка эмцита (эстрамустина), показания, взаимодействия, побочные эффекты и многое другое». Ссылка на Medscape. WebMD. Получено 8 февраля 2014.
- ^ а б c d е ж г час я j https://www.accessdata.fda.gov/drugsatfda_docs/label/2008/018045s023lbl.pdf
- ^ а б Цинь З, Ли Х, Чжан Дж, Тан Дж, Хан П, Сюй З, Ю И, Ян Ц, Ван С, Сюй Т, Сюй З, Цзоу Цзюй (сентябрь 2016 г.). «Химиотерапия с эстрамустином или без него для лечения устойчивого к кастрации рака простаты: систематический обзор и метаанализ». Медицина (Балтимор). 95 (39): e4801. Дои:10.1097 / MD.0000000000004801. ЧВК 5265899. PMID 27684806.
- ^ а б c d е ж г час Равери В., Физази К., Удар С., Друэ Л., Эймар Дж. К., Кулин С., Гравис Дж., Хеннекен С., Зербиб М. (декабрь 2011 г.). «Использование эстрамустинфосфата в современном лечении рака простаты на поздних стадиях». BJU Int. 108 (11): 1782–6. Дои:10.1111 / j.1464-410X.2011.10201.x. PMID 21756277.
- ^ а б c Симпсон, Д.; Вагстафф, AJ (2003). «Эстрамустин фосфат натрия». Американский журнал рака. 2 (5): 373–390. Дои:10.2165/00024669-200302050-00013.
- ^ Худес Г. (февраль 1997 г.). «Химиотерапия на основе эстрамустина». Семин. Урол. Онкол. 15 (1): 13–9. PMID 9050135.
- ^ а б c d Крейс В. (1995). «Возвращение к эстрамустину». Лечение рака. Res. 78: 163–84. Дои:10.1007/978-1-4615-2007-8_8. PMID 8595142.
- ^ а б c Гэлбрейт С.М., Дюшен Г.М. (апрель 1997 г.). «Андрогены и рак простаты: биология, патология и гормональная терапия». Евро. J. Рак. 33 (4): 545–54. Дои:10.1016 / S0959-8049 (96) 00444-3. PMID 9274433.
- ^ а б c d е ж г час Майкл Эттель; Эккехард Шиллингер (6 декабря 2012 г.). Эстрогены и антиэстрогены II: фармакология и клиническое применение эстрогенов и антиэстрогенов. Springer Science & Business Media. С. 540–. ISBN 978-3-642-60107-1.
- ^ а б c d е ж г час я j k Index Nominum 2000: Международный справочник лекарственных средств. Тейлор и Фрэнсис. Январь 2000. С. 406–407. ISBN 978-3-88763-075-1.
- ^ а б c d е https://www.drugs.com/international/estramustine.html
- ^ а б c d е ж г час я j «Капсулы с эстрацитом - Сводка характеристик продукта (SPC)». электронный сборник лекарств. Pfizer Limited. 12 августа 2013 г.. Получено 8 февраля 2014.
- ^ Аурел Лупулеску (24 октября 1990 г.). Гормоны и витамины при лечении рака. CRC Press. С. 40–. ISBN 978-0-8493-5973-6.
- ^ а б c Валентино Стелла; Рональд Борчардт; Майкл Хагеман; Реза Олияи, Ханс Мааг, Джефферсон Тилли (12 марта 2007 г.). Пролекарства: проблемы и награды. Springer Science & Business Media. С. 174–. ISBN 978-0-387-49782-2.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Китамура Т., Сузуки М., Нисимацу Х., Куросаки Т, Эномото Y, Фукухара Х., Куме Х., Такеучи Т, Мяо Л., Цзянган Х., Сяоцян Л. (январь 2010 г.). «Окончательный отчет о монотерапии низкими дозами эстрамустинфосфата (EMP) и терапии очень низкими дозами EMP в сочетании с агонистом LH-RH для ранее нелеченного распространенного рака простаты». Aktuelle Urologie. 41 Приложение 1: S34–40. Дои:10.1055 / с-0029-1224657. PMID 20094950.
- ^ Sayed Y, Taxel P (2003). «Применение терапии эстрогенами у мужчин». Curr Opin Pharmacol. 3 (6): 650–4. Дои:10.1016 / j.coph.2003.07.004. PMID 14644018.
- ^ а б Хедлунд ПО, Хенрикссон П. (2000). «Парентеральное введение эстрогена по сравнению с полным андрогеном при лечении прогрессирующей карциномы простаты: влияние на общую выживаемость и смертность от сердечно-сосудистых заболеваний. Скандинавская группа рака простаты (SPCG) -5 Trial Study». Урология. 55 (3): 328–33. Дои:10.1016 / с0090-4295 (99) 00580-4. PMID 10699602.
- ^ Симидзу Т.С., Сибата Й, Дзинбо Х., Сато Дж., Яманака Х. (1995). «Эстрамустин фосфат для предотвращения обострения при терапии депо аналогом лютеинизирующего гормона-рилизинг-гормона». Евро. Урол. 27 (3): 192–5. Дои:10.1159/000475159. PMID 7541359.
- ^ а б c d Мюллер (19 июня 1998 г.). Европейский индекс лекарств: европейские регистрации лекарств, четвертое издание. CRC Press. С. 245, 454. ISBN 978-3-7692-2114-5.
- ^ Кеннет Л. Беккер (2001). Принципы и практика эндокринологии и метаболизма. Липпинкотт Уильямс и Уилкинс. С. 2153–. ISBN 978-0-7817-1750-2.
- ^ Таммела Т. (ноябрь 2004 г.). «Эндокринное лечение рака простаты». J. Steroid Biochem. Мол. Биол. 92 (4): 287–95. Дои:10.1016 / j.jsbmb.2004.10.005. PMID 15663992.
- ^ Кокс Р.Л., Кроуфорд Э.Д. (декабрь 1995 г.). «Эстрогены в лечении рака простаты». Дж. Урол. 154 (6): 1991–8. Дои:10.1016 / S0022-5347 (01) 66670-9. PMID 7500443.
- ^ Физази К., Ле Мэтр А., Худес Дж., Берри В. Р., Келли В. К., Эймар Дж. К., Логотетис С. Дж., Пиньон Дж. П., Михильс С. (2007). «Добавление эстрамустина к химиотерапии и выживаемость пациентов с рефрактерным к кастрации раком простаты: метаанализ индивидуальных данных пациента». Ланцет Онкол. 8 (11): 994–1000. Дои:10.1016 / S1470-2045 (07) 70284-X. PMID 17942366.
- ^ Петриоли Р., Ровьелло Дж., Фьяски А.И., Лаэра Л., Бьянко В., Понкиетти Р., Барбанти Дж., Франсини Э. (октябрь 2015 г.). «Низкие дозы эстрамустинфосфата и сопутствующие низкие дозы ацетилсалициловой кислоты у пациентов с тяжелым предварительным лечением с прогрессирующим устойчивым к кастрации раком простаты». Клин генитурин рака. 13 (5): 441–6. Дои:10.1016 / j.clgc.2015.03.004. PMID 25920994.
- ^ а б c d е ж г час я j k л м п о п Gunnarsson PO, Forshell GP (июнь 1984 г.). «Клиническая фармакокинетика эстрамустинфосфата». Урология. 23 (6 Прил.): 22–7. Дои:10.1016 / S0090-4295 (84) 80093-X. PMID 6375076.
- ^ а б Александр Н. С., Хэнкок А. К., Масуд М. Б., Пит Б. Г., Прайс Дж. Дж., Тернер Р. Л., Стоун Дж., Уорд А. Дж. (Март 1979 г.). «Эстрацит в запущенной карциноме груди: исследование фазы II». Clin Radiol. 30 (2): 139–47. Дои:10.1016 / S0009-9260 (79) 80133-6. PMID 86404.
- ^ а б Дапонте Д., Сильвестр Р., Де Пау М., Фрисман А., Смит Р.М., Смит П.Х. (август 1983 г.). «Изменение количества лейкоцитов при лечении запущенного рака простаты эстрамустинфосфатом и стильбоэстролом». Br J Urol. 55 (4): 408–12. Дои:10.1111 / j.1464-410X.1983.tb03333.x. PMID 6349745.
- ^ а б c d е ж г час я j Дж. Элкс (14 ноября 2014 г.). Словарь лекарственных средств: химические данные: химические данные, структуры и библиографии. Springer. С. 502–503. ISBN 978-1-4757-2085-3.
- ^ а б Ван Л.Г., Лю XM, Крейс В., Будман Д.Р. (май 1998 г.). «Антагонистический эффект андрогенов метаболитов эстрамустинфосфата (EMP) на рецепторы андрогенов дикого типа и мутировавшие». Biochem. Pharmacol. 55 (9): 1427–33. Дои:10.1016 / S0006-2952 (97) 00657-6. PMID 10076535.
- ^ а б Ван Поппель Х, Вербрук П. У., Берт Л. (1990). «Влияние эстрамустинфосфата на свободные андрогены. Сравнительное исследование влияния орхиэктомии и эстрамустинфосфата на свободные андрогены у пациентов с раком простаты». Акта Урол Бельг. 58 (4): 89–95. PMID 2093302.
- ^ а б c Карр Дж. П., Вайсман З., Кирдани Р. Ю., Мерфи Г. П., Сандберг А. А. (август 1980 г.). «Влияние диэтилстильбэстрола и эстрамустинфосфата на сывороточный глобулин, связывающий половые гормоны, и уровни тестостерона у пациентов с раком простаты». Дж. Урол. 124 (2): 232–6. Дои:10.1016 / S0022-5347 (17) 55383-5. PMID 7190620.
- ^ Олсон КБ, Пиента К.Дж. (май 2000 г.). «Последние достижения в химиотерапии запущенного рака простаты». Curr Urol Rep. 1 (1): 48–56. Дои:10.1007 / s11934-000-0035-z. PMID 12084341.
- ^ а б Дэлин Л., Дамбер Дж. Э., фон Шульц Б., Бергман Б. (август 1986 г.). «Эстрогенные эффекты этинилэстрадиола / полиэстрадиолфосфата и эстрамустинфосфата у пациентов с карциномой простаты. Сравнительное исследование эстроген-чувствительных белков печени, гонадотропинов и пролактина». Br J Urol. 58 (4): 412–6. Дои:10.1111 / j.1464-410X.1986.tb09095.x. PMID 3092893.
- ^ Фредхольм Б., Йенсен Г., Линдског М. и Мунцинг Дж. (1974, январь). Влияние эстрамустинфосфата (эстрацита) на рост DMBA-индуцированных опухолей молочной железы у крыс. В Acta Pharmacologica et Toxicologica (Vol. 35, pp. 28-28). 35 Norre Sogade, PO Box 2148, DK-1016 Копенгаген, Дания: Munksgaard Int Publ Ltd.
- ^ а б c Punzi JS, Duax WL, Strong P, Griffin JF, Flocco MM, Zacharias DE, Carrell HL, Tew KD, Glusker JP (март 1992 г.). «Молекулярная конформация эстрамустина и двух аналогов». Мол. Pharmacol. 41 (3): 569–76. PMID 1545778.
- ^ а б Хаузер А. Р., Мерриман Р. (май 1984 г.). «Эстрамустин фосфат натрия». Препарат Интелл Клин Фарм. 18 (5): 368–74. Дои:10.1177/106002808401800502. PMID 6373212.
- ^ Тью К.Д., Стернс М.Э. (1989). «Эстрамустин - азотистый иприт / стероид с антимикротрубочковой активностью». Pharmacol. Ther. 43 (3): 299–319. Дои:10.1016/0163-7258(89)90012-0. PMID 2682681.
- ^ Франко Кавалли; Стэн Б. Кэй; Heine H Hansen; Джеймс О Армитидж; Мартина Пикар-Гебхарт (12 сентября 2009 г.). Учебник медицинской онкологии, четвертое издание. CRC Press. С. 442–. ISBN 978-0-203-09289-7.
- ^ Гуннарссон О., Андерссон С.Б., Йоханссон С.А. (1983). «Гидролиз эстрамустинфосфата; исследования in vitro». Eur J Drug Metab Фармакокинет. 8 (4): 395–402. Дои:10.1007 / BF03188772. PMID 6673977.
- ^ а б Озэки Т., Такеучи М., Судзуки М., Китамура Т., Такаянаги Р., Йокояма Х., Ямада И. (октябрь 2009 г.). «Однонуклеотидные полиморфизмы гена 17бета-гидроксистероид дегидрогеназы типа 7: механизм побочных реакций, связанных с эстрамустином?». Int. Дж. Урол. 16 (10): 836–41. Дои:10.1111 / j.1442-2042.2009.02374.x. PMID 19735314.
- ^ а б Сузуки М., Муто С., Хара К., Озэки Т., Ямада Ю., Кадоваки Т., Томита К., Камеяма С., Китамура Т. (февраль 2005 г.). «Однонуклеотидные полиморфизмы в генах 17-бета-гидроксистероид дегидрогеназы могут предсказывать риск побочных эффектов натрия эстрамустинфосфата у пациентов с раком простаты». Int. Дж. Урол. 12 (2): 166–72. Дои:10.1111 / j.1442-2042.2005.01004.x. PMID 15733111.
- ^ Гейт, Лоран; Тью, Кеннет Д. (2011). «Алкилирующие агенты»: 61–85. Дои:10.1007/978-90-481-9704-0_4. Цитировать журнал требует
| журнал =(Помогите) - ^ http://www.ilexmedical.com/files/PDF/Estradiol_ARC.pdf
- ^ Торстейн Лофтссон (25 января 2014 г.). Стабильность лекарств для ученых-фармацевтов. Академическая пресса. С. 77–. ISBN 978-0-12-411562-0.
- ^ С. Бернал (21 августа 1997 г.). Лекарственная устойчивость в онкологии. CRC Press. С. 287–. ISBN 978-1-4200-0209-6.
- ^ Сэмюэл Дж. Мерфф (20 февраля 2012 г.). Справочник по безопасности и здоровью цитотоксических препаратов. Правительственные институты. С. 89–. ISBN 978-1-60590-705-5.
- ^ Уильям Д. Фигг; Синди Х. Чау; Эрик Дж. Смолл (14 сентября 2010 г.). Медикаментозное лечение рака простаты. Springer Science & Business Media. С. 402–. ISBN 978-1-60327-829-4.
- ^ И.К. Мортон; Джудит М. Холл (6 декабря 2012 г.). Краткий словарь фармакологических агентов: свойства и синонимы. Springer Science & Business Media. С. 114–. ISBN 978-94-011-4439-1.
- ^ "Drugs @ FDA: одобренные FDA лекарственные препараты". Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Получено 29 января 2017.
- ^ Sweetman, S, ed. (12 февраля 2013 г.). «Эстрамустин натрия фосфат». Мартиндейл: полный справочник лекарств. Лондон, Великобритания: Pharmaceutical Press. Получено 8 февраля 2014.
дальнейшее чтение
- Тью К.Д. (сентябрь 1983 г.). «Механизм действия эстрамустина». Семин. Онкол. 10 (3 Дополнение 3): 21–6. PMID 6364362.
- Hoisaeter PA, Bakke A (сентябрь 1983 г.). «Эстрамустин фосфат (эстрацит): экспериментальные и клинические исследования в Европе». Семин. Онкол. 10 (3 Дополнение 3): 27–33. PMID 6364363.
- Сандберг А.А. (сентябрь 1983 г.). «Метаболические аспекты и действия, уникальные для Estracyt». Семин. Онкол. 10 (3 Дополнение 3): 3–15. PMID 6364364.
- Хаукаас С.А. (1984). «Иммунологические эффекты диэтилстильбэстрола и эстрамустинфосфата». Scand J Urol Nephrol Suppl. 83: 1–32. PMID 6387896.
- Хаузер А. Р., Мерриман Р. (май 1984 г.). «Эстрамустин фосфат натрия». Препарат Интелл Клин Фарм. 18 (5): 368–74. Дои:10.1177/106002808401800502. PMID 6373212.
- Сандберг А.А. (июнь 1984 г.). «Метаболические параметры эстрацита, имеющие отношение к его эффектам при раке простаты». Урология. 23 (6 Прил.): 11–21. Дои:10.1016 / S0090-4295 (84) 80092-8. PMID 6375075.
- Gunnarsson PO, Forshell GP (июнь 1984 г.). «Клиническая фармакокинетика эстрамустинфосфата». Урология. 23 (6 Прил.): 22–7. Дои:10.1016 / S0090-4295 (84) 80093-X. PMID 6375076.
- Форсгрен Б., Бьорк П. (июнь 1984 г.). «Специфическое связывание эстрамустина с белками простаты». Урология. 23 (6 Прил.): 34–8. Дои:10.1016 / S0090-4295 (84) 80095-3. PMID 6375077.
- Калланд Т., Хаукаас С.А. (июнь 1984 г.). «Иммунологические эффекты эстрамустинфосфата». Урология. 23 (6 Прил.): 39–45. Дои:10.1016 / S0090-4295 (84) 80096-5. PMID 6375078.
- Høisaeter PA (июнь 1984 г.). «Механизм действия Эмцита». Урология. 23 (6 Прил.): 46–8. Дои:10.1016 / S0090-4295 (84) 80097-7. PMID 6375079.
- Müntzing J, Gunnarsson K (июнь 1984 г.). «Доклиническая фармакология и токсикология эстрамустинфосфата». Урология. 23 (6 Прил.): 6–10. Дои:10.1016 / S0090-4295 (84) 80091-6. PMID 6375082.
- Slack NH, Murphy GP (июнь 1984 г.). «Клиническая токсичность и отдаленные результаты терапии Эмцитом рака простаты». Урология. 23 (6 Прил.): 73–7. Дои:10.1016 / S0090-4295 (84) 80103-X. PMID 6375085.
- Hedlund PO (1985). «Механизм действия эстрамустинфосфата при гормонально-зависимом и гормонально-независимом раке простаты». Прог. Clin. Биол. Res. 185A: 197–202. PMID 3898129.
- Hedlund PO (1987). «Эстрацит - механизм действия и клинический опыт». Прог. Clin. Биол. Res. 243B: 215–9. PMID 3309981.
- Мерфи Г.П. (1987). «Текущий обзор клинического опыта с Estracyt». Прог. Clin. Биол. Res. 243B: 221–5. PMID 3309982.
- Форсгрен Б. (1988). «Эстрамустин-связывающий белок в простате крысы и человека». Scand J Urol Nephrol Suppl. 107: 56–8. PMID 3287598.
- Тью К.Д., Стернс М.Э. (1989). «Внутриклеточные эффекты эстрамустина (Estracyt / Emcyt)». Прог. Clin. Биол. Res. 303: 169–75. PMID 2674983.
- Тью К.Д., Стернс М.Э. (1989). «Эстрамустин - азотистый иприт / стероид с антимикротрубочковой активностью». Pharmacol. Ther. 43 (3): 299–319. Дои:10.1016/0163-7258(89)90012-0. PMID 2682681.
- Кёнивес I (1989). «Эстрамустин фосфат (эстрацит) в лечении рака простаты». Инт Урол Нефрол. 21 (4): 393–7. Дои:10.1007 / BF02559635. PMID 2693392.
- Бенсон Р., Хартли-Асп Б. (1990). «Механизмы действия и клиническое применение эстрамустина». Рак Инвест. 8 (3–4): 375–80. Дои:10.3109/07357909009012056. PMID 2207764.
- Ван Поппель Х, Берт Л. (1991). «Настоящая роль эстрамустинфосфата в распространенном раке простаты». Прог. Clin. Биол. Res. 370: 323–41. PMID 1924466.
- Янкнегт Р.А. (1992).«Эстрамустин фосфат и другие цитотоксические препараты в лечении прогрессирующего рака простаты с плохим прогнозом». Простата Suppl. 4: 105–10. Дои:10.1002 / pros.2990210516. PMID 1574449.
- Tew KD, Glusker JP, Hartley-Asp B, Hudes G, Speicher LA (декабрь 1992 г.). «Доклинические и клинические перспективы использования эстрамустина в качестве антимитотического средства». Pharmacol. Ther. 56 (3): 323–39. Дои:10.1016 / 0163-7258 (92) 90023-С. PMID 1301594.
- Крейс В. (1995). «Возвращение к эстрамустину». Лечение рака. Res. 78: 163–84. Дои:10.1007/978-1-4615-2007-8_8. PMID 8595142.
- Перри С.М., Мактавиш Д. (июль 1995 г.). «Эстрамустин фосфат натрия. Обзор его фармакодинамических и фармакокинетических свойств, а также терапевтическая эффективность при раке простаты». Лекарства от старения. 7 (1): 49–74. Дои:10.2165/00002512-199507010-00006. PMID 7579781.
- Худес Г. (февраль 1997 г.). «Химиотерапия на основе эстрамустина». Семин. Урол. Онкол. 15 (1): 13–9. PMID 9050135.
- Bergenheim AT, Henriksson R (февраль 1998 г.). «Фармакокинетика и фармакодинамика эстрамустинфосфата». Клин Фармакокинет. 34 (2): 163–72. Дои:10.2165/00003088-199834020-00004. PMID 9515186.
- Китамура Т. (февраль 2001 г.). «Необходимость переоценки эстрамустинфосфата натрия (EMP) как варианта лечения для монотерапии первой линии при распространенном раке простаты». Int. Дж. Урол. 8 (2): 33–6. Дои:10.1046 / j.1442-2042.2001.00254.x. PMID 11240822.
- Симпсон, Д.; Вагстафф, AJ (2003). «Эстрамустин фосфат натрия». Американский журнал рака. 2 (5): 373–390. Дои:10.2165/00024669-200302050-00013.
- Равери В., Физази К., Удар С., Друэ Л., Эймар Дж. К., Кулин С., Гравис Дж., Хеннекен С., Зербиб М. (декабрь 2011 г.). «Использование эстрамустинфосфата в современном лечении рака простаты на поздних стадиях». BJU Int. 108 (11): 1782–6. Дои:10.1111 / j.1464-410X.2011.10201.x. PMID 21756277.
- Цинь З, Ли Х, Чжан Дж, Тан Дж, Хан П, Сюй З, Ю И, Ян Ц, Ван С, Сюй Т, Сюй З, Цзоу Цзюй (сентябрь 2016 г.). «Химиотерапия с эстрамустином или без него для лечения устойчивого к кастрации рака простаты: систематический обзор и метаанализ». Медицина (Балтимор). 95 (39): e4801. Дои:10.1097 / MD.0000000000004801. ЧВК 5265899. PMID 27684806.
- Иноуэ, Такахиро (2018). «Роль эстрамустинфосфата и других эстрогенов в резистентном к кастрации раке простаты»: 249–256. Дои:10.1007/978-981-10-7013-6_26. Цитировать журнал требует
| журнал =(Помогите)

