Норэтистерон - Norethisterone
 | |
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | В одиночку: Айгестин, Камила, Вереск, Микронор, Примолют Н, другие; С EE: Ло Лоэстрин, Лоэстрин, Микрогестин, Модикон, Норинил, Орто-Новум и другие; С E2: Activella, Activelle, Estalis, Kliogest, Necon, Novofem, Trisequens и другие. |
| Другие имена | СЕТЬ; Норэтиндрон; NSC-9564; LG-202; Этинилнортестостерон; Норпрегненинолон; Ангидрогидроксинорпрогестерон; Этинилэстренолон; 17α-этинил-19-нортестостерон; 17α-этинилестра-4-ен-17β-ол-3-он; 17α-гидрокси-19-норпрегн-4-ен-20-ин-3-он |
| AHFS /Drugs.com | Международные названия лекарств |
| MedlinePlus | a604034 |
| Данные лицензии | |
| Маршруты администрация | Устно, внутримышечная инъекция (в качестве NETE ) |
| Класс препарата | Прогестаген (лекарство); Прогестин |
| Код УВД | |
| Легальное положение | |
| Легальное положение |
|
| Фармакокинетический данные | |
| Биодоступность | 47–73% (в среднем 64%)[1][2] |
| Связывание с белками | 97%:[3] Альбумин: 61%;[3] SHBG: 36%[3] |
| Метаболизм | В основном CYP3A4 (печень );[4] также 5α- /5β-редуктаза, 3α- /3β-HSD, и ароматаза |
| Устранение период полураспада | 5,2–12,8 часов (в среднем 8,0 часов)[1] |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.000.619 |
| Химические и физические данные | |
| Формула | C20ЧАС26О2 |
| Молярная масса | 298.426 г · моль−1 |
| 3D модель (JSmol ) | |
| Температура плавления | От 203 до 204 ° C (от 397 до 399 ° F) |
| |
| |
| (проверять) | |
Норэтистерон, также известный как норэтиндрон и продается под многими торговыми марками, это прогестин лекарства, используемые в противозачаточные таблетки, менопаузальная гормональная терапия, и для лечения гинекологические расстройства.[3][5] Препарат доступен как в низких, так и в высоких дозах, и отдельно, и в сочетании с эстроген.[5][6] Это используется устно или, как норэтистерона энантат, к инъекция в мышцу.[3][5][7]
Побочные эффекты из норэтистерона включают нарушения менструального цикла, головные боли, тошнота, болезненность молочных желез, настроение изменения, угревая сыпь, усиленный рост волос.[8][9] Норэтистерон - это прогестин или синтетический прогестаген, и, следовательно, является агонист из рецептор прогестерона, то биологическая мишень прогестагенов, таких как прогестерон.[3][5] Имеет слабый андрогенный и эстрогенный активность, в основном в высоких дозировках, и никаких других важных гормональный Мероприятия.[3][10]
Норэтистерон был открыт в 1951 году и был одним из первых разработанных прогестинов.[11][12][13] Он был впервые введен для медицинского применения самостоятельно в 1957 году и был введен в сочетании с эстрогеном для использования в качестве противозачаточных таблеток в 1963 году.[13][14] Иногда его называют прогестином «первого поколения».[15][16] Вместе с дезогестрел, это один из немногих прогестинов, широко доступных в качестве «мини-таблетки», содержащие только прогестагены для контроля рождаемости.[17][18] Норэтистерон широко продается во всем мире.[19] Он доступен как дженерик.[20] В 2017 году это было 141-е место в списке наиболее часто назначаемых лекарств в Соединенных Штатах: было выписано более четырех миллионов рецептов.[21][22]
Медицинское использование
Норэтистерон используется как гормональное противозачаточное средство в сочетании с эстрогенами - обычно этинилэстрадиол (EE) - в комбинированные оральные противозачаточные таблетки и один в таблетки, содержащие только прогестагены.
Еще одно медицинское применение норэтистерона - облегчить эндометриоз связанная боль. Фактически, 50% пациентов, получавших медикаментозное или хирургическое лечение по поводу тазовой боли, связанной с эндометриозом, получили пользу от прогестин терапия. Это может быть связано с тем, что норэтистерон вызывает разрастание эндометрия во время секреторной фазы, что, как было показано, облегчает жалобы на боль в эндометрии. Другой способ, которым норэтистерон может уменьшать боль в эндометрии, - это ингибирование овуляция. Боль и дискомфорт при эндометриозе усиливаются во время овуляции.[23]
Доступные формы
| Сочинение | Доза | Фирменные наименования | Использовать |
|---|---|---|---|
| Только NET | Низкий (например, 0,35 мг) | Несколько[а] | Оральные контрацептивы, содержащие только прогестагены |
| Только NET или NETA | Высокая (например, 5 мг, 10 мг) | Несколько[b] | Гинекологические заболевания и другое использование |
| Только NETE | Инъекция (например, 200 мг) | Несколько[c] | Инъекционные противозачаточные средства, содержащие только прогестагены |
| NET или NETA с этинилэстрадиол | Низкий (например, 0,4 мг, 0,5 мг, 0,75 мг, 1 мг, 1,5 мг) | Несколько[d] | Комбинированный пероральный контрацептив |
| NET с местранол | Низкий (например, 1 мг, 2 мг) | Несколько[e] | Комбинированный пероральный контрацептив |
| НЕТА с эстрадиол | Низкий (например, 0,1 мг, 0,5 мг) | Несколько[f] | Комбинированная гормональная терапия в период менопаузы |
| NETE с эстрадиола валерат | Для инъекций (например, 50 мг) | Несколько[грамм] | Комбинированный инъекционный контрацептив |
| Сокращения: NET = норэтистерон. НЕТА = Норэтистерона ацетат. NETE = Норэтистерона энантат. Источники: [24][25][26][27] Примечания:
| |||
Противопоказания
Высокие дозы (10 мг / день) норэтистерона были связаны с: печеночная веноокклюзионная болезнь, и из-за этого побочного эффекта норэтистерон не следует назначать пациентам, проходящим аллогенный трансплантация костного мозга, так как это было связано со значительно более низкой годичной выживаемостью после трансплантации.[28]:217[29]
Побочные эффекты
В дозах противозачаточных средств и заместительной гормональной терапии (от 0,35 до 1 мг / день) норэтистерон оказывает существенно прогестагенное действие. побочные эффекты Только. В большинстве клинических исследований норэтистерона для контрацепции или гормональной терапии менопаузы препарат сочетался с эстрогеном, и по этой причине трудно определить, какие из побочных эффектов были вызваны норэтистероном, а какие - эстрогеном. такое исследование. Однако НЕТЕ, пролекарство норэтистерона, вводимое внутримышечно, которое используется в качестве контрацептива длительного действия, используется без эстрогена и, следовательно, может использоваться в качестве заменителя норэтистерона с точки зрения понимания его эффектов и переносимость. В клинических исследованиях наиболее частым побочным эффектом NETE был: нарушения менструального цикла, включая длительное кровотечение или кровянистые выделения и аменорея.[28]:253 Другие побочные эффекты включали периодические вздутие живота и болезненность молочных желез, оба из которых, как полагают, связаны с задержка воды и можно облегчить мочегонные средства.[28]:253 Не было никакой связи с увеличение веса, и артериальное давление, свертывание крови, и толерантность к глюкозе остались все нормально.[28]:253 Однако снижение HDL холестерин наблюдалось.[28]:253
В высоких дозах (от 5 до 60 мг / день), например, используемых при лечении гинекологических заболеваний, норэтистерон может вызывать гипогонадизм из-за его антигонадотропный эффекты и могут иметь эстрогенные и слабые андрогенные побочные эффекты.
Высокие дозы НЭТА (10 мг / день) были связаны с аномальным функциональные пробы печени, включая значительные повышение ферментов печени.[30][31][32] Эти ферменты печени включены лактатдегидрогеназа и глутаматпируват трансаминаза.[32] Хотя они были описаны как не имеющие клинического значения,[32] повышенные печеночные ферменты, связанные с НЭТА, могли препятствовать его дальнейшему развитию для мужской гормональной контрацепции.[30][31]
Андрогенный
Из-за своей слабой андрогенной активности норэтистерон может вызывать андрогенные побочные эффекты Такие как угревая сыпь, гирсутизм, и голос меняется легкой степени тяжести у некоторых женщин при высоких дозировках (например, от 10 до 40 мг / день).[9] В частности, это не относится к комбинированные оральные контрацептивы которые содержат норэтистерон и EE.[10] Такие составы содержат низкие дозы норэтистерона (от 0,35 до 1 мг / день).[10] в комбинации с эстроген и на самом деле связаны с улучшением симптомов акне.[33][34] Соответственно, они фактически одобрены FDA для лечения угрей у женщин в США.[33][34] Считается, что улучшение симптомов угревой сыпи связано с увеличением в 2-3 раза глобулин, связывающий половые гормоны (SHBG) и, как следствие, снижение свободных тестостерон уровни, вызванные ЭЭ, что приводит к общему снижению андрогенной передачи сигналов в организме.[35]
В сальные железы очень чувствительны к андрогенам, а их размер и активность являются потенциальными маркерами андрогенного действия.[36] Было обнаружено, что высокая доза норэтистерона или НЭТА в 20 мг / сутки значительно стимулирует сальные железы, тогда как более низкие дозы норэтистерона и НЭТА 5 мг / сутки и 2,5 мг / сутки, соответственно, существенно не стимулируют выработку кожного сала и, следовательно, считаются как лишенный значительной андрогенности.[36] И наоборот, дозировки норэтистерона от 0,5 до 3 мг / день дозозависимо снижают уровни SHBG (и, следовательно, подавляют продукцию SHBG в печени), что является еще одним высокочувствительным маркером андрогенности.[37]
Крупное клиническое исследование высоких и очень высоких пероральных доз норэтистерона (от 10 до 40 мг / день), вводимых в течение длительных периодов времени (от 4 до 35 недель) для предотвращения выкидыш в беременная женщины обнаружили, что 5,5% женщин испытали легкие андрогенные побочные эффекты, такие как легкие голос меняется (охриплость ), прыщи и гирсутизм и что у 18,3% младенцев женского пола, рожденных от матерей, наблюдались, в большинстве случаев лишь незначительные, вирилизация из гениталии.[9] Андрогенные симптомы у матери чаще всего возникали у женщин, получавших норэтистерон в дозе 30 мг / день или более в течение 15 недель или дольше.[9] У младенцев женского пола, которые испытали вирилизацию гениталий, единственным проявлением в 86,7% случаев было различное, но почти всегда небольшое увеличение клитора.[9] В оставшихся 13,3% случаев отмечено увеличение клитора и частичное сращение губно-мошоночные складки произошел.[9] Дозировки, использованные в этих случаях, составляли от 20 до 40 мг / день.[9]
В письме редактору на тему вирилизации, вызванной высокими дозами НЭТА у женщин, врач заявил, что они не наблюдали «ни малейшего доказательства вирилизации» и что «определенно не было ни гирсутизма, ни каких-либо изменений голоса» у женщин. 55 женщин с распространенным раком груди, которых лечили норэтистероном от 30 до 60 мг / день в течение шести месяцев.[38]
Норэтистерон в высоких дозах использовался для подавления менструация у женщин с тяжелым Интеллектуальная недееспособность которые были неспособны справиться с собственными менструациями.[39][40] Исследование 118 нерожавших женщин, получавших норэтистерон в дозе 5 мг / день в течение периода от 2 до 30 месяцев, показало, что препарат эффективен в производстве аменорея у 86% женщин, с прорывное кровотечение приходится на оставшиеся 14%.[39] Побочные эффекты, включая увеличение веса, гирсутизм, угревая сыпь, Головная боль, тошнота, и рвота ни у кого не было отмечено увеличения заболеваемости, и ни у одной из женщин не было отмечено «тревожных побочных эффектов».[39][40] Другое исследование норэтистерона в дозе 5 мг / день с участием 132 женщин также не упомянуло об андрогенных побочных эффектах.[41] Эти данные свидетельствуют о незначительном риске возникновения андрогенных побочных эффектов при приеме норэтистерона в дозировке 5 мг / день или его отсутствии.[39][40] Исследование 194 женщин, получавших НЭТА от 5 до 15 мг / день в течение средней продолжительности лечения 13 месяцев для подавления симптомов эндометриоз не наблюдали побочных эффектов у 55,2% пациентов, прибавку в весе у 16,1%, акне у 9,9%, лабильность настроения в 8,9%, приливы у 8,3% и углубление голоса у двух женщин (1,0%).[42]
Эстрогенный
Норэтистерон слабо эстрогенный (путем преобразования в его метаболит EE), и по этой причине было обнаружено, что высокие дозировки связаны с высоким уровнем эстрогенных побочных эффектов, таких как увеличение груди у женщин и гинекомастия у мужчин, но и с улучшением менопаузальный симптомы у женщин в постменопаузе.[43] Было высказано предположение, что очень высокие дозировки (например, 40 мг / день, которые иногда используются в клинической практике по различным показаниям) НЭТА (и, соответственно, норэтистерона) могут привести к повышенному риску Венозная тромбоэмболия (ВТЭ) аналогично высоким дозам (более 50 мкг / день) ЭЭ, и что даже дозы НЭТА от 10 до 20 мг, которые соответствуют дозам ЭЭ примерно от 20 до 30 мкг / сутки, могут у некоторых женщин быть связаны с Повышенный риск.[44][45] Исследование также показало, что этинилэстрадиол и норэтистерон имеют большее влияние на факторы свертывания крови при дозе норэтистерона 3 или 4 мг, чем при дозе 1 мг.[46] Это могло произойти из-за дополнительного количества этинилэстрадиола, вырабатываемого более высокими дозами норэтистерона.[46]
Передозировка
Сообщений о серьезных побочные эффекты при передозировке норэтистерона даже у маленьких детей.[47] Таким образом, передозировка обычно не требует лечения.[47] Высокие дозировки норэтистерона, до 60 мг / день, были изучены в течение длительного периода лечения без описанных серьезных побочных эффектов.[38]
Взаимодействия
5α-редуктаза играет важную роль в метаболизм норэтистерона и Ингибиторы 5α-редуктазы Такие как финастерид и дутастерид может подавлять его метаболизм.[нужна цитата ] Норэтистерон частично метаболизируется через гидроксилирование к CYP3A4, и ингибиторы и индукторы CYP3A4 может значительно изменить циркулирующий уровень норэтистерона.[4] Например, индукторы CYP3A4 рифампицин и бозентан было обнаружено, что воздействие норэтистерона снижается на 42% и 23% соответственно, а индукторы CYP3A4 карбамазепин и Зверобой также было обнаружено, что они ускоряют клиренс норэтистерона.[4]
Фармакология
Фармакодинамика
Норэтистерон - сильнодействующий прогестаген и слабый андроген и эстроген.[3] То есть это мощный агонист из рецептор прогестерона (PR) и слабый агонист рецептор андрогенов (AR) и рецептор эстрогена (ER).[3] Сам по себе норэтистерон имеет незначительное близость для ER; его эстрогенная активность обусловлена активный метаболит образуется в очень небольших количествах, этинилэстрадиол (EE), который является очень сильным эстрогеном.[3] Норэтистерон и его метаболиты обладают незначительным сродством к рецептор глюкокортикоидов (GR) и минералокортикоидный рецептор (MR) и, следовательно, не имеют глюкокортикоид, антиглюкокортикоид, минералокортикоид, или же антиминералокортикоид Мероприятия.[3]
| Сложный | Типа | PR | AR | ER | GR | МИСТЕР | SHBG | CBG |
|---|---|---|---|---|---|---|---|---|
| Норэтистерон | – | 67–75 | 15 | 0 | 0–1 | 0–3 | 16 | 0 |
| 5α-дигидроноретистерон | Метаболит | 25 | 27 | 0 | 0 | ? | ? | ? |
| 3α, 5α-тетрагидроноретистерон | Метаболит | 1 | 0 | 0–1 | 0 | ? | ? | ? |
| 3α, 5β-тетрагидроноретистерон | Метаболит | ? | 0 | 0 | ? | ? | ? | ? |
| 3β, 5α-Тетрагидроноретистерон | Метаболит | 1 | 0 | 0–8 | 0 | ? | ? | ? |
| Этинилэстрадиол | Метаболит | 15–25 | 1–3 | 112 | 1–3 | 0 | 0.18 | 0 |
| Норэтистерона ацетат | Пролекарство | 20 | 5 | 1 | 0 | 0 | ? | ? |
| Норэтистерона энантат | Пролекарство | ? | ? | ? | ? | ? | ? | ? |
| Норетинодрел | Пролекарство | 6 | 0 | 2 | 0 | 0 | 0 | 0 |
| Этинодиол | Пролекарство | 1 | 0 | 11–18 | 0 | ? | ? | ? |
| Этинодиол диацетат | Пролекарство | 1 | 0 | 0 | 0 | 0 | ? | ? |
| Линестренол | Пролекарство | 1 | 1 | 3 | 0 | 0 | ? | ? |
| Примечания: Значения указаны в процентах (%). Ссылка лиганды (100%) были промегестон для PR, метриболон для AR, эстрадиол для ER, дексаметазон для GR, альдостерон для МИСТЕР, дигидротестостерон за SHBG, и кортизол за CBG. Сноски: а = Активный или неактивный метаболит, пролекарство, или ни один из норэтистерона. Источники: См. Шаблон. | ||||||||
Прогестагенная активность
Норэтистерон - сильнодействующий прогестаген и связывается с PR примерно с 150% близость из прогестерон.[3] Напротив, его исходные соединения, тестостерон, нандролон (19-нортестостерон) и этистерон (17α-этинилтестостерон) имеют 2%, 22% и 44% относительной аффинности связывания прогестерона с PR.[48] В отличие от норэтистерона, его основной активный метаболит 5α-дигидроноретистерон (5α-DHNET), который образуется преобразованием через 5α-редуктаза, было обнаружено, что он обладает как прогестагенными, так и отмеченными антипрогестогенный Мероприятия,[49] хотя его сродство к PR значительно снижено по сравнению с норэтистероном и составляет всего 25% от сродства прогестерона.[3] Норэтистерон вызывает аналогичные изменения в эндометрий и влагалище, Такие как трансформация эндометрия, и аналогично антигонадотропный, овуляция -ингибирующие, и термогенный у женщин по сравнению с прогестероном, что соответствует его прогестагенной активности.[50][48][51]
Андрогенная активность
Норэтистерон имеет примерно 15% сродства анаболический андрогенный стероид (AAS) метриболон (R-1881) для AR и, соответственно, является слабо андрогенным.[3] В отличие от норэтистерона, 5α-DHNET, основной метаболит норэтистерона, демонстрирует более высокое сродство к AR, примерно 27% от сродства метриболона.[3] Однако, хотя 5α-DHNET имеет более высокое сродство к AR, чем норэтистерон, он значительно уменьшил и фактически почти полностью отменил андрогенную активность по сравнению с норэтистероном у грызунов. биоанализы.[52][53] Подобные результаты наблюдались для этистерон (17α-этинилтестостерон) и его 5α-восстановленный метаболит, тогда как 5α-восстановление усиливает как сродство к AR, так и андрогенную активность тестостерон и нандролон (19-нортестостерон) в биопробах на грызунах.[53] Таким образом, оказывается, что этинильная группа норэтистерона в положении C17α ответственна за его потерю андрогенности при 5α-восстановлении.[53]
Было обнаружено, что норэтистерон (от 0,5 до 3 мг / день) дозозависимо снижает уровни циркулирующего SHBG, что является общим свойством андрогенов и происходит из-за AR-опосредованного подавления продукции SHBG в печени.[37] Препарат также обладает эстрогенной активностью, а эстрогены, как известно, увеличивают производство SHBG в печени и уровни циркуляции, поэтому, похоже, андрогенная активность норэтистерона превосходит его эстрогенную активность в этом отношении.[37]
Норэтистерон в значительной степени (36%) связан с ГСПГ в обращении.[3] Хотя он имеет более низкое сродство к SHBG, чем эндогенные андрогены и эстрогены,[54] Норэтистерон может вытеснять тестостерон из ГСПГ и тем самым повышать уровень свободного тестостерона, и это действие может способствовать его слабому андрогенному эффекту.[55]
Эстрогенная активность

Норэтистерон связывается с ER, ERα и ERβ, с 0,07% и 0,01% от относительная аффинность связывания из эстрадиол.[56] Из-за этого очень низкого относительного сродства он практически неактивен как лиганд ER в клинических концентрациях.[3] Однако норэтистерон оказался субстрат за ароматаза и конвертируется в печень в небольшой степени (0,35%) в очень мощный эстроген EE, и по этой причине, в отличие от большинства других прогестинов, норэтистерон обладает некоторой эстрогенной активностью.[3] Однако при типичных дозировках норэтистерона, используемых в оральные контрацептивы (От 0,5 до 1 мг) уровни производимого ЭЭ низкие, и было сказано, что они, вероятно, не имеют клинического значения.[3] И наоборот, дозы 5 и 10 мг норэтистерона, которые используются при лечении гинекологические расстройства, конвертируются со скоростью 0,7% и 1,0% и производят уровни ЭЭ, которые соответствуют уровням, полученным при дозировках 30 и 60 мкг ЭЭ соответственно.[1][3] Уровни EE, образованные 0,5 и 1 мг норэтистерона, были оценены на основе более высоких дозировок, соответствующих дозировкам EE 2 и 10 мкг соответственно.[1] В высоких дозах норэтистерон может увеличить риск Венозная тромбоэмболия из-за метаболизма в EE.[57]
Нейростероидная активность
Нравиться прогестерон и тестостерон, норэтистерон метаболизируется в 3,5-тетрагидро метаболиты.[58] Взаимодействуют ли эти метаболиты норэтистерона с ГАМКА рецептор аналогично 3,5-тетрагидро метаболитам прогестерона и тестостерону. аллопрегнанолон и 3α-андростандиол соответственно, это тема, которая, похоже, не изучалась и, следовательно, требует пояснения.[58]
Подавление стероидогенеза
Норэтистерон является субстратом и известен как ингибитор из 5α-редуктаза с ингибированием 4,4% и 20,1% при 0,1 и 1 мкМ соответственно.[3] Однако терапевтические концентрации норэтистерона находятся на низком уровне. наномолярный диапазон, поэтому это действие может не иметь клинического значения при типичных дозировках.[3]
Было обнаружено, что норэтистерон и его основной активный метаболит 5α-DHNET действуют как необратимый ингибиторы ароматазы (Kя = 1,7 мкМ и 9,0 мкМ соответственно).[59] Однако, как и в случае 5α-редуктазы, требуемые концентрации, вероятно, слишком высоки, чтобы быть клинически значимыми при типичных дозах.[3] 5α-DHNET был специально оценен и обнаружил, что он селективно ингибирует ароматазу и не влияет на фермент расщепления боковой цепи холестерина (P450scc), 17α-гидроксилаза /17,20-лиаза, 21-гидроксилаза, или же 11β-гидроксилаза.[59] Поскольку он не ароматизируется (и, следовательно, не может быть преобразован в эстрогенный метаболит), в отличие от норэтистерона, 5α-DHNET был предложен в качестве потенциального терапевтического агента при лечении ER-положительных рак молочной железы.[59]
Другие занятия
Норэтистерон - очень слабый ингибитор CYP2C9 и CYP3A4 (IC50 = 46 мкМ и 51 мкМ соответственно), но для этих действий требуются очень высокие концентрации норэтистерона, которые намного превышают терапевтические уровни циркуляции (которые находятся в наномолярном диапазоне) и, следовательно, вероятно, не имеют клинического значения.[3]
Было обнаружено, что норэтистерон и некоторые из его 5α-восстановленных метаболитов продуцируют сосудорасширяющий эффекты у животных, которые не зависят от рецепторы половых стероидов и, следовательно, по механизму они не являются геномными.[60]
Норэтистерон стимулирует распространение из MCF-7 рак молочной железы клетки in vitro, действие, которое не зависит от классических PR и вместо этого опосредуется через компонент мембраны рецептора прогестерона-1 (PGRMC1).[61] Некоторые другие прогестины действуют аналогичным образом в этом анализе, тогда как прогестерон действует нейтрально.[61] Неясно, могут ли эти результаты объяснить различные риски рака груди, наблюдаемые при приеме прогестерона и прогестинов в клинические исследования.[62]
Антигонадотропные эффекты
Благодаря своей прогестагенной активности норэтистерон подавляет гипоталамо-гипофизарно-гонадная ось (Ось HPG) и, следовательно, имеет антигонадотропный последствия.[3][48] Ожидается, что эстрогенная активность норэтистерона в высоких дозах также будет способствовать его антигонадотропным эффектам.[63] Благодаря своим антигонадотропным эффектам норэтистерон подавляет гонадный половой гормон производство, подавляет овуляция у женщин и подавляет сперматогенез у мужчин.[3][48][64]
В овуляция - ингибирующая доза перорального норэтистерона и перорального НЭТА для женщин составляет около 0,5 мг / день.[3][65][66] Однако существуют некоторые противоречивые данные, предполагающие, что для полного подавления овуляции могут потребоваться более высокие дозы.[67] Было обнаружено, что внутримышечная инъекция 200 мг NETE предотвращает овуляцию и подавляет уровни эстрадиол, прогестерон, лютеинизирующий гормон (LH) и фолликулостимулирующего гормона (ФСГ) у женщин.[68][69][70][71]
В ранних исследованиях перорального приема норэтистерона у мужчин при дозах от 20 до 50 мг / день наблюдалось подавление 17-кетостероид выделение, повысился эстроген экскреция (за счет превращения в этинилэстрадиол ), подавление сперматогенеза, либидо, и эректильная функция, и заболеваемость гинекомастия.[72][73][74][43][75] Сообщалось, что доза перорального норэтистерона 25 мг / день в течение 3 недель для мужчин снижает уровень тестостерона примерно на 70%, до 100-200 нг / дл, в течение 4 или 5 дней, а также для подавления количество сперматозоидов и не оказывать влияния на либидо или эректильную функцию в течение этого короткого периода времени.[76][77]
Однократная внутримышечная инъекция 200 мг NETE отдельно или в комбинации с 2 мг эстрадиола валерат Было обнаружено, что он вызывает быстрое, сильное и стойкое снижение уровня гонадотропина и тестостерона у мужчин на срок до одного месяца.[64][78][79] Также было обнаружено, что внутримышечные инъекции 200 мг NETE один раз в 3 недели подавляют сперматогенез у мужчин.[72][80]
Фармакокинетика
В фармакокинетика норэтистерона были рассмотрены.[3][81]
Абсорбция
В устный биодоступность Норэтистерона составляет от 47 до 73% при средней биодоступности при пероральном приеме 64%.[1][2] Микронизация было обнаружено, что он значительно улучшает пероральную биодоступность норэтистерона за счет увеличения кишечный поглощение и сокращение кишечный метаболизм.[3] Было обнаружено, что однократная пероральная доза норэтистерона 2 мг приводит к пиковым циркулирующим уровням препарата в 12 нг / мл (40 нмоль / л), тогда как однократная пероральная доза норэтистерона 1 мг в сочетании с 2 мг эстрадиола приводит к пиковому значению. уровни норэтистерона 8,5 нг / мл (29 нмоль / л) через час после приема.[3]
- Уровни гормонов с норэтистерон
Распределение
В связывание с белками плазмы норэтистерона составляет 97%.[3] 61% привязан к альбумин и 36% связаны с ГСПГ.[3]
Метаболизм
Метаболизм норэтистерона и его пролекарства в людях |
Норэтистерон имеет период полувыведения от 5,2 до 12,8 часов, со средним периодом полувыведения 8,0 часов.[1] В метаболизм Норэтистерон очень похож на тестостерон (и нандролон) и происходит в основном за счет уменьшения Δ4 двойная связь до 5α- и 5β-дигидроноретистерона, за которым следует восстановление C3 кето группа к четырем изомеры 3,5-тетрагидроноретистерона.[3] Эти трансформации катализируются 5α- и 5β-редуктаза и 3α- и 3β-гидроксистероид дегидрогеназа как в печень и во внепеченочных тканях, таких как гипофиз, матка, простата, влагалище, и грудь.[83] За исключением 3α, 5α- и 3β, 5α-тетрагидроноретистерона, которые обладают значительным сродством к ER и в некоторой степени являются эстрогенными, 3,5-тетрагидрометаболиты норэтистерона неактивны с точки зрения сродства к рецепторы половых стероидов (в частности, PR, AR и ER).[84][85][86] Небольшое количество норэтистерона также преобразуется ароматаза в EE.[1][3][44] Норэтистерон метаболизируется в печени через гидроксилирование также, в основном CYP3A4.[4] Немного спряжение (включая глюкуронизация и сульфатирование )[83][87] норэтистерона и его метаболитов происходит, несмотря на стерическое препятствие посредством этинильная группа на C17α.[3] Этинильная группа норэтистерона сохраняется примерно в 90% всех его метаболитов.[3]
Норэтистерон используется в противозачаточных таблетках, в отличие от самого прогестерона, потому что он не метаболизируется так быстро, как прогестерон, при пероральном приеме. При пероральном приеме прогестерона он быстро метаболизируется в желудочно-кишечном тракте и печени и расщепляется на множество различных метаболитов. Принимая во внимание, что норэтистерон не так быстро метаболизируется, что позволяет норэтистерону присутствовать в более высоких количествах, что позволяет ему более эффективно конкурировать за сайты связывания рецепторов прогестерона.[3]
Устранение
Норэтистерон устранен От 33 до 81% в моча и от 35 до 43% в кал.[88]
Химия
Норэтистерон, также известный как 17α-этинил-19-нортестостерон или 17α-этинилестра-4-ен-17β-ол-3-он, представляет собой синтетический эстран стероидный препарат и производная из тестостерон.[89][26] Это, в частности, производное тестостерона, в котором этинильная группа был добавлен в позицию C17α и метильная группа в позиции C19 удалена; следовательно, это комбинированная производная от этистерон (17α-этинилтестостерон) и нандролон (19-нортестостерон).[89][26] Эти модификации приводят к увеличению прогестагенный деятельность и устный биодоступность а также уменьшился андрогенный /анаболический Мероприятия.[90]
Производные
Норэтистерон (НЕТТО) является исходное соединение большой группы прогестинов, которая включает большинство прогестинов, известных как производные 19-нортестостерона.[91] Эта группа делится на химическая структура в Estranes (производные норэтистерона) и гонаны (18-метилгонаны или 13β-этилэстраны; производные левоноргестрел ) и включает в себя следующие продаваемые лекарства:[92]
|
|
Некоторые из них действуют как пролекарства норэтистерона, включая NETA, NETE, этинодиола диацетат, линестренол, и кингестанола ацетат.[93][94][95] Норетинодрел также может быть пролекарством норэтистерона.[3][1] НЭТА принимают внутрь аналогично норэтистерону, а НЭТА принимают внутрь инъекция в мышцу.[10]
Не-17α-этинилированный
Прогестины 19-нортестостерона (19-NT), которые технически не являются производными норэтистерона (поскольку они не имеют C17α этинильная группа ), но все еще тесно связаны (с другими заменами в положениях C17α и / или C16β), включают следующие продаваемые лекарства:[89][26]
- C17α винил (этенил) производные норгестерон (17α-винил-δ5(10)-19-NT) и норвинистерон (17α-винил-19-NT)
- C17α аллил производные аллилестренол (3-декето-17α-аллил-19-NT) и Альтреногест (17α-аллил-δ9,11-19-NT)
- C17α алкил производная норметандрон (17α-метил-19-NT)
- C17α цианометил производная диеногест (17α-цианометил-δ9-19-NT)
- Этилпроизводное C16β оксендолон (16β-этил-19-NT)
Много анаболические стероиды семейства 19-нортестостеронов, таких как норетандролон и этилэстренол, также являются сильнодействующими гестагенами, но никогда не продавались как таковые.
Синтез
Химический синтез норэтистерона были опубликованы.[89][81]
Синтез 1
Эстрадиол 3-метиловый эфир (1, EME) частично восстанавливается до 1,5-диена (2), что также происходит на первой стадии синтеза нандролона. Окисление Оппенауэра затем превращает гидроксильную группу C17β в кетонную функциональность (3). Затем он реагирует с металлом. ацетилид в соответствующий C17α этинил сложный (4). Гидролиз енольного эфира в мягких условиях приводит непосредственно к (5),[96] что кажется норэтинодрел (хотя Ледничер заявляет, что в своей книге это «этонодрел» (что может быть синонимом этинодиол ); этонодрел с хлор атом), активный при пероральном приеме прогестин. Это прогестагенный компонент первого оральный контрацептив быть выставленным на продажу (например, Enovid). Обработка этиниленольного эфира сильной кислотой приводит к норэтистерону (6).[11]
На практике эти и все другие комбинированные пероральные контрацептивы представляют собой смеси 1-2% ЭЭ или местранол и устный прогестин. Было высказано предположение, что открытие необходимости эстрогена в дополнение к прогестину для противозачаточной эффективности связано с присутствием небольшого количества невосстановленных ЕМЕ (1) в ранних партиях 2. Это при окислении и этинилирование, конечно, приведет к местранолу (3). В любом случае необходимость наличия эстрогена в смеси теперь хорошо установлена экспериментально.
Синтез 2
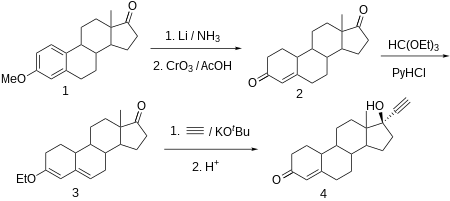
Норэтистерон производится из эстр-4-ен-3,17-дион (боландион), который, в свою очередь, синтезируется частичным восстановлением ароматической области 3-O-метилового эфира эстрон с литием в жидком аммиаке и одновременно с кетогруппой у C17α до гидроксильной группы, которая затем окисляется обратно до кетогруппы посредством триоксид хрома в уксусная кислота. Конъюгированный олефин C4-C5 и карбонильная группа у C3 затем превращается в диенолэтиловый эфир с использованием этилортоформиат. Полученный продукт этинилируют ацетилен в присутствии трет-бутоксид калия. После гидрохлорид гидролиз образовавшегося производного O-калия, в ходе которого простой эфир енола также гидролизуется, а оставшаяся двойная связь сдвигается, получается желаемый норэтистерон.
История
Норэтистерон был впервые синтезирован химиками Луис Мирамонтес, Карл Джерасси, и Джордж Розенкранц в Syntex в Мехико в 1951 г.[11] Это было полученный из этистерон, и было обнаружено, что он обладает примерно в 20 раз большей эффективностью в качестве прогестагена по сравнению с ним.[нужна цитата ] Норэтистерон был первым высокоактивным пероральным прогестаген быть синтезированным, и ему предшествовал (как прогестаген) прогестерон (1934), этистерон (1938), 19-норпрогестерон (1944), и 17α-метилпрогестерон (1949), а также нандролон (1950), тогда как норэтинодрел (1952) и норетандролон (1953) следили за синтезом норэтистерона.[12][13] Препарат был впервые введен в употребление только как Норлутинв США в 1957 году.[14] Впоследствии норэтистерон был введен в комбинации с местранол в качестве Орто-Новум в США в 1963 г. и был вторым прогестином после норэтинодрел в 1960 году для использования в оральный контрацептив.[13] В 1964 г. появились дополнительные противозачаточные препараты, содержащие норэтистерон в сочетании с местранолом или ЭЭ, такие как Норлестрин и Норинил, продавались в США.[13]
Общество и культура
Родовые имена
Норэтистерон это ГОСТИНИЦА и БАН препарата, пока норэтиндрон это его USAN.[89][26]
Фирменные наименования
Норэтистерон (NET), в том числе как NETA и NETE, продается под многими торговыми марками по всему миру.[26][19]
Доступность
Соединенные Штаты
Норэтистерон ранее был доступен отдельно в таблетках по 5 мг под торговой маркой Norlutin в Соединенных Штатах, но с тех пор этот препарат был прекращен в этой стране.[25] Однако НЭТА остается доступным в Соединенных Штатах только в таблетках по 5 мг под торговой маркой «Айгестин».[25] Это один из немногих препаратов, содержащих гестагены, не являющихся противозачаточными, которые остаются доступными в США.[25] Остальные включают прогестерон, медроксипрогестерона ацетат, мегестрола ацетат, и гидроксипрогестерона капроат, а также атипичный агент даназол.[25]
И норэтистерон, и НЭТА также доступны в США в качестве противозачаточных средств.[25] Норэтистерон доступен как отдельно (торговые марки Camila, Errin, Heather, Micronor, Nor-QD, другие), так и в комбинации с EE (Norinyl, Ortho-Novum и др.) Или местранолом (Norinyl, Ortho-Novum и др.), В то время как NETA доступен только в сочетании с ЭЭ (Норлестрин и др.).[25] NETE недоступен в США ни в какой форме.[25][102][103]
Исследование
Норэтистерон, как НЭТА и НЕТЕ, изучался на предмет использования в качестве потенциального мужской гормональный контрацептив в комбинации с тестостерон у мужчин.[104][105]
Норэтистерон длительного действия микросферы за внутримышечная инъекция были изучены для потенциального использования в контроле над рождаемостью.[106]
Рекомендации
- ^ а б c d е ж грамм час Станчик Ф.З. (сентябрь 2002 г.). «Фармакокинетика и эффективность прогестинов, используемых для заместительной гормональной терапии и контрацепции». Обзоры в эндокринных и метаболических расстройствах. 3 (3): 211–24. Дои:10.1023 / А: 1020072325818. PMID 12215716. S2CID 27018468.
- ^ а б Фотерби К. (август 1996 г.). «Биодоступность пероральных половых стероидов, используемых в оральной контрацепции и заместительной гормональной терапии». Контрацепция. 54 (2): 59–69. Дои:10.1016/0010-7824(96)00136-9. PMID 8842581.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа ab ac объявление ае аф аг ах ай эй ак аль являюсь Kuhl H (август 2005 г.). «Фармакология эстрогенов и прогестагенов: влияние разных путей введения» (PDF). Климактерический. 8 Дополнение 1: 3–63. Дои:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ а б c d Корхонен Т., Турпейнен М., Толонен А., Лайне К., Пелконен О. (май 2008 г.). «Идентификация ферментов цитохрома P450 человека, участвующих в биотрансформации in vitro линестренола и норэтиндрона». Журнал стероидной биохимии и молекулярной биологии. 110 (1–2): 56–66. Дои:10.1016 / j.jsbmb.2007.09.025. PMID 18356043. S2CID 10809537.
- ^ а б c d Тайтель Х.Ф., Кафриссен М.Э. (1995). «Норэтиндрон - обзор терапевтического применения». Международный журнал исследований фертильности и менопаузы. 40 (4): 207–23. PMID 8520623.
- ^ Кэтрин Родс Олден; Дейтра Леонард Лоудермилк; Мэри Кэтрин Кэшн; Шеннон Э. Перри (27 декабря 2013 г.). Охрана здоровья матери и женщины - электронная книга. Elsevier Health Sciences. С. 135–. ISBN 978-0-323-29368-6.
- ^ Kuhl H (сентябрь 1990 г.). «Фармакокинетика эстрогенов и прогестагенов». Maturitas. 12 (3): 171–97. Дои:10.1016 / 0378-5122 (90) 90003-о. PMID 2170822.
- ^ https://www.accessdata.fda.gov/drugsatfda_docs/label/2007/018405s023lbl.pdf
- ^ а б c d е ж грамм Якобсон Б.Д. (октябрь 1962 г.). «Опасности терапии норэтиндроном при беременности». Американский журнал акушерства и гинекологии. 84 (7): 962–8. Дои:10.1016/0002-9378(62)90075-3. PMID 14450719.
- ^ а б c d Рабочая группа МАИР по оценке канцерогенных рисков для человека; Всемирная организация здоровья; Международное агентство по изучению рака (2007 г.). Комбинированные эстроген-прогестагенные контрацептивы и комбинированная эстроген-прогестагеновая терапия менопаузы. Всемирная организация здоровья. стр. 417–. ISBN 978-92-832-1291-1.
Норэтистерон и его эфиры ацетата и энантата являются прогестагенами, которые обладают слабыми эстрогенными и андрогенными свойствами.
- ^ а б c d Джерасси, Карл; Miramontes, L .; Rosenkranz, G .; Сондхеймер, Франц (1954). «Стероиды. LIV.1Синтез 19-Nov-17α-этинилтестостерона и 19-Nor-17α-метилтестостерона2». Журнал Американского химического общества. 76 (16): 4092–4094. Дои:10.1021 / ja01645a010. ISSN 0002-7863.
- ^ а б Донна Шоуп (7 ноября 2007 г.). Справочник по контрацепции: руководство по практическому ведению. Springer Science & Business Media. С. 15–. ISBN 978-1-59745-150-5.
- ^ а б c d е Лара Маркс (2010). Сексуальная химия: история противозачаточных таблеток. Издательство Йельского университета. С. 74, 76. ISBN 978-0-300-16791-7.
- ^ а б Издательство William Andrew (22 октября 2013 г.). Энциклопедия фармацевтического производства, 3-е издание. Эльзевир. С. 2935–. ISBN 978-0-8155-1856-3.
- ^ Роберт Энтони Хэтчер; Анита Л. Нельсон, доктор медицины (2007). Противозачаточные технологии. Ярые СМИ. С. 195–. ISBN 978-1-59708-001-9.
- ^ Сулочана Гунашила (14 марта 2011 г.). Практическое лечение гинекологических проблем. JP Medical Ltd. стр. 31–. ISBN 978-93-5025-240-6.
- ^ Граймс Д.А., Лопес Л.М., О'Брайен П.А., Раймонд Э.Г. (ноябрь 2013 г.). «Таблетки, содержащие только прогестин, для контрацепции». Кокрановская база данных систематических обзоров (11): CD007541. Дои:10.1002 / 14651858.CD007541.pub3. PMID 24226383.
- ^ Хуссейн С.Ф. (февраль 2004 г.). «Таблетки, содержащие только прогестоген, и высокое кровяное давление: есть ли связь? Обзор литературы». Контрацепция. 69 (2): 89–97. Дои:10.1016 / j.contraception.2003.09.002. PMID 14759612.
- ^ а б «Норэтистерон».
- ^ «Доступность дженерика Айгестина».
- ^ «ТОП-300 2020». ClinCalc. Получено 11 апреля 2020.
- ^ «Норэтиндрон - Статистика употребления наркотиков». ClinCalc. Получено 11 апреля 2020.
- ^ Ким Дж.Дж., Курита Т., Булун С.Е. (февраль 2013 г.). «Действие прогестерона при раке эндометрия, эндометриозе, миоме матки и раке груди». Эндокринные обзоры. 34 (1): 130–62. Дои:10.1210 / er.2012-1043. ЧВК 3565104. PMID 23303565.
- ^ https://www.drugs.com/international/norethisterone.html
- ^ а б c d е ж грамм час "Drugs @ FDA: одобренные FDA лекарственные препараты". Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Получено 27 ноября 2016. Ошибка цитирования: указанная ссылка "Drugs @ FDA" была определена несколько раз с разным содержанием (см. страница помощи).
- ^ а б c d е ж Index Nominum 2000: Международный справочник лекарственных средств. Тейлор и Фрэнсис. Январь 2000. С. 749–. ISBN 978-3-88763-075-1.
- ^ Рабочая группа МАИР по оценке канцерогенных рисков для человека; Международное агентство по изучению рака (1 января 1999 г.). Гормональная контрацепция и гормональная терапия в постменопаузе (PDF). МАИР. п. 65. ISBN 978-92-832-1272-0. Сложить резюме.
- ^ а б c d е Джеффри К. Аронсон (21 февраля 2009 г.). Побочные эффекты Мейлера эндокринных и метаболических препаратов. Эльзевир. С. 217, 253, 275. ISBN 978-0-08-093292-7.
- ^ Hägglund H, Remberger M, Klaesson S, Lönnqvist B, Ljungman P, Ringdén O (декабрь 1998 г.). «Лечение норэтистероном, основным фактором риска веноокклюзионных заболеваний печени после аллогенной трансплантации костного мозга». Кровь. 92 (12): 4568–72. Дои:10.1182 / кровь.V92.12.4568. PMID 9845522.
- ^ а б Cornia PB, Anawalt BD (ноябрь 2004 г.). «Мужская гормональная контрацепция». Мнение экспертов о новых лекарствах. 9 (2): 335–44. Дои:10.1517/14728214.9.2.335. PMID 15571489. S2CID 26886374.
- ^ а б Корниа, Пол Б; Анавальт, Брэдли Д. (2005). «Мужские гормональные контрацептивы: потенциально патентоспособный и прибыльный продукт». Экспертное заключение о терапевтических патентах. 15 (12): 1727–1737. Дои:10.1517/13543776.15.12.1727. ISSN 1354-3776. S2CID 83941717.
- ^ а б c Kamischke A, Heuermann T, Krüger K, von Eckardstein S, Schellschmidt I, Rübig A, Nieschlag E (февраль 2002 г.). «Эффективный гормональный мужской контрацептив с использованием ундеканоата тестостерона с пероральными или инъекционными препаратами норэтистерона». Журнал клинической эндокринологии и метаболизма. 87 (2): 530–9. Дои:10.1210 / jcem.87.2.8218. PMID 11836281.
- ^ а б Джанкинс-Хопкинс Дж. М. (март 2010 г.). «Гормональная терапия от прыщей». Журнал Американской академии дерматологии. 62 (3): 486–8. Дои:10.1016 / j.jaad.2009.12.002. PMID 20159314.
- ^ а б Arowojolu AO, Gallo MF, Lopez LM, Grimes DA (июль 2012 г.). Аровожолу АО (ред.). «Комбинированные оральные противозачаточные таблетки для лечения акне». Кокрановская база данных систематических обзоров (7): CD004425. Дои:10.1002 / 14651858.CD004425.pub6. PMID 22786490.
- ^ ван Влотен В.А., Сигурдссон В. (2004). «Выбор орального контрацептива для лечения акне у женщин». Американский журнал клинической дерматологии. 5 (6): 435–41. Дои:10.2165/00128071-200405060-00008. PMID 15663340. S2CID 9947402.
- ^ а б Почи П.Е., Штраус Дж.С. (декабрь 1965 г.). «Недостаток андрогенного действия на сальные железы человека при низких дозах норэтиндрона». Американский журнал акушерства и гинекологии. 93 (7): 1002–4. Дои:10.1016/0002-9378(65)90162-6. PMID 5843402.
- ^ а б c d Kuhnz W, Heuner A, Hümpel M, Seifert W, Michaelis K (декабрь 1997 г.). «Превращение норэтистерона и норэтистерона ацетата в этинилэтрадиол in vivo у женщин в постменопаузе». Контрацепция. 56 (6): 379–85. Дои:10.1016 / с0010-7824 (97) 00174-1. PMID 9494772.
- ^ а б Карвен, С. (1962). «Вирилизация с норэтистероном». BMJ. 1 (5289): 1415. Дои:10.1136 / bmj.1.5289.1415-а. ISSN 0959-8138. ЧВК 1958463.
- ^ а б c d Roxburgh DR, West MJ (август 1973). «Использование норэтистерона для подавления менструации у умственно отсталых женщин». Медицинский журнал Австралии. 2 (7): 310–3. Дои:10.5694 / j.1326-5377.1973.tb128175.x. PMID 4746398.
- ^ а б c Roxburgh DR, West MJ (август 1973). «Использование норэтистерона для подавления менструации у умственно отсталых женщин». Медицинский журнал Австралии. 2 (7): 310–3. Дои:10.1097/00006254-197408000-00021. PMID 4746398.
- ^ Правление JA (апрель 1965 г.). «КЛИНИЧЕСКАЯ ОЦЕНКА ОРАЛЬНОГО КОНТРАЦЕПТИВНОГО ИСПОЛЬЗОВАНИЯ НОРЕТИНДРОНА 5 МГ. ПЛЮС МЕСТРАНОЛ 0,075 МГ». Журнал Канадской медицинской ассоциации. 92: 814–7. ЧВК 1927985. PMID 14272499.
- ^ Kaser DJ, Missmer SA, Берри KF, Laufer MR (апрель 2012 г.). «Использование только ацетата норэтиндрона для послеоперационного подавления симптомов эндометриоза». Журнал детской и подростковой гинекологии. 25 (2): 105–108. Дои:10.1016 / j.jpag.2011.09.013. PMID 22154396.
- ^ а б Полсен, Калифорния, Лич Р., Ланман Дж., Голдстон Н., Мэддок В. О., Хеллер К. Г. (октябрь 1962 г.). «Собственная эстрогенность норэтиндрона и норэтинодрела: сравнение с другими синтетическими прогестинами и прогестероном». Журнал клинической эндокринологии и метаболизма. 22 (10): 1033–9. Дои:10.1210 / jcem-22-10-1033. PMID 13942007.
- ^ а б Chu MC, Zhang X, Gentzschein E, Stanczyk FZ, Lobo RA (июнь 2007 г.). «Образование этинилэстрадиола у женщин во время лечения норэтиндрона ацетатом». Журнал клинической эндокринологии и метаболизма. 92 (6): 2205–7. Дои:10.1210 / jc.2007-0044. PMID 17341557.
- ^ Энн Коннолли; Аманда Бриттон (31 марта 2017 г.). Женское здоровье в первичной медико-санитарной помощи. Издательство Кембриджского университета. С. 153–. ISBN 978-1-108-16595-2.
- ^ а б Фаррис М., Бастианелли С., Розато Е., Бросенс I, Бенаджиано Дж. (Октябрь 2017 г.). «Фармакодинамика комбинированных эстроген-прогестиновых оральных контрацептивов: 2. Влияние на гемостаз». Обзор клинической фармакологии. 10 (10): 1129–1144. Дои:10.1080/17512433.2017.1356718. PMID 28712325. S2CID 205931204.
- ^ а б https://www.accessdata.fda.gov/drugsatfda_docs/label/2014/016954s106lbl.pdf
- ^ а б c d Kuhl H (2011). «Фармакология прогестагенов» (PDF). J Reproduktionsmed Эндокринол. 8 (1): 157–177.
- ^ Чу Й.Х., Ли К.А., Чжао Ц.Ф., Чжоу Ю.П., Цао, округ Колумбия (июнь 1985 г.). «[Антипрогестативное действие 5 альфа-дигидроноретистерона]». Чжунго Яо Ли Сюэ Бао = Acta Pharmacologica Sinica (на китайском языке). 6 (2): 125–9. PMID 2934946.
- ^ Линда Э. Маккуистион; Джойс Лефевер Ки; Эвелин Р. Хейс (25 марта 2014 г.). Фармакология: подход к сестринскому процессу, ориентированный на пациента. Elsevier Health Sciences. С. 846–. ISBN 978-0-323-29348-8.
- ^ Гринблатт РБ (июль 1956 г.). «Прогестативная активность 17-альфа-этинил-19-нортестостерона». Журнал клинической эндокринологии и метаболизма. 16 (7): 869–75. Дои:10.1210 / jcem-16-7-869. PMID 13332050.
- ^ Fragkaki AG, Angelis YS, Koupparis M, Tsantili-Kakoulidou A, Kokotos G, Georgakopoulos C (февраль 2009 г.). «Структурные характеристики анаболических андрогенных стероидов, способствующие связыванию с рецептором андрогенов и их анаболической и андрогенной активности. Прикладные модификации стероидной структуры». Стероиды. 74 (2): 172–97. Дои:10.1016 / j.steroids.2008.10.016. PMID 19028512. S2CID 41356223.
Многие синтетические стероиды с высокой миотрофической активностью проявляют миотрофно-андрогенную диссоциацию, поскольку из-за изменений, внесенных в структуру кольца A, они, вероятно, не будут субстратами для 5α-редуктаз [85]. 5α-уменьшение не всегда усиливает андрогенную активность, несмотря на высокий уровень RBA андрогенов в AR. Так обстоит дело с норэтистероном (рис.1, 34), синтетическое производное 19-нор-17α-этинилтестостерона, которое также подвергается ферментно-опосредованному восстановлению 5α и оказывает сильные андрогенные эффекты на органы-мишени. 5α-Восстановленный норэтистерон демонстрирует более высокое связывание AR, но демонстрирует значительно более низкую андрогенную активность, чем неизмененный норэтистерон [102,103].
- ^ а б c Лемус А.Е., Энрикес Дж., Гарсия Г.А., Грильяска I, Перес-Паласиос Дж. (Январь 1997 г.). «5альфа-редукция норэтистерона увеличивает его сродство к связыванию с рецепторами андрогенов, но снижает его андрогенное действие». Журнал стероидной биохимии и молекулярной биологии. 60 (1–2): 121–9. Дои:10.1016 / s0960-0760 (96) 00172-0. PMID 9182866. S2CID 33771349.
- ^ Маркус Фильши; Джон Гийбо (22 октября 2013 г.). Контрацепция: наука и практика. Elsevier Science. С. 26–. ISBN 978-1-4831-6366-6.
Норэтистерон связывается с SHBG с меньшей аффинностью, чем эндогенные андрогены и эстрогены [...]
- ^ Рикардо Аззиз (8 ноября 2007 г.). Нарушения избытка андрогенов у женщин. Springer Science & Business Media. С. 124–. ISBN 978-1-59745-179-6.
- ^ Койпер Г.Г., Карлссон Б., Грандиен К., Энмарк Э., Хэггблад Дж., Нильссон С., Густафссон Дж. А. (март 1997 г.). «Сравнение специфичности связывания лиганда и распределения транскриптов в тканях рецепторов эстрогена альфа и бета». Эндокринология. 138 (3): 863–70. Дои:10.1210 / endo.138.3.4979. PMID 9048584.
- ^ Wiegratz I, Kuhl H (сентябрь 2006 г.). «Метаболические и клинические эффекты прогестагенов». Европейский журнал контрацепции и репродуктивного здоровья. 11 (3): 153–61. Дои:10.1080/13625180600772741. PMID 17056444. S2CID 27088428.
- ^ а б Giatti S, Melcangi RC, Pesaresi M (август 2016 г.). «Другая сторона прогестинов: воздействие на мозг». Журнал молекулярной эндокринологии. 57 (2): R109-26. Дои:10.1530 / JME-16-0061. PMID 27339142.
- ^ а б c Ямамото Т., Тамура Т., Китаваки Дж., Осава И., Окада Х. (июнь 1994 г.). «Самоубийственная инактивация ароматазы в плаценте человека и лейомиоме матки 5-альфа-дигидроноретиндроном, метаболитом норэтиндрона, и его влияние на стероид-продуцирующие ферменты». Европейский журнал эндокринологии. 130 (6): 634–40. Дои:10.1530 / eje.0.1300634. PMID 8205267.
- ^ Перуския М., Вильялон С.М., Наваррете Э., Гарсия Г.А., Перес-Паласиос Г., Лемус А.Е. (август 2003 г.). «Сосудорасширяющий эффект норэтистерона и его 5 альфа-метаболитов: новое негеномное действие». Европейский журнал фармакологии. 475 (1–3): 161–9. Дои:10.1016 / с0014-2999 (03) 02106-х. PMID 12954372.
- ^ а б Neubauer H, Ma Q, Zhou J, Yu Q, Ruan X, Seeger H и др. (Октябрь 2013). «Возможная роль PGRMC1 в развитии рака груди». Климактерический. 16 (5): 509–13. Дои:10.3109/13697137.2013.800038. PMID 23758160. S2CID 29808177.
- ^ Траберт Б., Шерман М.Э., Каннан Н., Станчик Ф.З. (апрель 2020 г.). «Прогестерон и рак груди». Эндокринные обзоры. 41 (2): 320–344. Дои:10.1210 / endrev / bnz001. ЧВК 7156851. PMID 31512725.
- ^ Андерсон Р.А., Бэрд Д.Т. (декабрь 2002 г.). «Мужская контрацепция» (PDF). Эндокринные обзоры. 23 (6): 735–62. Дои:10.1210 / er.2002-0002. PMID 12466187.
- ^ а б Kamischke A, Nieschlag E (январь 2004 г.). «Прогресс в направлении гормональной мужской контрацепции». Тенденции в фармакологических науках. 25 (1): 49–57. Дои:10.1016 / j.tips.2003.11.009. PMID 14723979.
- ^ Рудель HW (сентябрь 1968 г.). «Фармакология оральных контрацептивов». Клиническое акушерство и гинекология. 11 (3): 632–44. Дои:10.1097/00003081-196811030-00002. PMID 4878826.
- ^ Станчик Ф.З. (ноябрь 2003 г.). «Не все прогестины созданы равными». Стероиды. 68 (10–13): 879–90. Дои:10.1016 / j.steroids.2003.08.003. PMID 14667980. S2CID 44601264.
- ^ Эндрикат Дж., Герлингер С., Ричард С., Розенбаум П., Дюстерберг Б. (декабрь 2011 г.). «Дозы ингибирования овуляции прогестинов: систематический обзор доступной литературы и препаратов, продаваемых во всем мире». Контрацепция. 84 (6): 549–57. Дои:10.1016 / j.contraception.2011.04.009. PMID 22078182.
- ^ Шоуп, Донна (1993). «Инъекционные противозачаточные средства и противозачаточные вагинальные кольца». Клинические перспективы в акушерстве и гинекологии: 144–157. Дои:10.1007/978-1-4612-2730-4_13. ISBN 978-1-4612-7645-6. ISSN 0178-0328.
- ^ Вайнер Э., Йоханссон Э.Д. (апрель 1975 г.). «Уровни норэтиндрона в плазме после внутримышечной инъекции 200 мг норэтиндронэнантата». Контрацепция. 11 (4): 419–25. Дои:10.1016/0010-7824(75)90004-9. PMID 1122756.
- ^ Фотерби К., Ховард Дж., Шриманкер К., старейшина М., Пока П. Г. (декабрь 1977 г.). «Влияние норэтистерона оенантата на уровни гонадотропина в сыворотке». Контрацепция. 16 (6): 591–604. Дои:10.1016/0010-7824(77)90060-9. PMID 606499.
- ^ Goebelsmann U, Stanczyk FZ, Brenner PF, Goebelsmann AE, Gentzschein EK, Mishell DR (март 1979). «Концентрации норэтиндрона (NET) в сыворотке крови после внутримышечной инъекции энантата NET. Влияние на сывороточный ЛГ, ФСГ, эстрадиол и прогестерон». Контрацепция. 19 (3): 283–313. Дои:10.1016/0010-7824(79)90022-2. PMID 572279.
- ^ а б Нойман Ф., Диалло Ф.А., Хасан С.Х., Шенк Б., Траоре I (1976). «Влияние фармацевтических препаратов на мужскую фертильность». Андрология. 8 (3): 203–35. Дои:10.1111 / j.1439-0272.1976.tb02137.x. PMID 793446. S2CID 24859886.
- ^ Хеллер CG, Лейдлоу WM, Харви HT, Нельсон WO (июль 1958 г.). «Влияние прогестагенных соединений на репродуктивные процессы мужчины». Летопись Нью-Йоркской академии наук. 71 (5): 649–65. Дои:10.1111 / j.1749-6632.1958.tb54641.x. PMID 13583821.
- ^ Хеллер К. Г., Мур Д. Д., Полсен Калифорния, Нельсон В. О., Лейдлоу В. М. (декабрь 1959 г.). «Влияние прогестерона и синтетических прогестинов на репродуктивную физиологию нормальных мужчин». Слушания Федерации. 18: 1057–65. PMID 14400846.
- ^ Паулсен CA (март 1965 г.). «МЕТАБОЛИЗМ ПРОГЕСТИНА: ОСОБЫЕ УКАЗАНИЯ НА ЭСТРОГЕННЫЕ ПУТИ». Метаболизм. 14 (3): ПРИЛОЖЕНИЕ: 313-9. Дои:10.1016/0026-0495(65)90018-1. PMID 14261416.
- ^ Мудгал Н. Р., Суреш Р. (1995). «Некоторые мысли о разработке мужских контрацептивов на химической основе» (PDF). Современная наука (Бангалор). 68 (4): 470–474. ISSN 0011-3891.
- ^ Johonsson, Elof D.B .; Нигрен, Карл-Госта (1973). «Снижение уровня тестостерона в плазме у мужчин с норэтиндроном». Контрацепция. 8 (3): 219–226. Дои:10.1016/0010-7824(73)90032-2. ISSN 0010-7824.
- ^ Амори, Джон К. (2003). «Андрогены и мужская контрацепция». Андрогены в здоровье и болезнях: 405–417. Дои:10.1007/978-1-59259-388-0_21. ISBN 978-1-61737-314-5.
- ^ Kamischke A, Diebäcker J, Nieschlag E (сентябрь 2000 г.). «Возможности норэтистерона энантата для мужской контрацепции: фармакокинетика и подавление функции гипофиза и гонад». Клиническая эндокринология. 53 (3): 351–8. Дои:10.1046 / j.1365-2265.2000.01097.x. PMID 10971453. S2CID 70515136.
- ^ Petry, R .; Mauss, J .; Senge, Th .; Рауш-Штроманн, Ж.-Г. (1970). "Über den Einfluß von Cyproteronacetat, Norethisteronönanthat und Gestonoroncapronat auf die Hypophysen-Gonadenachse beim Mann" [Влияние ципротерона-ацетата, норэтистерон-энантата и гестонорон-капроната на гипоадофизион]. Endokrinologie der Entwicklung und Reifung: 428–430. Дои:10.1007/978-3-642-80591-2_118.
- ^ а б Die Gestagene. Springer-Verlag. 27 ноября 2013. С. 13–14, 283–284. ISBN 978-3-642-99941-3.
- ^ Фридрих С., Берсе М., Кляйн С., Роде Б., Хёхель Дж. (Июнь 2018 г.). «Образование этинилэстрадиола in vivo после внутримышечного введения норэтистерона энантата». Журнал клинической фармакологии. 58 (6): 781–789. Дои:10.1002 / jcph.1079. PMID 29522253. S2CID 3813229.
- ^ а б Schoonen WG, Deckers GH, de Gooijer ME, de Ries R, Kloosterboer HJ (ноябрь 2000 г.). «Гормональные свойства норэтистерона, 7альфа-метил-норэтистерона и их производных». Журнал стероидной биохимии и молекулярной биологии. 74 (4): 213–22. Дои:10.1016 / с0960-0760 (00) 00125-4. PMID 11162927. S2CID 19797254.
[...] несколько моно- и дисульфатированных, а также моно- и диглюкуронидированных метаболитов NET были обнаружены в моче у женщин, получавших NET [16,17]. В неконъюгированной форме эти метаболиты NET (или MeNET) представлены 5α- и 5β-восстановленными NET (5α-NET или 5β-NET) и 3α- и 3β-гидрированными 5α-NET и 5β-NET, что приводит к 3α, 5α. -NET, 3β, 5α-NET, 3α, 5β-NET и 3β, 5β-NET или их соответствующие метаболиты MeNET (рис. 1 и 2). Эти стероидные превращения NET или MeNET могут происходить в печени, но также в гипофизе, эндометрии, простате, влагалище и груди. Ферментами, участвующими в этих метаболических процессах, являются 5α- и 5β-редуктаза, а также 3α- и 3β-гидроксистероиддегидрогеназа (HSD).
- ^ Чавес Б.А., Вильчис Ф., Перес А.Е., Гарсия Г.А., Грильяска I, Перес-Паласиос Г. (январь 1985 г.). «Стереоспецифичность внутриклеточного связывания норэтистерона и его метаболитов, сниженных по А-кольцу». Журнал стероидной биохимии. 22 (1): 121–6. Дои:10.1016/0022-4731(85)90151-7. PMID 3871879.
- ^ Гарса-Флорес Дж., Вильчис Ф., Гарсия Г.А., Менживар М., Перес-Паласиос Дж. (Июнь 1986 г.). «Уменьшение А-кольца усиливает антигонадотропный эффект норэтистерона». Acta Endocrinologica. 112 (2): 278–83. Дои:10.1530 / acta.0.1120278. PMID 3090814.
- ^ Лемус А.Е., Энрикес Дж., Эрнандес А., Сантильян Р., Перес-Паласиос Дж. (Февраль 2009 г.). «Биоконверсия норэтистерона, агониста рецептора прогестерона, в агонист рецептора эстрогена в остеобластических клетках». Журнал эндокринологии. 200 (2): 199–206. Дои:10.1677 / JOE-08-0166. PMID 19008332.
- ^ Скарси К.К., Дарин К.М., Чаппелл КА, Ниц С.М., Ламорд М. (ноябрь 2016 г.). «Лекарственное взаимодействие, эффективность и безопасность гормональных контрацептивов у женщин, живущих с ВИЧ». Безопасность лекарств. 39 (11): 1053–1072. Дои:10.1007 / s40264-016-0452-7. ЧВК 5048570. PMID 27562873.
- ^ Лесли Дж. ДеГрут (2001). Эндокринология. W.B. Saunders Co. стр. 2617. ISBN 978-0-7216-7843-6.
- ^ а б c d е Elks J (14 ноября 2014 г.). Словарь лекарственных средств: химические данные: химические данные, структуры и библиографии. Springer. С. 886–. ISBN 978-1-4757-2085-3.
- ^ Chwalisz K, Surrey E, Stanczyk FZ (июнь 2012 г.). «Гормональный профиль ацетата норэтиндрона: обоснование дополнительной терапии агонистами гонадотропин-рилизинг гормона у женщин с эндометриозом». Репродуктивные науки. 19 (6): 563–71. Дои:10.1177/1933719112438061. PMID 22457429. S2CID 2882899.
- ^ Донна Шоуп; Флоренс П. Хазелтин (6 декабря 2012 г.). Контрацепция. Springer Science & Business Media. С. 112–. ISBN 978-1-4612-2730-4.
- ^ Кеннет Дж. Райан (1999). Кистнер гинекология и женское здоровье. Мосби. п. 292. ISBN 978-0-323-00201-1.
- ^ Хаммерштейн Дж (декабрь 1990 г.). «Пролекарства: преимущество или недостаток?». Американский журнал акушерства и гинекологии. 163 (6, п. 2): 2198–203. Дои:10.1016 / 0002-9378 (90) 90561-К. PMID 2256526.
- ^ Эдельман А.Б., Черала Г., Станчик Ф.З. (октябрь 2010 г.). «Метаболизм и фармакокинетика противозачаточных стероидов у женщин с ожирением: обзор». Контрацепция. 82 (4): 314–23. Дои:10.1016 / j.contraception.2010.04.016. PMID 20851224.
- ^ Raynaud JP, Ojasoo T (ноябрь 1986). «Дизайн и использование антагонистов половых стероидов». Журнал стероидной биохимии. 25 (5B): 811–33. Дои:10.1016/0022-4731(86)90313-4. PMID 3543501.
Аналогичный андрогенный потенциал присущ норэтистерону и его пролекарствам (норэтистерона ацетат, этинодиолдиацетат, линестренол, норэтинодрел, квингестанол [ацетат]).
- ^ а б Фрэнк Б. Колтон, Патент США 2,655,518 (С 1952 по Searle & Co).
- ^ Ringold, H.J .; Rosenkranz, G .; Sondheimer, F. (1956). «Стероиды. LXXX.11-Метил-19-нортестостерон и 1-Метил-17α-этинил-19-нортестостерон». Журнал Американского химического общества. 78 (11): 2477–2479. Дои:10.1021 / ja01592a037.
- ^ Ueberwasser, H .; Heusler, K .; Kalvoda, J .; Meystre, C .; Wieland, P .; Anner, G .; Веттштейн, А. (1963). "19-Norsteroide II. Ein einfaches Herstellungsverfahren für 19-Norandrostan-Derivate. Über Steroide, 193. Mitteilung". Helvetica Chimica Acta. 46: 344–352. Дои:10.1002 / hlca.19630460135.
- ^ Онкен Д., Хойблен Д. (январь 1970 г.). «[Этинилированные стероиды]». Die Pharmazie. 25 (1): 3–9. PMID 4914401.
- ^ Патент США 2744122
- ^ Патент США 2774777
- ^ Верн Л. Буллоу (2001). Энциклопедия контроля рождаемости. ABC-CLIO. С. 145–. ISBN 978-1-57607-181-6.
- ^ Эллен Х. Московиц; Брюс Дженнингс (13 сентября 1996 г.). Принудительная контрацепция?: Моральные и политические проблемы длительного контроля над рождаемостью. Издательство Джорджтаунского университета. С. 40–. ISBN 978-1-58901-807-5.
- ^ Nieschlag E (ноябрь 2010 г.). «Клинические испытания мужской гормональной контрацепции» (PDF). Контрацепция. 82 (5): 457–70. Дои:10.1016 / j.contraception.2010.03.020. PMID 20933120.
- ^ Нишлаг, Эберхард; Behre, Hermann M .; Нишлаг, Эберхард; Behre, Hermann M .; Нишлаг, Сьюзен (2012). Нишлаг, Эберхард; Behre, Hermann M; Nieschlag, Susan (ред.). «Существенная роль тестостерона в гормональной мужской контрацепции». Тестостерон: 470–493. Дои:10.1017 / CBO9781139003353.023. ISBN 9781139003353.
- ^ Benagiano G, Primiero FM (июнь 1983 г.). «Противозачаточные средства длительного действия. Текущее состояние». Наркотики. 25 (6): 570–609. Дои:10.2165/00003495-198325060-00003. PMID 6223801. S2CID 45898359.
дальнейшее чтение
- Брогден Р.Н., Спейт TM, Эйвери Г.С. (1973). «Пероральные контрацептивы, содержащие только прогестагены: предварительный отчет о действии и клиническом применении норгестрела и норэтистерона». Наркотики. 6 (3): 169–81. Дои:10.2165/00003495-197306030-00004. PMID 4130566. S2CID 42295736.
- «Норэтистерон и ацетат норэтистерона». Монографии МАИР по оценке канцерогенного риска химических веществ для человека. 21: 441–60. Декабрь 1979 г. PMID 120838.
- Станчик Ф.З., Рой С. (июль 1990 г.). «Метаболизм левоноргестрела, норэтиндрона и структурно родственных противозачаточных стероидов». Контрацепция. 42 (1): 67–96. Дои:10.1016 / 0010-7824 (90) 90093-б. PMID 2143719.
- Wiseman LR, McTavish D (март 1994). «Трансдермальный эстрадиол / норэтистерон. Обзор его фармакологических свойств и клинического применения у женщин в постменопаузе». Наркотики и старение. 4 (3): 238–56. Дои:10.2165/00002512-199404030-00006. PMID 8199397. S2CID 68007924.
- Тайтель Х.Ф., Кафриссен М.Э. (1995). «Норэтиндрон - обзор терапевтического применения». Международный журнал исследований фертильности и менопаузы. 40 (4): 207–23. PMID 8520623.
- Майер В.Е., Герман-младший (август 2001 г.). «Фармакология и токсикология этинилэстрадиола и норэтиндрона ацетата у экспериментальных животных». Нормативная токсикология и фармакология. 34 (1): 53–61. Дои:10.1006 / rtph.2001.1483. PMID 11502156.
- Riis BJ, Lehmann HJ, Christiansen C (октябрь 2002 г.). «Норэтистерона ацетат в сочетании с эстрогеном: влияние на скелет и другие органы. Обзор». Американский журнал акушерства и гинекологии. 187 (4): 1101–16. Дои:10.1067 / моб.2002.122852. PMID 12389012.
- Дрейпер Б.Х., Моррони С., Хоффман М., Смит Дж., Бексинска М., Хэпгуд Дж., Ван дер Мерве Л. (июль 2006 г.). «Депо медроксипрогестерона по сравнению с норэтистерона оэнантатом для прогестагенной контрацепции длительного действия». Кокрановская база данных систематических обзоров (3): CD005214. Дои:10.1002 / 14651858.CD005214.pub2. PMID 16856087.
- Kuhl H, Wiegratz I (август 2007 г.). «Могут ли производные 19-нортестостерона ароматизироваться в печени взрослых людей? Есть ли клинические последствия?». Климактерический. 10 (4): 344–53. Дои:10.1080/13697130701380434. PMID 17653961. S2CID 20759583.
- Кейси CL, Мюррей Калифорния (2008). «Новости HT: в центре внимания комбинированная терапия эстрадиолом / норэтиндрона ацетатом». Клинические вмешательства при старении. 3 (1): 9–16. Дои:10.2147 / cia.s1663. ЧВК 2544373. PMID 18488874.
- Полен М.Э., Кертис К.М. (октябрь 2009 г.). «Когда женщине можно делать повторные инъекции только прогестагена - депо медроксипрогестерона ацетат или норэтистерон энантат?». Контрацепция. 80 (4): 391–408. Дои:10.1016 / j.contraception.2009.03.023. PMID 19751863.
- Chwalisz K, Surrey E, Stanczyk FZ (июнь 2012 г.). «Гормональный профиль ацетата норэтиндрона: обоснование дополнительной терапии агонистами гонадотропин-рилизинг гормона у женщин с эндометриозом». Репродуктивные науки. 19 (6): 563–71. Дои:10.1177/1933719112438061. PMID 22457429. S2CID 2882899.
внешняя ссылка
- «Норэтиндрон». Портал информации о наркотиках. Национальная медицинская библиотека США.