Полиэстрадиолфосфат - Polyestradiol phosphate
 | |
 Строение скелета полиэстрадиолфосфата (вверху) и клюшка из эстрадиолфосфат (один мономер фосфата полиэстрадиола) (внизу) | |
| Клинические данные | |
|---|---|
| Торговые наименования | Эстрадурин, Эстрадурин |
| Другие имена | PEP; Полимер фосфата эстрадиола; Эстрадиол-17β-фосфатный полимер; Полимер эстрадиола с фосфорной кислотой; Лев-114 |
| AHFS /Drugs.com | Международные названия лекарств |
| Беременность категория |
|
| Маршруты администрация | Внутримышечная инъекция[1][2] |
| Класс препарата | Эстроген; Эстрогеновый эфир |
| Код УВД | |
| Легальное положение | |
| Легальное положение |
|
| Фармакокинетический данные | |
| Биодоступность | Я: Высоко |
| Связывание с белками | Эстрадиол: ~ 98% (до альбумин и SHBG )[3][4][1] |
| Метаболизм | В основном в печень, в меньшей степени в почки, гонады, и мышца (к фосфатазы )[1] |
| Метаболиты | Эстрадиол, фосфорная кислота, и метаболиты эстрадиола[5][6] |
| Устранение период полураспада | PEP: 70 дней (10 недель)[7] Эстрадиол: 1-2 часа[8] |
| Экскреция | Моча (так как конъюгирует )[1] |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem SID | |
| DrugBank | |
| ChemSpider |
|
| UNII | |
| КЕГГ | |
| ЧЭМБЛ | |
| Химические и физические данные | |
| Формула | (C18ЧАС23О4П)п (n = переменная; п = 13) |
| Молярная масса | Полимер: Переменная Повторять блок: 334,347 г / моль |
| Температура плавления | От 195 до 202 ° C (от 383 до 396 ° F) |
| (проверить) | |
Полиэстрадиолфосфат (PEP), продается под торговой маркой Эстрадурин, является эстроген лекарство, которое используется в основном для лечения рак простаты у мужчин.[1][9][2][10] Он также используется женщинами для лечения рак молочной железы, как компонент гормональная терапия лечить низкий уровень эстрогена и менопаузальный симптомы, и как компонент феминизирующая гормональная терапия за трансгендерные женщины.[1][11] Это дается инъекция в мышцу раз в четыре недели.[1][2][12]
Общий побочные эффекты PEP включают Головная боль, болезненность молочных желез, развитие груди, феминизация, сексуальная дисфункция, бесплодие, и вагинальное кровотечение.[1][2] PEP - это синтетический эстроген и, следовательно, является агонист из рецептор эстрогена, то биологическая мишень из эстрогены подобно эстрадиол.[2][6][5] Это эфир эстрогена в виде полимер и чрезвычайно длительный пролекарство из эстрадиол в организме.[2][12][5][6] Время, необходимое для приема 50% дозы ПКП. устранен из организма больше двух месяцев.[7] Поскольку PEP работает путем преобразования в эстрадиол, он считается естественный и биоидентичный форма эстрогена.[5][2] В безопасность профиль парентеральный сложные эфиры эстрадиола, такие как PEP, значительно улучшены по сравнению с синтетическими устный эстрогены как этинилэстрадиол и диэтилстильбестрол.[2]
PEP был открыт примерно в 1953 году и использовался в медицине в Соединенные Штаты в 1957 г.[12][13][14] Вместе с эстрадиол ундецилат и эстрадиола валерат, он часто использовался в США и Европа как парентеральная форма эстрогена для лечения мужчин с раком простаты.[15] Однако он больше не доступен в США.[13][16]
Медицинское использование
PEP используется как внутримышечная инъекция за эстрогеновая терапия рака простаты у мужчин.[1][2] Он также используется для лечения рак молочной железы у женщин старше 5 лет постменопаузальный.[1][17][18] Кроме того, PEP используется в заместительная гормональная терапия за низкий уровень эстрогена из-за гипогонадизм или менопауза у женщин.[1] Он также используется в феминизирующая гормональная терапия за трансгендерные женщины.[11][19] PEP - это форма высокие дозы эстрогена терапия.[2] После инъекции очень медленно высвобождает активное вещество. эстрадиол в течение как минимум нескольких месяцев.[20][7]
PEP сравнивали с комбинированная андрогенная блокада (ТАКСИ; кастрация плюс флутамид ) для лечения рака простаты в большом рандомизированном клиническое испытание 915 пациентов.[21][22] Через 18,5 месяцев разницы в выживание или сердечно-сосудистая токсичность между двумя методами лечения.[21][22] Эти данные предполагают, что парентеральный формы эстрадиола могут иметь похожие эффективность и безопасность относительно андрогенная депривационная терапия (ADT) в лечении рака простаты.[21][22] Кроме того, эстрогены могут иметь значительные преимущества по сравнению с ADT с точки зрения потеря костной массы и переломы, приливы, сексуальная функция, и качество жизни, а также значительная экономия затрат на парентеральные формы эстрадиола по сравнению с ГнРГ аналог терапия.[21][22] С другой стороны, болезненность молочных желез и гинекомастия очень часто возникают при приеме эстрогенов, тогда как при кастрации и КАВ частота низка.[23] Однако гинекомастия, вызванная эстрогенами, обычно бывает легкой или средней степени тяжести и обычно вызывает лишь умеренный дискомфорт.[2] Кроме того, гинекомастию, вызванную эстрогенами, можно предотвратить с помощью профилактический облучение груди или можно исправить с помощью мастэктомия.[2]
PEP изучалась для лечения рака простаты в дозах 160 мг / месяц (три исследования) и 240 мг / месяц (четыре исследования).[24] При дозировке 160 мг / мес ПКП не полностью подавляет тестостерон уровней, не достигая диапазона кастрации, и значительно уступает орхиэктомия в замедлении прогрессирования болезни.[24][2] И наоборот, ПКП в дозировке 240 мг / мес приводит к большему подавлению тестостерона до диапазона кастрации, как и орхиэктомия, и по эффективности эквивалентен орхиэктомии.[24][2]
При раке простаты у мужчин ПКП обычно назначают в дозировке от 80 до 320 мг каждые 4 недели в течение первых 2–3 месяцев для быстрого повышения уровня эстрадиола.[1] После этого для поддержания уровня эстрадиола дозировку обычно снижают до 40–160 мг каждые 4 недели на основании клинических данных и лабораторных параметров.[1] При раке груди и низком уровне эстрогена у женщин дозировка составляет от 40 до 80 мг каждые 4 недели.[1] Для трансгендерных женщин доза составляет от 80 до 160 мг каждые 4 недели.[11][19][25][5]
Доступные формы
PEP предоставляется в виде порошка или водный раствор в флаконы и ампулы отдельно или в сочетании с мепивакаин и / или никотинамид (витамин B3 ) для администрирования через внутримышечная инъекция.[1][26][27] Мепивакаин - это местный анестетик и используется, чтобы избежать обжигающее ощущение во время инъекции PEP.[1] Каждый флакон / ампула эстрадурина содержит 80 мг PEP, 5 мг мепивакаина гидрохлорида, 40 мг никотинамида и 2 мл воды.[27]
Противопоказания
В противопоказания PEP в основном такие же, как и у эстрадиола, и включают:[1][28][29][30][31]
- Гиперчувствительность в PEP, мепивакаин, или другие ингредиенты
- Известный, предыдущий или предполагаемый рак молочной железы или другой эстроген-зависимый злокачественные опухоли (например., рак эндометрия )
- Вагинальное кровотечение по неизвестной причине или без лечения гиперплазия эндометрия
- Тромбоз и связанные, в том числе активные тромбофлебит, бывший или нынешний Венозная тромбоэмболия (тромбоз глубоких вен, легочная эмболия ), активные или недавние артериальная тромбоэмболия (например., стенокардия, инфаркт миокарда ), или известный тромбофилия (например., дефицит протеина С, дефицит протеина S, дефицит антитромбина )
- Суровый аритмия, гипотония, гипертония, или же нарушения липидного обмена
- Цереброваскулярные события (т.е. Инсульт )
- Острое заболевание печени или ранее подтверждено заболевание печени, с аномальным функциональные пробы печени или желтуха (например., Синдром Дубина-Джонсона, Синдром ротора )
- Суровый печеночная дисфункция
- Другие, включая порфирия, серповидноклеточная анемия, отосклероз, или же миастения
- Беременность, лактация, и кормление грудью
Побочные эффекты
Систематические исследования из побочные эффекты PEP отсутствуют.[1] Однако предполагается, что его побочные эффекты идентичны побочным эффектам эстрадиол и другие эфиры эстрадиола.[1] Побочные эффекты ПКП частично зависят от пола.[1] Общие или частые (> 10%) побочные эффекты включают: Головная боль, боль в животе, тошнота, сыпь, зуд, потеря либидо, Эректильная дисфункция, болезненность молочных желез, гинекомастия, феминизация, демаскулинизация, бесплодие, и вагинальное кровотечение или кровянистые выделения.[1][32] Побочные эффекты, которые возникают изредка или нечасто (0,1–1%), включают: натрий и задержка воды, отек, гиперчувствительность, напряжение груди, депрессия, головокружение, визуальные нарушения, сердцебиение, диспепсия, узловатая эритема, крапивница, и грудная боль.[1] Все другие побочные эффекты ПКП считаются редкими.[1]
Считается, что редкие (<0,1%) побочные эффекты ПКП включают: увеличение веса, нарушенной толерантности к глюкозе, настроение изменения (восторг или депрессия ), нервозность, усталость, Головная боль, мигрень, непереносимость контактные линзы, гипертония, тромбоз, тромбофлебит, тромбоэмболия, сердечная недостаточность, инфаркт миокарда, рвота, вздутие живота, холестатическая желтуха, желчекаменная болезнь кратковременное увеличение трансаминазы и билирубин, многоформная эритема, гиперпигментация, мышечные судороги, дисменорея, выделения из влагалища, предменструальные симптомы, увеличение груди, атрофия яичек, аллергические реакции (например., крапивница, бронхиальная астма, анафилактический шок ) из-за мепивакаин, и реакции в месте инъекции (например., боль, стерильные абсцессы, воспалительные инфильтраты ).[1]
В качестве тромбоэмболический и другие сердечно-сосудистый осложнения связаны в основном с синтетический устный эстрогены как этинилэстрадиол и диэтилстильбестрол, они встречаются гораздо реже с парентеральный биоидентичные формы эстрогенов, такие как ПЭП.[1][2]
Сердечно-сосудистые эффекты
PEP оказывает минимальное нежелательное воздействие на факторы коагуляции и считается, что увеличивает риск сгустки крови мало или совсем нет.[33][34] И это несмотря на то, что уровни эстрадиола могут достигать высоких концентраций, вплоть до 700 пг / мл при терапии высокими дозами (320 мг / мес) ПКП.[35] Это также контрастирует с пероральными синтетическими эстрогенами, такими как диэтилстильбестрол и этинилэстрадиол, которые вызывают заметное повышение факторов свертывания крови и высокую скорость образования тромбов при высоких дозах, используемых для достижения кастрированного уровня тестостерона при раке простаты.[33][34][6] Разница между двумя типами терапии связана с биоидентичный и парентеральный природа ПКП и ее минимальное влияние на синтез белка в печени.[33][34][6] На самом деле ПКП может снизить риск образования тромбов из-за снижения уровня определенных прокоагуляторных белков.[33][34] Хотя ПКП не увеличивает выработку печенью или уровни прокоагуляторных факторов, было обнаружено, что он значительно снижает уровень антикоагулянтных препаратов. антитромбин III, что может указывать на потенциальный риск тромбоэмболический и сердечно-сосудистые осложнения.[2] С другой стороны, ПКП значительно увеличивает уровень Холестерин HDL и значительно снижает уровень Холестерин ЛПНП, изменения, которые, как считается, защищают от ишемическая болезнь сердца.[2] Оказывается, что ПКП может оказывать положительное влияние на здоровье сердечно-сосудистой системы при более низких дозировках (например, 160 мг / день) из-за его положительного воздействия на уровни холестерина ЛПВП и ЛПНП, но они затмеваются при более высоких дозах (например, 240 мг / день) из-за к неблагоприятному дозозависимому воздействию на гемостаз, а именно уровни антитромбина III.[2]
Небольшие ранние пилотные исследования ПКП при раке простаты у мужчин не выявили сердечно-сосудистой токсичности.[33] Дозировка PEP 160 мг / месяц, по-видимому, не увеличивает риск сердечно-сосудистых осложнений.[2] Фактически, при этой дозировке наблюдалось потенциальное положительное влияние на смертность от сердечно-сосудистых заболеваний.[2] Однако впоследствии в крупных исследованиях было обнаружено, что ПКП в более высокой дозировке 240 мг / мес значительно увеличивает сердечно-сосудистые заболевания. болезненность относительно Модуляторы ГнРГ и орхиэктомия у мужчин, лечившихся им от рака простаты.[33][34][2] Увеличение сердечно-сосудистой заболеваемости на фоне терапии ПКП связано с увеличением нефатальных сердечно-сосудистых событий, в том числе ишемическая болезнь сердца и декомпенсация сердца в частности сердечная недостаточность.[34][36][37] И наоборот, ПКП не приводит к значительному увеличению сердечно-сосудистых заболеваний. смертность относительно модуляторов ГнРГ и орхиэктомии.[33][34] Более того, в одном большом исследовании в группу ПКП было рандомизировано большее количество пациентов с ранее существовавшим сердечно-сосудистым заболеванием (17,1% против 14,5%; значимость не сообщается), и это могло способствовать увеличению частоты сердечно-сосудистых заболеваний, наблюдаемых при ПКП.[34] В любом случае, некоторые исследования показали, что повышенная сердечно-сосудистая заболеваемость при ПКП ограничивается, в основном, первым или двумя годами терапии, тогда как одно исследование показало, что сердечно-сосудистая заболеваемость постоянно увеличивается на протяжении трех лет терапии.[33] Долгосрочный анализ риска, рассчитанный на более чем 10 лет, показал, что сердечно-сосудистые риски ПКП могут быть обращены вспять с помощью длительного лечения и что терапия может в конечном итоге привести к значительному снижению сердечно-сосудистого риска по сравнению с модуляторами гонадолиберина и орхиэктомией, хотя это не было подтверждено.[33]
Сердечно-сосудистая токсичность PEP намного меньше, чем у пероральных синтетических эстрогенов, таких как диэтилстильбестрол и этинилэстрадиол, которые увеличивают риск венозный и артериальная тромбоэмболия, следовательно, увеличивают риск Транзиторная ишемическая атака, нарушение мозгового кровообращения (инсульт) и инфаркт миокарда (сердечный приступ) и приводят к значительному увеличению смертности от сердечно-сосудистых заболеваний.[33][34] Считается, что относительно минимальная сердечно-сосудистая токсичность парентеральных форм эстрадиола, таких как PEP и трансдермальные пластыри с эстрадиолом с высокими дозами,[38] связано с их отсутствием влияния на факторы свертывания крови в печени.[33][34]
Передозировка
Острая токсичность исследования не указали на риск возникновения острых побочных эффектов при приеме передозировка PEP.[1] В средняя смертельная доза (LD50) PEP у мышей составляет примерно 700 мг / кг.[39] PEP вводили в общих количествах от 2000 до 3000 мг в течение нескольких месяцев пациентам с раком без токсичность наблюдаемый.[39] Наиболее вероятный признак передозировки обратимый феминизация, а именно гинекомастия.[1] Другой симптомы эстрогена передозировка может включать тошнота, рвота, вздутие живота, увеличенный вес, задержка воды, болезненность молочных желез, выделения из влагалища, тяжелые ноги, и судороги ног.[28] Эти побочные эффекты можно уменьшить, уменьшив дозу эстрогена.[28] Нет конкретного противоядие при передозировке ПЭП.[1] Лечение передозировки ПКП должно основываться на симптомы.[1]
Взаимодействия
Известный потенциал взаимодействия PEP в основном такие же, как и у эстрадиола, и включают:[1]
- Цитохром P450 ингибиторы, особенно CYP3A4, может уменьшить метаболизм эстрадиола и тем самым повышают уровень эстрадиола; примеры включают противоинфекционные (например., эритромицин, кларитромицин, кетоконазол, итраконазол ), циметидин, и грейпфрутовый сок[1][40]
- Цитохром P450 индукторы, особенно CYP3A4, может вызывать метаболизм эстрадиола и тем самым снижать уровень эстрадиола; примеры включают противосудорожные препараты (например., фенобарбитал, карбамазепин, фенитоин ), противоинфекционные (рифампицин, рифабутин, невирапин, и эфавиренц ), и Зверобой; кроме того, пока ритонавир и нелфинавир известны как сильные ингибиторы, они обладают индуцирующим действием в сочетании с стероидные гормоны[1]
- Определенный антибиотики (например., ампициллин, тетрациклины ) может снизить уровень эстрадиола путем ограничения энтерогепатическая рециркуляция эстрадиола[1]
- Парацетамол (ацетаминофен), определенные бета-блокаторы (например., метопролол ), и немного бензодиазепины может усилить эффекты ПКП[1]
- В коагуляция - стимулирующие эффекты ПКП могут усиливать аминокапроновая кислота[1]
- Полистирол фосфат может уменьшить эффекты антикоагулянты[1]
- Повышение эстрогенов тироксин-связывающий глобулин уровней и может привести к увеличению общего гормон щитовидной железы уровни (но не уровни свободных гормонов щитовидной железы в эутиреоид частные лица);[41] интерпретация тесты функции щитовидной железы следует учитывать это[1]
- Из-за снижение толерантности к глюкозе, может повлиять на потребность в инсулин или устно противодиабетические препараты[1]
- ПКП может ослабить действие фибраты (например., безафибрат ) и некоторые нестероидные противовоспалительные препараты (например., феназон )[1]
- Одновременное использование гепатотоксичный лекарства, особенно дантролен, может увеличить риск гепатотоксичности[1]
- Ингибиторы фосфатазы подобно левамизол может ингибировать расщепление PEP на эстрадиол
Взаимодействие с ПКП может быть меньше, чем с пероральными эстрогенами, из-за отсутствия первый проход сквозь печень.[1]
Фармакология
Фармакодинамика

PEP - это эфир эстрадиола в виде полимер и очень длительный пролекарство из эстрадиол.[2][7][5][6] Таким образом, это эстроген, или агонист из рецепторы эстрогена.[2][6][5] PEP имеет антигонадотропный и функциональный антиандрогенный эффекты из-за его эстрогенной активности.[35] Один повторять единицу PEP, соответствующий эстрадиолфосфат (минус ОН2), примерно на 23% выше молекулярный вес чем эстрадиол из-за присутствия в нем C17β фосфат сложный эфир.[42][15] Поскольку ПКП является пролекарством эстрадиола, он считается естественный и биоидентичный форма эстрогена.[5]
PEP - сильный ингибитор из нескольких ферменты, в том числе кислая фосфатаза, щелочная фосфатаза, и гиалуронидаза, in vitro.[43][44][45] В свете того, что фосфатазы, которые расщепляют ПЭП на эстрадиол и фосфорную кислоту, присутствуют в большинстве тканей организма, было сказано, что длительный период полувыведения и медленное высвобождение PEP несколько удивительно.[46] Считается, что ПКП может подавлять собственное метаболизм.[46]
| Эстроген | Форма | Доза (мг) | Продолжительность по дозе (мг) | ||
|---|---|---|---|---|---|
| EPD | CICD | ||||
| Эстрадиол | Aq. soln. | ? | – | <1 д | |
| Масло солн. | 40–60 | – | 1–2 ≈ 1–2 дня | ||
| Aq. Susp. | ? | 3.5 | 0,5–2 ≈ 2–7 дней; 3,5 ≈> 5 дней | ||
| Микросф. | ? | – | 1 ≈ 30 дней | ||
| Бензоат эстрадиола | Масло солн. | 25–35 | – | 1,66 ≈ 2–3 дня; 5 ≈ 3–6 дней | |
| Aq. Susp. | 20 | – | 10 ≈ 16–21 сут. | ||
| Эмульсия | ? | – | 10 ≈ 14–21 сут. | ||
| Дипропионат эстрадиола | Масло солн. | 25–30 | – | 5 ≈ 5–8 дней | |
| Эстрадиола валерат | Масло солн. | 20–30 | 5 | 5 ≈ 7–8 дней; 10 ≈ 10–14 дней; 40 ≈ 14–21 сут; 100 ≈ 21–28 дней | |
| Эстрадиол бенз. бутират | Масло солн. | ? | 10 | 10 ≈ 21 день | |
| Эстрадиола ципионат | Масло солн. | 20–30 | – | 5 ≈ 11–14 дней | |
| Aq. Susp. | ? | 5 | 5 ≈ 14–24 дня | ||
| Эстрадиол энантат | Масло солн. | ? | 5–10 | 10 ≈ 20–30 дней | |
| Эстрадиола диенантат | Масло солн. | ? | – | 7,5 ≈> 40 дней | |
| Эстрадиола ундецилат | Масло солн. | ? | – | 10–20 ≈ 40–60 дней; 25–50 ≈ 60–120 дней | |
| Полиэстрадиолфосфат | Aq. soln. | 40–60 | – | 40 ≈ 30 дней; 80 ≈ 60 дн .; 160 ≈ 120 дней | |
| Estrone | Масло солн. | ? | – | 1–2 ≈ 2–3 дня | |
| Aq. Susp. | ? | – | 0,1–2 ≈ 2–7 дней | ||
| Эстриол | Масло солн. | ? | – | 1–2 ≈ 1–4 дня | |
| Полиэстриолфосфат | Aq. soln. | ? | – | 50 ≈ 30 дн .; 80 ≈ 60 дней | |
Примечания и источники Примечания: Все водные суспензии являются из микрокристаллический размер частицы. Эстрадиол производство во время менструальный цикл составляет 30–640 мкг / день (всего 6,4–8,6 мг в месяц или цикл). В вагинальный эпителий дозировка созревания эстрадиол бензоат или эстрадиола валерат сообщалось, как от 5 до 7 мг / неделю. Эффективный доза, ингибирующая овуляцию из эстрадиол ундецилат составляет 20–30 мг / мес. Источники: См. Шаблон. | |||||
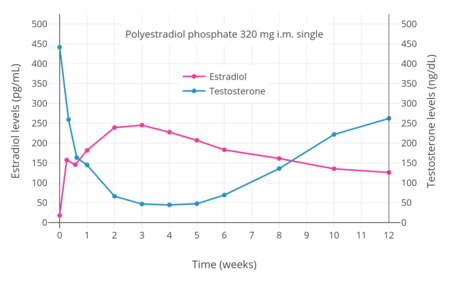
- Уровни гормонов с фосфат полиэстрадиола внутримышечно
Антигонадотропные эффекты
PEP имеет антигонадотропный эффекты из-за его эстрогенной активности.[36] Было обнаружено, что он снижает уровень тестостерона у мужчин на 55%, 75% и 85% при внутримышечных дозах 80, 160 и 240 мг каждые 4 недели соответственно.[46] Было обнаружено, что однократная внутримышечная инъекция 320 мг ПКП мужчинам снижает уровень тестостерона в пределах кастрированного диапазона (<50 нг / дл) в течение 3 недель.[7] Это было связано с уровнем циркулирующего эстрадиола чуть более 200 пг / мл.[35] Подавление уровня тестостерона, которое может быть достигнуто с помощью ПКП, равно таковому с орхиэктомия.[48] Однако для достижения таких концентраций тестостерона, которые в среднем составляют около 15 нг / дл, были необходимы более высокие концентрации эстрадиола, около 500 пг / мл.[35][48][49] Это было связано с введением внутримышечной дозы 320 мг ПКП каждые четыре недели и происходило через 90 дней лечения.[35] Однако сообщалось, что прием 240 мг ПКП каждые четыре недели в конечном итоге снижает уровень тестостерона в диапазоне кастрации.[50][51]
Механизм действия при раке простаты
Рост рака простаты обычно стимулируется: дигидротестостерон (DHT), и если рак не устойчивый к кастрации, это можно лечить лишая его андрогенов. Эстрадиол оказывает терапевтическое действие в основном за счет негативный отзыв на гипоталамо-гипофизарно-гонадная ось.[36][46][7] Это блокирует секреция из лютеинизирующий гормон, что, в свою очередь, уменьшает тестостерон производство в Клетки Лейдига из яички.[36][46][7] Эстрадиол также снижает процент свободного тестостерона за счет увеличения глобулин, связывающий половые гормоны (SHBG) уровни.[7] Кроме того, он показывает прямые цитотоксичность на раковые клетки простаты.[52][20]
Отличия от других эстрогенов

| Факторы | Оральные эстрогеныа | Парентеральные эстрогеныб |
|---|---|---|
| Фактор VII | Увеличивает | Без изменений |
| Фактор VIII Мероприятия | Увеличивает | Без изменений |
| Антитромбин III Мероприятия | Уменьшает | Уменьшает |
| Фрагмент протромбина 1 + 2 | Увеличивает | Без изменений |
| Активированная устойчивость к протеину С | Увеличивает | Без изменений |
| Фибриноген | Уменьшает | Без изменений |
| Сноски: а = Например, DES, EE. б = PEP. Источники: [34] | ||
Эстрогены влияют на синтез белка в печени, в том числе на синтез из белки плазмы, факторы коагуляции, липопротеины, и триглицериды.[48] Эти эффекты могут привести к повышенному риску тромбоэмболический и сердечно-сосудистый осложнения, которые, в свою очередь, могут привести к увеличению смертность.[48] Исследования показали, что у мужчин, получавших пероральные синтетические эстрогены, такие как этинилэстрадиол и диэтилстильбестрол при раке простаты.[48] Однако, в то время как пероральные синтетические эстрогены оказывают сильное влияние на синтез белка в печени, эффекты парентеральных биоидентичных эстрогенов, таких как PEP, на синтез белка в печени сравнительно очень слабы или даже полностью отсутствуют.[48] Это потому, что первый проход сквозь печень при пероральном применении следует избегать, так как биоидентичные эстрогены эффективно инактивируются в печени.[48] Соответственно, ПКП оказывает минимальное влияние на печень в дозировке не менее 240 мг / мес.[53]
Исследование показало, что в то время как внутримышечная ПКП в дозе 320 мг / месяц повышала уровни ГСПГ до 166% у мужчин с раком простаты, комбинация 80 мг / мес внутримышечного полиэстрадиолфосфата и 150 мкг / день перорально этинилэстрадиола увеличивала уровни ГСПГ до 617%, то есть почти 8-кратная разница в увеличении и почти 4-кратная разница в абсолютных уровнях между двумя схемами лечения.[35][7][54] Кроме того, в то время как сердечно-сосудистые осложнения отсутствовали в группе, принимавшей только ПКП, частота сердечно-сосудистых осложнений в течение года составляла 25% в группе, которая также лечилась этинилэстрадиолом.[7] Другое исследование не обнаружило изменений в уровнях фактор свертывания крови VII, белок, имеющий особое значение при побочных эффектах эстрогенов на сердечно-сосудистую систему, при внутримышечном введении 240 мг / мес.[53] Эти результаты демонстрируют огромное влияние синтетических пероральных эстрогенов, таких как этинилэстрадиол, на производство белка в печени по сравнению с парентеральными биоидентичными формами эстрогена, такими как PEP.[7]
Первоначально PEP обычно использовался в дозировке 80 мг в месяц в сочетании со 150 мкг этинилэстрадиола в день при лечении рака простаты.[46][55] Было обнаружено, что эта комбинация вызывает значительную частоту сердечно-сосудистой токсичности,[48] и в некоторых публикациях эта токсичность неправильно приписывалась ПКП.[56] Последующие исследования показали, что токсичность вызвана не PEP, а компонентом этинилэстрадиола.[57][46][48]
Исследование показало, что терапия внутримышечной ПКП, приводящая к повышению уровня эстрадиола около 400 пг / мл у мужчин с раком простаты, не влияла на гормон роста или инсулиноподобный фактор роста 1 уровней, тогда как добавление устных этинилэстрадиол значительно увеличил уровень гормона роста и снизил уровень инсулиноподобного фактора роста 1.[58][59]
Фармакокинетика
ПКП имеет очень длительную продолжительность и вводится внутримышечно каждые 4 недели.[35] У мужчин первоначальная внутримышечная инъекция ПКП приводит к быстрому повышению уровня эстрадиола, измеренному через 24 часа, с последующим медленным и постепенным дальнейшим повышением уровней по крайней мере до 28 дня (время следующей инъекции).[35] Последующие инъекции приводят к прогрессивному и значительному накоплению уровня эстрадиола, по крайней мере, до 6 месяцев.[35] Значение период полувыведения было установлено, что продолжительность ПКП составляет 70 дней (10 недель) при однократном внутримышечном введении 320 мг препарата.[7] В тМаксимум (время достижения максимальной концентрации) для эстрадиола составляло около 16 дней.[7] PEP имеет продолжительность приблизительно 1 месяц при однократной дозе 40 мг, 2 месяца при 80 мг и 4 месяца при 160 мг.[60]</ref>[61][62][63][39]
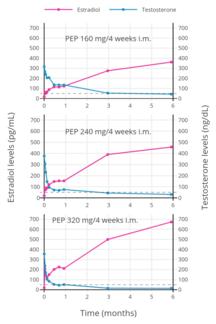
PEP достигает кровоток в течение нескольких часов после инъекции (90% через 24 часа), где он циркулирует и накапливается в ретикулоэндотелиальной системы.[52] Эстрадиол тогда расколотый из полимера фосфатазы, хотя очень медленно.[64] Уровни эстрадиола у мужчин при внутримышечных инъекциях ПКП один раз каждые 4 недели составляли около 350 пг / мл для 160 мг, 450 пг / мл для 240 мг и почти 700 пг / мл для 320 мг, все измерялись через 6 месяцев лечения.[35] С ежемесячными инъекциями, устойчивое состояние Концентрация эстрадиола достигается через 6–12 месяцев.[52] Эстрадиол метаболизируется в основном в печень к CYP3A4 и другие цитохром P450 ферменты, и в меньшей степени метаболизируется во внепеченочных тканях.[20][1] В метаболиты в основном выделенный в моча через почки.[1]
Ранние исследования показали, что дозировка 80 мг ПКП каждые 4 недели быстро приводит к относительно высокому среднему уровню эстрадиола, составляющему от 400 до 800 пг / мл.[65] Эти уровни аналогичны уровням 100 мг ундецилата эстрадиола каждый месяц, который, как было обнаружено, обеспечивает уровень эстрадиола от 500 до 600 пг / мл.[66][67] В результате ранее было сказано, что 80 мг ПКП в месяц и 100 мг ундецилата эстрадиола в месяц примерно эквивалентны.[68][69][7] Однако последующие исследования показали, что эта доза ПКП на самом деле обеспечивает гораздо более низкие уровни эстрадиола, чем было продемонстрировано первоначально.[35]
Химия
PEP - это синтетический эстран стероидный препарат и C17β фосфорная кислота (фосфат) сложный эфир из эстрадиол (эстрадиол 17β-фосфат ) в виде полимер.[70][15][46][71] Он также известен как полимер эстрадиола с фосфорной кислотой или как полимер эстрадиола 17β-фосфата, а также полимер эстра-1,3,5 (10) -триен-3,17β-диола 17β-фосфата.[15][70][46][71] Это было определено через ультрацентрифугирование что значит молекулярный вес PEP соответствует длине цепи примерно 13повторять единицы эстрадиола 17β-фосфата.[46] PEP тесно связан с полиэстриолфосфат (Гюнясан, Климадурин, Триодурин) и политестостерон флоретин фосфат (никогда не коммерциализированы), которые эстриол и сложные эфиры тестостерона в виде полимеры, соответственно.[60]А. Лабхарт (6 декабря 2012 г.). Клиническая эндокринология: теория и практика. Springer Science & Business Media. С. 551–. ISBN 978-3-642-96158-8. Полимер эстрадиола или эстриола и фосфорной кислоты обладает превосходным депо-действием при внутримышечном введении (полиэстриолфосфат или полиэстрадиолфосфат) (Таблица 16). Фосфорная кислота соединяется с молекулой эстрогена в C3 и C17 с образованием макромолекулы. Соединение накапливается в печени и селезенке, где эстроген постепенно высвобождается за счет отщепления фосфатной части под действием щелочной фосфатазы. [...] Конъюгированные эстрогены и полиэстриол и эстрадиолфосфат также можно вводить внутривенно в водном растворе. Однако внутривенное введение гормонов яичников не имеет преимуществ и, следовательно, не имеет практического значения. [...] При однократном введении были получены следующие продолжительности действия (WlED, 1954; LAURITZEN, 1968): [...] 50 мг полиэстрадиолфосфата ~ 1 месяц; 50 мг полиэстриолфосфата ~ 1 месяц; 80 мг полиэстриолфосфата ~ 2 месяца.
</ref>[72] Это также связано с полидиэтилстильбэстрол фосфат (никогда не коммерциализирован), сложный эфир диэтилстильбэстрола в виде полимер.[73]
| Эстроген | Структура | Сложный эфир (ы) | Относительный мол. масса | Относительный E2 содержаниеб | logPc | ||||
|---|---|---|---|---|---|---|---|---|---|
| Должность (я) | Moiet (ы) | Тип | Длинаа | ||||||
| Эстрадиол | – | – | – | – | 1.00 | 1.00 | 4.0 | ||
| Эстрадиола ацетат | C3 | Этановая кислота | Жирная кислота с прямой цепью | 2 | 1.15 | 0.87 | 4.2 | ||
| Бензоат эстрадиола | C3 | Бензолкарбоновая кислота | Ароматическая жирная кислота | – (~4–5) | 1.38 | 0.72 | 4.7 | ||
| Дипропионат эстрадиола | C3, C17β | Пропановая кислота (×2) | Жирная кислота с прямой цепью | 3 (×2) | 1.41 | 0.71 | 4.9 | ||
| Эстрадиола валерат | C17β | Пентановая кислота | Жирная кислота с прямой цепью | 5 | 1.31 | 0.76 | 5.6–6.3 | ||
| Бутират бензоата эстрадиола | C3, C17β | Бензойная кислота, Масляная кислота | Смешанная жирная кислота | – (~6, 2) | 1.64 | 0.61 | 6.3 | ||
| Эстрадиола ципионат | C17β | Циклопентилпропановая кислота | Ароматическая жирная кислота | – (~6) | 1.46 | 0.69 | 6.9 | ||
| Эстрадиол энантат | C17β | Гептановая кислота | Жирная кислота с прямой цепью | 7 | 1.41 | 0.71 | 6.7–7.3 | ||
| Эстрадиола диенантат | C3, C17β | Гептановая кислота (×2) | Жирная кислота с прямой цепью | 7 (×2) | 1.82 | 0.55 | 8.1–10.4 | ||
| Эстрадиола ундецилат | C17β | Ундекановая кислота | Жирная кислота с прямой цепью | 11 | 1.62 | 0.62 | 9.2–9.8 | ||
| Стеарат эстрадиола | C17β | Октадекановая кислота | Жирная кислота с прямой цепью | 18 | 1.98 | 0.51 | 12.2–12.4 | ||
| Дистеарат эстрадиола | C3, C17β | Октадекановая кислота (×2) | Жирная кислота с прямой цепью | 18 (×2) | 2.96 | 0.34 | 20.2 | ||
| Эстрадиола сульфат | C3 | Серная кислота | Водорастворимый конъюгат | – | 1.29 | 0.77 | 0.3–3.8 | ||
| Эстрадиол глюкуронид | C17β | Глюкуроновая кислота | Водорастворимый конъюгат | – | 1.65 | 0.61 | 2.1–2.7 | ||
| Эстрамустин фосфатd | C3, C17β | Нормюстин, фосфорная кислота | Водорастворимый конъюгат | – | 1.91 | 0.52 | 2.9–5.0 | ||
| Полиэстрадиолфосфате | C3 – C17β | Фосфорная кислота | Водорастворимый конъюгат | – | 1.23ж | 0.81ж | 2.9грамм | ||
| Сноски: а = Длина сложный эфир в углерод атомы за жирные кислоты с прямой цепью или приблизительная длина сложного эфира в атомах углерода для ароматические жирные кислоты. б = Относительное содержание эстрадиола по весу (т. Е. Относительное эстрогенный воздействие). c = Экспериментальный или прогнозируемый коэффициент разделения октанол / вода (т.е. липофильность /гидрофобность ). Извлекаются из PubChem, ChemSpider, и DrugBank. d = Также известен как эстрадиол нормустин фосфат. е = Полимер из эстрадиолфосфат (~13 повторять единицы ). ж = Относительная молекулярная масса или содержание эстрадиола на повторяющуюся единицу. грамм = logP повторяющейся единицы (т. е. эстрадиолфосфата). Источники: Смотрите отдельные статьи. | |||||||||
Растворимость
PEP очень низкий растворимость в воды, ацетон, хлороформ, диоксан, и этиловый спирт, но легко растворяется в базы, особенно в водный пиридин.[52]
Синтез
Как полифосфаты полифенолы, PEP можно приготовить из мономер (в данном случае эстрадиол) и фосфорилхлорид. Последний реагирует как с фенольным гидроксил группа в позиции 3 и алифатический один в позиции 17β. В молекулярная масса количества полученного полимера можно контролировать, прерывая реакцию через заданное время: чем дольше продолжается реакция, тем выше масса.[64][74]
История
Фармакологические эксперименты на эстрадиолфосфаты проведенное около 1950 г., привело к гипотезе о том, что эстрадиол-3,17β-дифосфат действует как ингибитор почечной недостаточности. щелочная фосфатаза.[64] Когда те же ученые захотели синтезировать простые фосфаты флоретин, соединение, содержащееся в листьях яблони,[75] вместо этого они случайно создали полимер.[74] Позже было показано, что он проявляет те же антифосфатазные свойства, что и дифосфат эстрадиола, и поэтому было выдвинуто предположение, что первоначальное открытие было связано с загрязнением полимерами эстрадиолфосфата.[64] Следовательно, эти полимеры были изучены более подробно, что привело к разработке ПЭП еще в 1953 г.[12] и его последующее внедрение в медицину в 1957 г. Соединенные Штаты.[13][14][76]
Общество и культура
Родовые имена
Полиэстрадиолфосфат это родовое имя препарата и его ГОСТИНИЦА и БАН.[15][70][42] Он также известен своим кодовым названием развития Лев-114.[15][42]
Фирменные наименования
ПЭП продается исключительно под торговыми марками Эстрадурин или Эстрадурин.[15][42]
Доступность

PEP продается в Соединенные Штаты и широко во всем Европа, в том числе в Австрия, Бельгия, то Чехия, Дания, Финляндия, Германия, Италия, то Нидерланды, Норвегия, Россия, Испания, Швеция, Швейцария, Украина, а объединенное Королевство.[15][26][1][77][78][14] Однако он больше не доступен в США и, возможно, в некоторых других странах,[13][16] но все еще известно, что он продается в Австрии, Бельгии, Дании, Финляндии, Нидерландах, Норвегии, Швеции и Швейцарии.[42][77][78][1]
Исследование
ПЭП изучается как средство повышения гормонального фона груди у женщин.[79]
Комбинация PEP и медроксипрогестерона ацетат изучался у женщин как длительный комбинированный инъекционный контрацептив для использования внутримышечная инъекция раз в три месяца.[80][81][82]
Смотрите также
Рекомендации
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа ab ac объявление ае аф аг ах ай эй ак аль являюсь ан ао ap водный ар так как в «Архивная копия». Архивировано из оригинал на 2018-01-02. Получено 2018-01-01.CS1 maint: заархивированная копия как заголовок (ссылка на сайт)
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Миккола А., Рууту М., Аро Дж., Ранникко С., Сало Дж. (1999). «Роль парентерального полиэстрадиолфосфата в лечении запущенного рака простаты на пороге нового тысячелетия». Энн Чир Гинекол. 88 (1): 18–21. ISSN 0355-9521. PMID 10230677.
Орхиэктомия и эстрогены используются для лечения запущенного рака простаты более 50 лет. Хотя орхиэктомия - простая процедура, она может вызвать психологический стресс. Оральная терапия эстрогенами так же эффективна, как орхиэктомия, с точки зрения ингибирующего действия на рак, но ее признание в качестве первичного гормонального лечения омрачено повышенным риском сердечно-сосудистых осложнений. Парентеральный эстроген, полиэстрадиолфосфат (PEP), эффективен, но также связан с сердечно-сосудистыми осложнениями, хотя и в меньшей степени. В течение последних 20 лет хорошо переносимые аналоги рилизинг-гормона лютеинизирующего гормона (LHRH) заменяют орхиэктомию и эстрогены. Были предприняты попытки повысить эффективность лечения путем добавления антиандрогенов к аналогам LHRH, а также к орхиэктомии (комбинированная андрогенная блокада, CAB). Однако эффективность аналогов LHRH и CAB не доказана выше, чем у простой орхиэктомии, и, кроме того, они являются дорогостоящими методами лечения. Орхиэктомия и аналоги LHRH связаны с негативным воздействием на костную массу и могут вызывать остеопороз, тогда как лечение ПКП имеет противоположный эффект. Парентеральное введение полиэстрадиолфосфата по-прежнему является дешевым потенциальным средством лечения распространенного рака предстательной железы, но необходимо провести дальнейшие исследования, чтобы установить его будущую роль, например сочетание ацетилсалициловой кислоты для предотвращения сердечно-сосудистых осложнений.
- ^ Станчик, Франк З .; Арчер, Дэвид Ф .; Бхавнани, Бхагу Р. (2013). «Этинилэстрадиол и 17β-эстрадиол в комбинированных пероральных контрацептивах: фармакокинетика, фармакодинамика и оценка риска». Контрацепция. 87 (6): 706–727. Дои:10.1016 / j.contraception.2012.12.011. ISSN 0010-7824. PMID 23375353.
- ^ Томмазо Фальконе; Уильям В. Херд (2007). Клиническая репродуктивная медицина и хирургия. Elsevier Health Sciences. С. 22, 362, 388. ISBN 978-0-323-03309-1.
- ^ а б c d е ж грамм час Майкл Эттель; Эккехард Шиллингер (6 декабря 2012 г.). Эстрогены и антиэстрогены II: фармакология и клиническое применение эстрогенов и антиэстрогенов. Springer Science & Business Media. п. 261 544. ISBN 978-3-642-60107-1.
Природные эстрогены, рассматриваемые здесь, включают: [...] сложные эфиры 17β-эстрадиола, такие как валерат эстрадиола, бензоат эстрадиола и ципионат эстрадиола. Этерификация направлена либо на лучшее всасывание после перорального приема, либо на замедленное высвобождение из депо после внутримышечного введения. Во время абсорбции сложные эфиры расщепляются эндогенными эстеразами и высвобождается фармакологически активный 17β-эстрадиол; поэтому сложные эфиры считаются естественными эстрогенами.
- ^ а б c d е ж грамм Kuhl H (2005). «Фармакология эстрогенов и прогестагенов: влияние разных путей введения» (PDF). Климактерический. 8 Дополнение 1: 3–63. Дои:10.1080/13697130500148875. PMID 16112947. S2CID 24616324.
- ^ а б c d е ж грамм час я j k л м п о Стеге Р., Гуннарссон П.О., Йоханссон С.Дж., Олссон П., Пусетт А., Карлстрём К. (май 1996 г.). «Фармакокинетика и подавление тестостерона однократной дозы полиэстрадиолфосфата (эстрадурина) у больных раком предстательной железы». Простата. 28 (5): 307–10. Дои:10.1002 / (SICI) 1097-0045 (199605) 28: 5 <307 :: AID-PROS6> 3.0.CO; 2-8. PMID 8610057.
- ^ Дюстерберг Б., Нишино Ю. (1982). «Фармакокинетические и фармакологические особенности эстрадиола валерата». Maturitas. 4 (4): 315–24. Дои:10.1016/0378-5122(82)90064-0. PMID 7169965.
- ^ Стеге Р., Карлстрем К., Хедлунд П.О., Пусетт А., фон Шульц Б., Хенрикссон П. (сентябрь 1995 г.). "Внутримышечные депо-эстрогены (эстрадурин) в лечении пациентов с карцином простаты. Historische Aspekte, Wirkungsmechanismus, Resultate und aktueller klinischer Stand" [Внутримышечные депо-эстрогены (эстрадурин) в лечении пациентов с карцином простаты. Исторические аспекты, механизм действия, результаты и текущее клиническое состояние. Уролог А (на немецком). 34 (5): 398–403. ISSN 0340-2592. PMID 7483157.
Более 50 лет назад пероральный эстроген уже использовался для лечения рака простаты. Из-за побочных эффектов со стороны сердечно-сосудистой системы с высокой заболеваемостью 25% это лечение не стало стандартом. Недавние исследования показывают, что парентеральное применение снижает риск побочных эффектов со стороны сердечно-сосудистой системы, поскольку позволяет избежать первого прохождения через печень высоких концентраций эстрогена, которые обычно возникают после перорального применения. Следовательно, можно избежать повышенного синтеза так называемых «стероид-чувствительных» белков печени, таких как факторы свертывания крови (особенно фактор VII). Это новое парентеральное применение эстрогенов показывает обнадеживающие результаты дешевой и эффективной гормональной терапии с низким уровнем побочных эффектов у пациентов с раком простаты.
- ^ Миккола, А; Аро, Дж; Ранникко, С; Рууту, М; Finnprostate, Group (март 2007 г.). «Десятилетняя выживаемость и смертность от сердечно-сосудистых заболеваний у пациентов с распространенным раком предстательной железы, в первую очередь леченных с помощью внутримышечного полиэстрадиолфосфата или орхиэктомии». Простата. 67 (4): 447–55. Дои:10.1002 / pros.20547. PMID 17219379. S2CID 20549248.
- ^ а б c Урдл, В. (2009). "Behandlungsgrundsätze bei Transsexualität" [Терапевтические принципы транссексуализма]. Gynäkologische Endokrinologie (на немецком). 7 (3): 153–160. Дои:10.1007 / s10304-009-0314-9. ISSN 1610-2894. S2CID 8001811.
- ^ а б c d Штейнбах Т., Вурм FR (2015). «Поли (фосфоэфир): новая платформа для разлагаемых полимеров». Энгью. Chem. Int. Эд. Англ.. 54 (21): 6098–108. Дои:10.1002 / anie.201500147. PMID 25951459.
- ^ а б c d «Drugs @ FDA: одобренные FDA лекарственные препараты: эстрадурин». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Получено 24 июн 2018.
- ^ а б c Издательство Уильям Эндрю (22 октября 2013 г.). Энциклопедия фармацевтического производства. Эльзевир. С. 2934–2935. ISBN 978-0-8155-1856-3.
- ^ а б c d е ж грамм час Index Nominum 2000: Международный справочник лекарственных средств. Тейлор и Фрэнсис. Январь 2000. С. 856–. ISBN 978-3-88763-075-1.
- ^ а б Мосби (11 февраля 2009 г.). Карманный словарь Мосби по медицине, медсестринскому делу и медицинским профессиям. Elsevier Health Sciences. С. 3672–. ISBN 978-0-323-06604-4.
- ^ Островски MJ, Джексон AW (1979). «Полиэстрадиолфосфат: предварительная оценка его воздействия на рак груди». Рак лечить Rep. 63 (11–12): 1803–7. PMID 393380.
- ^ Бруннер Н., Спанг-Томсен М., Каллен К. (1996). «Ксенотрансплантат рака груди человека T61: экспериментальная модель эстрогеновой терапии рака груди». Рак молочной железы Res. Рассматривать. 39 (1): 87–92. Дои:10.1007 / bf01806080. PMID 8738608. S2CID 27430232.
[...] В исследовании парентеральной терапии эстрогенами пациентов с метастатическим раком молочной железы 14 из 24 пациентов получили объективный ответ (включая пациентов со стабильным заболеванием> 6 месяцев) [13]. Единственным зарегистрированным побочным эффектом было кровотечение из гиперпластического эндометрия.
- ^ а б Арвер Д.С. (2015). "Транссексуализм, könsdysfori" [Транссексуализм, гендерная дисфория]. Получено 2018-11-12.
- ^ а б c W, Jasek, ed. (2007). Кодекс Австрии (на немецком языке) (62-е изд.). Вена: Österreichischer Apothekerverlag. С. 2992–4. ISBN 978-3-85200-181-4.
- ^ а б c d Sayed Y, Taxel P (2003). «Применение терапии эстрогенами у мужчин». Curr Opin Pharmacol. 3 (6): 650–4. Дои:10.1016 / j.coph.2003.07.004. PMID 14644018.
- ^ а б c d Хедлунд ПО, Хенрикссон П. (2000). «Парентеральное введение эстрогена по сравнению с полным андрогеном при лечении прогрессирующей карциномы простаты: влияние на общую выживаемость и смертность от сердечно-сосудистых заболеваний. Скандинавская группа рака простаты (SPCG) -5 Trial Study». Урология. 55 (3): 328–33. Дои:10.1016 / с0090-4295 (99) 00580-4. PMID 10699602.
- ^ Дипиндер Ф., Браунштейн Г.Д. (2012). «Медикаментозная гинекомастия: обзор, основанный на фактах». Экспертное заключение о безопасности лекарственных средств. 11 (5): 779–95. Дои:10.1517/14740338.2012.712109. PMID 22862307. S2CID 22938364.
Лечение эстрогенами имеет самую высокую частоту гинекомастии - 40-80%, далее идут антиандрогены, включая флутамид, бикалутамид и нилутамид, с частотой 40-70%, за ними следуют аналоги ГнРГ (гозерелин, лейпрорелин) и комбинированные андрогены депривация, оба с частотой 13% каждый.
- ^ а б c Norman G, Dean ME, Langley RE, Hodges ZC, Ritchie G, Parmar MK, Sydes MR, Abel P, Eastwood AJ (февраль 2008 г.). «Парентеральный эстроген в лечении рака простаты: систематический обзор». Br. J. Рак. 98 (4): 697–707. Дои:10.1038 / sj.bjc.6604230. ЧВК 2259178. PMID 18268497.
- ^ Шлаттерер К., фон Вердер К., Сталла Г.К. (1996). «Концепция многоэтапного лечения пациентов-транссексуалов». Exp. Clin. Эндокринол. Сахарный диабет. 104 (6): 413–9. Дои:10.1055 / с-0029-1211479. PMID 9021341.
- ^ а б Мюллер (19 июня 1998 г.). Европейский индекс лекарств: европейские регистрации лекарств, четвертое издание. CRC Press. С. 455–. ISBN 978-3-7692-2114-5.
- ^ а б https://web.archive.org/web/*/https://www.pfizer.com/sites/default/files/products/material_safety_data/ESTRADURINE.pdf
- ^ а б c Лауритцен С (сентябрь 1990 г.). «Клиническое применение эстрогенов и прогестагенов». Maturitas. 12 (3): 199–214. Дои:10.1016 / 0378-5122 (90) 90004-П. PMID 2215269.
- ^ Кристиан Лауритцен; Джон В. В. Стадд (22 июня 2005 г.). Текущее лечение менопаузы. CRC Press. С. 95–98, 488. ISBN 978-0-203-48612-2.
- ^ Лауртизен, Кристиан (2001). «Замещение гормонов до, во время и после менопаузы» (PDF). В Fisch, Franz H. (ed.). Менопауза - Андропауза: заместительная гормональная терапия на протяжении веков. Краузе и Пакернегг: Габлиц. С. 67–88. ISBN 978-3-901299-34-6.
- ^ Середина зимы, Одри (1976). «Противопоказания к терапии эстрогенами и управлению климактерическим синдромом в этих случаях». В Кэмпбелле, Стюарт (ред.). Ведение менопаузы и постменопаузального возраста: материалы международного симпозиума, состоявшегося в Лондоне 24–26 ноября 1975 г. Организовано Институтом акушерства и гинекологии Лондонского университета. MTP Press Limited. С. 377–382. Дои:10.1007/978-94-011-6165-7_33. ISBN 978-94-011-6167-1.
- ^ Буркхард Хелпап; Герберт Рюббен (12 марта 2013 г.). Простатакарзином - Патология, Практика и Клиника: Патология, Практика и Клиника. Springer-Verlag. С. 126–. ISBN 978-3-642-72110-6.
- ^ а б c d е ж грамм час я j k Окрим Дж., Лалани Э. Н., Абель П. (октябрь 2006 г.). «Therapy Insight: парентеральное лечение эстрогенами рака простаты - новый рассвет для старой терапии». Нат Клин Прак Онкол. 3 (10): 552–63. Дои:10.1038 / ncponc0602. PMID 17019433. S2CID 6847203.
- ^ а б c d е ж грамм час я j k Lycette JL, Bland LB, Garzotto M, Beer TM (декабрь 2006 г.). «Парентеральные эстрогены при раке простаты: может ли новый способ введения преодолеть старую токсичность?». Клин генитурин рака. 5 (3): 198–205. Дои:10.3816 / CGC.2006.n.037. PMID 17239273.
- ^ а б c d е ж грамм час я j k л Стеге Р., Карлстрём К., Коллсте Л., Эрикссон А., Хенрикссон П., Пусетт А. (1988). «Терапия одиночным лекарственным средством полиэстрадиолфосфата при раке простаты». Являюсь. J. Clin. Онкол. 11 Приложение 2: S101–3. Дои:10.1097/00000421-198801102-00024. PMID 3242384. S2CID 32650111.
- ^ а б c d Ваун Ки Хонг; Джеймс Ф. Холланд (2010). Holland-Frei Cancer Medicine 8. PMPH-США. С. 753–. ISBN 978-1-60795-014-1.
- ^ Рассел Н., Чунг А., Гроссманн М. (август 2017 г.). «Эстрадиол для смягчения побочных эффектов терапии андрогенной депривации». Endocr. Relat. Рак. 24 (8): R297 – R313. Дои:10.1530 / ERC-17-0153. PMID 28667081.
- ^ Langley RE, Cafferty FH, Alhasso AA, Rosen SD, Sundaram SK, Freeman SC, Pollock P, Jinks RC, Godsland IF, Kockelbergh R, Clarke NW, Kynaston HG, Parmar MK, Abel PD (апрель 2013 г.). «Сердечно-сосудистые исходы у пациентов с местнораспространенным и метастатическим раком простаты, получавших агонисты лютеинизирующего гормона-рилизинг-гормона или трансдермальный эстроген: рандомизированное исследование 2 фазы MRC PATCH (PR09)». Ланцет Онкол. 14 (4): 306–16. Дои:10.1016 / S1470-2045 (13) 70025-1. ЧВК 3620898. PMID 23465742.
- ^ а б c Дичфальсуи Э., Вестман А (апрель 1956 г.). «Выведение с мочой естественных эстрогенов у женщин, перенесших овариоэктомию, получавших полиэстрадиолфосфат (PEP)». Acta Endocrinol. 21 (4): 321–36. Дои:10.1530 / acta.0.0210321. PMID 13312990.
- ^ Ченг З.Н., Шу И, Лю З.К., Ван Л.С., Оу-Ян Д.С., Чжоу Х.Х. (2001). «Роль цитохрома P450 в метаболизме эстрадиола in vitro». Acta Pharmacol. Грех. 22 (2): 148–54. PMID 11741520.
- ^ Мазер Н.А. (2004). «Взаимодействие эстрогеновой терапии и заместительной терапии тиреоидными гормонами у женщин в постменопаузе». Щитовидная железа. 14 Дополнение 1: S27–34. Дои:10.1089/105072504323024561. PMID 15142374.
- ^ а б c d е https://www.drugs.com/international/polyestradiol-phosphate.html
- ^ Линдстедт Э (1980). «Полиэстрадиолфосфат и этинилэстрадиол в лечении рака предстательной железы». Scand J Urol Nephrol Suppl. 55: 95–7. PMID 6938044.
Полиэстрадиолфосфат представляет собой полимерный сложный эфир эстрадиола-17 бета и фосфорной кислоты. Большая молекула имеет очень слабые эстрогенные свойства, но является сильным ингибитором нескольких ферментов, например кислотная и щелочная фосфатазы и гиалуронидаза.
- ^ Стивен Ф.С., Гриффин М.М. (1982). «Ингибирование тромбинового расщепления фибриногена полиэстрадиолфосфатом; взаимодействие с ключевыми остатками аргинина в фибриногене, необходимым для ферментативного расщепления». Int. J. Biochem. 14 (8): 699–700. Дои:10.1016 / 0020-711X (82) 90004-0. PMID 7117668.
Было показано, что полиэстрадиолфосфат (PEP) обладает ингибирующей активностью в отношении гиалуронидазы, кислой фосфатазы и щелочной фосфатазы (Fernö et al., 1958).
- ^ Fernö O, Fex H, Högberg B, Linderot T, Veige S (1958). «Ингибиторы ферментов с высокой молекулярной массой. 3. Полиэстрадиолфосфат (PEP), эстроген длительного действия». Acta Chemica Scandinavica. 12 (8): 1675–1689. Дои:10.3891 / acta.chem.scand.12-1675.
- ^ а б c d е ж грамм час я j Gunnarsson PO, Norlén BJ (1988). «Клиническая фармакология полиэстрадиолфосфата». Простата. 13 (4): 299–304. Дои:10.1002 / pro.2990130405. PMID 3217277. S2CID 33063805.
- ^ Стеге Р., Карлстрём К., Коллсте Л., Эрикссон А., Хенрикссон П., Пусетт А. (1988). «Терапия одиночным лекарственным средством полиэстрадиолфосфата при раке простаты». Являюсь. J. Clin. Онкол. 11 Приложение 2: S101–3. Дои:10.1097/00000421-198801102-00024. PMID 3242384. S2CID 32650111.
- ^ а б c d е ж грамм час я фон Шульц Б., Карлстрём К., Коллсте Л., Эрикссон А., Хенрикссон П., Пусетт А., Стеге Р. (1989). «Эстрогеновая терапия и функция печени - метаболические эффекты перорального и парентерального введения». Простата. 14 (4): 389–95. Дои:10.1002 / pros.2990140410. PMID 2664738. S2CID 21510744.
- ^ Гохан Озигит; Угур Селек (1 августа 2017 г.). Принципы и практика уроонкологии: лучевая терапия, хирургия и системная терапия. Springer. стр. 334–. ISBN 978-3-319-56114-1.
Уровень кастрата был определен как уровень тестостерона менее 50 нг / дл (1,7 нмоль / л) много лет назад. Однако современные методы лабораторных исследований показали, что среднее значение после хирургической кастрации составляет 15 нг / дл [1]. Таким образом, в последнее время уровень определяется как менее 20 нг / дл (1 нмоль / л).
- ^ Миккола А.К., Рууту М.Л., Аро Дж.Л., Ранникко С.А., Сало Ю.О. (июль 1998 г.). «Парентеральное введение полиэстрадиолфосфата по сравнению с орхидэктомией в лечении распространенного рака простаты. Эффективность и сердечно-сосудистые осложнения: отчет о 2-летнем последующем наблюдении национального проспективного исследования рака простаты. Finnprostate Group». Br J Urol. 82 (1): 63–8. Дои:10.1046 / j.1464-410x.1998.00688.x. PMID 9698663.
- ^ Stege, R .; Carlström, K .; Collste, L .; Eriksson, A .; Хенрикссон, П. (1987). «Терапия одиночным лекарственным средством полиэстрадиолфосфата (PEP) при раке простаты (CAP)». Европейский журнал рака и клинической онкологии. 23 (8): 1249. Дои:10.1016/0277-5379(87)90236-7. ISSN 0277-5379.
- ^ а б c d Dinnendahl, V; Фрике, У, ред. (2010). Arzneistoff-Профиль (на немецком). 4 (23-е изд.). Эшборн, Германия: Govi Pharmazeutischer Verlag. ISBN 978-3-7741-98-46-3.
- ^ а б Хенрикссон П., Карлстрём К., Пусетт А., Гуннарссон П.О., Йоханссон С.Дж., Эрикссон Б., Альтерсгорд-Брорссон А.К., Нордле О., Стеге Р. (1999). «Время возрождения эстрогенов в лечении прогрессирующей карциномы простаты? Фармакокинетика, эндокринные и клинические эффекты режима парентерального введения эстрогенов». Простата. 40 (2): 76–82. Дои:10.1002 / (sici) 1097-0045 (19990701) 40: 2 <76 :: aid-pros2> 3.0.co; 2-q. PMID 10386467.
- ^ Карлстрем К., Коллсте Л., Эрикссон А., Хенрикссон П., Пусетт А., Стеге Р., фон Шульц Б. (1989). «Сравнение андрогенного статуса у пациентов с раком предстательной железы, получавших пероральные и / или парентеральные эстрогены или орхидэктомию». Простата. 14 (2): 177–82. Дои:10.1002 / pros.2990140210. PMID 2523531. S2CID 25516937.
- ^ Кокс Р.Л., Кроуфорд Э.Д. (декабрь 1995 г.). «Эстрогены в лечении рака простаты». Дж. Урол. 154 (6): 1991–8. Дои:10.1016 / S0022-5347 (01) 66670-9. PMID 7500443.
- ^ Wenderoth, U.K .; Якоби, Г. Х. (1983). «Аналоги гонадотропин-рилизинг гормона для паллиативного лечения рака простаты». Всемирный журнал урологии. 1 (1): 40–48. Дои:10.1007 / BF00326861. ISSN 0724-4983. S2CID 23447326.
- ^ О WK (сентябрь 2002 г.). «Растущая роль терапии эстрогенами при раке простаты». Clin рака простаты. 1 (2): 81–9. Дои:10.3816 / CGC.2002.n.009. PMID 15046698.
- ^ Стеге Р., Фрёландер Н., Карлстрём К., Пусетт А., фон Шульц Б. (1987). «Стероид-чувствительные белки, гормон роста и соматомедин С при раке предстательной железы: эффекты парентеральной и пероральной терапии эстрогенами». Простата. 10 (4): 333–8. Дои:10.1002 / pros.2990100407. PMID 2440014. S2CID 36814574.
- ^ фон Шульц Б., Карлстрём К. (февраль 1989 г.). «О регуляции глобулина, связывающего половые гормоны - вызов старой догме и очертания альтернативного механизма». J. Стероид Биохим. 32 (2): 327–34. Дои:10.1016/0022-4731(89)90272-0. PMID 2646476.
- ^ а б А. Лабхарт (6 декабря 2012 г.). Клиническая эндокринология: теория и практика. Springer Science & Business Media. С. 551–553. ISBN 978-3-642-96158-8.
- ^ Карл Кнёрр; Генриетта Кнёрр-Гертнер; Фриц К. Беллер; Кристиан Лауритцен (8 марта 2013 г.). Lehrbuch der Geburtshilfe und Gynäkologie: Physiologie und Pathologie der Reproduktion. Springer-Verlag. С. 508–. ISBN 978-3-662-00526-2.
- ^ Карл Кнёрр; Фриц К. Беллер; Кристиан Лауритцен (17 апреля 2013 г.). Lehrbuch der Gynäkologie. Springer-Verlag. п. 213. ISBN 978-3-662-00942-0.
- ^ Brambilla F, Berczeller PH, Epstein JA, Blatt MH, Kupperman HS (1961). «Опыт использования полиэстрадиолфосфата, эстрогена длительного действия». Акушерство и гинекология. 17 (1): 115–118. Дои:10.1097/00006250-196101000-00024 (неактивно 13.10.2020).CS1 maint: DOI неактивен по состоянию на октябрь 2020 г. (ссылка на сайт)
- ^ а б c d Diczfalusy, E (апрель 1954 г.). «Полиэстрадиолфосфат (PEP); водорастворимый эстроген длительного действия». Эндокринология. 54 (4): 471–7. Дои:10.1210 / эндо-54-4-471. PMID 13151143.
- ^ Якоби, Г. Р. (1 декабря 1982 г.). «Экспериментальное обоснование исследования антипролактинов в качестве паллиативного лечения рака простаты». В Якоби, Гюнтер Х; Хоэнфелльнер, Рудольф (ред.). Рак простаты. Уильямс и Уилкинс. п. 426. ISBN 978-0-683-04354-9.
- ^ Вермёлен А (1975). «Стероидные препараты длительного действия». Acta Clin Belg. 30 (1): 48–55. Дои:10.1080/17843286.1975.11716973. PMID 1231448.
- ^ Jacobi, G.H .; Альтвейн, Дж. Э. (1979). «Бромокриптин в качестве паллиативной терапии рака простаты на поздних стадиях: экспериментальный и клинический профиль в журнале Drugjournal = Urologia Internationalis». Urologia Internationalis. 34 (4): 266–290. Дои:10.1159/000280272. ISSN 1423-0399. PMID 89747.
- ^ Якоби Г. Х., Альтвейн Дж. Э., Курт К. Х., Бастинг Р., Хоэнфеллнер Р. (1980). «Лечение распространенного рака предстательной железы парентеральным ципротерона ацетатом: рандомизированное исследование фазы III». Br J Urol. 52 (3): 208–15. Дои:10.1111 / j.1464-410x.1980.tb02961.x. PMID 7000222.
- ^ П. Х. Смит (29 июня 2013 г.). Рак простаты и почек. Springer Science & Business Media. С. 307–. ISBN 978-1-4684-4349-3.
- ^ а б c С. Ганголли (1999). Словарь веществ и их эффектов: O-S. Королевское химическое общество. С. 425–. ISBN 978-0-85404-833-5.
- ^ а б Йоханссон, CJ; Gunnarsson, PO (июнь 2000 г.). «Фармакодинамическая модель подавления тестостерона после внутримышечной депо-эстрогеновой терапии при раке простаты». Простата. 44 (1): 26–30. Дои:10.1002 / 1097-0045 (20000615) 44: 1 <26 :: AID-PROS4> 3.0.CO; 2-P. PMID 10861754.
- ^ Патент США 2928849, Хёгберг Кнут Бертил; Fernö Ove Birger и Linderot Torsten Ove Enok et al., «Высокомолекулярные производные стероидов, содержащие гидроксильные группы, и способ их получения», опубликовано 15 марта 1960 г., переуступлено Leo Ab
- ^ Diczfalusy E, Fernö H, Fex B, Högberg B, Kneip P (1959). «Ингибиторы ферментов с высокой молекулярной массой. IV. Полимерные фосфаты синтетических эстрогенов» (PDF). Acta Chem. Сканд. 13 (5): 1011–1018. Дои:10.3891 / acta.chem.scand.13-1011.
- ^ а б Дицфалусы, Э; Fernö, O; Fex, H; Högberg, B; Linderot, T; Розенберг, Т. (1953). «Синтетические высокомолекулярные ингибиторы ферментов. I. Полимерные фосфаты флоретина и родственных соединений» (PDF). Acta Chem Scand. 7 (6): 921–7. Дои:10.3891 / acta.chem.scand.07-0913.
- ^ Пичинелли, А; Dapena, E; Mangas, JJ (1995). «Полифенольный образец в листьях яблони в зависимости от устойчивости к парше. Предварительное исследование». Журнал сельскохозяйственной и пищевой химии. 43 (8): 2273–78. Дои:10.1021 / jf00056a057.
- ^ Свенск Фармацевтика Тидскрифт. Sveriges Apotekareförbunds. 1973. с. 728.
- ^ а б http://www.micromedexsolutions.com
- ^ а б Свитмен, Шон С., изд. (2009). «Половые гормоны и их модуляторы». Мартиндейл: полный справочник лекарств (36-е изд.). Лондон: Фармацевтическая пресса. п. 2082. ISBN 978-0-85369-840-1.
- ^ Hartmann BW, Laml T, Kirchengast S, Albrecht AE, Huber JC (1998). «Гормональное увеличение груди: прогностическая значимость инсулиноподобного фактора роста-I». Гинеколь. Эндокринол. 12 (2): 123–7. Дои:10.3109/09513599809024960. PMID 9610425.
- ^ Джозеф Уильям Голдзихер; Кеннет Фотерби (1994). Фармакология противозачаточных стероидов. Raven Press. п. 154. ISBN 978-0-7817-0097-9.
- ^ Zañartu J, Rice-Wray E, Goldzieher JW (октябрь 1966 г.). «Контроль фертильности с помощью инъекционных стероидов длительного действия. Предварительный отчет». Акушер Гинеколь. 28 (4): 513–5. Дои:10.1097/00006250-196610000-00011 (неактивно 13.10.2020). PMID 5925038.CS1 maint: DOI неактивен по состоянию на октябрь 2020 г. (ссылка на сайт)
- ^ Гарри Бекман (1967). Ежегодник лекарственной терапии. Издатели ежегодников.
дальнейшее чтение
- Gunnarsson PO, Norlén BJ (1988). «Клиническая фармакология полиэстрадиолфосфата». Простата. 13 (4): 299–304. Дои:10.1002 / pro.2990130405. PMID 3217277. S2CID 33063805.
- фон Шульц Б., Карлстрём К., Коллсте Л., Эрикссон А., Хенрикссон П., Пусетт А., Стеге Р. (1989). «Эстрогеновая терапия и функция печени - метаболические эффекты при пероральном и парентеральном введении». Простата. 14 (4): 389–95. Дои:10.1002 / pros.2990140410. PMID 2664738. S2CID 21510744.
- Хенрикссон П. (1991). «Эстроген у больных раком простаты. Оценка риска и пользы». Drug Saf. 6 (1): 47–53. Дои:10.2165/00002018-199106010-00005. PMID 2029353. S2CID 39861824.
- Стеги Р., Сандер С. (март 1993 г.). "Эндокрин ведет себя при раке предстательной железы. En renessanse для парентерального эстрогена" [Эндокринное лечение рака простаты. Возрождение парентерального эстрогена. Tidsskr. Нет. Laegeforen. (на норвежском языке). 113 (7): 833–5. PMID 8480286.
- Стеге Р., Карлстрем К., Хедлунд П.О., Пусетт А., фон Шульц Б., Хенрикссон П. (сентябрь 1995 г.). "Внутримышечные депо-эстрогены (эстрадурин) в лечении пациентов с карцином простаты. Historische Aspekte, Wirkungsmechanismus, Resultate und aktueller klinischer Stand" [Внутримышечные депо-эстрогены (эстрадурин) в лечении пациентов с карцином простаты. Исторические аспекты, механизм действия, результаты и текущее клиническое состояние. Уролог А (на немецком). 34 (5): 398–403. ISSN 0340-2592. PMID 7483157.
- Смит PH, Робинсон MR (сентябрь 1995 г.). "Ренессанс терапии эстрогенами при распространенной карциноме простаты?". Уролог А (на немецком). 34 (5): 393–7. PMID 7483156.
- Кокс Р.Л., Кроуфорд Э.Д. (декабрь 1995 г.). «Эстрогены в лечении рака простаты». Дж. Урол. 154 (6): 1991–8. Дои:10.1016 / S0022-5347 (01) 66670-9. PMID 7500443.
- Миккола А., Рууту М., Аро Дж., Ранникко С., Сало Дж. (1999). «Роль парентерального полиэстрадиолфосфата в лечении запущенного рака простаты на пороге нового тысячелетия». Энн Чир Гинекол. 88 (1): 18–21. ISSN 0355-9521. PMID 10230677.
- О WK (сентябрь 2002 г.). «Растущая роль терапии эстрогенами при раке простаты». Clin рака простаты. 1 (2): 81–9. Дои:10.3816 / CGC.2002.n.009. PMID 15046698.
- Окрим Дж., Лалани Э. Н., Абель П. (октябрь 2006 г.). «Therapy Insight: парентеральное лечение эстрогенами при раке простаты - новая заря старой терапии». Нат Клин Прак Онкол. 3 (10): 552–63. Дои:10.1038 / ncponc0602. PMID 17019433. S2CID 6847203.
- Lycette JL, Bland LB, Garzotto M, Beer TM (декабрь 2006 г.). «Парентеральные эстрогены при раке простаты: может ли новый способ введения преодолеть старую токсичность?». Клин генитурин рака. 5 (3): 198–205. Дои:10.3816 / CGC.2006.n.037. PMID 17239273.
- Norman G, Dean ME, Langley RE, Hodges ZC, Ritchie G, Parmar MK, Sydes MR, Abel P, Eastwood AJ (февраль 2008 г.). «Парентеральный эстроген в лечении рака простаты: систематический обзор». Br. J. Рак. 98 (4): 697–707. Дои:10.1038 / sj.bjc.6604230. ЧВК 2259178. PMID 18268497.
- Окрим Дж, Абель П.Д. (2009). «Андрогенная депривация при раке простаты - потенциал парентерального эстрогена». Центральноевропейский журнал урологии. 62 (3): 132–140. Дои:10.5173 / ceju.2009.03.art1.
- Вибово Э, Шеллхаммер П., Вассерсуг Р.Дж. (январь 2011 г.). «Роль эстрогена в нормальной мужской функции: клиническое значение для пациентов с раком простаты на терапии депривации андрогенов». Дж. Урол. 185 (1): 17–23. Дои:10.1016 / j.juro.2010.08.094. PMID 21074215.
- Вибово Э., Вассерсуг Р.Дж. (сентябрь 2013 г.). «Влияние эстрогена на сексуальный интерес кастрированных мужчин: последствия для пациентов с раком простаты на терапии андрогенной депривации». Крит. Преподобный Онкол. Гематол. 87 (3): 224–38. Дои:10.1016 / j.critrevonc.2013.01.006. PMID 23484454.
- Филлипс И., Шах С.И., Дуонг Т., Абель П., Лэнгли Р.Е. (2014). «Андрогенная депривационная терапия и повторное появление парентерального эстрогена при раке простаты». Онкол Гематол Рев. 10 (1): 42–47. Дои:10.17925 / OHR.2014.10.1.42. ЧВК 4052190. PMID 24932461.
- Али Шах С.И. (2015). «Новый потенциал парентерального эстрогена в качестве андрогенной депривационной терапии рака простаты». Южноазиатский рак J. 4 (2): 95–7. Дои:10.4103 / 2278-330X.155699. ЧВК 4418092. PMID 25992351.
- Рассел Н., Чунг А., Гроссманн М. (август 2017 г.). «Эстрадиол для смягчения побочных эффектов терапии андрогенной депривации». Endocr. Relat. Рак. 24 (8): R297 – R313. Дои:10.1530 / ERC-17-0153. PMID 28667081.