Бензойная кислота - Википедия - Benzoic acid
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Бензойная кислота[1] | |||
| Систематическое название ИЮПАК Бензолкарбоновая кислота | |||
Другие имена
| |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| 3DMet | |||
| 636131 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.562 | ||
| Номер ЕС |
| ||
| Номер E | E210 (консерванты) | ||
| 2946 | |||
| КЕГГ | |||
| MeSH | бензойная + кислота | ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C7ЧАС6О2 | |||
| Молярная масса | 122.123 г · моль−1 | ||
| Внешность | Бесцветное кристаллическое твердое вещество | ||
| Запах | Слабый приятный запах | ||
| Плотность | 1,2659 г / см3 (15 ° С) 1,0749 г / см3 (130 ° С)[2] | ||
| Температура плавления | 122 ° С (252 ° F, 395 К)[7] | ||
| Точка кипения | 250 ° С (482 ° F, 523 К)[7] | ||
| 1,7 г / л (0 ° С) 2,7 г / л (18 ° С) 3,44 г / л (25 ° С) 5,51 г / л (40 ° С) 21,45 г / л (75 ° С) 56,31 г / л (100 ° С)[2][3] | |||
| Растворимость | растворим в ацетон, бензол, CCl4, CHCl3, алкоголь, этиловый эфир, гексан, фенилы, жидкость аммиак, ацетаты | ||
| Растворимость в метанол | 30 г / 100 г (-18 ° C) 32,1 г / 100 г (-13 ° С) 71,5 г / 100 г (23 ° С)[2] | ||
| Растворимость в этиловый спирт | 25,4 г / 100 г (-18 ° C) 47,1 г / 100 г (15 ° С) 52,4 г / 100 г (19,2 ° С) 55,9 г / 100 г (23 ° С)[2] | ||
| Растворимость в ацетон | 54,2 г / 100 г (20 ° С)[2] | ||
| Растворимость в оливковое масло | 4,22 г / 100 г (25 ° С)[2] | ||
| Растворимость в 1,4-диоксан | 55,3 г / 100 г (25 ° С)[2] | ||
| бревно п | 1.87 | ||
| Давление газа | 0,16 Па (25 ° C) 0,19 кПа (100 ° C) 22,6 кПа (200 ° C)[4] | ||
| Кислотность (пKа) | |||
| -70.28·10−6 см3/ моль | |||
| 1,5397 (20 ° С) 1,504 (132 ° С)[2] | |||
| Вязкость | 1,26 мПа (130 ° C) | ||
| Структура | |||
| Моноклиника | |||
| планарный | |||
| 1.72 D в диоксан | |||
| Термохимия | |||
Теплоемкость (C) | 146,7 Дж / моль · К[4] | ||
Стандартный моляр энтропия (S | 167,6 Дж / моль · К[2] | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -385,2 кДж / моль[2] | ||
Станд. Энтальпия горение (ΔcЧАС⦵298) | -3228 кДж / моль[4] | ||
| Опасности | |||
| Главный опасности | Раздражающий | ||
| Паспорт безопасности | Джей Ти Бейкер | ||
| Пиктограммы GHS |   [8] [8] | ||
| Сигнальное слово GHS | Опасность | ||
| H318, H335[8] | |||
| P261, P280, P305 + 351 + 338[8] | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 121,5 ° С (250,7 ° F, 394,6 К)[7] | ||
| 571 ° С (1060 ° F, 844 К)[7] | |||
| Смертельная доза или концентрация (LD, LC): | |||
LD50 (средняя доза ) | 1700 мг / кг (крыса, перорально) | ||
| Родственные соединения | |||
Связанный карбоновые кислоты | Гидроксибензойные кислоты Аминобензойные кислоты, Нитробензойные кислоты, Фенилуксусная кислота | ||
Родственные соединения | Бензальдегид, Бензиловый спирт, Бензоилхлорид, Бензиламин, Бензамид | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Бензойная кислота /бɛпˈzoʊ.ɪk/ представляет собой белое (или бесцветное) твердое вещество формулы C6ЧАС5CO2H. Это самый простой ароматный карбоновая кислота. Название происходит от камедь бензоин, который долгое время был его единственным источником. Бензойная кислота в природе встречается во многих растениях.[9] и служит промежуточным звеном в биосинтезе многих вторичные метаболиты. Соли бензойной кислоты используются в качестве пищевых консервантов. Бензойная кислота является важным прекурсором для промышленного синтеза многих других органических веществ. Соли и сложные эфиры бензойной кислоты известны как бензоаты /ˈбɛпzoʊ.eɪт/.
История
Бензойная кислота была открыта в шестнадцатом веке. В сухая перегонка из камедь бензоин был впервые описан Нострадамус (1556), а затем Алексиус Педемонтан (1560) и Блез де Виженера (1596).[10]
Юстус фон Либих и Фридрих Вёлер определил состав бензойной кислоты.[11] Последние также исследовали, как гиппуровая кислота относится к бензойной кислоте.
В 1875 году Сальковский открыл противогрибковый способности бензойной кислоты, которая долгое время использовалась для консервирования бензоатсодержащих плоды морошки.[12]
Это также одно из химических соединений, обнаруженных в кастореум. Это соединение собрано из касторовые мешки из Североамериканский бобр.
Производство
Промышленные препараты
Бензойная кислота коммерчески производится частичное окисление из толуол с кислород. Процесс катализируется кобальт или же марганец нафтенаты. В процессе используется большое количество материалов, и он идет с высоким выходом.[13]
Первый промышленный процесс включал реакцию бензотрихлорид (трихлорметилбензол) с гидроксид кальция в воде, используя утюг или соли железа как катализатор. Результирующий бензоат кальция превращается в бензойную кислоту с соляная кислота. Продукт содержит значительное количество производных хлорированной бензойной кислоты. По этой причине бензойная кислота для потребления человеком была получена сухой перегонкой бензоина камеди. Пищевая бензойная кислота теперь производится синтетическим путем.
Лабораторный синтез
Бензойная кислота дешевая и легкодоступная, поэтому лабораторный синтез бензойной кислоты в основном практикуется из-за ее педагогической ценности. Это обычная подготовка к бакалавриату.
Бензойную кислоту можно очистить перекристаллизация из воды из-за его высокой растворимости в горячей воде и плохой растворимости в холодной воде. Избегание использования органических растворителей для перекристаллизации делает этот эксперимент особенно безопасным. Этот процесс обычно дает около 65% выхода. [14]
Путем гидролиза
Как и другие нитрилы и амиды, бензонитрил и бензамид может быть гидролизован до бензойной кислоты или ее сопряженного основания в кислотных или основных условиях.
Из реактива Гриньяра
Бромбензол может быть превращен в бензойную кислоту путем «карбоксилирования» промежуточного соединения фенилмагний бромид.[15] Этот синтез предлагает студентам удобное упражнение для выполнения Реакция Гриньяра, важный класс углерод-углеродная связь образующая реакция в органической химии.[16][17][18][19][20]
Окисление бензильных соединений
Бензиловый спирт[21][22] и бензилхлорид и практически все производные бензила легко окисляются до бензойной кислоты.
Использует
Бензойная кислота в основном расходуется на производство фенол окислительным декарбоксилирование при 300-400 ° С:[23]
- C6ЧАС5CO2H + 1/2 О2 → С6ЧАС5ОН + СО2
Требуемая температура может быть снижена до 200 ° C путем добавления каталитических количеств солей меди (II). Фенол можно превратить в циклогексанол, который является исходным материалом для нейлон синтез.
Прекурсор пластификаторов
Бензоат пластификаторы, такие как сложные эфиры гликоля, диэтиленгликоля и триэтиленгликоля, получают переэтерификация из метилбензоат с соответствующими диол. Альтернативно эти частицы возникают при обработке бензоилхлорида диолом. Эти пластификаторы используются аналогично пластификаторам, полученным из терефталевая кислота сложный эфир.
Бензойная кислота и ее соли используются в пищу консерванты в лице E числа E210, E211, E212, и E213. Бензойная кислота подавляет рост плесень, дрожжи[24] и немного бактерии. Он либо добавляется напрямую, либо создается в результате реакций с его натрий, калий, или же кальций соль. Механизм начинается с поглощения бензойной кислоты клеткой. Если внутриклеточный pH изменяется на 5 или ниже, анаэробное брожение из глюкоза через фосфофруктокиназа уменьшено на 95%. Таким образом, эффективность бензойной кислоты и бензоата зависит от pH пищи.[25] Кислая еда и напитки, например фруктовый сок (лимонная кислота ), газированные напитки (углекислый газ ), безалкогольные напитки (фосфорная кислота ), соленья (уксус ) или другие подкисленные продукты консервируются бензойной кислотой и бензоатами.
Типичные уровни использования бензойной кислоты в качестве консерванта в пищевых продуктах составляют 0,05–0,1%. Пищевые продукты, в которых может использоваться бензойная кислота, и максимальные уровни для ее применения регулируются местными законами о пищевых продуктах.[26][27]
Высказывались опасения, что бензойная кислота и ее соли могут реагировать с аскорбиновая кислота (витамин C) в некоторых безалкогольных напитках, образуя небольшие количества канцерогенных веществ. бензол.[28]
Лекарственные
Бензойная кислота входит в состав Мазь Уитфилда который используется для лечения грибковых заболеваний кожи, таких как опоясывающий лишай, стригущий лишай, и нога спортсмена.[29][30] В качестве основного компонента камедь бензоин, бензойная кислота также является основным ингредиентом обоих настойка бензоина и бальзам Монаха. Такие продукты имеют долгую историю использования в качестве актуальных. антисептики и ингалянт противоотечные средства.
Бензойная кислота использовалась как отхаркивающее средство, обезболивающее, и антисептик в начале 20 века.[31]
Лабораторные исследования [32] а также недавние теоретические работы[33][34] подчеркнули, что производные бензойной кислоты перспективны для ингибирования коронавирус (SARS-CoV ).
Бензоилхлорид
Бензойная кислота является предшественником бензоилхлорид, С6ЧАС5C (O) Cl обработкой тионилхлорид, фосген или один из хлориды фосфора. Бензоилхлорид является важным исходным материалом для нескольких производных бензойной кислоты, таких как бензилбензоат, который используется в искусственные ароматизаторы и репелленты от насекомых.
Ниши и лабораторные применения
В учебных лабораториях бензойная кислота является обычным стандартом для калибровки калориметр бомбы.[35]
Биология и влияние на здоровье
Бензойная кислота, как и ее сложные эфиры, встречается в природе во многих видах растений и животных. Заметные количества содержатся в большинстве ягод (около 0,05%). Спелые плоды нескольких Vaccinium виды (например, клюква, V. vitis macrocarpon; черника, V. myrtillus) содержат до 0,03–0,13% свободной бензойной кислоты. Бензойная кислота также образуется в яблоки после заражения грибком Nectria galligena. Среди животных бензойная кислота была идентифицирована в основном у всеядных или фитофагов, например, во внутренних органах и мышцах рок куропатка (Lagopus muta), а также в секрете желез самцов овцебык (Ovibos moschatus) или азиатских слонов-быков (Elephas maximus ).[36] Бензоин камеди содержит до 20% бензойной кислоты и 40% эфиров бензойной кислоты.[37]
Что касается биосинтеза, бензоат вырабатывается растениями из коричной кислоты.[38] Путь был идентифицирован из фенол через 4-гидроксибензоат.[39]
Реакции
Реакции бензойной кислоты могут происходить как в ароматическое кольцо или на карбоксильная группа:
Ароматическое кольцо
Электрофильное ароматическое замещение реакция будет происходить в основном в 3-м положении из-за электроноакцепторный карбоксильная группа; т.е. бензойная кислота мета руководство.[40]
Карбоксильная группа
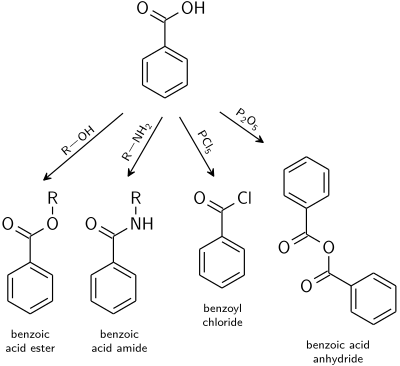
Реакции, характерные для карбоновые кислоты применимо также к бензойной кислоте.
- Бензоат сложные эфиры являются продуктом катализируемой кислотой реакции с спирты.
- Бензойная кислота амиды обычно готовятся из бензоилхлорид.
- Обезвоживание до бензойный ангидрид индуцируется уксусный ангидрид или же пятиокись фосфора.
- Производные кислот с высокой реакционной способностью, такие как галогенангидриды легко получить путем смешивания с галогенирование такие агенты, как хлориды фосфора или же тионилхлорид.
- Ортоэфиры может быть получен реакцией спиртов в кислых безводных условиях с бензонитрил.
- Приведение к бензальдегид и бензиловый спирт возможно использование ДИБАЛ-Н, LiAlH4 или же борогидрид натрия.
- Декарбоксилирование в бензол может происходить нагреванием в хинолин в присутствии солей меди. Декарбоксилирование Хунсдикера может быть достигнуто нагреванием серебряной соли.
Безопасность и метаболизм млекопитающих
Выводится как гиппуровая кислота.[41] Бензойная кислота метаболизируется бутират-КоА лигаза в промежуточный продукт, бензоил-КоА,[42] который затем метаболизируется глицин N-ацилтрансфераза в гиппуровую кислоту.[43] Люди метаболизируют толуол и бензойная кислота, которая выделяется в виде гиппуровая кислота.[44]
Для людей Всемирная организация здоровья с Международная программа химической безопасности (IPCS) предполагает, что предварительная переносимая доза составит 5 мг / кг массы тела в день.[36] Кошки имеют значительно более низкую толерантность к бензойной кислоте и ее соли чем крысы и мышей. Смертельная доза для кошек может составлять всего 300 мг / кг массы тела.[45] Устный LD50 для крыс - 3040 мг / кг, для мышей - 1940–2263 мг / кг.[36]
В Тайбэй Проведенное в 2010 году в городе Тайвань медицинское обследование показало, что 30% сушеных и маринованных пищевых продуктов содержат бензойную кислоту.[46]
Рекомендации
- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 745. Дои:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ^ а б c d е ж грамм час я j "бензойная кислота". chemister.ru. Получено 24 октября 2018.
- ^ Зейделл, Атертон; Линке, Уильям Ф. (1952). Растворимость неорганических и органических соединений. Ван Ностранд. Получено 29 мая 2014.
- ^ а б c Бензойная кислота в Linstrom, Peter J .; Маллард, Уильям Г. (ред.); Веб-книга NIST Chemistry, стандартная справочная база данных NIST номер 69, Национальный институт стандартов и технологий, Гейтерсбург (Мэриленд), http://webbook.nist.gov (Дата обращения 23 мая 2014)
- ^ Харрис, Дэниел (2010). Количественный химический анализ (8-е изд.). Нью-Йорк: В. Х. Фриман и компания. С. AP12. ISBN 9781429254366.
- ^ Олмстед, Уильям Н .; Бордвелл, Фредерик Г. (1980). «Константы ионно-парной ассоциации в диметилсульфоксиде». Журнал органической химии. 45 (16): 3299–3305. Дои:10.1021 / jo01304a033.
- ^ а б c d Записывать в базе данных веществ GESTIS Институт охраны труда и здоровья
- ^ а б c Сигма-Олдрич Ко., Бензойная кислота. Проверено 23 мая 2014.
- ^ «Ученые открывают последние шаги для создания бензойной кислоты в растениях». Новости сельского хозяйства Purdue.
- ^ Neumüller O-A (1988). Römpps Chemie-Lexikon (6 изд.). Штутгарт: Frankh'sche Verlagshandlung. ISBN 978-3-440-04516-9. OCLC 50969944.
- ^ Либих Дж.; Вёлер Ф (1832 г.). "Untersuchungen über das Radikal der Benzoesäure". Annalen der Chemie. 3 (3): 249–282. Дои:10.1002 / jlac.18320030302. HDL:2027 / hvd.hxdg3f.
- ^ Сальковский Э. (1875). Берл Клин Вохеншр. 12: 297–298. Отсутствует или пусто
| название =(помощь) - ^ Уэйд, Лерой Г. (2014). Органическая химия (Новое международное издание Пирсона). Харлоу: Pearson Education Limited. п. 985. ISBN 978-1-292-02165-2.
- ^ Д. Д. Перрин; У. Л. Ф. Армарего (1988). Очистка лабораторных химикатов (3-е изд.). Pergamon Press. стр.94. ISBN 978-0-08-034715-8.
- ^ Дональд Л. Павия (2004). Введение в методы органической лаборатории: маломасштабный подход. Томсон Брукс / Коул. С. 312–314. ISBN 978-0-534-40833-6.
- ^ Ширли, Д. А. (1954). «Синтез кетонов из галогенидов и металлоорганических соединений магния, цинка и кадмия». Орг. Реагировать. 8: 28–58.
- ^ Хурин, Д. М. (1991). «Карбанионы щелочных и щелочноземельных катионов: (ii) Селективность реакций присоединения карбонила». В Трост, Б.М.; Флеминг, И. (ред.). Комплексный органический синтез, Том 1: Дополнения к π-связям C — X, Часть 1. Elsevier Science. С. 49–75. Дои:10.1016 / B978-0-08-052349-1.00002-0. ISBN 978-0-08-052349-1.
- ^ «Реакция Гриньяра. Получение бензойной кислоты» (PDF). Портлендский муниципальный колледж. Архивировано из оригинал (PDF) 26 февраля 2015 г.. Получено 12 марта 2015.>
- ^ «Эксперимент 9: Синтез бензойной кислоты карбонилированием реактива Гриньяра» (PDF). Университет Висконсин-Мэдисон. Архивировано из оригинал (PDF) 23 сентября 2015 г.. Получено 12 марта 2015.
- ^ «Эксперимент 3: Получение бензойной кислоты» (PDF). Тоусонский университет. Архивировано из оригинал (PDF) 13 апреля 2015 г.. Получено 12 марта 2015.>
- ^ Амакава, Кадзухико; Коленько, Юрий В .; Вилла, Альберто; Шустер, Манфред Э /; Чепеи, Ленард-Иштван; Вайнберг, Гизела; Врабец, Сабина; Науманн д'Алнонкур, Рауль; Girgsdies, Франк; Прати, Лаура; Шлёгль, Роберт; Траншке, Аннетт (2013). «Многофункциональность кристаллических оксидных катализаторов MoV (TeNb) M1 в селективном окислении пропана и бензилового спирта». Катализ ACS. 3 (6): 1103–1113. Дои:10.1021 / cs400010q.
- ^ Сантонастасо, Марко; Фрикли, Саймон Дж .; Miedziak, Peter J .; Brett, Gemma L .; Эдвардс, Дженнифер К .; Хатчингс, Грэм Дж. (21 ноября 2014 г.). «Окисление бензилового спирта с использованием перекиси водорода, полученной in situ». Исследования и разработки в области органических процессов. 18 (11): 1455–1460. Дои:10.1021 / op500195e. ISSN 1083-6160.
- ^ Маки, Такао; Такеда, Кадзуо (2000). «Бензойная кислота и производные». Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.a03_555. ISBN 978-3527306732..
- ^ А. Д. Варт (1 декабря 1991 г.). «Механизм действия бензойной кислоты на Zygosaccharomyces bailii: влияние на уровни гликолитических метаболитов, выработку энергии и внутриклеточный pH». Appl Environ Microbiol. 57 (12): 3410–4. Дои:10.1128 / AEM.57.12.3410-3414.1991. ЧВК 183988. PMID 1785916.
- ^ Пастророва И., де Костер К.Г., Бум Дж. Дж. (1997). «Аналитическое исследование свободных и сложноэфирных бензойных и коричных кислот камеди бензоиновых смол с помощью ГХ-МС, ВЭЖХ-фритта, FAB-МС». Фитохим Анал. 8 (2): 63–73. Дои:10.1002 / (SICI) 1099-1565 (199703) 8: 2 <63 :: AID-PCA337> 3.0.CO; 2-Y.
- ^ Подробная информация о группе пищевых добавок GSFA: бензоаты (2006 г.) В архиве 26 сентября 2007 г. Wayback Machine
- ^ ДИРЕКТИВА ЕВРОПЕЙСКОГО ПАРЛАМЕНТА И СОВЕТА № 95/2 / EC от 20 февраля 1995 г. о пищевых добавках, кроме красителей и подсластителей (версии Consleg не содержат последних изменений в законе) В архиве 19 апреля 2003 г. Wayback Machine
- ^ Статья BfR Указания на возможное образование бензола из бензойной кислоты в пищевых продуктах, Заключение эксперта BfR № 013/2006, 1 декабря 2005 г.
- ^ «Мазь Уитфилда». Архивировано из оригинал 9 октября 2007 г.. Получено 15 октября 2007.
- ^ Чарльз Оуэнс Уилсон; Оле Гисволд; Джон Х. Блок (2004). Учебник Уилсона и Гисволда по органическим лекарственным и фармацевтическим препаратам. Липпинкотт Уильямс и Уилкинс. стр.234. ISBN 978-0-7817-3481-3.
- ^ Лиллард, Бенджамин (1919). «Троши бензойной кислоты». Практический аптекарь и фармацевтический обзор отзывов.
- ^ «Структурный вид инактивации основной протеиназы коронавируса SARS бензотриазольными эфирами». Химия и биология. 15 (6): 597–606. 23 июня 2008 г. Дои:https://doi.org/10.1016/j.chembiol.2008.04.011 Проверять
| doi =ценить (помощь). - ^ Брей, Уильям (2020). «Разработка лекарства против Covid-19 с помощью принципов квантовой механики приводит к созданию нового кандидата против вируса коронавируса и атипичной пневмонии - 2-фосфонобензойной кислоты». Дои:10.13140 / RG.2.2.17515.28962 / 2. Цитировать журнал требует
| журнал =(помощь) - ^ Стефаниу, Амалия; Пирву, Лючия; Албу, Бужор; Пинтили, Люсия (NaN). «Молекулярное докинговое исследование нескольких производных бензойной кислоты против SARS-CoV-2». Молекулы. 25 (24): 5828. Дои:10.3390 / молекул 25245828. Проверить значения даты в:
| дата =(помощь) - ^ Эксперимент 2: Использование калориметрии бомбы для определения энергии резонанса бензола В архиве 9 марта 2012 г. Wayback Machine
- ^ а б c «Краткий международный документ по химической оценке 26: БЕНЗОЙНАЯ КИСЛОТА И БЕНЗОАТ НАТРИЯ».
- ^ Томокуни К, Огата М (1972). «Прямое колориметрическое определение гиппуровой кислоты в моче». Clin Chem. 18 (4): 349–351. Дои:10.1093 / Clinchem / 18.4.349. PMID 5012256.
- ^ Фогт, Т. (2010). «Биосинтез фенилпропаноидов». Молекулярный завод. 3: 2–20. Дои:10,1093 / мп / ссп106. PMID 20035037.
- ^ Жюто, Пьер; Валери Коте; Мари-Франс Дакетт; Реджан Боде; Франсуа Лепин; Ричард Виллемур; Жан-Ги Бизайон (январь 2005 г.). «Cryptanaerobacter phenolicus gen. Nov., Sp. Nov., Анаэроб, который превращает фенол в бензоат через 4-гидроксибензоат». Международный журнал систематической и эволюционной микробиологии. 55 (1): 245–250. Дои:10.1099 / ijs.0.02914-0. PMID 15653882.
- ^ Brewster, R.Q .; Уильямс, B .; Филлипс, Р. (1955). «3,5-динитробензойная кислота». Органический синтез.; Коллективный объем, 3, п. 337
- ^ Группа экспертов по обзору косметических ингредиентов Бинду Наир (2001). «Заключительный отчет по оценке безопасности бензилового спирта, бензойной кислоты и бензоата натрия». Int J Tox. 20 (Прил. 3): 23–50. Дои:10.1080/10915810152630729. PMID 11766131. S2CID 13639993.
- ^ «бутират-КоА лигаза». БРЕНДА. Technische Universität Брауншвейг. Получено 7 мая 2014. Субстрат / Продукт
- ^ «глицин-N-ацилтрансфераза». БРЕНДА. Technische Universität Брауншвейг. Получено 7 мая 2014. Субстрат / Продукт
- ^ Кребс Х.А., Виггинс Д., Стаббс М. (1983). «Исследования механизма противогрибкового действия бензоата». Biochem J. 214 (3): 657–663. Дои:10.1042 / bj2140657. ЧВК 1152300. PMID 6226283.
- ^ Бедфорд П.Г., Кларк Э.Г. (1972). «Экспериментальное отравление бензойной кислотой у кошки». Vet Rec. 90 (3): 53–58. Дои:10.1136 / vr.90.3.53. PMID 4672555. S2CID 2553612.
- ^ Чен, Цзянь; Ю.Л. Као (18 января 2010 г.). «Почти 30% сушеных маринованных продуктов не прошли проверку на безопасность». Почта Китая.