Фосфофруктокиназа - Phosphofructokinase
| Фосфофруктокиназа | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||
| Идентификаторы | |||||||||||
| Символ | Ппфрукиназа | ||||||||||
| Pfam | PF00365 | ||||||||||
| ИнтерПро | IPR000023 | ||||||||||
| PROSITE | PDOC00336 | ||||||||||
| |||||||||||
Фосфофруктокиназа (ПФК) это киназа фермент, который фосфорилаты фруктозо-6-фосфат в гликолиз.
Функция
Катализируемый ферментами перенос фосфорильная группа из АТФ является важной реакцией в самых разных биологических процессах.[1] Фосфофруктокиназа катализирует фосфорилирование фруктозо-6-фосфат к фруктозо-1,6-бисфосфат, ключевой шаг регулирования в гликолитический путь.[2][3] это аллостерически подавленный АТФ и аллостерически активируется AMP, что указывает на энергетические потребности клетки, когда она проходит гликолитический путь.[4] ПФК существует как гомотетрамер в бактерии и млекопитающие (где каждый мономер обладает 2 похожими домены ) и как октомер в дрожжи (где есть 4 альфа- (PFK1) и 4 бета-цепи (PFK2), последние, как и мономеры млекопитающих, обладают 2 подобными доменами[3]). Этот белок может использовать морфеин модель аллостерическая регуляция.[5]
ПФК около 300 аминокислоты в длину и структурные исследования бактериальный фермент показали, что он состоит из двух одинаковых (альфа / бета) долей: одна участвует в связывании АТФ, а другая содержит как сайт связывания субстрата, так и аллостерический сайт (регуляторный сайт связывания, отличный от активного сайта, но это влияет на активность фермента). Идентичный тетрамер субъединицы принимают 2 различных конформации: в «закрытом» состоянии связанная ион магния связывает фосфорильные группы продуктов фермента (АДФ и фруктозо-1,6-бисфосфат); а в «открытом» состоянии ион магния связывает только ADP,[6] поскольку эти 2 продукта теперь еще дальше друг от друга. Эти конформации считаются последовательными этапами путь реакции это требует закрытия субъединицы, чтобы подвести 2 молекулы достаточно близко для реакции.[6]
Обратная реакция катализированный ферментом фруктозо-1,6-бисфосфатазой.
Семейство фосфофруктокиназ
PFK принадлежит к семейству фосфофруктокиназы B (PfkB) сахарные киназы.[7] Другие члены этого семейства (также известного как семейство рибокиназ) включают: рибокиназа (РК), аденозинкиназа (AK), инозинкиназа, и 1-фосфофруктокиназа.[7][8][9] Члены семейства PfkB / RK идентифицируются по наличию трех консервативных последовательностей мотивы.[7][8][10] Структуры нескольких семейств белков PfK были определены у ряда организмов и ферментативная активность этого семейства белков показывает зависимость от присутствия пятивалентных ионов.[11][7][10] PFK находится в версиях изоформ в скелетные мышцы (ПФКМ), в печень (ПФКЛ) и от тромбоциты (PFKP), что позволяет выражение и функция. По-прежнему предполагается, что изоформы могут играть роль в определенных гликолитические скорости в тканевой среде, в которой они находятся. У людей было обнаружено, что некоторые человеческие линии опухолевых клеток имели повышенную гликолитическую продуктивность и коррелировали с повышенным количеством PFKL.[12][13]
Клиническое значение
Дефицит ПФК приводит к гликогеноз VII типа (Болезнь Таруи), аутосомно-рецессивное заболевание, характеризующееся сильной тошнотой, рвотой, мышечными судорогами и миоглобинурией в ответ на приступы интенсивных или энергичных упражнений.[3] Больные обычно могут вести достаточно обычный образ жизни, научившись регулировать уровень активности.[3]
Регулирование
У человека есть два разных фермента фосфофруктокиназы:
| Тип | Синонимы | Номер ЕС | Субстрат | Товар | Гены паралогов |
|---|---|---|---|---|---|
| Фосфофруктокиназа 1 | 6-фосфофруктокиназа фосфогексокиназа | EC 2.7.1.11 |  Фруктоза 6-фосфат |  Фруктозо-1,6-бисфосфат | ПФКЛ, ПФКМ, ПФКП |
| Фосфофруктокиназа 2 | 6-фосфофрукто-2-киназа | EC 2.7.1.105 | 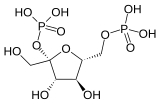 Фруктозо-2,6-бисфосфат | PFKFB1, PFKFB2, PFKFB3, PFKFB4 |
Смотрите также
- Дефицит фосфофруктокиназы (GSD тип VII, болезнь Таруи)
Рекомендации
- ^ Evans PR, Hellinga HW (1987). «Мутации в активном центре фосфофруктокиназы Escherichia coli». Природа. 327 (6121): 437–439. Bibcode:1987Натура.327..437H. Дои:10.1038 / 327437a0. PMID 2953977.
- ^ Вегенер Г, Краузе У (2002). «Различные способы активации фосфофруктокиназы, ключевого регуляторного фермента гликолиза, в работающих мышцах позвоночных». Biochem. Soc. Транс. 30 (2): 264–270. Дои:10.1042 / bst0300264. PMID 12023862.
- ^ а б c d Рабен Н., Эксельберт Р., Шпигель Р., Шерман Дж. Б., Накадзима Х., Плотц П., Хайниш Дж. (1995). «Функциональная экспрессия мутантной фосфофруктокиназы человека в дрожжах: генетические дефекты у французских канадских и швейцарских пациентов с дефицитом фосфофруктокиназы». Являюсь. J. Hum. Genet. 56 (1): 131–141. ЧВК 1801305. PMID 7825568.
- ^ Гаррет, Реджинальд; Гришэм, Реджинальд (2012). Биохимия. Cengage Learning. п. 585. ISBN 978-1133106296.
- ^ Т. Селвуд; Э. К. Яффе. (2011). «Динамические диссоциирующие гомоолигомеры и контроль функции белка». Arch. Biochem. Биофизы. 519 (2): 131–43. Дои:10.1016 / j.abb.2011.11.020. ЧВК 3298769. PMID 22182754.
- ^ а б Shirakihara Y, Evans PR (1988). «Кристаллическая структура комплекса фосфофруктокиназы Escherichia coli с продуктами ее реакции». J. Mol. Биол. 204 (4): 973–994. Дои:10.1016/0022-2836(88)90056-3. PMID 2975709.
- ^ а б c d Парк Дж., Гупта RS: Аденозинкиназа и рибокиназа - семейство белков РК. Cell Mol Life Sci 2008, 65: 2875-2896.
- ^ а б Борк П., Сандер С., Валенсия А: Конвергентная эволюция сходной ферментативной функции на разных белковых складках: гексокиназа, рибокиназа и семейства галактокиназ сахарокиназ. Protein Sci 1993, 2: 31-40.
- ^ Spychala J, Datta NS, Takabayashi K, Datta M, Fox IH, Gribbin T, Mitchell BS: Клонирование кДНК аденозинкиназы человека: сходство последовательностей с микробными рибокиназами и фруктокиназами. Proc Natl Acad Sci U S. A 1996, 93: 1232-1237.
- ^ а б Maj MC, Singh B, Gupta RS: Зависимость от пятивалентных ионов - это законсервированное свойство аденозинкиназы из различных источников: идентификация нового мотива, участвующего в связывании ионов фосфата и магния и ингибировании субстрата. Биохимия 2002, 41: 4059-4069.
- ^ Сигрелл Дж. А., Камерон А. Д., Джонс Т. А., Моубрей С. Л.: Структура рибокиназы Escherichia coli в комплексе с рибозой и динуклеотидом определена с точностью до 1,8 Разрешение: понимание нового семейства структур киназ. Структура 1998, 6: 183-193.
- ^ Сола-Пенна, Мауро; Да Силва, Даниэль; Коэльо, Вагнер С .; Marinho-Carvalho, Monica M .; Занкан, Патрисия (ноябрь 2010 г.). «Регуляция мышечного типа 6-фосфофрукто-1-киназы и ее значение для контроля метаболизма». IUBMB Life. 62 (11): 791–796. Дои:10.1002 / iub.393. ISSN 1521-6543. PMID 21117169.
- ^ Аусина, Присцила; Да Силва, Даниэль; Майерович, Давид; Занкан, Патрисия; Сола-Пенна, Мауро (июль 2018 г.). «Инсулин специфически регулирует экспрессию изоформ фосфофруктокиназы печени и мышц». Биомедицина и фармакотерапия. 103: 228–233. Дои:10.1016 / j.biopha.2018.04.033. ISSN 0753-3322. PMID 29655163.
внешняя ссылка
- Фосфофруктокиназы в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
