Обратная транскриптаза - Reverse transcriptase
| Обратная транскриптаза (РНК-зависимая ДНК-полимераза) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Идентификаторы | |||||||||
| Символ | RVT_1 | ||||||||
| Pfam | PF00078 | ||||||||
| Pfam клан | CL0027 | ||||||||
| ИнтерПро | IPR000477 | ||||||||
| PROSITE | PS50878 | ||||||||
| SCOP2 | 1hmv / Объем / СУПФАМ | ||||||||
| CDD | cd00304 | ||||||||
| |||||||||
| РНК-направленная ДНК-полимераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 2.7.7.49 | ||||||||
| Количество CAS | 9068-38-6 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
А обратная транскриптаза (RT) - это фермент используется для создания комплементарная ДНК (кДНК) из РНК шаблон, процесс, называемый обратная транскрипция. Обратные транскриптазы используются некоторыми вирусы Такие как ВИЧ и вирус гепатита В реплицировать свои геномы путем ретротранспозон мобильные генетические элементы для размножения в геноме хозяина и эукариотический ячейки для расширения теломеры в конце их линейные хромосомы. Вопреки широко распространенному мнению, этот процесс не нарушает потоки генетической информации, описанные классическим центральная догма, поскольку передача информации от РНК к ДНК явно считается возможной.[2][3][4]
Ретровирусная ОТ имеет три последовательных биохимических активности: РНК-зависимую. ДНК-полимераза Мероприятия, рибонуклеаза H (РНКаза H) и ДНК-зависимая ДНК-полимеразная активность. В совокупности эти активности позволяют ферменту превращать одноцепочечную РНК в двухцепочечную кДНК. В ретровирусах и ретротранспозонах эта кДНК может затем интегрироваться в геном хозяина, из которого могут быть созданы новые копии РНК через клетку-хозяин. транскрипция. Та же последовательность реакций широко используется в лаборатории для преобразования РНК в ДНК для использования в молекулярное клонирование, Секвенирование РНК, полимеразной цепной реакции (ПЦР), или анализ генома.
История
Обратные транскриптазы были открыты Говард Темин на Университет Висконсина-Мэдисона в Саркома Рауса вирионы[5] и независимо изолированы Дэвид Балтимор в 1970 г. Массачусетский технологический институт от двух опухолевых вирусов РНК: вирус лейкемии мышей и опять Вирус саркомы Рауса.[6] За свои достижения они разделили 1975 год. Нобелевская премия по физиологии и медицине (с Ренато Дульбекко ).
Хорошо изученные обратные транскриптазы включают:
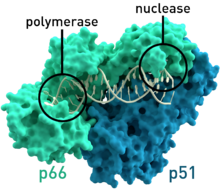
- Обратная транскриптаза ВИЧ-1 из Вирус иммунодефицита человека Тип 1 (PDB: 1HMV) Состоит из двух субъединиц с молекулярными массами 66 и 51 соответственно. кДа.[7]
- Обратная транскриптаза M-MLV из Вирус мышиного лейкоза Молони представляет собой единственный мономер 75 кДа.[8]
- Обратная транскриптаза AMV из вирус птичьего миелобластоза также имеет две субъединицы, субъединицу 63 кДа и субъединицу 95 кДа.[8]
- Обратная транскриптаза теломеразы который поддерживает теломеры из эукариотический хромосомы.[9]
Функция в вирусах

Ферменты кодируются и используются вирусами, которые используют обратную транскрипцию в качестве шага в процессе репликации. Обратная расшифровка РНК-вирусы, Такие как ретровирусы, используйте фермент для обратной транскрипции их РНК геномы в ДНК, которая затем интегрируется в геном хозяина и реплицируется вместе с ним. Обратная расшифровка ДНК-вирусы, такой как гепаднавирусы, может позволить РНК служить в качестве матрицы при сборке и создании цепей ДНК. ВИЧ заражает людей с помощью этого фермента. Без обратной транскриптазы вирусный геном не смог бы интегрироваться в клетку-хозяин, что привело бы к невозможности репликации.
Процесс обратной транскрипции или ретротранскрипции
Обратная транскриптаза создает двухцепочечную ДНК из матрицы РНК.
У видов вирусов с обратной транскриптазой, лишенной ДНК-зависимой ДНК-полимеразной активности, создание двухцепочечной ДНК может быть осуществлено с помощью кодируемой хозяином ДНК-полимераза δ, ошибочно принимая вирусную ДНК-РНК за праймер и синтезируя двухцепочечную ДНК по такому же механизму, как в удаление грунтовки, где вновь синтезированная ДНК вытесняет исходную матрицу РНК.
Процесс обратной транскрипции, также называемый ретротранскрипцией или ретротрами, чрезвычайно подвержен ошибкам, и именно на этом этапе могут происходить мутации. Такие мутации могут вызвать устойчивость к лекарству.
Обратная транскрипция ретровирусов

Ретровирусы, также называемый классом VI оцРНК-RT вирусы, представляют собой вирусы с обратной транскрипцией РНК с промежуточным ДНК. Их геномы состоят из двух молекул положительный смысл одноцепочечная РНК с Крышка 5 футов и 3 'полиаденилированный хвост. Примеры ретровирусов включают вирус иммунодефицита человека (ВИЧ ) и человеческий Т-лимфотропный вирус (HTLV ). Создание двухцепочечной ДНК происходит в цитозоль[10] как серию этих шагов:
- Лизил тРНК действует как праймер и гибридизуется с комплементарной частью генома вирусной РНК, называемой сайтом связывания праймера или PBS.
- Затем обратная транскриптаза добавляет нуклеотиды ДНК на 3'-конец праймера, синтезируя Комплементарная ДНК в U5 (некодирующую область) и R-область (прямой повтор, обнаруженный на обоих концах молекулы РНК) вирусной РНК.
- Домен фермента обратной транскриптазы, называемый РНКаза H разрушает области U5 и R на 5 ’конце РНК.
- Праймер тРНК затем «перескакивает» на 3 ’конца вирусного генома, и вновь синтезированные цепи ДНК гибридизуются с комплементарной областью R на РНК.
- Комплементарная ДНК (кДНК), добавленная в (2), дополнительно удлиняется.
- Большая часть вирусной РНК расщепляется РНКазой H, оставляя только последовательность PP.
- Начинается синтез второй цепи ДНК с использованием оставшегося фрагмента РР вирусной РНК в качестве праймера.
- Праймер тРНК уходит, и происходит «прыжок». PBS из второй цепи гибридизуется с комплементарным PBS на первой цепи.
- Обе цепи удлиняются с образованием полной двухцепочечной ДНК-копии исходного генома вирусной РНК, которая затем может быть включена в геном хозяина с помощью фермента. интегрировать.
Создание двухцепочечной ДНК также включает перенос прядей, при котором происходит транслокация короткого продукта ДНК из начального РНК-зависимого синтеза ДНК в области акцепторной матрицы на другом конце генома, которые позже достигаются и обрабатываются обратной транскриптазой для ее ДНК-зависимой активности ДНК.[11]
Ретровирусная РНК расположена от 5’-конца до 3 ’конца. Сайт, на котором грунтовка отожженная до вирусной РНК, называется сайтом связывания праймера (PBS). 5’-конец РНК к сайту PBS называется U5, а 3 ’конец РНК к PBS называется лидером. Праймер тРНК разматывается между 14 и 22 нуклеотиды и образует спаренный по основанию дуплекс с вирусной РНК в PBS. Тот факт, что PBS расположен около 5 ’конца вирусной РНК, необычен, потому что обратная транскриптаза синтезирует ДНК с 3’ конца праймера в направлении от 5 ’к 3’ (относительно вновь синтезированной цепи ДНК). Следовательно, праймер и обратная транскриптаза должны быть перемещены на 3’-конец вирусной РНК. Чтобы выполнить эту репозицию, несколько шагов и различные ферменты, включая ДНК-полимераза необходимы рибонуклеаза H (РНКаза H) и полинуклеотидное раскручивание.[12][13]
Обратная транскриптаза ВИЧ также имеет рибонуклеаза активность, которая разрушает вирусную РНК во время синтеза кДНК, а также ДНК-зависимая ДНК-полимераза деятельность, которая копирует смысл нить кДНК в антисмысловой ДНК с образованием промежуточного двухцепочечного вирусного ДНК (вДНК).[14]
В клеточной жизни
Самовоспроизводящиеся участки эукариотический геномы, известные как ретротранспозоны использовать обратную транскриптазу для перемещения из одной позиции в геноме в другую через промежуточную РНК. Их много в геномах растений и животных. Теломераза это еще одна обратная транскриптаза, обнаруженная у многих эукариот, включая человека, которая несет свой собственный РНК шаблон; эта РНК используется в качестве шаблона для Репликация ДНК.[15]
Первые сообщения об обратной транскриптазе у прокариот появились еще в 1971 году во Франции (Белянский et al., 1971a, 1972) и несколькими годами позже в СССР (Ромащенко 1977[16]). С тех пор они были широко описаны как часть бактериального Ретроны, отдельные последовательности, которые кодируют обратную транскриптазу, и используются в синтезе мсДНК. Чтобы инициировать синтез ДНК, нужен праймер. У бактерий праймер синтезируется во время репликации.[17]
Валериан Доля из штата Орегон утверждает, что вирусы из-за своего разнообразия сыграли эволюционную роль в развитии клеточной жизни, причем обратная транскриптаза играет центральную роль.[18]
Структура
Обратная транскриптаза использует структуру «правой руки», аналогичную структуре других полимеразы вирусных нуклеиновых кислот.[19][20] В дополнение к функции транскрипции обратные транскриптазы ретровирусов имеют домен, принадлежащий РНКаза H семья, которая жизненно важна для их воспроизводства. Разлагая матрицу РНК, он позволяет синтезировать другую цепь ДНК.[21] Некоторые фрагменты переваривания также служат праймером для ДНК-полимераза (тот же фермент или белок-хозяин), ответственный за создание другой (плюсовой) цепи.[19]
Точность репликации
В течение жизненного цикла ретровируса существует три разные системы репликации. Прежде всего, обратная транскриптаза синтезирует вирусную ДНК из вирусной РНК, а затем из вновь созданной комплементарной цепи ДНК. Второй процесс репликации происходит, когда ДНК-полимераза клетки-хозяина реплицирует интегрированную вирусную ДНК. Наконец, РНК-полимераза II транскрибирует провирусную ДНК в РНК, которая будет упакована в вирионы. Следовательно, мутация может происходить на одном или на всех этапах репликации.[22]
Обратная транскриптаза имеет высокий уровень ошибок при транскрипции РНК в ДНК, поскольку, в отличие от большинства других ДНК-полимеразы, у него нет корректура способность. Такая высокая частота ошибок позволяет мутации накапливаться с большей скоростью по сравнению с корректируемыми формами тиражирования. Коммерчески доступные обратные транскриптазы, производимые Промега В их руководствах указывается, что частота ошибок находится в диапазоне 1 из 17 000 баз для AMV и 1 из 30 000 для M-MLV.[23]
Помимо создания однонуклеотидные полиморфизмы обратные транскриптазы также участвуют в таких процессах, как расшифровка слияния, перетасовка экзонов и создание искусственных антисмысловой стенограммы.[24][25] Было высказано предположение, что это переключение шаблонов активность обратной транскриптазы, которая может быть полностью продемонстрирована in vivo, возможно, была одной из причин обнаружения нескольких тысяч неаннотированных транскриптов в геномах модельных организмов.[26]
Переключение шаблонов
Два РНК геномы упакованы в каждую частицу ретровируса, но после заражения каждый вирус генерирует только один провирус.[27] После заражения обратная транскрипция сопровождается переключением матрицы между двумя копиями генома (рекомбинация с выбором копии).[27]. В каждом цикле репликации происходит от 5 до 14 событий рекомбинации на геном.[28] Переключение шаблона (рекомбинация), по-видимому, необходимо для поддержания целостности генома и в качестве механизма репарации для восстановления поврежденных геномов.[29][27]
Приложения

Противовирусные препараты
В качестве ВИЧ использует обратную транскриптазу для копирования своего генетического материала и создания новых вирусов (часть круга пролиферации ретровирусов), были разработаны специальные лекарства, которые нарушают этот процесс и тем самым подавляют его рост. В совокупности эти препараты известны как ингибиторы обратной транскриптазы и включают аналоги нуклеозидов и нуклеотидов зидовудин (торговое название Ретровир), ламивудин (Эпивир) и тенофовир (Viread), а также ненуклеозидные ингибиторы, такие как невирапин (Вирамун).
Молекулярная биология
Обратная транскриптаза обычно используется в исследованиях для применения полимеразной цепной реакции техника для РНК в технике, называемой полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР). Классический ПЦР техника может быть применена только к ДНК цепей, но с помощью обратной транскриптазы РНК можно транскрибировать в ДНК, тем самым делая ПЦР возможен анализ молекул РНК. Обратная транскриптаза также используется для создания библиотеки кДНК из мРНК. Коммерческая доступность обратной транскриптазы значительно расширила знания в области молекулярной биологии, а также других ферменты, это позволило ученым клонировать, секвенировать и характеризовать РНК.
Обратная транскриптаза также использовалась в инсулин производство. Встраивая эукариотическую мРНК для производства инсулина вместе с обратной транскриптазой в бактерии, мРНК может быть вставлена в геном прокариота. Затем можно получить большое количество инсулина, что позволяет избежать сбора поджелудочной железы свиньи и других подобных традиционных источников. Прямая вставка эукариотической ДНК в бактерии не сработает, потому что она несет интроны, поэтому не будет успешно переводиться с использованием бактериальных рибосом. Процессинг в эукариотической клетке во время производства мРНК удаляет эти интроны, чтобы обеспечить подходящую матрицу. Обратная транскриптаза преобразовала эту отредактированную РНК обратно в ДНК, чтобы ее можно было включить в геном.
Смотрите также
- библиотека кДНК
- ДНК-полимераза
- мсДНК
- Вирус с обратной транскрипцией
- РНК-полимераза
- Теломераза
- Маркер ретротранспозона
Рекомендации
- ^ PDB: 3KLF; Ту Х, Дас К., Хан К., Бауман Д. Д., Кларк А. Д., Хоу Х, Френкель Ю. В., Гаффни Б. Л., Джонс Р. А., Бойер П. Л., Хьюз С. Г., Сарафианос С. Г., Арнольд Э. (октябрь 2010 г.). «Структурная основа устойчивости ВИЧ-1 к AZT путем удаления». Структурная и молекулярная биология природы. 17 (10): 1202–9. Дои:10.1038 / nsmb.1908. ЧВК 2987654. PMID 20852643.
- ^ Крик, Фрэнсис (1970). «Центральная догма молекулярной биологии». Природа. 227 (5258): 561–563. Bibcode:1970Натура.227..561C. Дои:10.1038 / 227561a0. PMID 4913914. S2CID 4164029.
- ^ Саркар, Сахотра (1996). Философия и история молекулярной биологии: новые перспективы. Дордрехт: Kluwer Academic Publishers. п. 187–232.
- ^ Данчен, Этьен; Почевиль, Арно; Рей, Оливье; Пужоль, Бенуа; Бланше, Саймон (2019). «Эпигенетически облегченная мутационная ассимиляция: эпигенетика как центр всеобъемлющего эволюционного синтеза». Биологические обзоры. 94: 259-282. Дои:10.1111 / brv.12453. S2CID 67861162.
- ^ Темин Х.М., Мизутани С. (июнь 1970 г.). «РНК-зависимая ДНК-полимераза в вирионах вируса саркомы Рауса». Природа. 226 (5252): 1211–3. Дои:10.1038 / 2261211a0. PMID 4316301. S2CID 4187764.
- ^ Балтимор Д. (июнь 1970 г.). «РНК-зависимая ДНК-полимераза в вирионах РНК опухолевых вирусов». Природа. 226 (5252): 1209–11. Дои:10.1038 / 2261209a0. PMID 4316300. S2CID 4222378.
- ^ Феррис А.Л., Хизи А., Шоуолтер С.Д., Пичуантес С., Бейб Л., Крейк С.С., Хьюз С.Х. (апрель 1990 г.). «Иммунологический и протеолитический анализ структуры обратной транскриптазы ВИЧ-1» (PDF). Вирусология. 175 (2): 456–64. Дои:10.1016 / 0042-6822 (90) 90430-у. PMID 1691562.
- ^ а б Кониси А., Ясукава К., Иноуэ К. (июль 2012 г.). «Повышение термостабильности α-субъединицы обратной транскриптазы вируса миелобластоза птиц путем сайт-направленного мутагенеза» (PDF). Письма о биотехнологии. 34 (7): 1209–15. Дои:10.1007 / s10529-012-0904-9. HDL:2433/157247. PMID 22426840. S2CID 207096569.
- ^ Autexier, Chantal; Лю, Нил Ф. (июнь 2006 г.). «Структура и функция обратной транскриптазы теломеразы». Ежегодный обзор биохимии. 75 (1): 493–517. Дои:10.1146 / annurev.biochem.75.103004.142412. PMID 16756500.
- ^ Bio-Medicine.org - Ретровирус Проверено 17 февраля 2009 г.
- ^ Телесницкий А, Гофф С.П. (1993). «Перенос сильной остановки цепи при обратной транскрипции». В Skalka MA, Goff SP (ред.). Обратная транскриптаза (1-е изд.). Нью-Йорк: Колд-Спринг-Харбор. п. 49. ISBN 978-0-87969-382-4.
- ^ Бернштейн А., Вайс Р., Туз Дж. (1985). «РНК опухолевых вирусов». Молекулярная биология опухолевых вирусов (2-е изд.). Колд-Спринг-Харбор, Нью-Йорк: Лаборатория Колд-Спринг-Харбор.
- ^ Мёллинг К., Брокер Ф. (апрель 2015 г.). «Обратная транскриптаза-РНКаза H: от вирусов к противовирусной защите». Летопись Нью-Йоркской академии наук. 1341 (1): 126–35. Bibcode:2015НЯСА1341..126М. Дои:10.1111 / nyas.12668. PMID 25703292. S2CID 42378727.
- ^ Kaiser GE (январь 2008 г.). «Жизненный цикл ВИЧ». Домашняя страница микробиологии Дока Кайзера. Общественный колледж графства Балтимор. Архивировано из оригинал on 26.07.2010.
- ^ Кригер М., Скотт М.П., Мацудаира П.Т., Лодиш Х.Ф., Дарнелл Дж.Э., Зипурски Л., Кайзер С., Берк А. (2004). Молекулярная клеточная биология. Нью-Йорк: W.H. Фриман и CO. ISBN 978-0-7167-4366-8.
- ^ Ромащенко, А.Г .; и другие. (1977). "Отделение от препаратов ДНК-полимераз и РНК-зависимой ДНК-полимераз; ошистка и свойства фермента". Известия АН СССР.. 233: 734–737.
- ^ Hurwitz J, Leis JP (январь 1972 г.). «РНК-зависимая ДНК-полимеразная активность РНК-опухолевых вирусов. I. Направляющее влияние ДНК в реакции». Журнал вирусологии. 9 (1): 116–29. Дои:10.1128 / JVI.9.1.116-129.1972. ЧВК 356270. PMID 4333538.
- ^ Арнольд К. (17 июля 2014 г.). "Могут ли гигантские вирусы быть источником жизни на Земле?". Национальная география. Получено 29 мая 2016.
- ^ а б Сарафианос С.Г., Маршан Б., Дас К., Химмель Д.М., Парняк М.А., Хьюз С.Г., Арнольд Э. (январь 2009 г.). «Структура и функция обратной транскриптазы ВИЧ-1: молекулярные механизмы полимеризации и ингибирования». Журнал молекулярной биологии. 385 (3): 693–713. Дои:10.1016 / j.jmb.2008.10.071. ЧВК 2881421. PMID 19022262.
- ^ Хансен Дж. Л., Лонг А. М., Шульц СК (август 1997 г.). «Структура РНК-зависимой РНК-полимеразы полиовируса». Структура. 5 (8): 1109–22. Дои:10.1016 / S0969-2126 (97) 00261-X. PMID 9309225.
- ^ Шульц SJ, Champoux JJ (июнь 2008 г.). «Активность РНКазы H: структура, специфичность и функция в обратной транскрипции». Вирусные исследования. 134 (1–2): 86–103. Дои:10.1016 / j.virusres.2007.12.007. ЧВК 2464458. PMID 18261820.
- ^ Ббенек К., Кункель А.Т. (1993). «Верность ретровирусных обратных транскриптаз». В Скалке М.А., Гофф П.С. (ред.). Обратная транскриптаза. Нью-Йорк: Пресса лаборатории Колд-Спринг-Харбор. п. 85. ISBN 978-0-87969-382-4.
- ^ «Инструкция по эксплуатации комплекта Промега» (PDF). 1999. Архивировано с оригинал (PDF) 21 ноября 2006 г.
- ^ Хаусли Дж., Толлервей Д. (август 2010 г.). «Видимый неканонический транс-сплайсинг создается обратной транскриптазой in vitro». PLOS ONE. 5 (8): e12271. Bibcode:2010PLoSO ... 512271H. Дои:10.1371 / journal.pone.0012271. ЧВК 2923612. PMID 20805885.
- ^ Цзэн XC, Ван SX (июнь 2002 г.). «Доказательства того, что кДНК BmTXK beta-BmKCT китайского скорпиона Buthus martensii Karsch является артефактом, созданным в процессе обратной транскрипции». Письма FEBS. 520 (1–3): 183–4, ответ автора 185. Дои:10.1016 / S0014-5793 (02) 02812-0. PMID 12044895. S2CID 24619868.
- ^ ван Бакель Х., Нислоу С., Бленкоу Б.Дж., Хьюз Т.Р. (2011). «Ответ на» реальность повсеместной транскрипции"". PLOS Биология. 9 (7): e1001102. Дои:10.1371 / journal.pbio.1001102. ЧВК 3134445.
- ^ а б c Роусон JMO, Николайчик О.А., Кил Б.Ф., Патак В.К., Ху В.С. Рекомбинация необходима для эффективной репликации ВИЧ-1 и поддержания целостности вирусного генома. Nucleic Acids Res. 2018 16 ноября; 46 (20): 10535-10545. DOI: 10.1093 / nar / gky910. PMID: 30307534
- ^ Кромер Д., Гримм А.Дж., Шлуб Т.Е., Мак Дж., Давенпорт М.П. Оценка скорости переключения и рекомбинации шаблонов ВИЧ in vivo. СПИД. 2016 Янв; 30 (2): 185-92. Doi: 10.1097 / QAD.0000000000000936. PMID: 26691546
- ^ Ху ВС, Темин Х.М. Ретровирусная рекомбинация и обратная транскрипция. Наука. 1990, 30 ноября; 250 (4985): 1227-33. PMID: 1700865
внешняя ссылка
- РНК + транскриптаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- анимация действия обратной транскриптазы и трех ингибиторов обратной транскриптазы
- Молекула месяца (Сентябрь 2002 г.) в RCSB PDB
- Репликация ВИЧ Медицинская 3D-анимация. (Ноябрь 2008 г.). Видео от Boehringer Ingelheim.
- Goodsell DS. «Молекула месяца: обратная транскриптаза (сентябрь 2002 г.)». Научно-исследовательское сотрудничество в области структурной биоинформатики (RCSB) Банк данных белков (PDB). Получено 2013-01-13.
- Обзор всей структурной информации, доступной в PDB за UniProt: P03366 (Обратная транскриптаза вируса иммунодефицита человека) в PDBe-KB.
