Гексокиназа - Hexokinase
| Гексокиназа | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Кристаллические структуры гексокиназы 1 из Kluyveromyces lactis.[1] | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 2.7.1.1 | ||||||||
| Количество CAS | 9001-51-8 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| гексокиназа 1 | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | HK1 | ||||||
| Ген NCBI | 3098 | ||||||
| HGNC | 4922 | ||||||
| OMIM | 142600 | ||||||
| RefSeq | NM_000188 | ||||||
| UniProt | P19367 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 10 q22 | ||||||
| |||||||
| гексокиназа 2 | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | HK2 | ||||||
| Ген NCBI | 3099 | ||||||
| HGNC | 4923 | ||||||
| OMIM | 601125 | ||||||
| RefSeq | NM_000189 | ||||||
| UniProt | P52789 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 2 p13 | ||||||
| |||||||
| гексокиназа 3 (белые клетки) | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | HK3 | ||||||
| Ген NCBI | 3101 | ||||||
| HGNC | 4925 | ||||||
| OMIM | 142570 | ||||||
| RefSeq | NM_002115 | ||||||
| UniProt | P52790 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 5 q35.2 | ||||||
| |||||||
| Гексокиназа_1 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 кристаллическая структура человеческой глюкокиназы | |||||||||
| Идентификаторы | |||||||||
| Символ | Гексокиназа_1 | ||||||||
| Pfam | PF00349 | ||||||||
| Pfam клан | CL0108 | ||||||||
| ИнтерПро | IPR022672 | ||||||||
| PROSITE | PDOC00370 | ||||||||
| SCOP2 | 1cza / Объем / СУПФАМ | ||||||||
| |||||||||
| Гексокиназа_2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Комплекс гексокиназы I типа головного мозга крысы с глюкозой и ингибитором глюкозо-6-фосфатом | |||||||||
| Идентификаторы | |||||||||
| Символ | Гексокиназа_2 | ||||||||
| Pfam | PF03727 | ||||||||
| Pfam клан | CL0108 | ||||||||
| ИнтерПро | IPR022673 | ||||||||
| PROSITE | PDOC00370 | ||||||||
| SCOP2 | 1cza / Объем / СУПФАМ | ||||||||
| |||||||||
А гексокиназа является фермент это фосфорилаты гексозы (шесть углеродных сахара ), образуя гексозофосфат. У большинства организмов глюкоза это самый важный субстрат для гексокиназ и глюкозо-6-фосфат это самый важный продукт. Гексокиназа обладает способностью переносить неорганическую фосфатную группу с АТФ на субстрат.
Гексокиназы не следует путать с глюкокиназа, которая является специфической изоформой гексокиназы. Все гексокиназы способны фосфорилировать несколько гексоз, но глюкокиназа действует с сродством к субстрату в 50 раз меньше, и ее основным субстратом гексозы является глюкоза.
Вариация
Гены которые кодируют гексокиназу, были обнаружены во всех сферах жизни и существуют среди множества видов, которые варьируются от бактерии, дрожжи, и растения людям и другим позвоночные. Они относятся к категории актиновая складка белки, имеющие общие АТФ ядро сайта связывания, окруженное большим количеством вариабельных последовательностей, которые определяют сродство к субстрату и другие свойства.
Несколько изоформ гексокиназы или изоферменты которые предоставляют разные функции, могут выполняться в одном виды.
Реакция
Внутриклеточные реакции, опосредованные гексокиназами, можно охарактеризовать как:
- Гексоза-CH2ОН + MgATP2−
→ Гексоза-CH2O-PO2−
3 + MgADP−
+ H+
где гексоза-CH2OH представляет собой любую из нескольких гексоз (например, глюкозу), которые содержат доступный -CH2ОН фрагмент.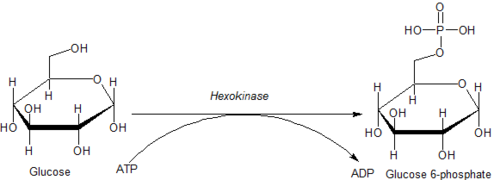
Последствия фосфорилирования гексозы
Фосфорилирование гексозы, такой как глюкоза, часто ограничивает его до ряда внутриклеточных метаболических процессов, таких как гликолиз или гликоген синтез. Это связано с тем, что фосфорилированные гексозы заряжены, и поэтому их труднее вывести из клетки.
У пациентов с эссенциальная фруктозурия, метаболизм фруктозы с помощью гексокиназы до фруктозо-6-фосфата является основным методом метаболизма фруктозы с пищей; этот путь не имеет значения у нормальных людей.
Размер разных изоформ
Большинство бактериальных гексокиназ имеют размер примерно 50 кДа. Многоклеточные организмы, включая растения и животных, часто имеют более одной изоформы гексокиназы. Большинство из них имеют размер около 100 кДа и состоят из двух половин (N и C-конца), которые имеют большую гомологию последовательностей. Это предполагает эволюционное происхождение за счет дупликации и слияния предковой гексокиназы 50 кДа, аналогичной таковой у бактерий.
Типы гексокиназ млекопитающих
Есть четыре важных млекопитающее изоферменты гексокиназы (ЕС 2.7.1.1 ), которые различаются по субклеточному расположению и кинетике по отношению к различным субстратам и условиям, а также физиологической функции. Их называют гексокиназами I, II, III и IV или гексокиназами A, B, C и D.
Гексокиназы I, II и III
Гексокиназы I, II и III обозначаются как "низкокалиевые"мизоферментов из-за высокого сродства к глюкозе (ниже 1 мМ). Гексокиназы I и II следуют Кинетика Михаэлиса-Ментен при физиологических концентрациях субстратов.[нужна цитата ] Все трое сильно подавленный по их продукту, глюкозо-6-фосфат. Молекулярная масса составляют около 100 кДа. Каждая состоит из двух одинаковых половинок по 50 кДа, но только в гексокиназе II обе половины имеют функциональные активные центры.
- Гексокиназа I / A обнаружена во всех тканях млекопитающих и считается «домашним ферментом», на который не влияет большинство физиологических, гормональных и метаболических изменений.
- Гексокиназа II / B представляет собой основную регулируемую изоформу во многих типах клеток, и ее количество увеличивается при многих раковых заболеваниях. Это гексокиназа, обнаруженная в мышцах и сердце. Гексокиназа II также расположена на внешней мембране митохондрий, поэтому она может иметь прямой доступ к АТФ.[2] Относительная удельная активность гексокиназы II увеличивается с увеличением pH, по крайней мере, в диапазоне pH от 6,9 до 8,5.[3]
- Гексокиназа III / C в физиологических концентрациях ингибируется глюкозой субстратом. Мало что известно о регуляторных характеристиках этой изоформы.
Гексокиназа IV («глюкокиназа»)
Гексокиназа IV млекопитающих, также называемая глюкокиназа, отличается от других гексокиназ кинетикой и функциями.
Расположение фосфорилирование на субклеточном уровне происходит, когда глюкокиназа перемещается между цитоплазма и ядро из печень клетки. Глюкокиназа может фосфорилировать глюкозу только в том случае, если концентрация этого субстрата достаточно высока; его Km для глюкозы в 100 раз выше, чем у гексокиназ I, II и III.
Гексокиназа IV является мономерной, около 50 кДа, проявляет положительную кооперативность с глюкозой и не является аллостерически ингибируется его продуктом, глюкозо-6-фосфатом.
Гексокиназа IV присутствует в печень, поджелудочная железа, гипоталамус, тонкий кишечник, и, возможно, некоторые другие нейроэндокринный клеток и играет важную регулирующую роль в углеводный обмен. в бета-клетки поджелудочной железы островки, он служит датчиком глюкозы для контроля инсулин релиз и аналогично контролирует глюкагон выпуск в альфа-клетки. В гепатоциты печени глюкокиназа реагирует на изменения уровня глюкозы в окружающей среде увеличением или уменьшением синтеза гликогена.
При гликолизе
Глюкоза уникальна тем, что она может использоваться для производства АТФ всеми клетками как в присутствии, так и в отсутствие молекулярного кислорода (O2). Первый шаг в гликолиз это фосфорилирование глюкозы гексокиназой.
| D-Глюкоза | Гексокиназа | α-D-Глюкозо-6-фосфат | |
 |  | ||
| АТФ | ADP | ||
 | |||
Соединение C00031 в КЕГГ База данных Pathway. Фермент 2.7.1.1 в КЕГГ База данных Pathway. Соединение C00668 в КЕГГ База данных Pathway. Реакция R01786 в КЕГГ База данных Pathway.
Катализируя фосфорилирование глюкозы с образованием глюкозо-6-фосфата, гексокиназы поддерживают нисходящий градиент концентрации, который способствует облегченному транспорту глюкозы в клетки. Эта реакция также инициирует все физиологически значимые пути утилизации глюкозы, включая гликолиз и пентозофосфатный путь.[4] Добавление заряженного фосфат Группа в положении 6 гексоз также обеспечивает `` захват '' глюкозы и 2-дезоксигексозных аналогов глюкозы (например, 2-дезоксиглюкозы и 2-фтор-2-дезоксиглюкозы) внутри клеток, поскольку заряженные гексозофосфаты не могут легко проникнуть через клеточную мембрану.
Ассоциация с митохондриями
Гексокиназы I и II могут физически связываться с внешней поверхностью наружной мембраны митохондрии через специфическое связывание с порином или зависимым от напряжения анионным каналом. Эта ассоциация обеспечивает прямой доступ гексокиназы к АТФ, генерируемому митохондриями, который является одним из двух субстратов гексокиназы. Уровень митохондриальной гексокиназы в быстрорастущих злокачественных опухолевых клетках значительно выше, чем в нормальных тканях. Было показано, что митохондриально связанная гексокиназа является движущей силой[5] для чрезвычайно высоких уровней гликолиза, которые имеют место в аэробных условиях в опухолевых клетках (так называемый эффект Варбурга, описанный Отто Генрих Варбург в 1930 г.).
Сюжет о гидропатии

Потенциальные трансмембранные части белка можно обнаружить с помощью анализа гидропатии. В анализе гидропатии используется алгоритм, который количественно определяет гидрофобный характер в каждой позиции полипептидной цепи. Один из принятых весы для гидропатии это метод Кайта и Дулиттла, который полагается на создание графиков гидропатии. На этих графиках отрицательные числа представляют гидрофильные области, а положительные числа представляют гидрофобные области на оси ординат. Потенциальный трансмембранный домен имеет длину около 20 аминокислот по оси абсцисс.
По этим стандартам был создан анализ гидропатии гексокиназы в дрожжах. Похоже, что гексокиназа обладает единственным потенциальным трансмембранным доменом, расположенным вокруг аминокислоты 400. Следовательно, гексокиназа, скорее всего, не является интегральным мембранным белком дрожжей.[6]
Дефицит
Дефицит гексокиназы генетическое аутосомно-рецессивное заболевание, вызывающее хроническую гемолитическую анемию. Хроническая гемолитическая анемия вызвана мутацией в гене HK, который кодирует фермент HK. Мутация вызывает снижение активности HK, что вызывает дефицит гексокиназы.[7]
Смотрите также
- Аллостерия
- Ферментный катализ
- Гибкий компоновщик
- Флуоресцентные биосенсоры глюкозы
- Глюкокиназа
- Гликолиз
- Гликоген
- Глюкозо-6-фосфатаза
- Инсулин
- Динамика белкового домена
- Гибкость белка
использованная литература
- ^ PDB: 3O08; Кюттнер Е.Б., Кеттнер К., Кейм А., Свергун Д.И., Волке Д. (2010). «Кристаллическая структура димера KlHxk1 в кристаллической форме I». Дои:10.2210 / pdb3o08 / pdb. Цитировать журнал требует
| журнал =(Помогите) - ^ «Данные гексокиназы по Uniprot». uniprot.org.
- ^ Шимчикова Д., Хенеберг П. (август 2019 г.). «Идентификация щелочного оптимума pH глюкокиназы человека из-за коррекции АТФ-опосредованного смещения результатов ферментных анализов». Научные отчеты. 9 (1): 11422. Дои:10.1038 / s41598-019-47883-1. ЧВК 6684659. PMID 31388064.
- ^ Роби, РБ; Хэй, Н. (2006). «Митохондриальные гексокиназы, новые медиаторы антиапоптотического действия факторов роста и Akt». Онкоген. 25 (34): 4683–96. Дои:10.1038 / sj.onc.1209595. PMID 16892082.
- ^ Бустаманте Э, Педерсен П (1977). «Высокий аэробный гликолиз клеток гепатомы крысы в культуре: роль митохондриальной гексокиназы». Proc Natl Acad Sci USA. 74 (9): 3735–9. Bibcode:1977PNAS ... 74.3735B. Дои:10.1073 / пнас.74.9.3735. ЧВК 431708. PMID 198801.
- ^ Боуэн, Р. А. Молекулярный инструментарий: графики гидрофобности белков. Государственный университет Колорадо, 1998. Интернет. 15 ноября 2010г. <http://www.vivo.colostate.edu/molkit/index.html В архиве 25 июня 2010 г. Wayback Machine >
- ^ «Недостаток гексокиназы». Enerca. Enerca. Получено 6 апреля 2017.
АТФ ADP АТФ ADP + + 2 ×  2 ×  2 × 3-фосфоглицерат 2 ×  2 × 2-фосфоглицерат 2 ×  2 × Фосфоенолпируват 2 ×  ADP АТФ 2 × Пируват 2 × |





