Пируват карбоксилаза - Pyruvate carboxylase
| Пируват карбоксилаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
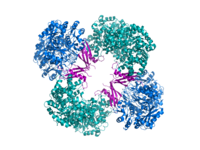
 Кристаллографическая структура пируваткарбоксилазы из Rhizobium etli: домен биотинкарбоксилазы (синий); аллостерический связывающий домен (зеленый); биотин-связывающий домен (красный); и карбоксилтрансферазный домен (оранжевый)[1] | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 6.4.1.1 | ||||||||
| Количество CAS | 9014-19-1 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| Пируват карбоксилтрансфераза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | PYR_CT | ||||||||
| Pfam | PF00682 | ||||||||
| ИнтерПро | IPR000891 | ||||||||
| PROSITE | PDOC50991 | ||||||||
| |||||||||
| Пируват карбоксилаза | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | ПК | ||||||
| Ген NCBI | 5091 | ||||||
| HGNC | 8636 | ||||||
| OMIM | 608786 | ||||||
| RefSeq | NM_000920 | ||||||
| UniProt | P11498 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 6.4.1.1 | ||||||
| Locus | Chr. 11 q11-q13.1 | ||||||
| |||||||
Пируват карбоксилаза (ПК), кодируемый геном PC, является фермент из лигаза класс, который катализирует (в зависимости от вида) физиологически необратимый[нужна цитата ] карбоксилирование из пируват формировать оксалоацетат (OAA).
Он катализирует следующую реакцию:
- пируват + HCO−
3 + АТФ → оксалоацетат + АДФ + P
Это важный анаплеротическая реакция который создает оксалоацетат из пирувата. Фермент - митохондриальный белок содержащий биотин протезная группа,[1] требующий магний или марганец и ацетил-КоА.
Пируваткарбоксилаза была впервые открыта в 1959 г. Кейс Вестерн Резервный университет М. Ф. Аттер и Д. Б. Кич.[6][7] С тех пор он был обнаружен у самых разных прокариот и эукариот, включая грибы, бактерии, растения и животных.[8] У млекопитающих ПК играет решающую роль в глюконеогенезе и липогенезе, в биосинтезе нейротрансмиттеры и индуцированной глюкозой секреции инсулина островками поджелудочной железы. Оксалоацетат, продуцируемый ПК, является важным промежуточным продуктом, который используется в этих биосинтетических путях.[9] У млекопитающих ПК экспрессируется тканеспецифическим образом, причем его активность наиболее высока в печени и почках (глюконеогенные ткани), в жировой ткани и лактирующей молочной железе (липогенные ткани) и в островках поджелудочной железы. Активность умеренная в мозге, сердце и надпочечниках и меньше всего в лейкоцитах и фибробластах кожи.[10]
Структура
Структурные исследования ПК были проведены электронная микроскопия ограниченным протеолиз и путем клонирования и секвенирования генов и кДНК, кодирующих фермент. Наиболее хорошо охарактеризованные формы активного ПК состоят из четырех идентичных субъединиц, расположенных в виде тетраэдра. Каждая субъединица содержит одну биотин часть, действующая как качающаяся рука для транспортировки углекислый газ к каталитическому центру, который образуется на границе раздела между соседними мономерами. Каждая субъединица функционального тетрамера содержит четыре домена: домен карбоксилирования биотина (BC), домен транскарбоксилирования (CT), домен носителя биотина карбоксила (BCCP) и недавно названный домен PC тетрамеризации (PT).[11][12] Из двух наиболее полных доступных кристаллических структур были визуализированы асимметричная и симметричная формы белка.[13] В Золотистый стафилококк тетрамер в комплексе с активатором коферментом A является высокосимметричным, обладает симметрией 222, и это было подтверждено крио-ЭМ исследованиями.[12] В отличие от Rhizobium etli, тетрамер в комплексе с этил-КоА, негидролизуемым аналогом ацетил-КоА, обладает только одной линией симметрии.[13]
Пируваткарбоксилаза использует ковалентно присоединенный биотин кофактор, который используется, чтобы катализировать АТФ - зависимое карбоксилирование пирувата до оксалоацетата в две стадии. Биотин изначально карбоксилируется в активном центре BC под действием АТФ и бикарбоната. Карбоксильная группа впоследствии переносится карбоксибиотином на второй активный сайт в домене CT, где пируват карбоксилируется с образованием оксалоацетата. Домен BCCP передает связанный кофактор между двумя удаленными активными сайтами. Сайт аллостерического связывания в ПК предлагает мишень для модификаторов активности, которые могут быть полезны при лечении ожирения или диабета типа II, а механистические выводы, полученные из полного структурного описания RePC (R. etli), позволяют проводить подробные исследования индивидуума. каталитические и регуляторные сайты фермента.[13]
Механизм реакции

(А) АТФ-зависимое карбоксилирование биотина (домен BC);
(B) Транскарбоксилирование пирувата (CT-домен).
Механизм реакции можно разделить на две частичные реакции (см. Рисунок справа). В первой реакции АТФ карбоксилируется с образованием угольно-фосфорного ангидрида [−O (−O) P (= O) O – C (= O) O−], который, в свою очередь, карбоксилат биотин кофактор, ковалентно связанный с остатком лизина домена BCCP.[8] Углекислый фосфорный ангидрид разлагается на диоксид углерода и фосфат до того, как его атакует связанная с ферментом молекула биотина. У большинства видов эта реакция требует ацетил-КоА в качестве аллостерического активатора связывания с доменом PT.[12] Во второй реакции, протекающей в домене СТ соседнего мономера, диоксид углерода переносится на молекулу акцептора, пируват, с образованием оксалоацетата. Реакция протекает через удаление протона из пирувата с помощью еще не идентифицированного остатка активного центра с образованием энолировать промежуточный. Затем енолятное промежуточное соединение атакует CO2 временно высвобождается из связанной с ферментом молекулы биотина. Результирующий оксалоацетат выпущен. Молекула биотина протонируется указанным выше остатком активного сайта и высвобождается из активного центра домена СТ, который подвергается повторному карбоксилированию.[12][13] Главный регулятор активности фермента, ацетил-КоА, стимулирует расщепление АТФ в первой частичной реакции, а также, как было показано, вызывает конформационные изменения в тетрамерной структуре фермента.[9]
Функция
В течение глюконеогенез, пируваткарбоксилаза участвует в синтезе фосфоенолпируват (PEP) из пируват. Пируват сначала превращается пируваткарбоксилазой в оксалоацетат (OAA) в митохондрии, требующей гидролиз одной молекулы АТФ. Затем OAA декарбоксилируется и одновременно фосфорилируется, что катализируется одной из двух изоформ фосфоенолпируваткарбоксикиназа (PEPCK) либо в цитозоль или в митохондрии производить PEP. В обычных глюконеогенных условиях OAA превращается в PEP митохондриальной PEPCK; затем образовавшийся PEP транспортируется из митохондриального матрикса системой-переносчиком анионов,[14] и превращается в глюкозу цитозольными глюконеогенными ферментами. Однако во время голодания, когда концентрация цитозольного НАДН низкая, а уровни митохрондриального НАДН высокие, оксалоацетат может использоваться в качестве челнока восстанавливающих эквивалентов. Таким образом, OAA преобразуется в малат митохондриальным малатдегидрогеназа (MDH). После экспорта в цитозоль малат снова превращается в OAA с сопутствующим снижением NAD.+; OAA впоследствии превращается в PEP, который доступен для глюконеогенеза в цитозоле вместе с транспортируемым восстанавливающим эквивалентом NADH.[1]
Очень высокий уровень активности ПК вместе с высокой активностью других глюконеогенных ферментов, включая PEPCK, фруктозо-1,6-бисфосфатаза и глюкозо-6-фосфатаза в печени и коре почек, предполагают, что основная роль ПК заключается в участии в глюконеогенезе в этих органах. Во время голодания или голодания, когда эндогенная глюкоза необходима для определенных тканей (головного мозга, лейкоцитов и мозгового вещества почек), экспрессия PC и других глюконеогенных ферментов повышается.[15] Было показано, что у крыс и мышей изменение статуса питания влияет на активность ПК в печени.[16] Голодание способствует выработке глюкозы в печени, поддерживаемой повышенным потоком пирувата, и увеличивает активность ПК и концентрацию белка; диабет аналогичным образом увеличивает глюконеогенез за счет повышенного поглощения субстрата и увеличения потока через PC печени у мышей и крыс.[17][18] Подобно другим глюконеогенным ферментам, ПК положительно регулируется глюкагон и глюкокортикоиды в то время как негативно регулируется инсулин.[8] Дальнейшее подтверждение ключевой роли ПК в глюконеогенезе у молочного скота, у которого гексоза абсорбционная способность при адекватных уровнях питания, PC и связанный с ним глюконеогенный фермент PEPCK заметно повышаются во время перехода к лактации в связи с предполагаемой поддержкой синтеза лактозы для производства молока.[19]
Помимо роли ПК в глюконеогенезе, ПК выполняет анаплеротический роль (реакция, катализируемая ферментами, которая может пополнять запасы промежуточных продуктов в цикле лимонной кислоты) для цикл трикарбоновых кислот (необходим для получения оксалоацетата), когда промежуточные соединения удаляются для различных биосинтетических целей.
Нажмите на гены, белки и метаболиты ниже, чтобы ссылки на соответствующие статьи.[§ 1]
- ^ Интерактивную карту путей можно редактировать на WikiPathways: «ГликолизГлюконеогенез_WP534».
Клиническое значение
Как перекресток между углевод и липид метаболизм, экспрессия пируваткарбоксилазы в глюконеогенных тканях, жировых тканях и островках поджелудочной железы должны быть скоординированы. В условиях переедания уровни ПК в β-клетках поджелудочной железы повышаются, чтобы увеличить цикл пирувата в ответ на хронически повышенный уровень глюкоза.[20] Напротив, уровни фермента ПК в печени снижаются на инсулин;[21] в периоды избыточного питания ткань адипоцитов увеличивается за счет чрезмерной экспрессии PC и других липогенных ферментов.[10][22] Печеночный контроль уровня глюкозы все еще регулируется при избыточном питании, но при диабете 2 типа, вызванном ожирением, регуляция периферических уровней глюкозы больше не регулируется инсулином. диабет 2 типа крысы, хроническое воздействие β-клетки к глюкозе из-за периферической инсулинорезистентности приводит к снижению активности фермента ПК и снижению пируват кататься на велосипеде[23][24] Продолжающееся перепроизводство глюкозы гепатоциты вызывает резкое изменение экспрессия гена в β-клетки с большим увеличением обычно подавляемых генов и эквивалентным снижением экспрессии мРНК инсулина, ионных насосов, необходимых для секреции инсулина, и метаболических ферментов, связанных с секрецией инсулина, включая пируваткарбоксилазу[25][26] Одновременно в жировой ткани развивается инсулинорезистентность, вызывающая накопление триаглицеринов и неэтерифицированных жирные кислоты в обращении; это не только еще больше ухудшает функцию β-клеток,[26][27] но также дальнейшее снижение экспрессии PC.[28][29] Эти изменения приводят к снижению β-клетка фенотип при декомпенсированном диабете.
А дефицит пируваткарбоксилазы может вызвать лактоацидоз в результате лактат построить.[30] Обычно избыток пируват шунтируется в глюконеогенез путем превращения пирувата в оксалоацетат, но из-за дефицита фермента избыток пирувата превращается в лактат вместо. Поскольку ключевая роль глюконеогенеза заключается в поддержании содержание сахара в крови, дефицит пируваткарбоксилазы также может привести к гипогликемия.
Смотрите также
использованная литература
- ^ а б c PDB: 2QF7; Джитрапакди С., Сент-Морис М., Реймент I, Клеланд В.В., Уоллес Дж. С., Аттвуд П. В. (август 2008 г.). «Структура, механизм и регуляция пируваткарбоксилазы». Biochem. J. 413 (3): 369–87. Дои:10.1042 / BJ20080709. ЧВК 2859305. PMID 18613815.
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000173599 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000024892 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Utter MF, Keech DB (май 1960 г.). «Образование оксалоацетата из пирувата и диоксида углерода». J. Biol. Chem. 235: PC17–8. PMID 13840551.
- ^ Коэн Н.Д., Биген Х., Аттер М.Ф., Ригли Н.Г. (март 1979 г.). «Повторное исследование электронного микроскопа пируваткарбоксилазы из куриной печени». J. Biol. Chem. 254 (5): 1740–7. PMID 762171.
- ^ а б c Джитрапакди С., Видал-Пуч А., Уоллес Дж. С. (апрель 2006 г.). «Анаплеротические роли пируваткарбоксилазы в тканях млекопитающих». Cell. Мол. Life Sci. 63 (7–8): 843–54. Дои:10.1007 / s00018-005-5410-у. PMID 16505973. S2CID 850667.
- ^ а б Джитрапакди С., Незич М.Г., Кэссиди А.И., Хью-Гудолл Ю., Уоллес Дж. К. (июль 2002 г.). «Молекулярное клонирование и доменная структура пируваткарбоксилазы курицы». Biochem. Биофиз. Res. Сообщество. 295 (2): 387–93. Дои:10.1016 / S0006-291X (02) 00651-4. PMID 12150961.
- ^ а б Джитрапакди С., Уокер М.Э., Уоллес Дж. С. (июнь 1996 г.). «Идентификация новых альтернативно сплайсированных мРНК пируваткарбоксилазы с дивергентными 5'-нетранслируемыми областями, которые экспрессируются тканеспецифическим образом». Biochem. Биофиз. Res. Сообщество. 223 (3): 695–700. Дои:10.1006 / bbrc.1996.0958. PMID 8687459.
- ^ Кондо С., Накадзима Ю., Сугио С., Йонг-Бяо Дж., Суэда С., Кондо Х. (март 2004 г.). «Структура биотинкарбоксилазы субъединицы пируваткарбоксилазы из Aquifex aeolicus при разрешении 2,2 A». Acta Crystallogr. D. 60 (Pt 3): 486–92. Дои:10.1107 / S0907444904000423. PMID 14993673.
- ^ а б c d Yu LP, Xiang S, Lasso G, Gil D, Valle M, Tong L (июнь 2009 г.). «Симметричный тетрамер пируваткарбоксилазы S. aureus в комплексе с коферментом А». Структура. 17 (6): 823–32. Дои:10.1016 / j.str.2009.04.008. ЧВК 2731552. PMID 19523900.
- ^ а б c d Сент-Морис М., Рейнхардт Л., Суриния К. Х., Этвуд П. В., Уоллес Дж. К., Клеланд В. В., Реймент I (август 2007 г.). «Доменная архитектура пируваткарбоксилазы, биотин-зависимого многофункционального фермента». Наука. 317 (5841): 1076–9. Дои:10.1126 / science.1144504. PMID 17717183. S2CID 34738991.
- ^ Старк Р., Паскель Ф, Турку А. и др. (2009). «Цикл фосфоенолпирувата через митохондриальную фосфоенолпируваткарбоксикиназу связывает анаплероз и митохондриальный ГТФ с секрецией инсулина». Журнал биологической химии. 284 (39): 26578–26590. Дои:10.1074 / jbc.M109.011775. ЧВК 2785346. PMID 19635791.
- ^ Ротман Д.Л., Магнуссон И., Кац Л.Д., Шульман Р.Г., Шульман Г.И. (октябрь 1991 г.). «Количественное определение гликогенолиза и глюконеогенеза в печени у людей натощак с 13С ЯМР». Наука. 254 (5031): 573–6. Дои:10.1126 / science.1948033. PMID 1948033.
- ^ Bizeau ME, Short C, Thresher JS, Commerford SR, Willis W.T., Pagliassotti MJ (2001). "Повышенная способность пирувата является причиной увеличения глюконеогенеза, вызванного диетой. in vitro". Am. J. Physiol. Regul. Интегр. Комп. Физиол. 281 (2): R427 – R433. Дои:10.1152 / ajpregu.2001.281.2.R427. PMID 11448844.
- ^ Сальто Р., Сола М., Олисер Ф.Дж., Варгас А.М. (декабрь 1996 г.). «Влияние голодания, диабета и интоксикации тетрахлорметаном на кору почек крысы и уровни пируваткарбоксилазы печени». Arch. Physiol. Биохим. 104 (7): 845–850. CiteSeerX 10.1.1.378.3073. Дои:10.1076 / apab.104.7.845.13111. PMID 9127680.
- ^ Большой V, Бейлот М (июнь 1999 г.). «Модификации активности цикла лимонной кислоты и глюконеогенеза при диабете, вызванном стрепозотоцином, и эффекты метформина». Сахарный диабет. 48 (6): 1251–1257. Дои:10.2337 / диабет.48.6.1251. PMID 10342812.
- ^ Гринфилд РБ, Чецава MJ, Донкин SS (2002). «Изменение экспрессии мРНК глюконеогенных ферментов в печени молочного скота при переходе к лактации». Журнал молочной науки. 83 (6): 1228–1236. Дои:10.3168 / jds.S0022-0302 (00) 74989-7. PMID 10877388.
- ^ Лю Й.К., Хань Дж., Эпштейн П.Н., Лонг Ю.С. (декабрь 2005 г.). «Повышенная пролиферация β-клеток крыс в 60% островков панкреатэктомии за счет увеличения метаболического потока глюкозы через пируваткарбоксилазный путь». Am. J. Physiol. Эндокринол. Метаб. 288 (3): E471 – E478. Дои:10.1152 / ajpendo.00427.2004. PMID 15507531.
- ^ Десвернь Б., Михалик Л., Вали В. (апрель 2006 г.). «Транскрипционная регуляция обмена веществ». Physiol. Rev. 86 (2): 465–514. Дои:10.1152 / физрев.00025.2005. PMID 16601267.
- ^ Линч С.Дж., Макколл К.М., Биллингсли М.Л., Болен Л.М., Хренюк С.П., Мартин Л.Ф., Виттерс Л.А., Ваннуччи С.Дж. (май 1992 г.). «Пируваткарбоксилаза при генетическом ожирении». Am. J. Physiol. 262 (5, часть 1): E608 – E618. Дои:10.1152 / ajpendo.1992.262.5.E608. PMID 1375435.
- ^ Макдональд М.Дж., Тан Дж., Полонский К.С. (ноябрь 1996 г.). «Низкая митохондриальная глицеринфосфатдегидрогеназа и пируваткарбоксилаза в островках поджелудочной железы у крыс с диабетом Цукера с ожирением». Сахарный диабет. 45 (11): 1626–1630. Дои:10.2337 / диабет.45.11.1626. PMID 8866570.
- ^ Макдональд MJ, Efendic S, Ostenson CG (июль 1996 г.). «Нормализация инсулином низкой митохондриальной глицеринфосфатдегидрогеназы и пируваткарбоксилазы в островках поджелудочной железы крысы GK». Сахарный диабет. 45 (7): 886–890. Дои:10.2337 / диабет.45.7.886. PMID 8666138.
- ^ Laybutt DR, Glandt M, Xu G, Ahn YB, Tvedi N, Bonner-Weir S, Weir GC (январь 2003 г.). «Критическое уменьшение массы β-клеток со временем приводит к двум различным результатам. Адаптация с нарушенной толерантностью к глюкозе или декомпенсированным диабетом». J. Biol. Chem. 278 (5): 2997–3005. Дои:10.1074 / jbc.M210581200. PMID 12438314.
- ^ а б Пуату V, Робертсон Р.П. (февраль 2002 г.). «Вторичная недостаточность ß-клеток при сахарном диабете 2 типа - сочетание глюкотоксичности и липотоксичности». Эндокринология. 143 (2): 339–342. Дои:10.1210 / en.143.2.339. PMID 11796484.
- ^ Баучер А., Лу Д., Берджесс С.К., Теламак-Поттс С., Дженсен М.В., Малдер Х., Ван М.Ю., Унгер Р.Х., Шерри А.Д., Ньюгард С.Б. (2004). «Биохимический механизм липид-индуцированного нарушения секреции инсулина, стимулированной глюкозой, и обратимости с аналогом малата». J. Biol. Chem. 279 (26): 27263–27271. Дои:10.1074 / jbc.M401167200. PMID 15073188.
- ^ Буш А.К., Кордери Д., Дениер Г.С., Байден Т.Дж. (апрель 2002 г.). «Профили экспрессии генов, регулируемых пальмитатом и олеатом, позволяют по-новому взглянуть на влияние хронического воздействия на функцию β-клеток поджелудочной железы». Сахарный диабет. 51 (4): 977–987. Дои:10.2337 / диабет.51.4.977. PMID 11916915.
- ^ Иидзука К., Накадзима Х., Намба М., Миягава Дж., Миядзаки Дж., Ханафуса Т., Мацудзава И. (январь 2002 г.). «Метаболические последствия длительного воздействия свободных жирных кислот на β-клетки поджелудочной железы с особым упором на нечувствительность к глюкозе». Биохим. Биофиз. Acta. 1586 (1): 23–31. Дои:10.1016 / s0925-4439 (01) 00082-5. PMID 11781146.
- ^ Гарсия-Касорла А., Рабье Д., Туати Дж., Шадфо-Векеманс Б., Марсак С., де Лонле П., Саудубрей Дж. М. (январь 2006 г.). «Дефицит пируваткарбоксилазы: метаболические характеристики и новые неврологические аспекты». Анна. Neurol. 59 (1): 121–7. Дои:10.1002 / ana.20709. PMID 16278852. S2CID 21367897.