Метилмалонил-КоА мутаза - Methylmalonyl-CoA mutase
| метилмалонил-КоА мутаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 5.4.99.2 | ||||||||
| Количество CAS | 9023-90-9 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
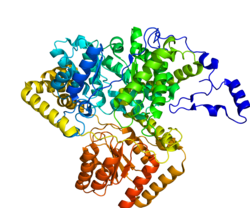
Мутаза метилмалонил-КоА (MCM), митохондриальная, также известен как метилмалонил-КоА изомераза, представляет собой белок, который у человека кодируется MUT ген. Эта витамин B12 -зависимый фермент катализирует изомеризацию метилмалонил-КоА в сукцинил-КоА у людей. Мутации в MUT ген может привести к различным типам метилмалоновая ацидурия.[5]
MCM был впервые обнаружен в крыса печень и овец почка в 1955 году. В скрытом виде это 750 аминокислоты в длину. При входе в митохондрии лидерная последовательность митохондрий из 32 аминокислот на N-конце белка расщепляется, образуя полностью процессированный мономер. Затем мономеры объединяются в гомодимеры и связывают AdoCbl (по одному на каждый активный центр мономера) с образованием конечного активного центра. холоэнзим форма.[6]
Структура
Ген
В MUT ген лежит на хромосома расположение 6п12.3 и состоит из 13 экзоны, охватывающий более 35 КБ.[7]
Протеин
Зрелый фермент представляет собой гомодимер с N-концевым доменом связывания CoA и C-концевым доменом связывания кобаламина.[8]
Функция
Мутаза метилмалонил-КоА экспрессируется в высоких концентрациях в почка, в промежуточных концентрациях в сердце, яичники, мозг, мышца, и печень, и в низких концентрациях в селезенка.[6] Фермент можно найти повсюду Центральная нервная система (ЦНС).[6] MCM находится в митохондриях, где находится ряд веществ, в том числе аминокислоты с разветвленной цепью изолейцин и валин, а также метионин, треонин, тимин и нечетная цепочка жирные кислоты, метаболизируются через метилмалонат-полуальдегид (MMlSA) или пропионил-КоА (Pr-CoA) в обычное соединение - метилмалонил-КоА (MMl-CoA). МСМ катализирует обратимую изомеризацию 1-метилмалонил-КоА в сукцинил-КоА, требуя кобаламина. (витамин B12) в форме аденозилкобаламина (AdoCbl) в качестве кофактора. Как важный этап катаболизма пропионата, эта реакция необходима для разложения нечетноцепочечных жирные кислоты, аминокислоты валин, изолейцин, метионин, и треонин, и холестерин,[9] передача метаболитов из расщепления этих аминокислот в цикл трикарбоновых кислот.[10]
Мутаза метилмалонил-КоА катализирует следующую реакцию:
| L-метилмалонил-КоА | метилмалонил-КоА мутаза | Сукцинил-КоА | |
 |  | ||
 | |||
| метилмалонил-КоА мутаза | |||
Субстрат метилмалонил-КоА мутазы, метилмалонил-КоА, в первую очередь происходит от пропионил-КоА, вещество, образовавшееся в результате катаболизма и переваривания изолейцин, валин, треонин, метионин, тимин, холестерин, или жирные кислоты с нечетной цепью. Продукт фермента, сукцинил-КоА, является ключевой молекулой цикл трикарбоновых кислот.
Клиническое значение
Дефицит этого фермента вызывает наследственное нарушение обмена веществ, дефицит метилмалонил-КоА мутазы, что является одной из причин метилмалоновая ацидемия (также называемый метилмалоновой ацидурией или ММА). ММА - это аутосомно-рецессивный наследственная врожденная ошибка обмена веществ, характеризующаяся повторяющимися эпизодами рвоты, вялости, глубокого кетоацидоз, гипераммониемия, и панцитопения в младенчестве и может вызвать раннюю смерть. Осложнения включают: кардиомиопатия, метаболический инсульт, панкреатит, и прогрессирующая почечная недостаточность.[5][11]
Либо мутации гена MUT (кодирует мутазу метилмалонил-КоА), или ММАА (кодирует шаперонный белок мутазы метилмалонил-КоА, ММАА белок) может привести к метилмалонилацидемии.[12] Мутации в MUT можно разделить на MUT0 (не проявляет активности даже при избытке AdoCbl), или MUT1 (демонстрирует очень низкую активность в присутствии избытка AdoCbl).[8] Более половины мутаций MUT находятся миссенс-мутации[10] в то время как бессмысленные мутации составляют значительную оставшуюся фракцию (примерно 14%)[13]
Общие методы лечения ММА включают: пересадка печени или печень и трансплантацияпочки бороться с почечная болезнь метилмалоновой ацидемии. Однако пагубные неврологические эффекты могут продолжать беспокоить пациентов даже после успешной операции. Считается, что это связано с широким распространением мутазы метилмалонил-КоА во всей центральной нервной системе. Из-за потери функциональности фермента уровни субстрата накапливаются в ЦНС. Субстрат, L-метилмалонил-КоА, гидролизуется с образованием метилмалоната (метилмалоновой кислоты), нейротоксической дикарбоновой кислоты, которая из-за плохой транспортной способности дикарбоновой кислоты гематоэнцефалическим барьером эффективно задерживается в ЦНС, что приводит к неврологическому истощению. Для борьбы с этими эффектами не рекомендуются периоперационные антикатаболические режимы и отказ от диеты.[6]
В мышиный Модель зарекомендовала себя как адекватный и точный способ изучения эффектов ММА и возможных методов лечения.[14][15]
Механизм

Механизм реакции MCM начинается с гомолитического расщепления C-Co (III), атомы C и Co каждый приобретают по одному из электронов, которые образовали разрыв пары электронов. Ион Co, следовательно, колеблется между состояниями окисления Co (III) и Co (II) [эти два состояния различимы спектроскопически: Co (III) красный и диамагнитный (нет неспаренных электронов), тогда как Co (II) желтый и парамагнитные (неспаренные электроны)]. Следовательно, роль коэнзима B-12 в каталитическом процессе - роль обратимого генератора свободный радикал. Связь C-Co (III) является слабой с энергией диссоциации = 109 кДж / моль и, по-видимому, дополнительно ослабляется из-за стерических взаимодействий с ферментом. В гомолитический Реакция необычна в биологии, как и наличие связи металл-углерод.
Мутаза метилмалонил-КоА является членом изомераза подсемейство аденозилкобаламинзависимых ферментов. Кроме того, он классифицируется как класс I, так как это фермент «DMB-off» / «His-on». Это относится к природе кофактора AdoCbl в активном центре метилмалонил-КоА.[16] AdoCbl состоит из центрального кобальт -содержащий кольцо Corrin, верхний аксиальный лиганд (β-аксиальный лиганд) и нижний аксиальный лиганд (α-аксиальный лиганд). В мутазе метилмалонил-КоА β-аксиальный лиганд 5’-дезокси-5’-аденозин обратимо диссоциирует с образованием дезоксиаденозильный радикал. Α-аксиальный лиганд 5,6-диметилбензимидазол (DMB) участвует в организации активного сайта, чтобы позволить гистидин -610 для связывания с Co вместо DMB (причина обозначения «DMB-off» / «His-on»).[16] Связывание остатка гистидина-610 увеличивает скорость гомолитического β-аксиального лиганда - разрыва связи Co в 10 раз.12.[17]

Другие важные остатки мутазы метилмалонил-КоА включают гистидин-244, который действует как общая кислота рядом с субстратом и защищает радикалы от побочных реакций с участием кислорода,[20] Глутамат -370, водородная связь которого с 2’-OH группой рибоза β-аксиального лиганда сил взаимодействия между радикалами β-аксиального лиганда и субстратом,[21] и тирозин -89, который стабилизирует реактивные радикальные промежуточные соединения и учитывает стереоселективность фермента.[18][22]
Перерабатывающий белок, ММАА белок, играет важную роль в загрузке и обмене кофакторов.[12][23] ММАА белок способствует ассоциации с MCM апофермент, и позволяет переносить кофактор AdoCbl к активному центру фермента.[23] Кроме того, если связанный AdoCbl накапливает окислительное повреждение во время нормального функционирования, ММАА белок способствует замене поврежденного кофактора на новый AdoCbl через GTP -надежный путь.[12][23]
Взаимодействия
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000146085 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000023921 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б Кейфи Ф., Санкиан М., Могхаддассиан М., Рольфс А., Варастех А.Р. (январь 2016 г.). «Молекулярный, биохимический и структурный анализ новой мутации у пациентов с дефицитом мутазы метилмалонил-КоА». Ген. 576 (1 Пет 2): 208–13. Дои:10.1016 / j.gene.2015.10.002. PMID 26449400.
- ^ а б c d Ballhausen D, Mittaz L, Boulat O, Bonafé L, Braissant O (декабрь 2009 г.). «Доказательства катаболического пути метаболизма пропионата в ЦНС: характер экспрессии мутазы метилмалонил-КоА и альфа-субъединицы пропионил-КоА-карбоксилазы в мозге развивающихся и взрослых крыс». Неврология. 164 (2): 578–87. Дои:10.1016 / j.neuroscience.2009.08.028. PMID 19699272. S2CID 34612963.
- ^ Чандлер Р.Дж., Вендитти КП (01.10.2016). «Генетические и геномные системы для изучения метилмалоновой ацидемии». Молекулярная генетика и метаболизм. 86 (1–2): 34–43. Дои:10.1016 / j.ymgme.2005.07.020. ЧВК 2657357. PMID 16182581.
- ^ а б Дреннан С.Л., Мэтьюз Р.Г., Розенблатт Д.С., Ледли Ф.Д., Фентон В.А., Людвиг М.Л. (май 1996 г.). «Молекулярные основы дисфункции некоторых мутантных форм метилмалонил-КоА мутазы: выводы из структуры метионинсинтазы». Труды Национальной академии наук Соединенных Штатов Америки. 93 (11): 5550–5. Bibcode:1996PNAS ... 93.5550D. Дои:10.1073 / пнас.93.11.5550. ЧВК 39284. PMID 8643613.
- ^ Мартинес М.А., Ринкон А., Десвиат Л.Р., Меринеро Б., Угарте М., Перес Б. (апрель 2005 г.). «Генетический анализ трех генов, вызывающих изолированную метилмалоновую ацидемию: идентификация 21 нового аллельного варианта». Молекулярная генетика и метаболизм. 84 (4): 317–25. Дои:10.1016 / j.ymgme.2004.11.011. PMID 15781192.
- ^ а б Форни П., Фрозе Д.С., Суормала Т., Юэ В.В., Баумгартнер М.Р. (декабрь 2014 г.). «Функциональная характеристика и категоризация миссенс-мутаций, вызывающих дефицит метилмалонил-КоА мутазы (MUT)». Человеческая мутация. 35 (12): 1449–58. Дои:10.1002 / humu.22633. ЧВК 4441004. PMID 25125334.
- ^ Дюндар Х., Озгюль Р.К., Гюзель-Озантюрк А., Дурсун А., Сиври С., Алифендиоглу Д., Джошкун Т., Токатли А. (август 2012 г.). «Мутационный анализ пациентов с метилмалоновой ацидемией на основе микрочипов: выявление 10 новых мутаций». Молекулярная генетика и метаболизм. 106 (4): 419–23. Дои:10.1016 / j.ymgme.2012.05.014. PMID 22727635.
- ^ а б c Такахаши-Иньигес Т., Гарсия-Арельяно Х., Трухильо-Рольдан М.А., Флорес М.Э. (январь 2011 г.). «Защита и реактивация мутазы метилмалонил-КоА человека белком ММАА». Сообщения о биохимических и биофизических исследованиях. 404 (1): 443–7. Дои:10.1016 / j.bbrc.2010.11.141. PMID 21138732.
- ^ Бак NE, Вуд LR, Гамильтон NJ, Беннетт MJ, Питерс HL (ноябрь 2012 г.). «Лечение мутации стопкодона метилмалонил-КоА мутазы». Сообщения о биохимических и биофизических исследованиях. 427 (4): 753–7. Дои:10.1016 / j.bbrc.2012.09.133. PMID 23041189.
- ^ Чандлер Р.Дж., Вендитти С.П. (ноябрь 2012 г.). «Доклиническая эффективность и дозирование вектора AAV8, экспрессирующего метилмалонил-КоА-мутазу человека, на мышиной модели метилмалоновой ацидемии (ММА)». Молекулярная генетика и метаболизм. 107 (3): 617–9. Дои:10.1016 / j.ymgme.2012.09.019. ЧВК 3522145. PMID 23046887.
- ^ Маноли И., Сисол Дж. Р., Ли Л., Уиллье П., Гароне С., Ван С., Зерфас П. М., Кусмано-Озог К., Янг С., Триведи Н. С., Ченг Дж., Слоан Дж. Л., Чандлер Р. Дж., Абу-Асаб М., Цокос М., Элкахлун AG, Розен С., Эннс Г.М., Берри Г.Т., Хоффманн В., ДиМауро С., Шнерманн Дж., Вендитти С.П. (август 2013 г.). «Нацеленность на дисфункцию митохондрий проксимальных канальцев ослабляет почечную болезнь метилмалоновой ацидемии». Труды Национальной академии наук Соединенных Штатов Америки. 110 (33): 13552–7. Bibcode:2013ПНАС..11013552М. Дои:10.1073 / pnas.1302764110. ЧВК 3746875. PMID 23898205.
- ^ а б Такахаси-Иньигес Т., Гарсия-Эрнандес Э., Аррегин-Эспиноса Р., Флорес М.Э. (июнь 2012 г.). «Роль витамина B12 в активности мутазы метилмалонил-КоА». Журнал науки B Чжэцзянского университета. 13 (6): 423–37. Дои:10.1631 / jzus.B1100329. ЧВК 3370288. PMID 22661206.
- ^ Власи М., Чоудхури С., Банерджи Р. (май 2002 г.). «Важность гистидинового лиганда для кофермента B12 в реакции, катализируемой мутазой метилмалонил-КоА». Журнал биологической химии. 277 (21): 18523–7. Дои:10.1074 / jbc.M111809200. PMID 11893736.
- ^ а б Мансия Ф., Смит Г.А., Эванс ПР (июнь 1999 г.). «Кристаллическая структура субстратных комплексов метилмалонил-КоА мутазы». Биохимия. 38 (25): 7999–8005. Дои:10.1021 / bi9903852. PMID 10387043.
- ^ Mancia F, Evans PR (июнь 1998 г.). «Конформационные изменения в связывании субстрата с метилмалонил-КоА-мутазой и новое понимание механизма свободных радикалов». Структура. 6 (6): 711–20. Дои:10.1016 / s0969-2126 (98) 00073-2. PMID 9655823.
- ^ Маити Н., Виджаджа Л., Банерджи Р. (ноябрь 1999 г.). «Перенос протона от гистидина 244 может способствовать реакции 1,2-перегруппировки в коферментной B (12) -зависимой метилмалонил-КоА мутазе». Журнал биологической химии. 274 (46): 32733–7. Дои:10.1074 / jbc.274.46.32733. PMID 10551831.
- ^ Бакель В., Фридрих П., Голдинг Б.Т. (октябрь 2012 г.). «Водородные связи направляют короткоживущий 5'-дезоксиаденозильный радикал к месту действия». Angewandte Chemie. 51 (40): 9974–6. Дои:10.1002 / anie.201205299. PMID 22945861.
- ^ Тома Н.Х., Мейер Т.В., Эванс П.Р., Ледлей П.Ф. (октябрь 1998 г.). «Стабилизация радикальных промежуточных продуктов с помощью остатка тирозина активного центра в мутазе метилмалонил-КоА». Биохимия. 37 (41): 14386–93. CiteSeerX 10.1.1.608.304. Дои:10.1021 / bi981375o. PMID 9772164.
- ^ а б c d е Froese DS, Kochan G, Muniz JR, Wu X, Gileadi C, Ugochukwu E, Krysztofinska E, Gravel RA, Oppermann U, Yue WW (декабрь 2010 г.). «Структуры человеческой GTPase MMAA и витамин B12-зависимой метилмалонил-CoA мутазы и понимание их комплексообразования». Журнал биологической химии. 285 (49): 38204–13. Дои:10.1074 / jbc.M110.177717. ЧВК 2992254. PMID 20876572.
- ^ Падовани Д., Лабунска Т., Банерджи Р. (июнь 2006 г.). «Энергетика взаимодействия шаперона G-белка, MeaB и B12-зависимой метилмалонил-КоА мутазы». Журнал биологической химии. 281 (26): 17838–44. Дои:10.1074 / jbc.M600047200. PMID 16641088.
- ^ Таока С., Падмакумар Р., Лай М.Т., Лю Х.В., Банерджи Р. (декабрь 1994 г.). «Ингибирование мутазы метилмалонил-КоА человека различными сложными эфирами КоА». Журнал биологической химии. 269 (50): 31630–4. PMID 7989334.
дальнейшее чтение
- Ледли Ф. Д., Розенблатт Д. С. (1997). «Мутации в mut метилмалоновой ацидемии: клинические и ферментативные корреляции». Человеческая мутация. 9 (1): 1–6. Дои:10.1002 / (SICI) 1098-1004 (1997) 9: 1 <1 :: AID-HUMU1> 3.0.CO; 2-E. PMID 8990001.
- Людвиг ML, Мэтьюз RG (1997). «Взгляды на структуру B12-зависимых ферментов». Ежегодный обзор биохимии. 66: 269–313. Дои:10.1146 / annurev.biochem.66.1.269. PMID 9242908.
- Лубрано Р., Элли М., Росси М., Травассо Е., Рагги С., Барсотти П., Кардуччи С., Берлоко П. (август 2007 г.). «Трансплантация почки при метилмалоновой ацидемии: может ли это быть лучшим вариантом? Отчет о случае через 10 лет и обзор литературы». Детская нефрология. 22 (8): 1209–14. Дои:10.1007 / s00467-007-0460-z. PMID 17401587. S2CID 24610554.
- Frenkel EP, Kitchens RL (декабрь 1975 г.). «Внутриклеточная локализация печеночной пропионил-КоА-карбоксилазы и метилмалонил-КоА мутазы у людей и нормальных крыс с дефицитом витамина В12». Британский журнал гематологии. 31 (4): 501–13. Дои:10.1111 / j.1365-2141.1975.tb00885.x. PMID 24458. S2CID 1232083.
- Крейн AM, Янсен Р., Эндрюс ER, Ледли Ф. Д. (февраль 1992 г.). «Клонирование и экспрессия мутантной мутазы метилмалонил-кофермента А с измененным сродством к кобаламину, которая вызывает мут-метилмалоновую ацидурию». Журнал клинических исследований. 89 (2): 385–91. Дои:10.1172 / JCI115597. ЧВК 442864. PMID 1346616.
- Крейн А.М., Мартин Л.С., Валле Д., Ледли Ф. Д. (май 1992 г.). «Фенотип заболевания у трех пациентов с идентичными мутациями в мутазе метилмалонил-КоА». Генетика человека. 89 (3): 259–64. Дои:10.1007 / BF00220536. PMID 1351030. S2CID 5624280.
- Рафф М.Л., Крейн А.М., Янсен Р., Ледли Ф.Д., Розенблатт Д.С. (январь 1991 г.). «Генетическая характеристика мутации локуса MUT, различающей гетерогенность mut0 и mut-метилмалоновой ацидурии за счет межараллельной комплементации». Журнал клинических исследований. 87 (1): 203–7. Дои:10.1172 / JCI114972. ЧВК 295026. PMID 1670635.
- Янсен Р., Ледли Ф. Д. (ноябрь 1990 г.). «Гетерозиготные мутации в локусе mut в фибробластах с mut0 метилмалоновой ацидемией, идентифицированные клонированием кДНК с помощью полимеразной цепной реакции». Американский журнал генетики человека. 47 (5): 808–14. ЧВК 1683687. PMID 1977311.
- Nham SU, Wilkemeyer MF, Ledley FD (декабрь 1990 г.). «Структура локуса метилмалонил-КоА-мутазы (MUT) человека». Геномика. 8 (4): 710–6. Дои:10.1016 / 0888-7543 (90) 90259-В. PMID 1980486.
- Ledley FD, Lumetta M, Nguyen PN, Kolhouse JF, Allen RH (май 1988 г.). «Молекулярное клонирование мутазы L-метилмалонил-КоА: перенос генов и анализ линий мутных клеток». Труды Национальной академии наук Соединенных Штатов Америки. 85 (10): 3518–21. Bibcode:1988PNAS ... 85.3518L. Дои:10.1073 / pnas.85.10.3518. ЧВК 280243. PMID 2453061.
- Янсен Р., Калоусек Ф., Фентон В. А., Розенберг Л. Е., Ледли Ф. Д. (февраль 1989 г.). «Клонирование полноразмерной метилмалонил-КоА мутазы из библиотеки кДНК с использованием полимеразной цепной реакции». Геномика. 4 (2): 198–205. Дои:10.1016/0888-7543(89)90300-5. PMID 2567699.
- Фентон WA, Hack AM, Kraus JP, Розенберг LE (март 1987 г.). «Иммунохимические исследования фибробластов пациентов с дефицитом апофермента метилмалонил-КоА мутазы: обнаружение мутации, препятствующей импорту митохондрий». Труды Национальной академии наук Соединенных Штатов Америки. 84 (5): 1421–4. Bibcode:1987PNAS ... 84.1421F. Дои:10.1073 / pnas.84.5.1421. ЧВК 304442. PMID 2881300.
- Zoghbi HY, O'Brien WE, Ledley FD (ноябрь 1988 г.). «Отношения сцепления мутазы метилмалонил-КоА человека с локусами HLA и D6S4 на хромосоме 6». Геномика. 3 (4): 396–8. Дои:10.1016/0888-7543(88)90135-8. PMID 2907507.
- Колхаус Дж. Ф., Атли С., Аллен Р. Х. (апрель 1980 г.). «Выделение и характеристика мутазы метилмалонил-КоА из плаценты человека». Журнал биологической химии. 255 (7): 2708–12. PMID 6102092.
- Фентон В.А., Хак А.М., Уиллард Х.Ф., Гертлер А., Розенберг Л.Е. (апрель 1982 г.). «Очистка и свойства мутазы метилмалонил-кофермента А из печени человека». Архивы биохимии и биофизики. 214 (2): 815–23. Дои:10.1016/0003-9861(82)90088-1. PMID 6124211.
- Куреши А.А., Крейн А.М., Матиашук Н.В., Резвани И., Ледли Ф.Д., Розенблатт Д.С. (апрель 1994 г.). «Клонирование и экспрессия мутаций, демонстрирующих внутригенную комплементацию при mut0 метилмалоновой ацидурии». Журнал клинических исследований. 93 (4): 1812–9. Дои:10.1172 / JCI117166. ЧВК 294249. PMID 7909321.
- Крейн AM, Ledley FD (июль 1994 г.). «Кластеризация мутаций в мутазе метилмалонил-КоА, связанных с мут-метилмалоновой ацидемией». Американский журнал генетики человека. 55 (1): 42–50. ЧВК 1918235. PMID 7912889.
- Джаната Дж., Когекар Н., Фентон В.А. (сентябрь 1997 г.). «Экспрессия и кинетическая характеристика мутазы метилмалонил-КоА у пациентов с мут-фенотипом: доказательства естественной межараллельной комплементации». Молекулярная генетика человека. 6 (9): 1457–64. Дои:10.1093 / hmg / 6.9.1457. PMID 9285782.
внешние ссылки
- GeneReviews / NIH / NCBI / UW запись о метилмалоновой ацидемии
- Метилмалонил-КоА + мутаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)