Метионинсинтаза - Википедия - Methionine synthase
Метионинсинтаза также известен как РС, MeSe, MetH отвечает за регенерацию метионин из гомоцистеин. У людей это кодируется MTR ген (5-метилтетрагидрофолат-гомоцистеинметилтрансфераза).[5][6] Метионинсинтаза входит в состав S-аденозилметионин (Одно и тоже) биосинтез и регенерация цикл.[7] У животных этот фермент требует Витамин B12 (кобаламин) как кофактор, тогда как форма, обнаруженная в растениях, не зависит от кобаламина.[8] Микроорганизмы экспрессируют как кобаламин-зависимые, так и кобаламиннезависимые формы.[8]
Механизм

Метионинсинтаза катализирует заключительный этап регенерации метионин (Встретил) из гомоцистеин (Hcy). Общая реакция трансформируется 5-метилтетрагидрофолат (N5-MeTHF) в тетрагидрофолат (THF) при переносе метильной группы на гомоцистеин с образованием метионина. Метионинсинтаза - единственный фермент млекопитающих, метаболизирующий N5-MeTHF для регенерации активного кофактора THF. В кобаламин-зависимых формах фермента реакция протекает в две стадии в реакции пинг-понга. Фермент изначально переходит в реактивное состояние за счет передачи метильной группы от N5-MeTHF в Co (I) в связанном с ферментом кобаламин (Cob), образуя метилкобаламин (Me-Cob), который теперь содержит Me-Co (III), и активируя фермент. Затем Hcy, который координировался с ферментом, связанным цинк с образованием реактивного тиолата вступает в реакцию с Me-Cob. Активированная метильная группа передается от Me-Cob к тиолату Hcy, который регенерирует Co (I) в cob, и Met высвобождается из фермента. Независимый от початков механизм следует по тому же общему пути, но с прямой реакцией между тиолатом цинка и N5-MeTHF.[9][10]

Механизм действия фермента зависит от постоянной регенерации Co (I) в початках, но это не всегда гарантируется. Вместо этого каждые 1-2000 каталитических оборотов Co (I) может окисляться до Co (II), что навсегда остановит каталитическую активность. Отдельный белок, Метионинсинтаза редуктаза, катализирует регенерацию Co (I) и восстановление ферментативной активности. Поскольку окисление cob-Co (I) неизбежно отключает cob-зависимую активность метионинсинтазы, дефекты или дефицит метионинсинтазы редуктазы были причастны к некоторым ассоциациям болезней для дефицита метионинсинтазы, обсуждаемым ниже. Два фермента образуют сеть мусорщиков, показанную в нижнем левом углу.[11]
Структура
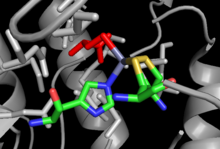
Кристаллические структуры как для cob-независимого, так и для cob-зависимого MetH были решены с небольшим сходством в общей структуре, несмотря на идентичную суммарную реакцию, выполняемую каждым из них, и сходство в сайтах связывания, таких как сайт связывания Hcy.[12] Cob-зависимый MetH разделен на 4 отдельных домена: активация, связывание кобаламина (домен Cob), связывание гомоцистеина (домен Hcy) и N 5-метил-THF (домен MeTHF). Домен активации является местом взаимодействия с редуктазой метионинсинтазы и связывает СЭМ который используется как часть цикла реактивации фермента. Домен Cob содержит Cob, зажатый между несколькими большими альфа-спиралями и связанный с ферментом, так что атом кобальта группы открыт для контакта с другими доменами. Домен Hcy содержит критический сайт связывания цинка, состоящий из остатков цистеина или гистидина, скоординированных с ионом цинка, который может связывать Hcy, с примером из не-Cob-зависимого MetH, показанного справа. Тогда5-MeTHF-связывающий домен содержит консервативный ствол, в котором N5-MeTHF может связывать водород с аспарагин, аргинин, и аспарагиновая кислота остатки. Вся структура претерпевает драматические колебательные движения во время катализа, когда домен Cob перемещается назад и вперед от домена Hcy к домену Fol, перенося активную метильную группу из домена Fol в домен Hcy.[13]
Функция

Основная цель метионинсинтазы - регенерировать Met в цикле S-аденозилметионина, который за один оборот потребляет Met и АТФ и генерирует Hcy. Этот цикл имеет решающее значение, поскольку S-аденозилметионин широко используется в биологии в качестве источника активной метильной группы, и поэтому метионинсинтаза выполняет важную функцию, позволяя циклу SAM сохраняться без постоянного притока Met. Таким образом, метионинсинтаза также служит для поддержания низких уровней Hcy и, поскольку метионинсинтаза является одним из немногих ферментов, которые использовали N5-MeTHF в качестве субстрата для косвенного поддержания уровня THF.
У растений и микроорганизмов метионинсинтаза служит двойной цели: как для продолжения цикла SAM, так и для катализирования последней стадии синтеза в de novo синтез Met. Хотя реакция одинакова для обоих процессов, общая функция у людей отличается от метионинсинтазы, поскольку Met является незаменимой аминокислотой, которая не синтезируется de novo в организме.[14]
Клиническое значение
Мутации в гене MTR были идентифицированы как основная причина дефицита метилкобаламина группы комплементации G или дефицита метилкобаламина cblG-типа.[5] Дефицит или нарушение регуляции фермента из-за недостаточности редуктазы метионинсинтазы может напрямую привести к повышению уровня гомоцистеина (гипергомоцистеинемия ), что связано со слепотой, неврологическими симптомами и врожденными дефектами. В большинстве случаев дефицит метионинсинтазы проявляется симптомами в течение 2 лет после рождения, у многих пациентов быстро развивается тяжелая энцефалопатия.[15] Одним из следствий снижения активности метионинсинтазы, которое можно измерить с помощью обычных клинических анализов крови, является мегалобластная анемия.
Генетика
Идентифицировано несколько полиморфизмов в гене MTR.[нужна цитата ]
- 2756D → G (Асп919Gly)
Смотрите также
- Метилтрансфераза
- Синдром Аракавы II
- 5-метилтетрагидрофолат (5-Me-THF, 5-Me-H4F, 5-MTHF)
- Бетаин-гомоцистеин S-метилтрансфераза
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000116984 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000021311 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б "MTR 5-метилтетрагидрофолат-гомоцистеинметилтрансфераза (Homo sapiens)". Entrez. 19 мая 2009 года. Получено 24 мая 2009.
- ^ Ли Ю.Н., Гулати С., Бейкер П.Дж., Броуди Л.С., Банерджи Р., Крюгер В.Д. (декабрь 1996 г.). «Клонирование, картирование и анализ РНК гена метионинсинтазы человека». Молекулярная генетика человека. 5 (12): 1851–8. Дои:10.1093 / hmg / 5.12.1851. PMID 8968735.
- ^ Банерджи Р.В., Мэтьюз Р.Г. (март 1990 г.). «Кобаламин-зависимая метионинсинтаза». Журнал FASEB. 4 (5): 1450–9. Дои:10.1096 / fasebj.4.5.2407589. HDL:2027.42/154369. PMID 2407589.
- ^ а б Зидовский, Т. М. (1986). «Стереохимический анализ переноса метила, катализируемого кобаламин-зависимой метионинсинтазой из Escherichia coli B». Журнал Американского химического общества. 108 (11): 3152–3153. Дои:10.1021 / ja00271a081.
- ^ Zhang Z, Tian C, Zhou S, Wang W, Guo Y, Xia J, Liu Z, Wang B, Wang X, Golding BT, Griff RJ, Du Y, Liu J (декабрь 2012 г.). «Дизайн на основе механизмов, синтез и биологические исследования N-замещенных аналогов тетрагидрофолата в качестве ингибиторов кобаламин-зависимой метионинсинтазы и потенциальных противораковых агентов». Европейский журнал медицинской химии. 58: 228–36. Дои:10.1016 / j.ejmech.2012.09.027. PMID 23124219.
- ^ Matthews, R.G .; Smith, A.E .; Zhou, Z. S .; Taurog, R.E .; Bandarian, V .; Evans, J.C .; Людвиг, М. (2003). «Кобаламин-зависимые и кобаламин-независимые метиониновые синтазы: есть ли два решения одной и той же химической проблемы?». Helvetica Chimica Acta. 86 (12): 3939. Дои:10.1002 / hlca.200390329.
- ^ Wolthers KR, Scrutton NS (июнь 2007 г.). «Взаимодействие белков в человеческом комплексе метионинсинтазы-метионинсинтазы редуктазы и последствия для механизма реактивации ферментов». Биохимия. 46 (23): 6696–709. Дои:10.1021 / bi700339v. PMID 17477549.
- ^ Пейчал Р., Людвиг М.Л. (февраль 2005 г.). «Кобаламиннезависимая метионинсинтаза (MetE): прямая двойная бочка, которая возникла в результате дупликации генов». PLOS Биология. 3 (2): e31. Дои:10.1371 / journal.pbio.0030031. ЧВК 539065. PMID 15630480.
- ^ Эванс Дж. К., Хаддлер Д. П., Хилгерс М. Т., Романчук Г., Мэтьюз Р. Г., Людвиг М. Л. (март 2004 г.). «Структуры N-концевых модулей предполагают большие перемещения доменов во время катализа метионинсинтазой». Труды Национальной академии наук Соединенных Штатов Америки. 101 (11): 3729–36. Bibcode:2004PNAS..101.3729E. Дои:10.1073 / pnas.0308082100. ЧВК 374312. PMID 14752199.
- ^ Hesse H, Hoefgen R (июнь 2003 г.). «Молекулярные аспекты биосинтеза метионина». Тенденции в растениеводстве. 8 (6): 259–62. Дои:10.1016 / S1360-1385 (03) 00107-9. PMID 12818659.
- ^ Outteryck O, de Sèze J, Stojkovic T, Cuisset JM, Dobbelaere D, Delalande S, Lacour A, Cabaret M, Lepoutre AC, Deramecourt V, Zéphir H, Fowler B, Vermersch P (июль 2012 г.). «Дефицит метионинсинтазы: редкая причина лейкоэнцефалопатии у взрослых». Неврология. 79 (4): 386–8. Дои:10.1212 / WNL.0b013e318260451b. PMID 22786600.
дальнейшее чтение
- Людвиг ML, Мэтьюз RG (1997). «Взгляды на структуру B12-зависимых ферментов». Ежегодный обзор биохимии. 66: 269–313. Дои:10.1146 / annurev.biochem.66.1.269. PMID 9242908.
- Мэтьюз Р., Шеппард С., Гулдинг С. (апрель 1998 г.). «Метилентетрагидрофолатредуктаза и метионинсинтаза: биохимия и молекулярная биология» (PDF). Европейский журнал педиатрии. 157 Приложение 2: S54–9. Дои:10.1007 / PL00014305. PMID 9587027.
- Гарович-Кочич В., Розенблатт Д.С. (август 1992 г.). «Ауксотрофия метионина при врожденных нарушениях метаболизма кобаламина». Клиническая и следственная медицина. 15 (4): 395–400. PMID 1516297.
- О'Коннор Д.Л., Мориарти П., Пиччиано М.Ф. (1992). «Влияние дефицита железа на поток фолиевой кислоты в молочной железе». Международный журнал исследований витаминов и питания. Internationale Zeitschrift für Vitamin- und Ernährungsforschung. Журнал International de Vitaminologie et de Nutrition. 62 (2): 173–80. PMID 1517041.
- Эверман Б.В., Коблин Д.Д. (март 1992 г.). «Старение, хроническое введение этанола и острое воздействие закиси азота: влияние на витамин B12 и статус фолиевой кислоты у крыс». Механизмы старения и развития. 62 (3): 229–43. Дои:10.1016 / 0047-6374 (92) 90109-Q. PMID 1583909.
- Вассилиадис А., Розенблатт Д.С., Купер Б.А., Бержерон Дж. Дж. (Август 1991 г.). «Накопление лизосомального кобаламина в фибробластах от пациента с врожденной ошибкой метаболизма кобаламина (группа комплементации cblF): визуализация радиоавтографией на электронном микроскопе». Экспериментальные исследования клеток. 195 (2): 295–302. Дои:10.1016/0014-4827(91)90376-6. PMID 2070814.
- Ли Ю.Н., Гулати С., Бейкер П.Дж., Броди Л.С., Банерджи Р., Крюгер В.Д. (декабрь 1996 г.). «Клонирование, картирование и анализ РНК гена метионинсинтазы человека». Молекулярная генетика человека. 5 (12): 1851–8. Дои:10.1093 / hmg / 5.12.1851. PMID 8968735.
- Гулати С., Бейкер П., Ли Ю.Н., Фаулер Б., Крюгер В., Броди Л.С., Банерджи Р. (декабрь 1996 г.). «Дефекты метионинсинтазы человека у пациентов с cblG». Молекулярная генетика человека. 5 (12): 1859–65. Дои:10.1093 / hmg / 5.12.1859. PMID 8968736.
- Leclerc D, Campeau E, Goyette P, Adjalla CE, Christensen B, Ross M, Eydoux P, Rosenblatt DS, Rozen R, Gravel RA (декабрь 1996). «Метионинсинтаза человека: клонирование кДНК и идентификация мутаций у пациентов группы комплементации cblG фолат / кобаламинных расстройств». Молекулярная генетика человека. 5 (12): 1867–74. Дои:10.1093 / hmg / 5.12.1867. PMID 8968737.
- Чен Л.Х., Лю М.Л., Хван Х.Й., Чен Л.С., Коренберг Дж., Шейн Б. (февраль 1997 г.). «Метионинсинтаза человека. Клонирование кДНК, локализация и экспрессия гена». Журнал биологической химии. 272 (6): 3628–34. Дои:10.1074 / jbc.272.6.3628. PMID 9013615.
- Уилсон А., Леклерк Д., Сабери Ф., Кампо Е., Хванг Х.Й., Шейн Б., Филлипс Дж. А., Розенблатт Д.С., Гравий Р.А. (август 1998 г.). «Функционально нулевые мутации у пациентов с cblG-вариантной формой дефицита метионинсинтазы». Американский журнал генетики человека. 63 (2): 409–14. Дои:10.1086/301976. ЧВК 1377317. PMID 9683607.
- Саломон О, Розенберг Н., Зивелин А., Стейнберг Д.М., Корнброт Н., Дардик Р., Инбал А., Селигсон Ю. (2002). «Полиморфизмы метионинсинтазы A2756G и метилентетрагидрофолатредуктазы A1298C не являются факторами риска идиопатической венозной тромбоэмболии». Гематологический журнал. 2 (1): 38–41. Дои:10.1038 / sj.thj.6200078. PMID 11920232.
- Уоткинс Д., Ру М., Хван Х.Й., Ким С.Д., Мюррей А., Филип Н.С., Ким В., Легакис Х., Вай Т., Хилтон Дж.Ф., Ге Б., Доре С., Хосак А., Уилсон А., Гравел Р.А., Шейн Б., Хадсон Т.Дж. , Розенблатт Д.С. (июль 2002 г.). «Гипергомоцистеинемия из-за дефицита метионинсинтазы, cblG: структура гена MTR, разнообразие генотипов и распознавание общей мутации, P1173L». Американский журнал генетики человека. 71 (1): 143–53. Дои:10.1086/341354. ЧВК 384971. PMID 12068375.
- Де Марко П., Калево М.Г., Морони А., Арата Л., Мерелло Е., Финнелл Р. Х., Чжу Х., Андреусси Л., Кама А., Капра V (2002). «Исследование полиморфизмов MTHFR и MS как факторов риска NTD в итальянской популяции». Журнал генетики человека. 47 (6): 319–24. Дои:10.1007 / с100380200043. PMID 12111380.
- Дулин М.Т., Барбо С., Макдоннелл М., Хёсс К., Уайтхед А.С., Митчелл Л.Е. (ноябрь 2002 г.). «Генетические эффекты матери, оказываемые генами, участвующими в реметилировании гомоцистеина, влияют на риск расщелины позвоночника». Американский журнал генетики человека. 71 (5): 1222–6. Дои:10.1086/344209. ЧВК 385102. PMID 12375236.
- Чжу Х., Плетеный Нью-Джерси, Шоу Г.М., Ламмер Э.Дж., Хендрикс К., Суарес Л., Кэнфилд М., Финнелл Р.Х. (март 2003 г.). «Полиморфизм фермента реметилирования гомоцистеина и повышенный риск дефектов нервной трубки». Молекулярная генетика и метаболизм. 78 (3): 216–21. Дои:10.1016 / S1096-7192 (03) 00008-8. PMID 12649067.
внешняя ссылка
- GeneReviews / NCBI / NIH / UW запись о нарушениях внутриклеточного метаболизма кобаламина
- ФЕРМЕНТ: EC 2.1.1.13
- 5-метилтетрагидрофолат-гомоцистеин + S-метилтрансфераза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)







