Гомогентизат 1,2-диоксигеназа - Homogentisate 1,2-dioxygenase
| гомогентизат 1,2-диоксигеназа | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 3D-рендеринг гомогентизатдиоксигеназы с аминокислотными остатками активного центра и окрашенными атомами железа. Гистидин имеет коричневый цвет, глутамат - красный цвет, а железо - синий. | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 1.13.11.5 | ||||||||
| Количество CAS | 9029-49-6 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| гомогентизат-1,2-диоксигеназа (гомогентизатоксидаза) | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | HGD | ||||||
| Альт. символы | AKU | ||||||
| Ген NCBI | 3081 | ||||||
| HGNC | 4892 | ||||||
| OMIM | 607474 | ||||||
| RefSeq | XM_001125882 | ||||||
| UniProt | Q93099 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 1.13.11.5 | ||||||
| Locus | Chr. 3 q21-q23 | ||||||
| |||||||
Гомогентизат 1,2-диоксигеназа (оксидаза гомогентизиновой кислоты, гомогентизатоксидаза, гомогентизиказа) является фермент который катализирует превращение гомогентизат к 4-малейлацетоацетат. Гомогентизат-1,2-диоксигеназа или HGD участвует в катаболизме ароматических колец, а точнее в расщеплении аминокислот. тирозин и фенилаланин.[1] HGD появляется в метаболическом пути деградации тирозина и фенилаланина, как только образуется гомогентизат молекулы. Гомогентизат реагирует с HGD с образованием малейлацетоацетата, который затем используется в метаболических путях. HGD требует использования Fe2+ и O2 для того, чтобы расщепить ароматическое кольцо гомогентизата.[2]
Активный сайт фермента
Активный центр гомогентизат-1,2-диоксигеназы определяли через кристаллическую структуру, которая была зафиксирована в работе Titus et al.[1] Благодаря кристаллической структуре было обнаружено, что активный центр содержит следующие остатки; His292, His335, His365, His371 и Glu341.

Гомогентизат связывается в активном центре с Glu341, His335 и His371 через атом Fe2 +. His292 связывается с гидроксильной группой ароматического кольца. His365 связывается с Glu341 посредством водородной связи для стабилизации боковых цепей аминокислот.
Патология
Хомегентизат 1,2-диоксигеназа участвует в одном из видов метаболических заболеваний, называемых алкаптонурия. Это нарушение происходит из-за неспособности организма справляться с гомогентизатом, который при окислении организмом будет производить соединение, известное как охронотический пигмент, который вызывает черный цвет и имеет несколько отрицательных эффектов.[нужна цитата ]Этот первый из этих эффектов заключается в том, что ушная сера пациента начинает чернеть или краснеть, в зависимости от диеты пациента, поскольку кровь окисляется и, таким образом, становится черной из-за избытка охронотического пигмента. Другой эффект охронотического пигмента заключается в том, что он может накапливаться в соединительной ткани организма, что приводит к дегенеративный артрит, по мере взросления человека.[2] Алкаптонурия имеет еще один эффект: она также может вызвать почернение мочи, если оставить ее на достаточно долгое время для окисления, хотя это часто является методом тестирования на генетический дефект. Нарушение обмена веществ аутосомно-рецессивный, так что оба родителя должны передать ген своим детям, чтобы у ребенка был дефект.[нужна цитата ]
Механизм
Borowski et al. предложили механизм HGD в своей статье, опубликованной в Journal of the American Chemistry. Они основывают свой механизм на результатах гибридной DFT расчеты с B3LYP функционалы, использующие программы Gaussian03 и Ягуар. Раскрытие ароматического кольца в гомогентизате - многоступенчатый процесс. В первых двух шагах Fe2+ координирует карбонильный и ортофенольный атомы кислорода. Атом железа также координирован с His335, His371 и Glu341. О2 затем связывается с атомом железа.,[2] последующее взаимодействие с ароматическим кольцом с образованием промежуточного соединения с пероксомостиковой связью.
На следующем шаге O2 раскалывается с образованием эпоксид. Это промежуточное соединение эпоксида, позволяющее радикальным реакциям в конечном итоге открывать и окислять шестичленное кольцо.
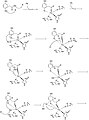
Шаги 1-8 механизма
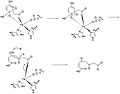
Шаги 9-11 механизма
использованная литература
- ^ а б Titus GP, Mueller HA, Burgner J, Rodríguez De Córdoba S, Peñalva MA, Timm DE (июль 2000 г.). «Кристаллическая структура гомогентизатдиоксигеназы человека». Структурная биология природы. 7 (7): 542–6. Дои:10.1038/76756. HDL:10261/71724. PMID 10876237. S2CID 6219553.
- ^ а б c Боровски Т., Георгиев В., Зигбан ЧП (декабрь 2005 г.). «Механизм каталитической реакции гомогентизатдиоксигеназы: гибридное исследование методом DFT». Журнал Американского химического общества. 127 (49): 17303–14. Дои:10.1021 / ja054433j. PMID 16332080.
внешние ссылки
- GeneReviews / NCBI / NIH / UW запись об алкаптонурии
- Записи OMIM об Алкаптонурии
- Гомогентизат + 1,2-диоксигеназа в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)



