Пропионил-КоА - Propionyl-CoA
 | |
| Имена | |
|---|---|
| Название ИЮПАК S-[2-[3-[[4-[[[(2р,3S,4р,5р) -5- (6-аминопурин-9-ил) -4-гидрокси-3-фосфонооксиоксолан-2-ил] метоксигидроксифосфорил] оксигидроксифосфорил] окси-2-гидрокси-3,3-диметилбутаноил] амино] пропаноиламино] этил] пропантиоат | |
| Другие имена Пропионил-кофермент А; Пропаноил Коэнзим А | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.005.698 |
| MeSH | пропионил-коэнзим + A |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C24ЧАС40N7О17п3S | |
| Молярная масса | 823,60 г / моль |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Пропионил-КоА это кофермент А производная от пропионовая кислота. Он состоит из 24 углеродных цепей (без кофермента это трехуглеродная структура), и его производство и метаболическая судьба зависят от того, в каком организме он присутствует.[1] Несколько различных путей могут привести к его производству, например, через катаболизм определенных аминокислоты или окисление из жирные кислоты с нечетной цепью.[2] Позже его можно разбить на пропионил-КоА карбоксилаза или через цикл метилцитрата.[3] Однако у разных организмов пропионил-КоА может быть изолирован в контролируемых областях, чтобы уменьшить его потенциальную токсичность за счет накопления.[4] Генетические недостатки, касающиеся производства и распада пропионил-КоА, также имеют большое клиническое и человеческое значение.[5]
Производство
Есть несколько различных путей, по которым может производиться пропионил-КоА:
- Пропионил-КоА, трехуглеродная структура, считается второстепенным видом пропионовой кислоты. Следовательно, цепочки нечетных чисел жирные кислоты окисляются с образованием как пропионил-КоА, так и ацетил-КоА. Пропионил-КоА позже превращается в сукцинил-КоА через пропионил-КоА карбоксилаза (PCC) за счет использования витамина B12.[2]
- Пропионил-КоА образуется не только в результате окисления жирных кислот с нечетной цепью, но также путем окисления аминокислоты включая метионин, валин, изолейцин, и треонин. Кроме того, катаболизм аминокислот также может быть результатом превращения пропионил-КоА в метилмалонил-КоА к пропионил-КоА карбоксилаза.[1]
- Холестерин окисление, которое образует желчные кислоты, также образует пропионил-КоА в качестве побочного продукта. В эксперименте, проведенном Suld et al., При объединении печени митохондрии и пропионовая кислота с добавлением кофермента А, меченые изотопы псионовой кислоты разлагались. Однако после инкубации с 5β-холестаном-3α, 7α, 12α, 26-тетрол-26,27-C14 пропионил-КоА удалось восстановить вместе с образованием желчь.[6]
Метаболическая судьба
В метаболический (катаболическая судьба) пропионил-КоА зависит от того, в какой среде он синтезируется. Следовательно, пропионил-КоА в анаэробный окружающая среда могла иметь другую судьбу, чем в аэробный организм. Множественные пути - катаболизм пропионил-КоА-карбоксилазой или метилцитратсинтаза - также зависят от присутствия различных генов.[7]
Реакция с пропионил-КоА карбоксилазой
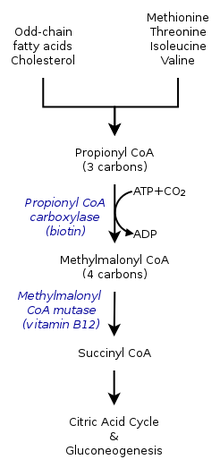
В цикле лимонной кислоты у людей пропионил-КоА, который взаимодействует с оксалоацетатом с образованием метилцитрата, также может катализироваться в метилмалонил-КоА через карбоксилирование к пропионил-КоА карбоксилаза (PCC). Метилмалонил-КоА позже превращается в сукцинил-КоА для дальнейшего использования в цикл трикарбоновых кислот. PCC не только катализирует карбоксилирование пропионил-КоА до метилмалонил-КоА, но также действует на несколько различных ацил-КоА. Тем не менее, его самое высокое сродство к связыванию относится к пропионил-КоА. Далее было показано, что превращение пропионил-КоА ингибируется из-за отсутствия нескольких TCA маркеры, такие как глутамат. Механизм показан на рисунке слева.[2]
Механизм
У млекопитающих пропионил-КоА превращается в (S)-метилмалонил-КоА к пропионил-КоА карбоксилаза, а биотин -зависимый фермент, также требующий бикарбоната и АТФ.
Этот продукт преобразован в (р) -метилмалонил-КоА по метилмалонил-КоА рацемаза.
(р) -Метилмалонил-КоА превращается в сукцинил-КоА, промежуточное звено в цикл трикарбоновых кислот, к метилмалонил-КоА мутаза, фермент, требующий

кобаламин чтобы катализировать миграцию углерод-углеродной связи.
В метилмалонил-КоА мутаза механизм начинается с разрыва связи между 5 ' CH
2- 5'-дезоксиаденозила и кобальта, который находится в степени окисления 3+ (III), что дает 5'-дезоксиаденозильный радикал и кобаламин в восстановленной степени окисления Co (II).
Затем этот радикал отрывает атом водорода от метильной группы метилмалонил-КоА, что приводит к образованию радикала метилмалонил-КоА. Считается, что этот радикал образует углерод-кобальтовую связь с коферментом, за которой затем следует перегруппировка углеродного скелета субстрата, в результате чего образуется радикал сукцинил-КоА. Этот радикал затем продолжает отщеплять водород от ранее полученного 5'-дезоксиаденозина, снова создавая дезоксиаденозильный радикал, который атакует кофермент для преобразования исходного комплекса.
Дефект фермента мутазы метилмалонил-КоА приводит к метилмалоновая ацидурия, опасное заболевание, вызывающее снижение pH крови.[8]
Метилцитратный цикл
Накопление пропионил-КоА может оказаться токсичным для различных организмов. Поскольку были предложены различные циклы в отношении того, как пропионил-КоА превращается в пируват, одним из изученных механизмов является метилцитратный цикл. Первоначальная реакция бета-окисление с образованием пропионил-КоА, который далее расщепляется циклом. Этот путь включает ферменты, связанные как с циклом метилцитрата, так и с цикл лимонной кислоты. Все это способствует общей реакции по детоксикации бактерий от вредного пропионил-КоА. Его также считают результатом катаболизма жирных кислот микобактерий.[3] Чтобы продолжить, ген prpC кодирует метилцитрат-синтазу, и, если он не присутствует, цикл метилцитрата не произойдет. Вместо этого катаболизм происходит через пропионил-КоА карбоксилазу.[7] Этот механизм показан ниже слева вместе с участвующими реагентами, продуктами, промежуточными продуктами и ферментами.
Бактериальный метаболизм
Микобактерии туберкулеза метаболизм
На окисление пропионил-КоА с образованием пирувата влияет его необходимость в Микобактерии туберкулеза. Накопление пропионил-КоА может привести к токсическим эффектам. В Микобактерии туберкулеза, было высказано предположение, что метаболизм пропионил-КоА участвует в клеточной стенке биогенез. Отсутствие таких катаболизм поэтому повысит восприимчивость клетки к различным токсинам, особенно к макрофаг противомикробный механизмы. Другая гипотеза относительно судьбы пропионил-КоА в М. туберкулезсостоит в том, что, поскольку пропионил-КоА продуцируется катаболизмом бета-жирных кислот с нечетной цепью, цикл метилцитрата активируется впоследствии, чтобы свести на нет любую потенциальную токсичность, действуя как буферный механизм.[11]
Возможный секвестр в Р. sphaeroides
Пропионил-КоА может оказывать множество неблагоприятных и токсических воздействий на различные виды животных, в том числе бактерия. Например, подавление пируватдегидрогеназа накоплением пропионил-КоА в Rhodobacter sphaeroides может оказаться смертельным. Кроме того, как и в случае с Кишечная палочка, приток пропионил-КоА в Миобактериальные виды могут привести к токсичности, если с ними не бороться немедленно. Эта токсичность вызвана метаболизмом липидов, образующих бактериальный клеточная стенка. Используя этерификацию длинноцепочечных жирных кислот, избыток пропионил-КоА может быть изолирован и сохранен в липиде, триацилглицерин (ТАГ), что приводит к регуляции повышенных уровней пропионил-КоА. Такой процесс метильного разветвления жирных кислот заставляет их действовать как поглотители для накопления пропиона. [4]
кишечная палочка метаболизм
В исследовании, проведенном Луо и др., кишечная палочка штаммы были использованы для изучения того, как метаболизм пропионил-КоА может потенциально привести к производству 3-гидроксипропионовая кислота (3-л.с.). Было показано, что мутация в ключевом гене, участвующем в этом пути, сукцинат-КоА-трансфераза, привело к значительному увеличению 3-х.[7] Однако это все еще развивающаяся область, и информация по этой теме ограничена.[12]

Метаболизм растений
Аминокислотный обмен веществ в растениях было признано спорным вопросом, из-за отсутствия конкретных доказательств для любого конкретного пути. Однако было высказано предположение, что участвуют ферменты, связанные с производством и использованием пропионил-КоА. С этим связан метаболизм изобутирил-КоА. Эти две молекулы считаются промежуточными продуктами в валин метаболизм. Поскольку пропионат представляет собой пропионил-КоА, было обнаружено, что пропионил-КоА превращается в β-гидроксипропионат через пероксисомальный ферментативный β-окисление путь. Тем не менее на заводе Арабидопсис, ключевые ферменты в превращении валина в пропионил-КоА не наблюдались. В ходе различных экспериментов, проведенных Лукасом и др., Было высказано предположение, что у растений через пероксисомальный ферменты, пропионил-КоА (и изобутирил-КоА ) участвуют в метаболизме многих различных субстратов (в настоящее время оцениваются на идентичность), а не только валин.[13]

Метаболизм грибов
Производство пропионил-КоА через катаболизм из жирные кислоты также связан с тиоэтерификация. В исследовании, посвященном Aspergillus nidulans, было обнаружено, что при ингибировании метилцитрата синтаза ген, mcsA, пути, описанного выше, производство различных поликетиды тоже было подавлено. Таким образом, использование пропионил-КоА через цикл метилцитрата снижает его концентрацию, а затем увеличивает концентрацию поликетидов. Поликетид отличается от более известного соединения, полипептид, в том смысле, что поликетид представляет собой структуру, обычно обнаруживаемую в грибах, которая состоит из ацетил - и малонил -CoAs. Они обладают определенными свойствами, которые расширили исследования их лечебных и потенциально вредных свойств, ограничивая токсичность поликетидов для сельскохозяйственных культур в сельском хозяйстве. фитопатогенный грибы.[14]
Человеческое и клиническое значение

Gen5
Подобно тому, как пероксисомальные ферменты растений связывают пропионил-КоА и изобутирил-КоА, Gen5, an ацетилтрансфераза у человека связывается с пропионил-КоА и бутирил-КоА. Они специфически связываются с каталитическим доменом Gen5L2. Эта консервативная ацетилтрансфераза отвечает за регуляцию транскрипции посредством лизин ацетилирование из гистон N-концевой хвосты. Эта функция ацетилирования имеет гораздо более высокую скорость реакции, чем пропионилирование или же бутирилирование. Из-за структуры пропионил-КоА Gen5 различает разные ацил-КоА молекулы. Фактически было обнаружено, что пропил группа бутирл-КоА не может связываться из-за отсутствия стереоспецифичности с активным сайтом связывания Gen5 из-за ненасыщенный ацильные цепи. С другой стороны, третий углерод пропионил-КоА может поместиться в активный сайт Gen5 с правильной ориентацией.[15]
Пропионовая ацидемия
в неонатальный стадии развития, пропионовая ацидемия, который является медицинской проблемой, определяемой как нехватка пропионил-КоА карбоксилазы, может вызвать ухудшение, умственную отсталость и множество других проблем. Это вызвано накоплением пропионил-КоА, поскольку он не может быть преобразован в метилмалонил-КоА. Новорожденных проверяют на повышенный пропионилкарнитин. Дальнейшие способы диагностики этого заболевания включают анализ мочи. Используемые лекарства помогают обратить вспять и предотвратить повторяющиеся симптомы, включая использование добавок для уменьшения пропионат производство.[5]
Рекомендации
- ^ а б Дасгупта А (01.01.2019). «Глава 2 - Биотин: фармакология, патофизиология и оценка статуса биотина». В Дасгупте А (ред.). Биотин и другие помехи в иммуноанализах. Эльзевир. С. 17–35. Дои:10.1016 / B978-0-12-816429-7.00002-2. ISBN 9780128164297.
- ^ а б c Wongkittichote P, Ah Mew N, Chapman KA (декабрь 2017 г.). «Пропионил-КоА карбоксилаза - обзор». Молекулярная генетика и метаболизм. 122 (4): 145–152. Дои:10.1016 / j.ymgme.2017.10.002. ЧВК 5725275. PMID 29033250.
- ^ а б Аптон А.М., МакКинни Дж.Д. (декабрь 2007 г.). «Роль цикла метилцитрата в метаболизме пропионата и детоксикации у Mycobacterium smegmatis». Микробиология. 153 (Pt 12): 3973–82. Дои:10.1099 / mic.0.2007 / 011726-0. PMID 18048912.
- ^ а б Долан С.К., Виджая А., Геддис С.М., Весна Д.Р., Сильва-Роча Р., Велч М. (март 2018 г.). «Любить яд: цикл метилцитрата и бактериальный патогенез». Микробиология. 164 (3): 251–259. Дои:10.1099 / мик. 0.000604. PMID 29458664.
- ^ а б Щелочков О.А., Каррильо Н., Вендитти С. (1993). «Пропионовая ацидемия». В Adam MP, Ardinger HH, Pagon RA, Wallace SE, Bean LJ, Stephens K, Amemiya A (ред.). GeneReviews®. Вашингтонский университет, Сиэтл. PMID 22593918. Получено 2019-06-13.
- ^ Suld HM, Staple E, Gurin S (февраль 1962 г.). «Механизм образования желчных кислот из холестерина: окисление 5bita-choles-tane-3alpha, 7alpha, 12alpha-triol и образование пропионовой кислоты из боковой цепи митохондриями печени крысы» (PDF). Журнал биологической химии. 237: 338–44. PMID 13918291.
- ^ а б c Ло Х, Чжоу Д., Лю Х, Ни З, Кирога-Санчес Д.Л., Чанг И (2016-05-26). «Производство 3-гидроксипропионовой кислоты через путь пропионил-КоА с использованием рекомбинантных штаммов Escherichia coli». PLOS ONE. 11 (5): e0156286. Bibcode:2016PLoSO..1156286L. Дои:10.1371 / journal.pone.0156286. ЧВК 4882031. PMID 27227837.
- ^ Халарнкар П.П., Бломквист Г.Дж. (01.01.1989). «Сравнительные аспекты метаболизма пропионата». Сравнительная биохимия и физиология. B, Сравнительная биохимия. 92 (2): 227–31. Дои:10.1016/0305-0491(89)90270-8. PMID 2647392.
- ^ Лю В.Б., Лю ХХ, Шэнь М.Дж., Ше Г.Л., Е BC (апрель 2019 г.). «Азотный регулятор GlnR непосредственно контролирует транскрипцию оперона prpDBC, участвующего в цикле метилцитрата у Mycobacterium smegmatis». Журнал бактериологии. 201 (8). Дои:10.1128 / JB.00099-19. ЧВК 6436344. PMID 30745367.
- ^ Райан Д.Г., член парламента Мерфи, Фрезза С., Праг Х.А., Чучани Е.Т., О'Нил Л.А., Миллс Е.Л. (январь 2019 г.). «Связывание метаболитов цикла Кребса с передачей сигналов при иммунитете и раке». Метаболизм природы. 1 (1): 16–33. Дои:10.1038 / с42255-018-0014-7. ЧВК 6485344. PMID 31032474.
- ^ Муньос-Элиас EJ, Аптон AM, Cherian J, McKinney JD (июнь 2006 г.). «Роль цикла метилцитрата в метаболизме Mycobacterium tuberculosis, внутриклеточном росте и вирулентности». Молекулярная микробиология. 60 (5): 1109–22. Дои:10.1111 / j.1365-2958.2006.05155.x. PMID 16689789.
- ^ Хан Дж., Хоу Дж., Чжан Ф., Ай Дж., Ли М, Цай С. и др. (Май 2013). «Множественные пути доставки пропионил-кофермента А для производства биопластичного поли (3-гидроксибутират-со-3-гидроксивалерата) в Haloferax mediterranei». Прикладная и экологическая микробиология. 79 (9): 2922–31. Дои:10.1128 / AEM.03915-12. ЧВК 3623125. PMID 23435886.
- ^ Лукас К.А., Филли Дж. Р., Эрб Дж. М., Graybill ER, Хоуз Дж. У. (август 2007 г.). «Пероксисомальный метаболизм пропионовой и изомасляной кислот в растениях». Журнал биологической химии. 282 (34): 24980–9. Дои:10.1074 / jbc.M701028200. PMID 17580301.
- ^ Чжан Ю.К., Брок М., Келлер Н.П. (октябрь 2004 г.). «Связь метаболизма пропионил-КоА с биосинтезом поликетидов у Aspergillus nidulans». Генетика. 168 (2): 785–94. Дои:10.1534 / генетика.104.027540. ЧВК 1448837. PMID 15514053.
- ^ Рингель А.Е., Вольбергер С. (июль 2016 г.). «Структурная основа дискриминации ацильных групп Gcn5L2 человека». Acta Crystallographica Раздел D. 72 (Пт 7): 841–8. Дои:10.1107 / S2059798316007907. ЧВК 4932917. PMID 27377381.

