Сериндегидратаза - Serine dehydratase
| Сериндегидратаза | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Идентификаторы | |||||||
| Символ | SDS | ||||||
| Ген NCBI | 10993 | ||||||
| HGNC | 10691 | ||||||
| OMIM | 182128 | ||||||
| RefSeq | NM_006843 | ||||||
| UniProt | P20132 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 4.3.1.17 | ||||||
| Locus | Chr. 12 q24.21 | ||||||
| |||||||
Сериндегидратаза или же L-серин аммиаклиаза (SDH) входит в β-семейство пиридоксальфосфат-зависимый (PLP) ферменты. СДГ широко встречается в природе, но его структурные и химические свойства сильно различаются у разных видов. SDH находится в дрожжи, бактерии и цитоплазма млекопитающих гепатоциты. Реакция, которую он катализирует, - это дезаминирование из L-серин уступить пируват, с выпуском аммиак.[1]
Этот фермент имеет 1 субстрат, L-серин, и два товары, пируват и NH3, и использует 1 кофактор, пиридоксальфосфат (PLP). Основная роль фермента заключается в глюконеогенез в печень цитоплазма. Ориентируя подложки и используя PLP кофермент, SDH снижает энергия активации преобразовать L-серин в пируват, который затем можно преобразовать в глюкоза.
Номенклатура
Сериндегидратаза также известна как:[2]
- L-серин аммиак-лиаза
- Серин дезаминаза
- Дегидратаза L-гидроксиаминокислоты
- L-сериндезаминаза
- L-сериндегидратаза
- L-серин гидролаза
Структура фермента
ХолоЭнзим:В холоэнзим SDH содержит 319 остатки, 1 PLP кофактор молекула и 131 молекула воды.[1] Общая складка мономер очень похож на другие PLP-зависимые ферменты Бета-семьи. Фермент содержит большое количество домен (каталитический домен или PLP- привязка домен) и небольшой домен. К доменам присоединяются два пептид линкеры (остатки 32-35 и 138-146), при этом созданный внутренний разрыв является пространством для активный сайт[1] (Рисунок 1).

Рисунок 1 показывает большой каталитический домен пурпурным и голубым цветом и малый регуляторный домен зеленым цветом в мономере сериндегидратазы. Показаны два мономера (левый и правый), и кофермент PLP помещен в щель между двумя доменами. [1]
Два димера:Два мономеры hSDS (SDH человека) собраны вместе, чтобы создать димер. Интерфейс между двумя мономерами формируется через водородные связи и гидрофобные взаимодействия. Контакты мономер – мономер включают шесть пар водородные связи образуется между 10 остатками (Arg98 -Asn 260, Leu310 -Asn 260, и Leu265 -Lys263 ). Дополнительные взаимодействия включают ряд гидрофобные контакты между остатками Мет17, Lys21, Asn 101, Glu102, Ser306, Иль308, Ser309, и Иль264 в каждом мономер.[1] (Фигура 2).
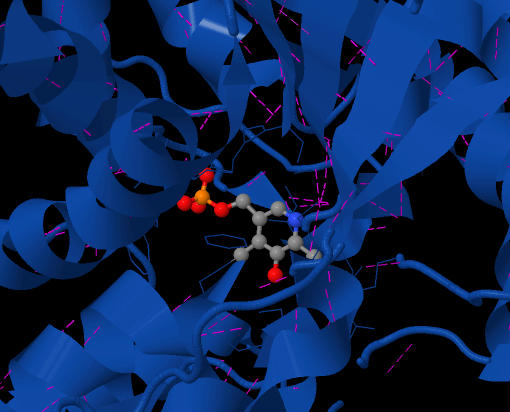
фигура 2 показывает кофермент PLP, расположенный в активном центре SDH. Фиолетовые штрихи - это задействованные водородные связи. Вид сверху на фермент.
Сайт связывания кофактора:В PLP кофактор расположен между Бета-нити 7 и 10 большого домена и лежит на большом внутреннем зазоре между малым и большим доменом. Кофактор ковалентно связаны через Базовая связь Шиффа к Lys41. Кофактор зажат между боковой цепью Phe 40 и основная сеть Ala222. Каждый из полярных заместителей PLP координирован функциональными группами: пиридиний азот PLP связан водородными связями с боковой цепью Cys 303, C3-гидроксильная группа PLP связана водородными связями с боковой цепью Asn 67, а фосфатная группа PLP координируется амидами основной цепи тетраглициновой петли.[1][3] (Рисунок 3 и Рисунок 4).

Рисунок 3 показывает водородную связь в активном центре SDH. Водородные связи (красный цвет) между белком, водой (синие шарики) и кофактором PLP (фиолетовый).[1]

Рисунок 4 показаны альфа-спирали (розовый) и бета-листы (желтый), участвующие во вторичной структуре SDH.
Ферментный механизм
Деградация серин к пируват является примером пиридоксальфосфат-зависимый (PLP) катализированный бета-устранение реакция. Бета-исключения[4] опосредованный PLP дает продукты, которые подверглись двухэлектронному окисление в C-альфа. Как правило, бета-исключения включают удаление галогенид и протон из соседнего бета-углерод дать двойная связь; таким образом, происхождение двойной связи пи-электроны происходят от связи C-H на бета-углероде субстрата.
Бета-исключения происходят без сети окисление или же снижение ПЛП. В целом реакция катализируемый сериндегидратазой, включает две стадии: каталитическое удаление и неферментативное гидролиз реакция. Основная роль SDH - снизить энергия активации этой реакции путем связывания кофермент и субстрат в частности конформационный геометрия.
Механистические шаги:[5]
(На панели 1 рисунка 5)В ферменте SDH активный сайт, Lys41 расположен над молекулой PLP со своим Группа R NH2 подключен к C4 PLP через Базовая связь Шиффа. В фосфат группа PLP расположена в кармане остатков G. Серин входит в активный центр, и его положительно заряженная аминогруппа притягивает отрицательно заряженную фосфатную группу PLP. Создается промежуточный альдимин PLP-Ser. Роль SDH состоит в том, чтобы ориентировать Calpha-H молекулы серина параллельно перекрывающимся 2p орбитали ПЛП система пи; другими словами, SDH удерживает серин перпендикулярно плоскости кольца PLP.[5] (См. Рисунок 6 для ориентации подложки с PLP).
(На панели 2 рисунка 5)ПЛП фосфат депротонировать аминогруппа из серин. В депротонированный аминогруппа серина теперь хороший нуклеофил который атакует основание Lys-PLP Шиффа на углероде C4 (показано на панели 1). Lys41 выпущен из PLP.[5]
(На панели 3 рисунка 5)В COOH группа серин плотно расположен в ферменте SDH, так что серин молекула перпендикулярна PLP система пи. Группа R Группа ОН участвует в двух водородные связи с SDH Ala222 и протонированный фосфат PLP. Протонированный фосфат PLP затем действует как кислота и жертвует свой протон гидроксил серина. Согласованным образом водород группы R серин удаляется Lys41 и выделяется вода. Созданный промежуточный продукт представляет собой PLP-аминоакрилат.[5]
В реакции, когда вода уходит из бета-углерода субстрата, SDH ориентирует вновь созданные двойная связь перпендикулярно плоскости PLP (рисунок 6). Это позволяет новому пи-облигации между Calpha и Cbeta, чтобы сформировать резонанс с системой PLP pi.[5] (Рисунок 6)
(На панели 4 рисунка 5)Lys41 из активного сайта SDH атакует C4 PLP, образуя тетраэдрический промежуточный.[5]
(На панели 5 рисунка 5)А Базовая связь Шиффа затем образуется и высвобождается аминоакрилатная группа, которая подвергается неферментативному гидролитическому дезаминированию с пируват.[5]
(На панели 6 рисунка 5)Аминоакрилат, высвобождаемый из PLP, нестабилен в водный раствор и быстро таутомеризуется к предпочтительному я добываю форма; это спонтанно гидролизованный уступить альфа-кетокислота продукт пируват. Связывание фермент-основание Шиффа PLP реформируется.[5]

Рисунок 5 показывает механизм превращения L-серина в аминоакрилат, который дезаминируется в пируват неферментативным гидролизом. На рисунке показан активный сайт SDH, кофермент PLP и субстрат.[1]

Ингибиторы
Согласно серии анализов, выполненных Cleland (1967), линейная скорость пируват формирование на различных концентрации ингибиторов продемонстрировали, что L-цистеин и D-серин соревновательно подавляют фермент SDH.[6] Причина, по которой активность SDH подавленный L-цистеином, потому что неорганическая сера создается из L-Цистеин через цистиндесульфразу и серосодержащие группы, как известно, способствуют ингибированию.[7] L-треонин также конкурентно ингибирует сериндегидратазу.
Кроме того, известно, что инсулин ускоряет гликолиз и подавлять индукцию сериндегидратазы печени у взрослых диабетик крысы.[8] Исследования были проведены, чтобы показать инсулин вызывает 40-50% ингибирование индукции сериндегидратазы посредством глюкагон в гепатоциты крыс.[9] Исследования также показали, что инсулин и адреналин ингибировать активность сериндегидратазы путем ингибирования транскрипция гена SDH в гепатоцитах.[10] Точно так же повышение уровня глюкагон, увеличивают активность SDH, потому что это гормон активирует фермент SDH. Это имеет смысл в контексте глюконеогенез. Основная роль SDH заключается в создании пируват которая может быть преобразована в свободную глюкозу. И глюкагон дает сигнал подавить глюконеогенез и увеличить количество свободной глюкозы в крови, высвобождая запасы гликогена из печени.
Гомоцистеин, соединение, которое SDH объединяет с серином для создания цистатионин, также неконкурентно подавляет действие SDH. Исследования показали, что гомоцистеин реагирует с коферментом PLP SDH с образованием комплекса. Этот комплекс лишен коферментной активности, и SDH не может функционировать (см. Раздел «Механизм фермента»).[11] В целом гомоцистеин представляет собой аминокислоту и метаболит метионин; повышенный уровень гомоцистеина может привести к гомоцистинурия (см. раздел «Актуальность болезни»).[12]
Биологическая функция
В целом уровни SDH снижаются с увеличением размера млекопитающего.[13]
Исследования показывают, что фермент SDH из гепатоцитов крысы играет важную роль в глюконеогенезе; его деятельность дополняется диеты с высоким содержанием белка и голод. В периоды низкой углеводы, серин превращается в пируват через SDH. Этот пируват попадает в митохондрии где его можно преобразовать в оксалоацетат, и, следовательно, глюкоза.[14]
Рисунок 7 показаны возможные пути превращения L-серина в глюкозу во время глюконеогенеза.
Однако о свойствах и функциях человеческого SDH известно немного, поскольку человеческая печень имеет низкую активность SDH. В исследовании, проведенном Йошидой и Кикучи, были изучены пути распада глицина. Глицин может превращаться в серин и либо становиться пируватом через сериндегидратазу, либо подвергаться окислительный раскол в метилен-ТГФ, аммиак, и диоксид углерода. Результаты показали второстепенное значение пути SDH.[14][15]
Актуальность болезни
Хотя есть много споров о роли SDH в гепатоцитах человека, исследования показали, что некетотический гипергликемия связано с дефицитом треониндегидратаза, близкое следствие сериндегидратазы. Также было обнаружено, что сериндегидратаза отсутствует у человека. карцинома толстой кишки и крыса саркома. Наблюдаемый дисбаланс ферментов в этих опухолях показывает, что повышенная способность к синтезу серина связана с его использованием для нуклеотид биосинтез как часть биохимической приверженности клеточная репликация в раковых клетках. Этот шаблон находится в саркомы и карциномы, и в опухолях человеческого и грызунового происхождения. Таким образом, SDH играет важную роль в развитии гипергликемия и опухоли.[16]
Кроме того, гомоцистинурия это наследственное заболевание вызвано дефицитом L-сериндегидратазы. К его симптомам относятся умственная отсталость, смерть, атеросклероз и коронарный тромбоз, а также вывих хрусталика глаза. Гомоцистинурия - это заболевание, характеризующееся высоким уровнем гомоцистеина в моче и плазме. L-сериндегидратаза конденсирует гомоцистеин с серином с образованием цистатионин.[17] Однако предыдущий абзац ошибочен, поскольку в нем SDS приравнивается к CBS, что когда-то считалось так, но теперь известно, что это не так.
Эволюция
Сравнение сериндегидратазы человека и крысы с использованием кДНК библиотека была идентична, за исключением участка из 36 аминокислотных остатков. Общая гомология между SDH крысы и SDH человека составляет 81% в нуклеотидной последовательности и 84% в аминокислотной последовательности. Также было обнаружено сходство между дрожжами и Кишечная палочка треониндегидратаза и сериндегидратаза человека. SDH человека показывает гомологию последовательности 27% с дрожжевым ферментом и 27% с ферментом E. coli.[18]
Кроме того, показано, что первичные структуры схожи между SDH млекопитающих и микробной треониндегидратазой, особенно в последовательностях, окружающих кофактор PLP, и G-остатки, окружающие фосфатную группу PLP. Таким образом, в ферментах PLP наблюдается высокая степень сохранения остатков активного центра во время эволюции. При сохранении последовательности активного сайта предполагается, что ферменты дегидратазы произошли от общего предка.[18]

Рисунок 8 показывает сходство последовательностей аминокислотной последовательности SDH человека с последовательностями SDH крысы, дрожжей и Кишечная палочка треониндегидратазы. Звездочки и крестики обозначают сходство последовательностей с SDH человека.[18]
В анализе, проведенном Мехтой и Кристен из Центра биоинформатики и биотехнологии, пиридоксаль-5-фосфат (витамин B6) -зависимые ферменты, действующие на аминокислотные субстраты, имеют множественное эволюционное происхождение. Общая Ферменты B6 разделились на четыре независимые эволюционные линии: семейство α (т.е. аспартатаминотрансфераза ), β-семейство (сериндегидратаза), D-аланинаминотрансфераза семья и аланин рацемаза семья. Пример эволюционного сходства в семействе Бета виден в механизме. Все β-ферменты лиасы и катализируют реакции, в которых участвуют Cα и Cβ. В целом в PLP -зависимых ферментов, PLP в каждом случае ковалентно присоединен через иминную связь к аминогруппе в активном центре.[19]

Рисунок 9 отображает эволюционное происхождение ферментов от PLP-зависимого фермента до семейства бета и SDH.
внешняя ссылка
- Серин + дегидратаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
Рекомендации
- ^ а б c d е ж грамм час Сунь Л., Бартлам М., Лю И, Панг Х, Рао З. (март 2005 г.). «Кристаллическая структура пиридоксаль-5'-фосфат-зависимой сериндегидратазы из печени человека». Белковая наука. 14 (3): 791–8. Дои:10.1110 / пс. 041179105. ЧВК 2279282. PMID 15689518.
- ^ «Запись в базе данных KEGG ENZYME». Киотская энциклопедия генов и геномов. Kanehisa Laboratories. Получено 17 мая 2011.
- ^ Toyota CG, Berthold CL, Gruez A, Jónsson S, Lindqvist Y, Cambillau C, Richards NG (апрель 2008 г.). «Дифференциальная субстратная специфичность и кинетическое поведение Escherichia coli YfdW и Oxalobacter formigenes formyl кофермента А трансферазы». Журнал бактериологии. 190 (7): 2556–64. Дои:10.1128 / JB.01823-07. ЧВК 2293189. PMID 18245280.
- ^ Содерберг Т. (8 ноября 2015 г.). «14.4: Пиридоксальфосфат - кофактор поглотителя электронов». LibreTexts.
- ^ а б c d е ж грамм час Ямада Т., Комото Дж., Таката И., Огава Х., Питот Х.С., Такусагава Ф. (ноябрь 2003 г.). «Кристаллическая структура сериндегидратазы печени крысы». Биохимия. 42 (44): 12854–65. Дои:10.1021 / bi035324p. PMID 14596599.
- ^ Гэннон Ф., Бриджелэнд Э.С., Джонс К.М. (февраль 1977 г.). «L-сериндегидратаза из Arthrobacter globiformis». Биохимический журнал. 161 (2): 345–55. Дои:10.1042 / bj1610345. ЧВК 1164512. PMID 322657.
- ^ Накагава Х., Кимура Х. (ноябрь 1969 г.). «Свойства кристаллической сериндегидратазы печени крысы». Журнал биохимии. 66 (5): 669–83. Дои:10.1093 / oxfordjournals.jbchem.a129180. PMID 5358627.
- ^ Фридленд Р.А., Тейлор А.Р. (декабрь 1964 г.). «Исследования глюкозо-6-фосфатазы и глутаминазы в печени и почках крыс». Biochimica et Biophysica Acta (BBA) - Специализированная секция по энзимологическим вопросам. 92 (3): 567–71. Дои:10.1016/0926-6569(64)90016-1. PMID 14264889.
- ^ Миура С., Накагава Х (октябрь 1970 г.). «Исследования молекулярных основ развития сериндегидратазы в печени крыс». Журнал биохимии. 68 (4): 543–8. Дои:10.1093 / oxfordjournals.jbchem.a129384. PMID 5488777.
- ^ Канамото Р., Су И, Пито Х.С. (август 1991 г.). «Влияние глюкозы, инсулина и цАМФ на транскрипцию гена сериндегидратазы в печени крысы». Архивы биохимии и биофизики. 288 (2): 562–6. Дои:10.1016 / 0003-9861 (91) 90236-К. PMID 1654838.
- ^ Пестана А., Сандовал IV, Сольс А (октябрь 1971 г.). «Ингибирование гомоцистеином сериндегидратазы и других пиридоксаль-5'-фосфатных ферментов крысы посредством блокировки кофактора». Архивы биохимии и биофизики. 146 (2): 373–9. Дои:10.1016/0003-9861(71)90139-1. PMID 4398884.
- ^ Херд Р. В., Хаммонд Э. Дж., Уайлдер Б. Дж. (Март 1981 г.). «Судороги, вызванные гомоцистеином: усиление витамином B6 и ингибирование гидразином». Исследование мозга. 209 (1): 250–4. Дои:10.1016/0006-8993(81)91190-2. PMID 6260308. S2CID 29790535.
- ^ Роуселл Э.В., Карни Дж. А., Вахби С. Д., Аль-Тай А. Х., Роуселл К. В. (1979). «Активность L-сериндегидратазы и L-серинпируват аминотрансферазы у различных видов животных». Сравнительная биохимия и физиология. B, Сравнительная биохимия. 63 (4): 543–55. Дои:10.1016/0305-0491(79)90061-0. PMID 318433.
- ^ а б Снелл К. (1984). «Ферменты обмена серина в нормальных, развивающихся и опухолевых тканях крыс». Достижения в регуляции ферментов. 22: 325–400. Дои:10.1016/0065-2571(84)90021-9. PMID 6089514.
- ^ Коята Х., Хирага К. (февраль 1991 г.). «Система расщепления глицином: структура кДНК, кодирующей человеческий H-белок, и частичная характеристика его гена у пациентов с гиперглицинемией». Американский журнал генетики человека. 48 (2): 351–61. ЧВК 1683031. PMID 1671321.
- ^ Снелл К., Нацумеда Й., Эбл Дж. Н., Гловер Дж. Л., Вебер Дж. (Январь 1988 г.). «Ферментативный дисбаланс в метаболизме серина при карциноме толстой кишки человека и саркоме крысы». Британский журнал рака. 57 (1): 87–90. Дои:10.1038 / bjc.1988.15. ЧВК 2246686. PMID 3126791.
- ^ Портер П.Н., Гришейвер М.С., Джонс О.В. (сентябрь 1974 г.). «Характеристика человеческой цистатионин-бета-синтазы. Доказательства идентичности человеческой L-сериндегидратазы и цистатионин-бета-синтазы». Biochimica et Biophysica Acta. 364 (1): 128–39. Дои:10.1016/0005-2744(74)90140-5. PMID 4433562.
- ^ а б c Огава Х, Гоми Т, Кониси К., Датэ Т, Накашима Х, Нос К., Мацуда Й, Перайно С., Питот ХК, Фудзиока М. (сентябрь 1989 г.). «Сериндегидратаза печени человека. Клонирование кДНК и гомология последовательности с дегидратазами гидроксиаминокислых из других источников». Журнал биологической химии. 264 (27): 15818–23. PMID 2674117.
- ^ Кристен П., Мехта П.К. (2001). «От кофактора к ферментам. Молекулярная эволюция пиридоксаль-5'-фосфат-зависимых ферментов». Химическая запись. 1 (6): 436–47. Дои:10.1002 / tcr.10005. PMID 11933250.
