Тимидилатсинтаза - Thymidylate synthase
| тимидилатсинтаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 2.1.1.45 | ||||||||
| Количество CAS | 9031-61-2 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| Тимидилатсинтаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | Тимидилат_синт | ||||||||
| Pfam | PF00303 | ||||||||
| ИнтерПро | IPR000398 | ||||||||
| PROSITE | PDOC00086 | ||||||||
| SCOP2 | 1тыс / Объем / СУПФАМ | ||||||||
| |||||||||
Тимидилатсинтаза (TS) (EC 2.1.1.45 )[5] является фермент который катализирует превращение дезоксиуридина монофосфат (dUMP) в монофосфат дезокситимидина (dTMP). Тимидин - один из нуклеотиды в ДНК. При торможении ТС происходит дисбаланс дезоксинуклеотиды и повышенный уровень свалка возникают. Оба вызывают повреждение ДНК.[6][7]
Функция
Следующая реакция катализируется тимидилатсинтазой:
- 5,10-метилентетрагидрофолат + dUMP дигидрофолат + dTMP
С помощью редуктивного метилирование, дезоксиуридина монофосфат (dUMP) и N5, N10-метилентетрагидрофолат вместе используются для образования dTMP, давая дигидрофолат как вторичный продукт.
Это обеспечивает единственный de novo путь производства dTMP и единственный фермент в метаболизме фолиевой кислоты, в котором 5,10-метилентетрагидрофолат окисляется во время одноуглеродного переноса.[8] Фермент необходим для регулирования сбалансированного поступления 4 предшественников ДНК при нормальной репликации ДНК: дефекты активности фермента, влияющие на процесс регуляции, вызывают различные биологические и генетические аномалии, такие как смерть без тимина.[9] Фермент является важной мишенью для некоторых химиотерапевтических препаратов. Тимидилатсинтаза - это фермент с концентрацией от 30 до 35 килограмм.Да у большинства видов, за исключением простейших и растений, где он существует в виде бифункционального фермента, который включает домен дигидрофолатредуктазы.[8] Остаток цистеина участвует в каталитическом механизме (он ковалентно связывает промежуточное соединение 5,6-дигидро-dUMP). Последовательность вокруг активного сайта этого фермента сохраняется от фагов до позвоночных.
Тимидилатсинтаза индуцируется фактором транскрипции LSF /TFCP2 а LSF - это онкоген в гепатоцеллюлярная карцинома. LSF и тимидилатсинтаза играют важную роль в пролиферации и прогрессировании рака печени и устойчивости к лекарствам.[10]
Клиническое значение
Тимидилатсинтаза (ТС) играет решающую роль на ранних стадиях ДНК биосинтез.[11] Повреждение или делеция ДНК происходят ежедневно в результате как эндогенных факторов, так и факторов окружающей среды. К таким факторам окружающей среды относятся: ультрафиолетовый повреждения и сигаретный дым, содержащие различные канцерогены.[12] Следовательно, синтез и внедрение здоровой ДНК жизненно важны для нормального функционирования организма и предотвращения раковой активности. Кроме того, подавление синтеза важных нуклеотиды необходимо для роста клеток. По этой причине TS стал важной мишенью для лечения рака с помощью химиотерапия. Чувствительность TS к подавлению ингибиторов TS является ключевым фактором его успеха в лечении рака толстой кишки, поджелудочной железы, яичников, желудка и молочной железы.[11]
Использование TS в качестве мишени для лекарств
Использование Ингибиторы TS стал основным направлением использования TS в качестве мишени для наркотиков. Наиболее широко используемый ингибитор - это 5-фторурацил (5-FU), который действует как антиметаболит который необратимо ингибирует TS путем конкурентного связывания.[13][14] Однако из-за низкого уровня 5-ФУ, обнаруженного у многих пациентов, было обнаружено, что в сочетании с лейковорин (LV), 5-FU имеет больший успех в подавлении механизмов прогрессирования опухоли и повышении активности иммунной системы.[15]
Экспериментально было показано, что низкие уровни экспрессии TS приводят к лучшему ответу на 5-FU и более высокому уровню успеха и выживаемости пациентов с раком толстой кишки и печени.[11] Однако дополнительные эксперименты просто заявили, что уровни TS могут быть связаны со стадией заболевания, распространение клеток и опухоль дифференциация для тех, у кого легкое аденокарцинома но низкие уровни не обязательно являются показателями высокого успеха. Уровни экспрессии TS мРНК может быть полезным в прогнозировании злокачественного потенциала определенных раковых клеток, тем самым улучшая цели лечения рака и обеспечивая более высокие показатели выживаемости среди онкологических больных [Хашимото].
Связь TS с клеточным циклом также способствует его использованию в лечении рака. Несколько зависит от клеточного цикла киназы и факторы транскрипции влияют на уровни TS в клеточном цикле, повышая его активность во время S фаза но снизить его активность, пока клетки больше не размножаются.[11] Саморегулирующим образом TS контролирует не только свою собственную трансляцию, но и трансляцию других белков, таких как p53, который в результате мутации является корнем большого роста опухоли. Благодаря своей трансляции TS по-разному экспрессируется в раковых клетках и опухолях, что приводит к ранней гибели клеток.[14]
Интерактивная карта проезда
Нажмите на гены, белки и метаболиты ниже, чтобы ссылки на соответствующие статьи.[§ 1]
- ^ Интерактивную карту путей можно редактировать на WikiPathways: «ФторпиримидинActivity_WP1601».
Описание механизма
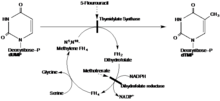
В предложенном механизме TS образует ковалентную связь с субстратом dUMP через 1,4-присоединение с участием нуклеофила цистеина. Тетрагидрофолат субстрата отдает метильную группу альфа-углероду, одновременно восстанавливая новый метил на dUMP с образованием dTMP.[16]

Было доказано, что имин, образующийся в результате реакции с ТГФ и dUMP, является промежуточным звеном в реакции с dUMP через мутации в структуре TS, которые препятствуют завершению механизма. V316Am TS, мутант с делецией С-концевых валинов из обеих субъединиц, позволяет катализировать дегалогенирование BrdUMP, предшествующее механизму, описанному выше, и ковалентной связи с THF и dUMP. Мутантный TS неспособен выполнить C-концевое конформационное изменение, необходимое для разрыва ковалентных связей с образованием dTMP, таким образом показывая, что предложенный механизм верен. Структура была выведена с помощью рентгеновской кристаллографии V316Am TS, чтобы проиллюстрировать полную гомодимерную структуру TS (рис. 1). Кроме того, он показал возможные взаимодействия 175Arg и 174Arg между димерами. Считается, что эти аргинины стабилизируют структуры UMP в активных центрах, создавая водородные связи с фосфатной группой (рис. 2). [Страуд и Файнер-Мур][нужна цитата ]5-ФУ является ингибитором TS. При попадании в клетку 5-фторурацил (5-FU) внутриклеточно превращается во множество активных метаболитов. Одним из таких метаболитов является FdUMP, который отличается от dUMP фтором вместо водорода на альфа-углероде. FdUMP способен ингибировать TS путем связывания с сайтом связывания нуклеотидов dUMP. Это конкурентное связывание подавляет нормальную функцию синтеза dTMP из dUMP [Longley].[нужна цитата ] Таким образом, dUMP не может пройти реакцию элиминирования и завершить отложение метила из ТГФ.

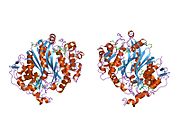
Рисунок 1. На этом рисунке изображен гомодимер TS. Как видите, оранжевая и бирюзовая основы никогда не соединяются и не переплетаются, но между димерами существуют взаимодействия боковых цепей. На оранжевом белке вы можете визуально обнаружить две длинные боковые цепи, которые входят в белок бирюзового цвета (они расположены внутри желтого круга). Остальные бежевые части представляют собой боковые цепи, которые взаимодействуют внутри активного сайта. Чуть ниже желтого круга вы можете увидеть тот же образец боковых цепей и конфигурации.

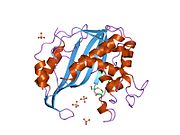
Рисунок 2. На этом рисунке показаны возможные взаимодействия водородных связей между аргининами и UMP в активном центре тимидилатсинтазы. Это видно по слабым линиям между синими и красными наконечниками. Эти аргинины используются для удержания положения молекулы UMP, чтобы взаимодействие могло происходить правильно. Два аргинина в правом верхнем углу, которые расположены рядом друг с другом на позвоночнике, на самом деле происходят из другого белка этого димерного фермента. Это взаимодействие является одной из многих межмолекулярных сил, которые удерживают вместе эти две третичные структуры. Желтая полоса в верхней средней области показывает серную связь, которая образуется между боковой цепью цистеина и UMP. Это ковалентно удерживает UMP в активном сайте до тех пор, пока он не прореагирует с образованием TMP.
Смотрите также
- Аналоги пиримидина
- Ингибитор тимидилатсинтазы
- Тимидинкиназа
- Тимидинкиназа в клинической химии
- Тимидилаткиназа
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000176890 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск ансамбля 89: ENSMUSG00000025747 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Ген Entrez: тимидилатсинтетаза TYMS».
- ^ «ДНК: форма и функция» (PDF).
- ^ «Синтез ДНК».
- ^ а б Страуд Р. М., Санти Д. В., Харди Л. В., Монфор В. Р., Джонс М. О., Файнер-Мур Дж. С. (1987). «Атомная структура тимидилатсинтазы: цель для рационального дизайна лекарств». Наука. 235 (4787): 448–455. Bibcode:1987Sci ... 235..448H. Дои:10.1126 / science.3099389. PMID 3099389.
- ^ Гото О, Симидзу К., Канеда С., Налбантоглу Дж., Такеиси К., Сено Т., Аюсава Д. (1990). «Структурно-функциональный анализ гена тимидилатсинтазы человека». J. Biol. Chem. 265 (33): 20277–20284. PMID 2243092.
- ^ Сантекадур П.К., Раджасекаран Д., Сиддик А., Гредлер Р., Чен Д., Шаус С.Е., Хансен Ю., Фишер П. Б., Саркар Д. (2012). «Фактор транскрипции LSF: новый онкоген для гепатоцеллюлярной карциномы» (PDF). Am J Cancer Res. 2 (3): 269–85. ЧВК 3365805. PMID 22679558.
- ^ а б c d Питерс Дж. Дж., Бэкус Х. Х., Фримантл С., ван Триест Б., Кодаччи-Пизанелли Г., ван дер Вильт К. Л., Смид К., Лунек Дж., Калверт А. Х., Марш С., МакЛеод Х. Л., Блумена Е., Мейер С., Янсен Дж., Ван Грёнинген С. , Пинедо HM (2002). «Индукция тимидилатсинтазы как механизм устойчивости к 5-фторурацилу». Биохим. Биофиз. Acta. 1587 (2–3): 194–205. Дои:10.1016 / S0925-4439 (02) 00082-0. PMID 12084461.
- ^ «Лейковорин». Информация о лекарствах MedlinePlus. Национальная медицинская библиотека США.
- ^ Папамикл Д. (2000). «Использование ингибиторов тимидилатсинтазы в лечении прогрессирующего колоректального рака: текущее состояние». Онколог. 4 (6): 478–87. Дои:10.1634 / теонколог.4-6-478. PMID 10631692.
- ^ а б Папамикл Д. (1999). «Использование ингибиторов тимидилатсинтазы в лечении запущенного колоректального рака: текущее состояние». Онколог. 4 (6): 478–87. Дои:10.1634 / теонколог.4-6-478. PMID 10631692.
- ^ Николини А., Конте М., Росси Г., Феррари П., Даффи М., Барак В., Карпи А., Микколи П. (2011). «Дополнительный 5-FU-LV значительно увеличивает выживаемость при раке желудочно-кишечного тракта». Передние биоски. 3: 1475–82. Дои:10.2741/348. PMID 21622151.
- ^ Каррерас Ч.В., Санти Д.В. (1995). «Каталитический механизм и структура тимидилатсинтазы». Анну. Преподобный Biochem. 64: 721–62. Дои:10.1146 / annurev.bi.64.070195.003445. PMID 7574499.
дальнейшее чтение
- Каррерас Ч.В., Санти Д.В. (1995). «Каталитический механизм и структура тимидилатсинтазы». Ежегодный обзор биохимии. 64 (1): 721–762. Дои:10.1146 / annurev.bi.64.070195.003445. PMID 7574499.
- Банерджи Д., Майер-Кукук П., Капио Дж. И др. (2002). «Новые аспекты устойчивости к лекарствам, направленным на дигидрофолатредуктазу и тимидилатсинтазу». Биохим. Биофиз. Acta. 1587 (2–3): 164–73. Дои:10.1016 / S0925-4439 (02) 00079-0. PMID 12084458.
- Лю Дж., Шмитц Дж. К., Лин Х и др. (2002). «Тимидилатсинтаза как регулятор трансляции экспрессии клеточных генов». Биохим. Биофиз. Acta. 1587 (2–3): 174–82. Дои:10.1016 / s0925-4439 (02) 00080-7. PMID 12084459.
- Чу Дж, Дольник Би Джей (2002). «Природная антисмысловая (rTSalpha) РНК индуцирует сайт-специфическое расщепление мРНК тимидилатсинтазы». Биохим. Биофиз. Acta. 1587 (2–3): 183–93. Дои:10.1016 / s0925-4439 (02) 00081-9. PMID 12084460.
- Петерс Дж. Дж., Бэкус Х. Х., Фримантл С. и др. (2002). «Индукция тимидилатсинтазы как механизм устойчивости к 5-фторурацилу». Биохим. Биофиз. Acta. 1587 (2–3): 194–205. Дои:10.1016 / S0925-4439 (02) 00082-0. PMID 12084461.
- Кости М.П., Тонди Д., Ринальди М. и др. (2002). «Структурные исследования видоспецифического ингибирования тимидилатсинтазы». Биохим. Биофиз. Acta. 1587 (2–3): 206–14. Дои:10.1016 / s0925-4439 (02) 00083-2. PMID 12084462.
- Лин Д., Ли Х, Тан В. и др. (2007). Генетический полиморфизм ферментов, метаболизирующих фолат, и риск рака желудочно-пищеводного тракта: потенциальное взаимодействие питательных веществ и генов в развитии рака. Форум питания. 60. С. 140–5. Дои:10.1159/000107090. ISBN 978-3-8055-8216-2. PMID 17684410.
внешняя ссылка
- Тимидилат + синтетаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- PDBe-KB предоставляет обзор всей структурной информации, доступной в PDB для тимидилатсинтазы человека