Дигидрофолатредуктаза - Dihydrofolate reductase
| Дигидрофолатредуктаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
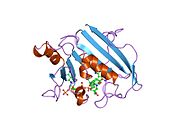
 Кристаллическая структура дигидрофолатредуктазы куриной печени. Запись PDB 8dfr | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 1.5.1.3 | ||||||||
| Количество CAS | 9002-03-3 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| BRENDA | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
| Дигидрофолатредуктаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | DHFR_1 | ||||||||
| Pfam | PF00186 | ||||||||
| Pfam клан | CL0387 | ||||||||
| ИнтерПро | IPR001796 | ||||||||
| PROSITE | PDOC00072 | ||||||||
| SCOP2 | 1dhi / Объем / СУПФАМ | ||||||||
| |||||||||
| Дигидрофолатредуктаза R67 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
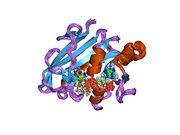
 Структура высокого разрешения кодируемой плазмидой дигидрофолатредуктазы из Кишечная палочка. Запись PDB 2gqv | |||||||||
| Идентификаторы | |||||||||
| Символ | DHFR_2 | ||||||||
| Pfam | PF06442 | ||||||||
| ИнтерПро | IPR009159 | ||||||||
| SCOP2 | 1vif / Объем / СУПФАМ | ||||||||
| |||||||||
Дигидрофолатредуктаза, или DHFR, является фермент что уменьшает дигидрофолиевая кислота к тетрагидрофолиевая кислота, с помощью НАДФН так как донор электронов, которые могут быть преобразованы в виды тетрагидрофолата кофакторы используется в химии переноса 1-углерода. У человека фермент DHFR кодируется DHFR ген.[5][6]Он находится в области q11 → q22 хромосомы 5.[7] Бактериальный виды обладают отчетливым DHFR ферменты (в зависимости от характера связывания диаминогетероциклических молекул), но млекопитающее DHFR очень похожи.[8]
Структура
Центральная восьмицепочечная бета-гофрированный лист составляет главную особенность полипептид раскладывание позвоночника ДХФР.[9] Семь из этих нитей параллельны, а восьмая - антипараллельно. Четыре альфа спирали соедините последовательные бета-нити.[10] Остатки 9-24 называются «Met20» или «петля 1» и, наряду с другими петлями, являются частью основного субдомена, который окружает активный сайт.[11] В активный сайт расположен в N-концевой половина последовательности, которая включает консервированный Pro -Trp дипептид; то триптофан было показано, что участвует в связывании субстрат ферментом.[12]

DHFR человека со связанным дигидрофолатом и НАДФН
Функция
Дигидрофолатредуктаза превращает дигидрофолат в тетрагидрофолат, протонный челнок, необходимый для синтеза de novo пурины, тимидиловая кислота, и некоторые аминокислоты. В то время как функциональный ген дигидрофолатредуктазы был картирован на хромосоме 5, несколько безинтронных процессированных псевдогенов или генов, подобных дигидрофолатредуктазе, были идентифицированы на отдельных хромосомах.[13]

Реакция катализируется DHFR.

Путь синтеза тетрагидрофолата.
Обнаруженный во всех организмах, DHFR играет важную роль в регулировании количества тетрагидрофолата в клетке. Тетрагидрофолат и его производные необходимы для пурин и тимидилат синтез, которые важны для пролиферации и роста клеток.[14] DHFR играет центральную роль в синтезе нуклеиновая кислота предшественников, и было показано, что мутантным клеткам, которые полностью лишены DHFR, для роста необходимы глицин, аминокислота и тимидин.[15] DHFR также был продемонстрирован как фермент, участвующий в восстановлении тетрагидробиоптерина из дигидробиоптерина.[16]
Механизм

Общий механизм
DHFR катализирует перенос гидрида из НАДФН к дигидрофолат с сопутствующим протонированием для получения тетрагидрофолат.[14] В конце концов, дигидрофолат восстанавливается до тетрагидрофолата, а НАДФН окисляется до НАДФ +. Высокая гибкость Met20 и других петель рядом с активным центром играет роль в стимулировании высвобождения продукта, тетрагидрофолата. В частности, петля Met20 помогает стабилизировать никотинамидное кольцо НАДФН, способствуя передаче гидрида от НАДФН к дигидрофолату.[11]

Механизм этого фермента ступенчатый и стационарный случайный. В частности, каталитическая реакция начинается с присоединения НАДФН и субстрата к сайту связывания фермента с последующим протонированием и переносом гидрида от кофактора НАДФН к субстрату. Однако два последних шага не выполняются одновременно в одном и том же переходном состоянии.[17][18] В исследовании с использованием вычислительного и экспериментального подходов Лю и другие сделать вывод, что стадия протонирования предшествует переносу гидрида.[19]

Показано, что ферментативный механизм DHFR зависит от pH, особенно на стадии переноса гидрида, поскольку показано, что изменения pH оказывают заметное влияние на электростатику активного центра и состояние ионизации его остатков.[19] Кислотность целевого азота на субстрате важна для связывания субстрата с сайтом связывания фермента, который, как доказано, является гидрофобным, даже если он имеет прямой контакт с водой.[17][20] Asp27 - единственный заряженный гидрофильный остаток в сайте связывания, и нейтрализация заряда на Asp27 может изменить pKa фермента. Asp27 играет решающую роль в каталитическом механизме, помогая протонировать субстрат и удерживая субстрат в конформации, благоприятной для переноса гидрида.[21][17][20] Показано, что стадия протонирования связана с таутомеризацией енола, хотя это превращение не считается благоприятным для донорства протона.[18] Доказано участие молекулы воды в стадии протонирования.[22][23][24] Вход молекулы воды в активный центр фермента облегчается петлей Met20.[25]
Конформационные изменения DHFR
Каталитический цикл реакции, катализируемой DHFR, включает пять важных промежуточных продуктов: холоэнзим (E: NADPH), комплекс Михаэлиса (E: NADPH: DHF), комплекс тройных продуктов (E: NADPH).+: THF), бинарный комплекс тетрагидрофолата (E: THF) и комплекс THFFNADPH (E: NADPH: THF). Этап диссоциации продукта (THF) от E: NADPH: THF до E: NADPH является этапом, определяющим скорость во время стационарного оборота.[21]
Конформационные изменения имеют решающее значение для каталитического механизма DHFR.[26] Петля Met20 DHFR способна открывать, закрывать или закрывать активный сайт.[23][17] Соответственно, Met20 присваиваются три различные конформации, классифицируемые как открытое, закрытое и закрытое состояния. Кроме того, была определена дополнительно искаженная конформация Met20 из-за нечетких результатов характеризации.[23] Петля Met20 наблюдается в закрытой конформации в трех промежуточных продуктах лигирования, где никотинамидное кольцо закрыто от активного сайта. Эта конформационная особенность объясняет тот факт, что замещение NADP+ НАДФН предшествует диссоциации продукта. Таким образом, следующий раунд реакции может произойти при связывании субстрата.[21]


R67 DHFR
Благодаря своей уникальной структуре и каталитическим свойствам R67 DHFR широко изучается. R67 DHFR представляет собой DHFR, кодируемый R-плазмидой типа II, не имеющий генетической и структурной связи с хромосомным DHFR E. coli. Это гомотетрамер, который обладает симметрией 222 с единственной порой активного центра, которая подвергается воздействию растворителя [ноль].[27] Эта симметрия активного центра приводит к разному способу связывания фермента: он может связываться с двумя молекулами дигидрофолата (ДГФ) с положительной кооперативностью или двумя молекулами НАДФН с отрицательной кооперативностью, или с одним субстратом плюс один, но только последний имеет каталитическую активность. Мероприятия.[28] По сравнению с хромосомным DHFR E. coli, он имеет более высокий Kм в связывании дигидрофолата (ДГФ) и НАДФН. Гораздо более низкая каталитическая кинетика показывает, что перенос гидрида является стадией, определяющей скорость, а не высвобождением продукта (ТГФ).[29]
В структуре R67 DHFR гомотетрамер образует пору активного центра. В каталитическом процессе ДГФ и НАДФН попадают в поры из противоположного положения. Π-π-стэкинг-взаимодействие между никотинамидным кольцом НАДФН и птеридиновым кольцом DHF плотно соединяет два реагента в активном центре. Однако при связывании наблюдалась гибкость пара-аминобензоилглутаматного хвоста DHF, что может способствовать образованию переходного состояния.[30]
Клиническое значение
Дефицит дигидрофолатредуктазы был связан с мегалобластная анемия.[13] Лечение с уменьшенный формы фолиевой кислоты. Поскольку тетрагидрофолат, продукт этой реакции, является активной формой фолиевой кислоты у людей, ингибирование DHFR может вызывать функциональную дефицит фолиевой кислоты. DHFR является привлекательной фармацевтической мишенью для ингибирования из-за его ключевой роли в синтезе предшественников ДНК. Триметоприм, антибиотик, подавляет бактериальный DHFR, в то время как метотрексат, а химиотерапия агент, ингибирует DHFR млекопитающих. Однако, сопротивление развился против некоторых лекарств в результате мутационных изменений самого DHFR.[31]
Мутации DHFR вызывают редкую аутосомно-рецессивную врожденную ошибку метаболизма фолиевой кислоты, которая приводит к мегалобластная анемия, панцитопения и суровый дефицит церебрального фолата что может быть исправлено фолиновая кислота добавка.[32][33]
Терапевтические приложения
Поскольку фолиевая кислота необходима быстро делящимся клеткам для производства тимин, этот эффект можно использовать с терапевтической пользой.
DHFR может использоваться при лечении рака и в качестве потенциальной мишени против бактериальных инфекций. DHFR отвечает за уровни тетрагидрофолата в клетке, а ингибирование DHFR может ограничивать рост и пролиферацию клеток, которые характерны для рака и бактериальных инфекций. Метотрексат, а конкурентный ингибитор DHFR, является одним из таких противораковых препаратов, которые ингибируют DHFR.[34] Другие препараты включают триметоприм и пириметамин. Эти три широко используются в качестве противоопухолевых и противомикробных средств.[35] Другие классы соединений, которые нацелены на ДГФР в целом, и бактериальные ДГФР в частности, относятся к таким классам, как диаминоптеридины, диаминотриазины, диаминопирролохиназолины, стильбены, халконы, дезоксибензоины и многие другие.[36]
Триметоприм показал активность против различных Грамположительный бактериальные возбудители.[37] Однако устойчивость к триметоприму и другим лекарствам, направленным на ДГФР, может возникать из-за множества механизмов, ограничивающих успех их терапевтического применения.[38][39][40] Устойчивость может возникнуть в результате амплификации гена DHFR, мутации в DHFR,[41][42] снижение потребления наркотиков, среди прочего. Несмотря на это, триметоприм и сульфаметоксазол в комбинации используется в качестве антибактериального средства в течение десятилетий.[37]
Фолиевая кислота необходимо для роста,[43] и путь метаболизма фолиевой кислоты является целью при разработке методов лечения рака. DHFR - одна из таких целей. Режим фторурацил, доксорубицин, а метотрексат продлевает выживаемость у пациентов с распространенным раком желудка.[44] Дальнейшие исследования ингибиторов DHFR могут привести к новым способам лечения рака.
Бактериям также необходим DHFR для роста и размножения, и, следовательно, селективные ингибиторы бактериального DHFR нашли применение в качестве антибактериальных агентов.[37]
Классы малых молекул, используемых в качестве ингибиторов дигидрофолатредуктазы, включают диаминохиназолин и диаминопирролохиназолин,[45] диаминопиримидин, диаминоптеридин и диаминотриазины.[46]
Возможное лечение сибирской язвы

Дигидрофолатредуктаза из бацилла сибирской язвы (BaDHFR) утвержденный лекарственный препарат-мишень для лечения инфекционного заболевания, сибирской язвы. BaDHFR менее чувствителен к триметоприм аналоги, чем дигидрофолатредуктаза из других видов, таких как кишечная палочка, Золотистый стафилококк, и Пневмококк. Структурное сопоставление дигидрофолатредуктазы всех четырех видов показывает, что только BaDHFR имеет комбинацию фенилаланин и тирозин в позициях 96 и 102 соответственно.
Устойчивость BaDHFR к триметоприм аналоги обусловлены этими двумя остатками (F96 и Y102), которые также обеспечивают улучшенную кинетику и каталитическую эффективность.[47] В текущих исследованиях используются мутанты активного сайта в BaDHFR для руководства оптимизацией новых антифолатных ингибиторов.[47]
Как инструмент исследования
DHFR использовался как инструмент для обнаружения белок-белковые взаимодействия в анализ комплементации белок-фрагмент (СПС).
Клетки CHO
DHFR отсутствует Клетки CHO являются наиболее часто используемыми клеточная линия для производства рекомбинантных белков. Эти клетки трансфицированный с плазмида несущий dhfr ген и ген рекомбинантного белка в одном система экспрессии, а затем подверглись селективные условия в тимидин-дефицитном Средняя. Выживают только клетки с экзогенным геном DHFR вместе с интересующим геном.
Взаимодействия
Было показано, что дигидрофолатредуктаза взаимодействует с GroEL[48] и Mdm2.[49]
Интерактивная карта проезда
Нажмите на гены, белки и метаболиты ниже, чтобы ссылки на соответствующие статьи.[§ 1]
- ^ Интерактивную карту путей можно редактировать на WikiPathways: «ФторпиримидинActivity_WP1601».
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000228716 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск ансамбля 89: ENSMUSG00000021707 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Chen MJ, Shimada T., Moulton AD, Harrison M, Nienhuis AW (декабрь 1982 г.). «Гены дигидрофолатредуктазы человека без интронов происходят из процессированных молекул РНК». Труды Национальной академии наук Соединенных Штатов Америки. 79 (23): 7435–9. Bibcode:1982PNAS ... 79.7435C. Дои:10.1073 / пнас.79.23.7435. ЧВК 347354. PMID 6961421.
- ^ Chen MJ, Shimada T, Moulton AD, Cline A, Humphries RK, Maizel J, Nienhuis AW (март 1984). «Функциональный ген дигидрофолатредуктазы человека». Журнал биологической химии. 259 (6): 3933–43. PMID 6323448.
- ^ Funanage VL, Myoda TT, Moses PA, Cowell HR (октябрь 1984 г.). «Отнесение гена дигидрофолатредуктазы человека к области q11 ---- q22 хромосомы 5». Молекулярная и клеточная биология. 4 (10): 2010–6. Дои:10.1128 / mcb.4.10.2010. ЧВК 369017. PMID 6504041.
- ^ Смит С.Л., Патрик П., Стоун Д., Филлипс А.В., Берчалл Дж. Дж. (Ноябрь 1979 г.). «Дигидрофолатредуктаза печени свиньи. Очистка, свойства и аминокислотная последовательность». Журнал биологической химии. 254 (22): 11475–84. PMID 500653.
- ^ Мэтьюз Д.А., Олден Р.А., Болин Дж.Т., Фрир С.Т., Хэмлин Р., Сюонг Н., Краут Дж., По М., Уильямс М., Хугстин К. (июль 1977 г.). «Дигидрофолатредуктаза: рентгеновская структура бинарного комплекса с метотрексатом». Наука. 197 (4302): 452–5. Bibcode:1977Научный ... 197..452М. Дои:10.1126 / science.17920. PMID 17920.
- ^ Филман Д. Д., Болин Дж. Т., Мэтьюз Д. А., Краут Дж. (Ноябрь 1982 г.). «Кристаллические структуры кишечная палочка и Lactobacillus casei дигидрофолатредуктаза очищена с разрешением 1,7 Å. II. Окружающая среда связанного НАДФН и значение для катализа ». Журнал биологической химии. 257 (22): 13663–72. PMID 6815179.
- ^ а б Осборн MJ, Schnell J, Benkovic SJ, Дайсон HJ, Райт ЧП (август 2001 г.). «Динамика основной цепи в комплексах дигидрофолатредуктазы: роль гибкости петли в каталитическом механизме». Биохимия. 40 (33): 9846–59. Дои:10.1021 / bi010621k. PMID 11502178.
- ^ Болин Дж. Т., Филман Д. Д., Мэтьюз Д. А., Хэмлин Р. К., Краут Дж. (Ноябрь 1982 г.). «Кристаллические структуры кишечная палочка и Lactobacillus casei дигидрофолатредуктаза очищена с разрешением 1,7 Å. I. Общие особенности и связывание метотрексата ». Журнал биологической химии. 257 (22): 13650–62. PMID 6815178.
- ^ а б «Энтрез Ген: дигидрофолатредуктаза DHFR».
- ^ а б Шнелл-младший, Дайсон Х.Дж., Райт ЧП (2004). «Структура, динамика и каталитическая функция дигидрофолатредуктазы». Ежегодный обзор биофизики и структуры биомолекул. 33 (1): 119–40. Дои:10.1146 / annurev.biophys.33.110502.133613. PMID 15139807. S2CID 28611812.
- ^ Урлауб Г., Часин Л.А. (июль 1980 г.). «Выделение мутантов клеток китайского хомячка, дефицитных по активности дигидрофолатредуктазы». Труды Национальной академии наук Соединенных Штатов Америки. 77 (7): 4216–20. Bibcode:1980PNAS ... 77.4216U. Дои:10.1073 / pnas.77.7.4216. ЧВК 349802. PMID 6933469.
- ^ Crabtree MJ, Tatham AL, Hale AB, Alp NJ, Channon KM (октябрь 2009 г.). «Критическая роль рециклинга тетрагидробиоптерина дигидрофолатредуктазой в регуляции эндотелиального связывания синтазы оксида азота: относительная важность синтеза биоптерина de novo по сравнению с путями спасения». Журнал биологической химии. 284 (41): 28128–36. Дои:10.1074 / jbc.M109.041483. ЧВК 2788863. PMID 19666465.
- ^ а б c d Род TH, Брукс CL (июль 2003 г.). «Как дигидрофолатредуктаза способствует протонированию дигидрофолата». Журнал Американского химического общества. 125 (29): 8718–9. Дои:10.1021 / ja035272r. PMID 12862454.
- ^ а б Ван К., Беннетт BC, Уилсон М.А., Ковалевский А., Ланган П., Хауэлл Е.Е., Дилвис С. (декабрь 2014 г.). «На пути к разрешению каталитического механизма дигидрофолатредуктазы с использованием нейтронной и рентгеновской кристаллографии сверхвысокого разрешения». Труды Национальной академии наук Соединенных Штатов Америки. 111 (51): 18225–30. Bibcode:2014PNAS..11118225W. Дои:10.1073 / pnas.1415856111. ЧВК 4280638. PMID 25453083.
- ^ а б Лю CT, Фрэнсис К., Лейфилд Дж. П., Хуанг X, Хаммес-Шиффер С., Коэн А., Бенкович С. Дж. (Декабрь 2014 г.). "кишечная палочка катализируемый дигидрофолатредуктазой перенос протонов и гидридов: временной порядок и роли Asp27 и Tyr100 ». Труды Национальной академии наук Соединенных Штатов Америки. 111 (51): 18231–6. Bibcode:2014ПНАС..11118231Л. Дои:10.1073 / pnas.1415940111. ЧВК 4280594. PMID 25453098.
- ^ а б Chekster CM, Vandemeulebroucke A, Blanchard JS (январь 2011 г.). «Кинетический и химический механизм дигидрофолатредуктазы из Микобактерии туберкулеза". Биохимия. 50 (3): 367–75. Дои:10.1021 / bi1016843. ЧВК 3074011. PMID 21138249.
- ^ а б c Fierke CA, Johnson KA, Benkovic SJ (июнь 1987 г.). «Построение и оценка кинетической схемы, связанной с дигидрофолатредуктазой из кишечная палочка". Биохимия. 26 (13): 4085–92. Дои:10.1021 / bi00387a052. PMID 3307916.
- ^ Рейес В.М., Савая М.Р., Браун К.А., Краут Дж. (Февраль 1995 г.). «Изоморфные кристаллические структуры кишечная палочка дигидрофолатредуктаза в комплексе с фолатом, 5-деазафолатом и 5,10-дидеазатетрагидрофолатом: механистические последствия ». Биохимия. 34 (8): 2710–23. Дои:10.1021 / bi00008a039. PMID 7873554.
- ^ а б c Sawaya MR, Kraut J (январь 1997 г.). «Петли и подобласти движений в механизме кишечная палочка дигидрофолатредуктаза: кристаллографические доказательства ". Биохимия. 36 (3): 586–603. Дои:10.1021 / bi962337c. PMID 9012674.
- ^ Чен Ю.К., Краут Дж., Блэкли Р.Л., Каллендер Р. (июнь 1994 г.). «Определение с помощью спектроскопии комбинационного рассеяния pKa N5 дигидрофолата, связанного с дигидрофолатредуктазой: механистические последствия». Биохимия. 33 (23): 7021–6. Дои:10.1021 / bi00189a001. PMID 8003467.
- ^ Шримптон П., Аллеманн Р.К. (июнь 2002 г.). «Роль воды в каталитическом цикле дигидрофолатредуктазы E. coli». Белковая наука. 11 (6): 1442–51. Дои:10.1110 / пс. 5060102. ЧВК 2373639. PMID 12021443.
- ^ Антикайнен Н.М., Смайли Р.Д., Бенкович С.Дж., Хаммес Г.Г. (декабрь 2005 г.). "Конформационно-связанный ферментный катализ: исследование одиночной молекулы и переходной кинетики дигидрофолатредуктазы". Биохимия. 44 (51): 16835–43. Дои:10.1021 / bi051378i. PMID 16363797.
- ^ Нараяна Н., Мэтьюз Д.А., Хауэлл Е.Е., Нгуен-хуу X (ноябрь 1995 г.). «Кодируемая плазмидой дигидрофолатредуктаза из устойчивых к триметоприму бактерий имеет новый D2-симметричный активный сайт». Структурная биология природы. 2 (11): 1018–25. Дои:10.1038 / nsb1195-1018. PMID 7583655. S2CID 11914241.
- ^ Брэдрик Т.Д., Бичем Дж. М., Хауэлл Е. Е. (сентябрь 1996 г.). «Необычные стехиометрии связывания и кооперативность наблюдаются во время образования бинарных и тройных комплексов в единственной активной поре дигидрофолатредуктазы R67, симметричного белка D2». Биохимия. 35 (35): 11414–24. Дои:10.1021 / bi960205d. PMID 8784197.
- ^ Пак Х, Чжуан П., Николс Р., Хауэлл Э. (январь 1997 г.). «Механистические исследования дигидрофолатредуктазы R67. Влияние pH и мутации H62C». Журнал биологической химии. 272 (4): 2252–8. Дои:10.1074 / jbc.272.4.2252. PMID 8999931.
- ^ Камат Г., Хауэлл Э., Агарвал П.К. (октябрь 2010 г.). "Хвост, виляющий собакой: понимание катализа дигидрофолатредуктазы R67". Биохимия. 49 (42): 9078–88. Дои:10.1021 / bi1007222. PMID 20795731.
- ^ Ковмен А.Ф., Лью А.М. (ноябрь 1989 г.). «Выбор антифолатного препарата приводит к дупликации и перестройке хромосомы 7 у Plasmodium chabaudi». Молекулярная и клеточная биология. 9 (11): 5182–8. Дои:10.1128 / mcb.9.11.5182. ЧВК 363670. PMID 2601715.
- ^ Банк С., Блом Х. Дж., Уолтер Дж., Азиз М., Уркхарт Дж., Клутье С. М. и др. (Февраль 2011 г.). «Выявление и характеристика врожденной ошибки метаболизма, вызванной дефицитом дигидрофолатредуктазы». Американский журнал генетики человека. 88 (2): 216–25. Дои:10.1016 / j.ajhg.2011.01.004. ЧВК 3035707. PMID 21310276.
- ^ Нихан В.Л., Хоффманн Г.Ф., Barshop BA (30 декабря 2011 г.). Атлас наследственных заболеваний обмена веществ 3E. CRC Press. С. 141–. ISBN 978-1-4441-4948-7.
- ^ Ли Р., Сираварапорн Р., Читнумсуб П., Сираварапорн В., Вуден Дж., Атаппилли Ф., Терли С., Хол В.Г. (январь 2000 г.). «Трехмерная структура М. туберкулез дигидрофолатредуктаза открывает возможности для создания новых противотуберкулезных препаратов ». Журнал молекулярной биологии. 295 (2): 307–23. Дои:10.1006 / jmbi.1999.3328. PMID 10623528. S2CID 24527344.
- ^ Бенкович SJ, Fierke CA, Naylor AM (март 1988 г.). «Понимание функции ферментов из исследований мутантов дигидрофолатредуктазы». Наука. 239 (4844): 1105–10. Bibcode:1988Научный ... 239.1105Б. Дои:10.1126 / science.3125607. PMID 3125607.
- ^ Сринивасан Б., Тонддаст-Навай С., Рой А., Чжоу Х., Сколник Дж. (Сентябрь 2018 г.). «Химическое пространство кишечная палочка Ингибиторы дигидрофолатредуктазы: новые подходы к открытию новых лекарств от старых насекомых ». Обзоры медицинских исследований. 39 (2): 684–705. Дои:10.1002 / med.21538. ЧВК 6370515. PMID 30192413.
- ^ а б c Хавсер С., Локюро С., Ислам К. (март 2006 г.). «Ингибиторы дигидрофолатредуктазы как антибактериальные средства». Биохимическая фармакология. 71 (7): 941–8. Дои:10.1016 / j.bcp.2005.10.052. PMID 16359642.
- ^ Нараяна Н., Мэтьюз Д.А., Хауэлл Е.Е., Нгуен-хуу X (ноябрь 1995 г.). «Кодируемая плазмидой дигидрофолатредуктаза из устойчивых к триметоприму бактерий имеет новый D2-симметричный активный сайт». Структурная биология природы. 2 (11): 1018–25. Дои:10.1038 / nsb1195-1018. PMID 7583655. S2CID 11914241.
- ^ Huennekens FM (июнь 1996 г.). «В поисках дигидрофолатредуктазы». Белковая наука. 5 (6): 1201–8. Дои:10.1002 / pro.5560050626. ЧВК 2143423. PMID 8762155.
- ^ Банерджи Д., Майер-Кукук П., Капио Дж., Будак-Альпдоган Т., Горлик Р., Бертино Дж. Р. (июль 2002 г.). «Новые аспекты устойчивости к лекарствам, направленным на дигидрофолатредуктазу и тимидилатсинтазу». Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1587 (2–3): 164–73. Дои:10.1016 / S0925-4439 (02) 00079-0. PMID 12084458.
- ^ Топрак Э., Верес А., Мишель Дж. Б., Чайт Р., Хартл Д. Л., Кишони Р. (декабрь 2011 г.). «Эволюционные пути к устойчивости к антибиотикам при динамически устойчивом выборе лекарств». Природа Генетика. 44 (1): 101–5. Дои:10,1038 / нг.1034. ЧВК 3534735. PMID 22179135.
- ^ Родригес СП, Берштейн С., Ли А., Лозовский Э.Р., Хартл Д.Л., Шахнович Е.И. (март 2016 г.). «Биофизические принципы предсказывают фитнес-ландшафты лекарственной устойчивости». Труды Национальной академии наук Соединенных Штатов Америки. 113 (11): E1470-8. Bibcode:2016PNAS..113E1470R. Дои:10.1073 / pnas.1601441113. ЧВК 4801265. PMID 26929328.
- ^ Бейли С.В., Эйлинг Дж. Э. (сентябрь 2009 г.). «Чрезвычайно медленная и непостоянная активность дигидрофолатредуктазы в печени человека и ее значение для высокого потребления фолиевой кислоты». Труды Национальной академии наук Соединенных Штатов Америки. 106 (36): 15424–9. Дои:10.1073 / pnas.0902072106. ЧВК 2730961. PMID 19706381.
- ^ Мурад А.М., Сантьяго Ф.Ф., Петрояну А., Роча П.Р., Родригес М.А., Рауш М. (июль 1993 г.). «Модифицированная терапия 5-фторурацилом, доксорубицином и метотрексатом при распространенном раке желудка». Рак. 72 (1): 37–41. Дои:10.1002 / 1097-0142 (19930701) 72: 1 <37 :: AID-CNCR2820720109> 3.0.CO; 2-P. PMID 8508427.
- ^ Сринивасан Б., Сколник Дж. (Май 2015 г.). "Понимание медленного начала ингибирования сильного связывания кишечная палочка дигидрофолатредуктаза: подробная механистическая характеристика пирроло [3,2-f] хиназолин-1,3-диамина и его производных как новых ингибиторов прочного связывания ». Журнал FEBS. 282 (10): 1922–38. Дои:10.1111 / фев.13244. ЧВК 4445455. PMID 25703118.
- ^ Сринивасан Б., Тонддаст-Навай С., Сколник Дж. (Октябрь 2015 г.). "Исследования связывания лиганда, предварительная взаимосвязь структура-активность и подробная механистическая характеристика производных 1-фенил-6,6-диметил-1,3,5-триазин-2,4-диамина как ингибиторов кишечная палочка дигидрофолатредуктаза ". Европейский журнал медицинской химии. 103: 600–14. Дои:10.1016 / j.ejmech.2015.08.021. ЧВК 4610388. PMID 26414808.
- ^ а б Байерлейн Дж. М., Карри Н. Г., Андерсон А. С. (октябрь 2010 г.). "Целевые мутации дигидрофолатредуктазы Bacillus anthracis конденсируют сложные взаимосвязи структура-активность". Журнал медицинской химии. 53 (20): 7327–36. Дои:10.1021 / jm100727t. ЧВК 3618964. PMID 20882962.
- ^ Mayhew M, da Silva AC, Martin J, Erdjument-Bromage H, Tempst P, Hartl FU (февраль 1996 г.). «Сворачивание белка в центральной полости шаперонинового комплекса GroEL-GroES». Природа. 379 (6564): 420–6. Bibcode:1996Натура 379..420М. Дои:10.1038 / 379420a0. PMID 8559246. S2CID 4310511.
- ^ Магуайр М., Нилд ПК, Девлинг Т., Дженкинс Р.Э., Парк Б.К., Полански Р., Влаткович Н., Бойд М.Т. (май 2008 г.). «MDM2 регулирует активность дигидрофолатредуктазы посредством моноубиквитинирования». Исследования рака. 68 (9): 3232–42. Дои:10.1158 / 0008-5472.CAN-07-5271. ЧВК 3536468. PMID 18451149.
дальнейшее чтение
- Йоска TM, Андерсон AC (октябрь 2006 г.). «Взаимосвязь между структурой и активностью дигидрофолатредуктазы Bacillus cereus и Bacillus anthracis: на пути к идентификации новых сильнодействующих лекарственных средств». Противомикробные препараты и химиотерапия. 50 (10): 3435–43. Дои:10.1128 / AAC.00386-06. ЧВК 1610094. PMID 17005826.
- Чан, округ Колумбия, Фу Х, Форш Р.А., Куинер С.Ф., Розовски А. (июнь 2005 г.). «Дизайн, синтез и антифолатная активность новых аналогов пиритрекима и других ингибиторов диаминопиримидин дигидрофолатредуктазы с омега-карбоксиалкокси или омега-карбокси-1-алкинильным замещением в боковой цепи». Журнал медицинской химии. 48 (13): 4420–31. Дои:10.1021 / jm0581718. PMID 15974594.
- Банерджи Д., Майер-Кукук П., Капио Дж., Будак-Альпдоган Т., Горлик Р., Бертино Дж. Р. (июль 2002 г.). «Новые аспекты устойчивости к лекарствам, направленным на дигидрофолатредуктазу и тимидилатсинтазу». Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1587 (2–3): 164–73. Дои:10.1016 / S0925-4439 (02) 00079-0. PMID 12084458.
- Стокман Б.Дж., Нирмала Н.Р., Вагнер Г., Делкэмп Т.Дж., ДеЯрман М.Т., Фрайсхайм Дж. Х. (январь 1992 г.). «Последовательность-специфические назначения резонанса 1H и 15N для человеческой дигидрофолатредуктазы в растворе». Биохимия. 31 (1): 218–29. Дои:10.1021 / bi00116a031. PMID 1731871.
- Beltzer JP, Spiess M (декабрь 1991 г.). «Связывание in vitro рецептора асиалогликопротеина с бета-адаптином везикул, покрытых плазматической мембраной». Журнал EMBO. 10 (12): 3735–42. Дои:10.1002 / j.1460-2075.1991.tb04942.x. ЧВК 453108. PMID 1935897.
- Дэвис Дж. Ф., Делкамп Т. Дж., Прендергаст Н. Дж., Эшфорд В. А., Фрайсхайм Дж. Х., Краут Дж. (Октябрь 1990 г.). «Кристаллические структуры рекомбинантной дигидрофолатредуктазы человека в комплексе с фолатом и 5-деазафолатом». Биохимия. 29 (40): 9467–79. Дои:10.1021 / bi00492a021. PMID 2248959.
- Уилл К.Л., Дольник Би Джей (декабрь 1989 г.). «5-Фторурацил ингибирует процессинг мРНК предшественника дигидрофолатредуктазы и / или стабильность ядерной мРНК в устойчивых к метотрексату клетках KB». Журнал биологической химии. 264 (35): 21413–21. PMID 2592384.
- Мастерс Дж. Н., Аттарди Дж. (Март 1985 г.). «Дискретные транскрипты гена дигидрофолатредуктазы человека присутствуют на карте полисомной РНК с их 5'-концами на несколько сотен нуклеотидов выше основного сайта старта мРНК». Молекулярная и клеточная биология. 5 (3): 493–500. Дои:10.1128 / mcb.5.3.493. ЧВК 366741. PMID 2859520.
- Miszta H, Dabrowski Z, Lanotte M (ноябрь 1988 г.). «In vitro паттерны экспрессии ферментной тетрагидрофолатдегидрогеназы (EC 1.5.1.3) в стромальных клетках костного мозга». Лейкемия. 2 (11): 754–9. PMID 3185016.
- Офнер К., Д'Арси А., Винклер Ф.К. (июнь 1988 г.). «Кристаллическая структура дигидрофолатредуктазы человека в комплексе с фолатом». Европейский журнал биохимии / FEBS. 174 (2): 377–85. Дои:10.1111 / j.1432-1033.1988.tb14108.x. PMID 3383852.
- Ян Дж. К., Мастерс Дж. Н., Аттарди Дж. (Июнь 1984 г.). «Организация гена дигидрофолатредуктазы человека. Обширная консервация G + C-богатой 5'-некодирующей последовательности и сильное отклонение размера интрона от гомологичных генов млекопитающих». Журнал молекулярной биологии. 176 (2): 169–87. Дои:10.1016/0022-2836(84)90419-4. PMID 6235374.
- Мастерс Дж. Н., Ян Дж. К., Челлини А., Аттарди Дж. (Июнь 1983 г.). «Псевдоген дигидрофолатредуктазы человека и его связь с множеством форм специфической информационной РНК». Журнал молекулярной биологии. 167 (1): 23–36. Дои:10.1016 / S0022-2836 (83) 80032-1. PMID 6306253.
- Chen MJ, Shimada T, Moulton AD, Cline A, Humphries RK, Maizel J, Nienhuis AW (март 1984). «Функциональный ген дигидрофолатредуктазы человека». Журнал биологической химии. 259 (6): 3933–43. PMID 6323448.
- Funanage VL, Myoda TT, Moses PA, Cowell HR (октябрь 1984 г.). «Отнесение гена дигидрофолатредуктазы человека к области q11 ---- q22 хромосомы 5». Молекулярная и клеточная биология. 4 (10): 2010–6. Дои:10.1128 / mcb.4.10.2010. ЧВК 369017. PMID 6504041.
- Мастерс Дж. Н., Аттарди Дж. (1983). «Нуклеотидная последовательность кДНК, кодирующая редуктазу дигидрофолиевой кислоты человека». Ген. 21 (1–2): 59–63. Дои:10.1016/0378-1119(83)90147-6. PMID 6687716.
- Моранди К., Мастерс Дж. Н., Моттес М., Аттарди Дж. (Апрель 1982 г.). "Множественные формы информационной РНК дигидрофолатредуктазы человека. Клонирование и экспрессия в кишечная палочка кодирующей последовательности их ДНК ". Журнал молекулярной биологии. 156 (3): 583–607. Дои:10.1016/0022-2836(82)90268-6. PMID 6750132.
- Бонифачи Н., Сития Р., Рубартелли А. (сентябрь 1995 г.). «Ядерная транслокация экзогенного слитого белка, содержащего Tat ВИЧ, требует разворачивания». СПИД. 9 (9): 995–1000. Дои:10.1097/00002030-199509000-00003. PMID 8527095. S2CID 8417864.
- Mayhew M, da Silva AC, Martin J, Erdjument-Bromage H, Tempst P, Hartl FU (февраль 1996 г.). «Сворачивание белка в центральной полости шаперонинового комплекса GroEL-GroES». Природа. 379 (6564): 420–6. Bibcode:1996Натура 379..420М. Дои:10.1038 / 379420a0. PMID 8559246. S2CID 4310511.
- Гросс М., Робинсон CV, Мэйхью М., Хартл Ф.У., Рэдфорд С.Е. (декабрь 1996 г.). «Значительная защита водородного обмена в GroEL-связанном DHFR поддерживается во время итерационных циклов цикла субстрата». Белковая наука. 5 (12): 2506–13. Дои:10.1002 / pro.5560051213. ЧВК 2143321. PMID 8976559.
- Schleiff E, Shore GC, Goping IS (март 1997 г.). «Человеческий митохондриальный импортный рецептор, Tom20p. Использование глутатиона для выявления специфических взаимодействий между Tom20-глутатион S-трансферазой и митохондриальными белками-предшественниками». Письма FEBS. 404 (2–3): 314–8. Дои:10.1016 / S0014-5793 (97) 00145-2. PMID 9119086. S2CID 29177508.
- Коди В., Галицкий Н., Люфт Дж. Р., Пэнгборн В., Росовски А., Блэкли Р. Л. (ноябрь 1997 г.). «Сравнение двух независимых кристаллических структур тройных комплексов дигидрофолатредуктазы человека, восстановленных никотинамидадениндинуклеотидфосфатом и очень прочно связывающимся ингибитором PT523». Биохимия. 36 (45): 13897–903. Дои:10.1021 / bi971711l. PMID 9374868.
- Вангури В.К., Ван С., Годына С., Ранганатан С., Ляу Г. (апрель 2000 г.). «Тромбоспондин-1 связывается с полигистидином с высоким сродством и специфичностью». Биохимический журнал. 347 (Pt 2): 469–73. Дои:10.1042/0264-6021:3470469. ЧВК 1220979. PMID 10749676.
внешние ссылки
- Нобелевская лекция по медицине 1988 г.
- Протеопедия: Дигидрофолатредуктаза
- Обзор всей структурной информации, доступной в PDB для UniProt: P00374 (Дигидрофолатредуктаза) на PDBe-KB.