Фумараза - Fumarase

Фумараза (или же фумаратгидратаза) является фермент который катализирует обратимый гидратация /обезвоживание из фумарат к малат. Фумараза бывает двух видов: митохондриальный и цитозольный. Митохондриальный изофермент участвует в Цикл Кребса (также известный как цикл трикарбоновой кислоты [TCA] или цикл лимонной кислоты), и цитозольный изофермент участвует в метаболизм из аминокислоты и фумарат. Субклеточная локализация определяется наличием сигнальной последовательности на аминоконце в митохондриальной форме, в то время как субклеточная локализация в цитозольной форме определяется отсутствием сигнальной последовательности, обнаруженной в митохондриальной форме.[4]
Этот фермент участвует в 2 метаболические пути: цикл лимонной кислоты, восстановительный цикл лимонной кислоты (CO2 фиксация), а также важна в карцинома почек. Мутации в этом гене были связаны с развитием лейомиом на коже и матке в сочетании с почечно-клеточной карциномой.
Номенклатура
Этот фермент принадлежит к семейству лиасы особенно гидролазы, которые расщепляют углерод-кислородные связи. В систематическое название этого класса ферментов (S) -малат гидролаза (фумаратобразующая). Другие широко используемые имена включают:
- фумараза
- L-малат гидролаза
- (S) -малат гидролаза
Структура
Ген
Ген FH локализован в хромосомной позиции 1q42.3-q43. Ген FH содержит 10 экзонов.
Протеин
Кристаллические структуры фумаразы С из кишечная палочка наблюдались два занятых дикарбоксилата участок связывания. Они известны как активный сайт и сайт B. И активный сайт, и сайт B идентифицированы как имеющие области, не занятые связанной лиганд. Эта так называемая «свободная» кристаллическая структура демонстрирует сохранение воды в активном центре. Подобная ориентация была обнаружена в других кристаллических структурах фумаразы C. Кристаллографические исследования сайта B фермента показали, что есть сдвиг на His129. Эта информация свидетельствует о том, что вода является постоянным компонентом активного центра. Это также предполагает, что использование имидазол -имидазолий конверсия контролирует доступ к аллостерическому сайту B.[5]
Функция
Механизм


Рисунок 2 изображает механизм реакции фумаразы. Две кислотно-основные группы катализируют перенос протона, и состояние ионизации этих групп частично определяется двумя формами фермента E1 и E2. В E1, группы существуют во внутренне нейтрализованном состоянии A-H / B:, в то время как в E2, они происходят в цвиттерионный A- / BH+ государственный. E1 связывает фумарат и способствует его превращению в малат, а E2 связывает малат и способствует его превращению в фумарат. Две формы должны подвергаться изомеризации при каждом каталитическом обороте.[6]
Несмотря на его биологическое значение, механизм реакции фумаразы до конца не изучен. Саму реакцию можно отслеживать в любом направлении; однако образование фумарата, в частности, из S-малата менее изучено из-за высокой pKа значение Hр (Рис. 1) атом, который удаляется без помощи кофакторы или же коферменты. Однако реакция фумарата на L-малат более понятна и включает стереоспецифический гидратация фумарата с образованием S-малата путем транс-добавления гидроксил группы и атома водорода через 1,4-транс-присоединение гидроксильной группы. Ранние исследования этой реакции показали, что образование фумарата из S-малата связано с дегидратацией малата до карбокатионного промежуточного продукта, который затем теряет альфа-протон с образованием фумарата. Это привело к выводу, что при образовании S-малата из фумарата E1 устранение, протонирование фумарата до карбокатиона сопровождалось добавлением гидроксильной группы из H2О. Однако более поздние испытания предоставили доказательства того, что этот механизм на самом деле имеет место посредством кислотно-щелочного каталитического выведения с помощью карбанионного промежуточного соединения. Устранение E1CB (Фигура 2).[6][7][8]
Биохимический путь
Функция фумаразы в цикл лимонной кислоты состоит в том, чтобы облегчить переходный этап в производстве энергии в виде НАДН.[9] в цитозоль фермент метаболизирует фумарат, который является побочным продуктом цикл мочевины а также катаболизм аминокислот. Исследования показали, что активный сайт состоит из аминокислотных остатков трех из четырех субъединиц тетрамерного фермента.[10]
Первичный сайт связывания на фумаразе известен как каталитический сайт A. Исследования показали, что каталитический сайт A состоит из аминокислотных остатков трех из четырех субъединиц тетрамерного фермента. Два потенциальных кислотно-основных каталитических остатка в реакции включают His 188 и Lys 324.[6][7][8]
Подтипы
Есть два класса фумаразов.[11] Классификация зависит от расположения соответствующих субъединиц, требований к металлу и их термической стабильности. К ним относятся класс I и класс II. Фумаразы класса I способны изменять состояние или становиться неактивными под воздействием тепла или излучения, чувствительны к супероксид-аниону, зависят от железа II (Fe2 +) и представляют собой димерные белки, состоящие из примерно 120 кДа. Фумаразы класса II, обнаруженные как у прокариот, так и у эукариот, представляют собой тетрамерные ферменты с плотностью 200 000 дптр, которые содержат три отдельных сегмента существенно гомологичных аминокислот. Они также не зависят от железа и термостабильны. Известно, что прокариоты имеют три различные формы фумаразы: фумараза A, фумараза B и фумараза C. Фумараза C является частью фумаразы класса II, тогда как фумараза A и фумараза B из кишечная палочка (Кишечная палочка) относятся к классу I.[10]
Клиническое значение
Дефицит фумаразы характеризуется многоводие и аномалии мозга плода. В период новорожденности обнаруживаются тяжелые неврологические нарушения, плохое питание, задержка развития и гипотония. Дефицит фумаразы подозревается у младенцев с множественными тяжелыми неврологическими отклонениями в отсутствие острого метаболического кризиса. Потенциальными причинами могут быть неактивность цитозольной и митохондриальной форм фумаразы. Изолированная, повышенная концентрация фумаровая кислота Анализ мочи на органическую кислоту свидетельствует о дефиците фумаразы. В настоящее время доступно молекулярно-генетическое тестирование на дефицит фумаразы.[11]
Фумараза распространена как в тканях плода, так и в тканях взрослого человека. Большой процент фермента выражается в кожа, паращитовидная железа, лимфа, и двоеточие. Мутации в производстве и развитии фумаразы привели к открытию нескольких связанных с фумаразой заболеваний у людей. К ним относятся доброкачественный мезенхимальный опухоли матки, лейомиоматоз и почечная клетка карцинома, и дефицит фумаразы. Зародышевые мутации в фумаразе связаны с двумя различными состояниями. Если у фермента промах мутации и делеции в рамке считывания с 3 ’конца, приводит к дефициту фумаразы. Если он содержит гетерозиготный 5 ’миссенс-мутация и делеции (от одной пары оснований до целого гена), затем лейомиоматоз и почечно-клеточная карцинома / синдром Рида (множественные кожные и матка лейомиоматоз ) могло произойти.[10][11]
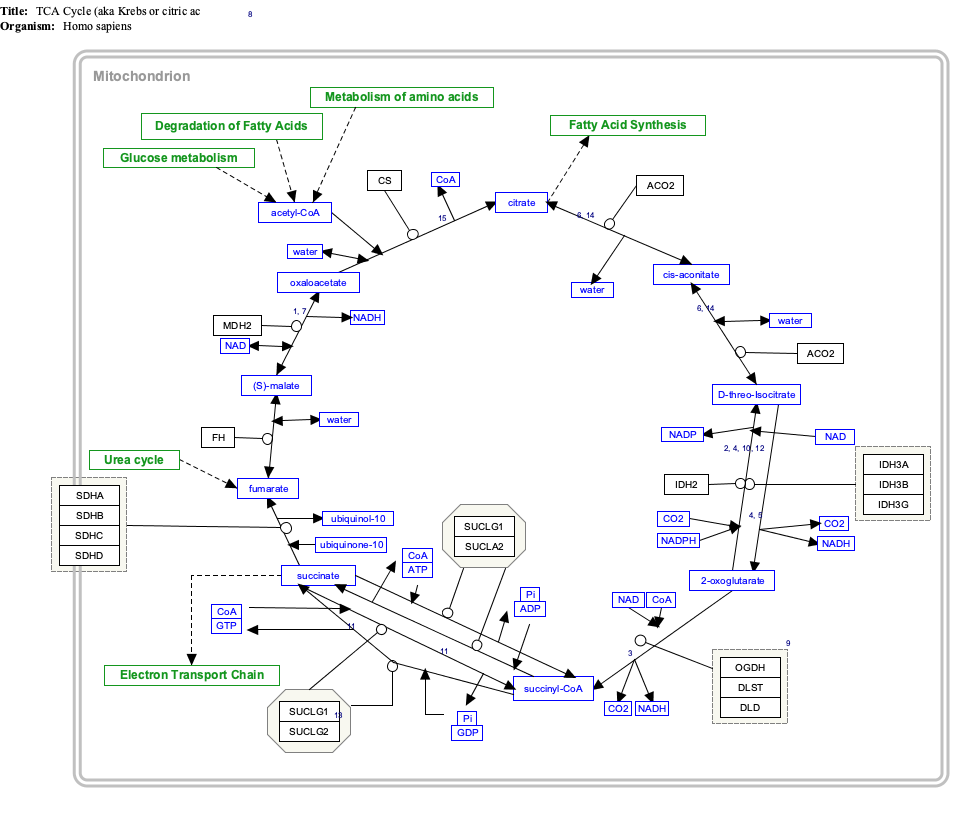
Интерактивная карта проезда
Нажмите на гены, белки и метаболиты ниже, чтобы ссылки на соответствующие статьи. [§ 1]
- ^ Интерактивную карту путей можно редактировать на WikiPathways: "TCACycle_WP78".
Смотрите также
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000091483 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ FH (фумаратгидратаза)
- ^ Уивер Т. (октябрь 2005 г.). «Структура свободной фумаразы С из Escherichia coli». Acta Crystallogr. D. 61 (Pt 10): 1395–401. Дои:10.1107 / S0907444905024194. PMID 16204892.
- ^ а б c Гегемония А.Д., Фрей П.А. (2007). Механизмы ферментативных реакций. Оксфорд [Оксфордшир]: Издательство Оксфордского университета. ISBN 978-0-19-512258-9.
- ^ а б Бегли Т.П., Макмерри Дж. (2005). Органическая химия биологических путей. Робертс и Ко. Издатели. ISBN 978-0-9747077-1-6.
- ^ а б Уолш C (1979). Механизмы ферментативных реакций. Сан-Франциско: В. Х. Фриман. ISBN 978-0-7167-0070-8.
- ^ Йогев О., Наамати А., Сосны О. (2011). «Фумараза: парадигма двойного нацеливания и двойных локализованных функций». Журнал FEBS. 278 (22): 4230–42. Дои:10.1111 / j.1742-4658.2011.08359.x. PMID 21929734.
- ^ а б c Эстевес М., Скарда Дж., Спенсер Дж., Банашак Л., Уивер TM (июнь 2002 г.). «Рентгеновская кристаллографическая и кинетическая корреляция клинически наблюдаемой фумаразной мутации человека». Белковая наука. 11 (6): 1552–7. Дои:10.1110 / л.с. 0201502. ЧВК 2373640. PMID 12021453.[постоянная мертвая ссылка ]
- ^ а б c Линч А.М., Мортон С.К. (01.07.2006). «FH (фумаратгидратаза)». Атлас генетики и цитогенетики в онкологии и гематологии.
внешняя ссылка
- Фумараза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Структура фумарата
- Структура S-малата
- Связь с нарушением цикла лимонной кислоты
- Видео с фумаратом → (S) L-малат