Митохондриальный матрикс - Mitochondrial matrix
| Клеточная биология | |
|---|---|
| В митохондрия | |
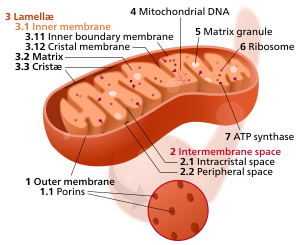 Компоненты типичной митохондрии
3 Ламели
4 Митохондриальная ДНК |
в митохондрия, то матрица пространство внутри внутренней мембраны. Слово «матрица» происходит от того факта, что это пространство вязкое по сравнению с относительно водной цитоплазмой. Митохондриальный матрикс содержит митохондрии. ДНК, рибосомы, растворимый ферменты, небольшие органические молекулы, нуклеотид кофакторы и неорганические ионы.[1] Ферменты в матрице облегчают реакции, ответственные за производство АТФ, такой как цикл лимонной кислоты, окислительного фосфорилирования, окисление пируват, а бета-окисление жирных кислот.[1]
Состав матрицы, основанный на ее структурах и содержании, создает среду, которая позволяет анаболический и катаболический пути, по которым следует двигаться вперед. В электронная транспортная цепь и ферменты в матрице играют большую роль в цикл лимонной кислоты и окислительного фосфорилирования. В цикл лимонной кислоты производит НАДН и FADH2 за счет окисления, которое будет уменьшено в окислительного фосфорилирования производить АТФ.[2][3]
Цитозольная, межмембранное пространство, отсек имеет содержание воды 3,8 мкл / мг белка, а митохондриальный матрикс 0,8 мкл / мг белка.[4] Неизвестно, как митохондрии поддерживают осмотический баланс через внутреннюю митохондриальную мембрану, хотя мембрана содержит аквапорины которые считаются каналом регулируемого водного транспорта. Митохондриальный матрикс имеет pH около 7,8, что выше, чем pH межмембранного пространства митохондрий, который составляет около 7,0–7,4.[5] Митохондриальная ДНК была открыта Нэшем и Маргит в 1963 году. В митохондриальном матриксе присутствует от одной до многих двухцепочечных, в основном кольцевых, ДНК. Митохондриальная ДНК составляет 1% от общей ДНК клетки. Он богат гуанин и цитозин содержание. Митохондрии млекопитающих содержат рибосомы 55s.
Сочинение
Метаболиты
Матрица содержит большое количество различных метаболиты вовлечены в процессы внутри матрицы. В цикл лимонной кислоты вовлекает ацил-КоА, пируват, ацетил-КоА, цитрат, изоцитрат, α-кетоглутарат, сукцинил-КоА, фумарат, сукцинат, L-малат, и оксалоацетат.[2] В цикл мочевины использует [[орнитинL-орнитин]], карбамоилфосфат, и L-цитруллин.[4] Цепь переноса электронов окисляет коферменты НАДН и FADH2. В синтезе белка используются митохондриальные ДНК, РНК, и тРНК.[5] Регулирование процессов использует ионы (Ca2+ /K+ /Mg+ ).[6] Дополнительные метаболиты, присутствующие в матрице: CO2, ЧАС2О, О2, АТФ, ADP, и пя.[1]
Ферменты
Ферменты из процессов, происходящих в матрице. Циклу лимонной кислоты способствует пируватдегидрогеназа, цитрат-синтаза, аконитаза, изоцитратдегидрогеназа, α-кетоглутаратдегидрогеназа, сукцинил-КоА синтетаза, фумараза, и малатдегидрогеназа.[2] Циклу мочевины способствует карбамоилфосфатсинтетаза I и орнитин-транскарбамилаза.[4] β-Окисление использует пируваткарбоксилаза, ацил-КоА дегидрогеназа, и β-кетотиолаза.[1] Производству аминокислот способствует трансаминазы.[7] Аминокислотный метаболизм опосредуется протеазы, Такие как предследовательная протеаза[8].
Компоненты внутренней мембраны
Внутренняя мембрана представляет собой фосфолипидный бислой содержащий комплексы окислительного фосфорилирования. который содержит электронная транспортная цепь что находится на кристы внутренней мембраны и состоит из четырех белковых комплексов и АТФ-синтаза. Эти комплексы комплекс I (НАДН: кофермент Q оксидоредуктаза), комплекс II (сукцинат: коэнзим Q оксидоредуктаза), комплекс III (коэнзим Q: цитохром с оксидоредуктаза) и комплекс IV (цитохром с оксидаза).[6]
Контроль внутренней мембраны над составом матрицы
Цепь переноса электронов отвечает за установление pH и электрохимический градиент что облегчает производство АТФ за счет перекачки протонов. Градиент также обеспечивает контроль концентрации ионов, таких как Ca2+ управляется митохондриальным мембранным потенциалом.[1] Мембрана допускает только неполярные молекулы, такие как CO2 и О2 и небольшие незаряженные полярные молекулы, такие как ЧАС2О для входа в матрицу. Молекулы входят и выходят из митохондриального матрикса через транспортные белки и ионные транспортеры. Затем молекулы могут покидать митохондрии через порин.[9] Эти приписываемые характеристики позволяют контролировать концентрации ионы и метаболиты необходим для регулирования и определяет скорость производства АТФ.[10][11]
Процессы
Цикл лимонной кислоты
После гликолиза цикл лимонной кислоты активируется путем производства ацетил-КоА. Окисление пируват пируватдегидрогеназой в матрице производит CO2, ацетил-КоА и НАДН. Бета-окисление жирных кислот служит альтернативой катаболический путь, который производит ацетил-КоА, НАДН и FADH2.[1] Производство ацетил-КоА запускает цикл лимонной кислоты, в то время как коферменты произведенные используются в электронная транспортная цепь.[11]

Все ферменты для цикла лимонной кислоты находятся в матрице (например, цитрат-синтаза, изоцитратдегидрогеназа, α-кетоглутаратдегидрогеназа, фумараза, и малатдегидрогеназа ) кроме сукцинатдегидрогеназа который находится на внутренней мембране и является частью белка комплекс II в электронная транспортная цепь. Цикл производит коферменты НАДН и ФАДН.2 за счет окисления углерода в двух циклах. Окисление НАДН и ФАДН2 производит GTP из сукцинил-CoA синтетазы.[2]
Окислительного фосфорилирования
НАДН и FADH2 производятся в матриксе или транспортируются через порин и транспортные белки, чтобы подвергнуться окислению посредством окислительного фосфорилирования.[1] НАДН и ФАД2 подвергаются окислению в цепи переноса электронов, передавая электроны возродить НАД+ и FAD. Протоны втягиваются в межмембранное пространство энергией электронов, проходящих через цепь переноса электронов. Наконец, четыре электрона принимаются кислородом в матрице, чтобы завершить цепочку переноса электронов. Протоны возвращаются в митохондриальный матрикс через белок. АТФ-синтаза.Энергия используется для вращения АТФ-синтазы, которая облегчает прохождение протона, производящего АТФ. Разница pH между матрицей и межмембранным пространством создает электрохимический градиент, с помощью которого АТФ-синтаза может благоприятно пропускать протон в матрицу.[6]
Цикл мочевины
Первые две стадии цикла мочевины происходят в митохондриальном матриксе клеток печени и почек. На первом этапе аммиак превращается в карбамоилфосфат за счет вложения двух молекул АТФ. Этому шагу способствует карбамоилфосфатсинтетаза I. Второй шаг облегчен орнитин-транскарбамилаза обращает карбамоилфосфат и орнитин в цитруллин. После этих начальных шагов цикл мочевины продолжается во внутреннем пространстве мембраны до тех пор, пока орнитин снова не войдет в матрицу через транспортный канал, чтобы продолжить первые шаги внутри матрицы.[12]
Трансаминирование
α-кетоглутарат и оксалоацетат могут быть преобразованы в аминокислоты в матрице в процессе трансаминирование. Эти реакции облегчаются трансаминазами, чтобы производить аспартат и аспарагин из оксалоацетата. Трансаминирование α-кетоглутарата дает глутамат, пролин, и аргинин. Эти аминокислоты затем используются либо внутри матрикса, либо транспортируются в цитозоль для производства белков.[7][13]
Регулирование
Регуляция в матрице в первую очередь контролируется концентрацией ионов, концентрацией метаболитов и энергетическим зарядом. Наличие таких ионов, как Ca2+ контроль различные функции цикла лимонной кислоты. в матрице активирует пируватдегидрогеназа, изоцитратдегидрогеназа, и α-кетоглутаратдегидрогеназа что увеличивает скорость реакции в цикле.[14] Концентрация промежуточных продуктов и коферментов в матрице также увеличивает или уменьшает скорость производства АТФ из-за анаплеротический и катаплеротические эффекты. НАДН может действовать как ингибитор за α-кетоглутарат, изоцитратдегидрогеназа, цитрат-синтаза, и пируватдегидрогеназа. Концентрация оксалоацетата, в частности, поддерживается на низком уровне, поэтому любые колебания этой концентрации служат для ускорения цикла лимонной кислоты.[2] Производство АТФ также служит средством регулирования, действуя как ингибитор изоцитратдегидрогеназы, пируватдегидрогеназы, белковых комплексов цепи переноса электронов и АТФ-синтазы. ADP действует как активатор.[1]
Синтез белка
Митохондрии содержат собственный набор ДНК, используемый для производства белков, входящих в цепь переноса электронов. Митохондриальная ДНК кодирует только около тринадцати белков, которые используются при обработке митохондриальных транскриптов, рибосомальные белки, рибосомная РНК, переносить РНК, и белковые субъединицы найдено в белковые комплексы цепи переноса электронов.[15][16]
Смотрите также
Рекомендации
- ^ а б c d е ж грамм Воет, Дональд; Воет, Джудит; Пратт, Шарлотта (2013). Основы биохимии жизни на молекулярном уровне. Нью-Йорк: John Wiley & Sons, Inc., стр. 582–584. ISBN 978-1118129180.
- ^ а б c d е Страйер, L; Берг, Дж; Тимочко, JL (2002). Биохимия. Сан-Франциско: W.H. Фримен. С. 509–527, 569–579, 614–616, 638–641, 732–735, 739–748, 770–773. ISBN 978-0-7167-4684-3.
- ^ Митчелл, Питер; Мойл, Дженнифер (1967-01-14). «Хемиосмотическая гипотеза окислительного фосфорилирования». Природа. 213 (5072): 137–139. Дои:10.1038 / 213137a0. PMID 4291593.
- ^ а б c Соболь, S; Scholz, R; Freisl, M; Elbers, R; Heldt, H.W. (1976). Распределение метаболитов между митохондриями и цитозолем перфузированной печени. Нью-Йорк: Эльзевир. С. 29–40. ISBN 978-0-444-10925-5.
- ^ а б Порселли, Анна-Мария; Гелли, Анна; Занна, Клаудия; Пинтон, Паоло; Риццуто, Росарио; Руголо, Микела (28 января 2005). «Разница pH на внешней митохондриальной мембране, измеренная с помощью мутанта зеленого флуоресцентного белка». Сообщения о биохимических и биофизических исследованиях. 326 (4): 799–804. Дои:10.1016 / j.bbrc.2004.11.105. PMID 15607740.
- ^ а б c Dimroth, P .; Kaim, G .; Матти, У. (1 января 2000 г.). «Решающая роль мембранного потенциала для синтеза АТФ с помощью F (1) F (o) АТФ-синтаз». Журнал экспериментальной биологии. 203 (Пт 1): 51–59. ISSN 0022-0949. PMID 10600673.
- ^ а б Кармен, А .; Wroblewski, F .; Ладью, Дж. С. (1955-01-01). «Активность трансаминаз в крови человека». Журнал клинических исследований. 34 (1): 126–131. Дои:10.1172 / JCI103055. ISSN 0021-9738. ЧВК 438594. PMID 13221663.
- ^ Кинг, Джон V .; Liang, Wenguang G .; Scherpelz, Kathryn P .; Шиллинг, Александр Б .; Мередит, Стивен С .; Тан, Вэй-Джен (2014-07-08). «Молекулярная основа распознавания и деградации субстрата протеазой предпоследовательности человека». Структура (Лондон, Англия: 1993). 22 (7): 996–1007. Дои:10.1016 / j.str.2014.05.003. ISSN 1878-4186. ЧВК 4128088. PMID 24931469.
- ^ Альбертс, Брюс; Джонсон, Александр; Льюис, Джулиан; Робертс, Кейт; Питерс, Уолтер; Рафф, Мартин (1994). Молекулярная биология клетки. Нью-Йорк: Garland Publishing Inc. ISBN 978-0-8153-3218-3.
- ^ Андерсон, С .; Банкир, А. Т .; Barrell, B.G .; de Bruijn, M.H.L .; Coulson, A.R .; Drouin, J .; Eperon, I.C .; Nierlich, D. P .; Роу, Б.А. (1981-04-09). «Последовательность и организация митохондриального генома человека». Природа. 290 (5806): 457–465. Дои:10.1038 / 290457a0. PMID 7219534.
- ^ а б Iuchi, S .; Лин, Э. К. (1993-07-01). «Адаптация Escherichia coli к окислительно-восстановительной среде путем экспрессии генов». Молекулярная микробиология. 9 (1): 9–15. Дои:10.1111 / j.1365-2958.1993.tb01664.x. ISSN 1365-2958. PMID 8412675.
- ^ Тухман, Мендель; Плант, Роберт Дж. (1995-01-01). «Мутации и полиморфизмы в гене орнитин-транскарбамилазы человека: дополнение к обновлению мутации». Человеческая мутация. 5 (4): 293–295. Дои:10.1002 / humu.1380050404. ISSN 1098-1004. PMID 7627182.
- ^ Кирш, Джек Ф .; Эйхеле, Грегор; Форд, Джеффри Ч .; Винсент, Майкл Дж .; Янсониус, Йохан Н.; Геринг, Хайнц; Кристен, Филипп (1984-04-15). «Механизм действия аспартатаминотрансферазы предложен на основе ее пространственной структуры». Журнал молекулярной биологии. 174 (3): 497–525. Дои:10.1016/0022-2836(84)90333-4. PMID 6143829.
- ^ Дентон, Ричард М .; Randle, Филип Дж .; Бриджес, Барбара Дж .; Купер, Рональд Х .; Kerbey, Alan L .; Паск, Елена Т .; Северсон, Дэвид Л .; Стэнсби, Дэвид; Уайтхаус, Сьюзен (1975-10-01). «Регулирование пируватдегидрогеназы млекопитающих». Молекулярная и клеточная биохимия. 9 (1): 27–53. Дои:10.1007 / BF01731731. ISSN 0300-8177. PMID 171557.
- ^ Фокс, Томас Д. (2012-12-01). «Синтез, импорт и сборка митохондриального белка». Генетика. 192 (4): 1203–1234. Дои:10.1534 / генетика.112.141267. ISSN 0016-6731. ЧВК 3512135. PMID 23212899.
- ^ Grivell, L.A .; Пел, Х.Дж. (1994). «Синтез белка в митохондриях» (PDF). Мол. Биол. Представитель. 19 (3): 183–194. Дои:10.1007 / bf00986960.
