Карцинома почек - Renal cell carcinoma
| Карцинома почек | |
|---|---|
 | |
| Микрофотография наиболее распространенного типа карцинома почек (прозрачная ячейка) - справа от изображения; неопухолевая почка находится слева от изображения. Образец нефрэктомии. H&E пятно | |
| Специальность | Онкология |
Карцинома почек (RCC) это рак почки что происходит в подкладке проксимальный извитый каналец, часть очень маленьких трубок в почках, по которым проходит первичная моча. ПКР - наиболее распространенный тип рака почек у взрослых, на который приходится примерно 90–95% случаев.[1] Возникновение ПКР показывает преобладание мужчин над женщинами в соотношении 1,5: 1. ПКР чаще всего возникает между 6 и 7 десятилетием жизни.[2]
Первоначальное лечение чаще всего заключается в частичном или полном удалении пораженной почки (ей).[3] Если рак не метастазировал (не распространился на другие органы) или не проник глубже в ткани почек, пятилетняя выживаемость составляет 65–90%,[4] но он значительно снижается, когда рак распространился.
Организм замечательно умеет скрывать симптомы, и в результате люди с ПКР часто уже имеют запущенное заболевание к тому времени, когда оно обнаруживается.[5] Начальные симптомы ПКР часто включают: кровь в моче (встречается у 40% пострадавших при первом обращении за медицинской помощью), боль в боку (40%), образование в животе или боках (25%), потеря веса (33%), лихорадка (20%), высокое кровяное давление (20%), ночная потливость и в целом плохое самочувствие.[1] При метастазировании ПКР он чаще всего распространяется на лимфатический узел, легкие, печень, надпочечники, мозг или кости.[6] Иммунотерапия и таргетная терапия улучшили прогноз метастатического ПКР.[7][8]
RCC также связан с рядом паранеопластические синдромы (ПНС), которые являются состояниями, вызванными либо гормонами, вырабатываемыми опухолью, либо атакой организма на опухоль, и присутствуют примерно у 20% пациентов с ПКР.[1] Эти синдромы чаще всего поражают ткани, не пораженные раком.[1] Наиболее распространенные ПНС у людей с ПКР: высокий уровень кальция в крови, высокое количество эритроцитов, высокое количество тромбоцитов и вторичный амилоидоз.[6]
Признаки и симптомы
Исторически сложилось так, что практикующие врачи ожидали, что человек представит три результата. Эта классическая триада[9] равно 1: гематурия, то есть когда в моче присутствует кровь, 2: боль в боку, то есть боль по бокам тела между бедром и ребрами, и 3: образование в брюшной полости, похожее на вздутие живота, но больше. В настоящее время известно, что эта классическая триада симптомов встречается только в 10–15% случаев и обычно указывает на запущенную стадию почечно-клеточного рака (ПКР).[9] Сегодня ПКР часто протекает бессимптомно (то есть симптомы практически отсутствуют) и обычно выявляется случайно, когда человека обследуют на предмет других заболеваний.[10]
Другие признаки и симптомы могут включать: гематурия;[9] боль в пояснице;[9] брюшная масса;[10] недомогание, что является общим недомоганием;[10] потеря веса и / или потеря аппетита;[11] анемия в результате депрессии эритропоэтин;[9] эритроцитоз (увеличение производства красные кровяные тельца ) из-за повышенной секреции эритропоэтина;[9] варикоцеле, который проявляется у мужчин как увеличение лозовидного сплетения вен, дренирующих яичко (чаще левого яичка)[10] гипертония (высокое кровяное давление) в результате секреции ренин опухолью;[12] гиперкальциемия, то есть повышение уровня кальция в крови;[13] нарушение сна или ночная потливость;[11] повторяющийся лихорадка;[11] и хроническая усталость.[14]
Факторы риска
Стиль жизни
Наибольшие факторы риска ПКР связаны с образом жизни; курение, ожирение и гипертония (высокое кровяное давление), по оценкам, составляет до 50% случаев.[15]Воздействие на рабочем месте некоторых химических веществ, таких как асбест, кадмий, свинец, хлорированные растворители, нефтехимические вещества и ПАУ (полициклический ароматический углеводород ) был изучен в нескольких исследованиях с неубедительными результатами.[16][17][18]Еще один предполагаемый фактор риска - длительное использование нестероидные противовоспалительные препараты (НПВП).[19]
Наконец, исследования показали, что женщины, у которых гистерэктомия риск развития ПКР более чем в два раза выше, чем у тех, кто этого не сделал.[20] С другой стороны, умеренное употребление алкоголя оказывает защитное действие.[21] Причина этого остается неясной.
Генетика
Наследственные факторы оказывают незначительное влияние на индивидуальную восприимчивость, а ближайшие родственники людей с ПКР имеют в два-четыре раза повышенный риск развития этого состояния.[22] Другие генетически связанные состояния также увеличивают риск ПКР, в том числе: наследственная папиллярная карцинома почек, наследственный лейомиоматоз, Синдром Бирта – Хогга – Дуба, синдром гиперпаратиреоза-опухоли челюсти, семейный папиллярная карцинома щитовидной железы, болезнь фон Гиппеля – Линдау[23] и серповидноклеточная анемия.[24]
Однако наиболее значимое заболевание, влияющее на риск, не связано генетически - пациенты с приобретенным кистозный Заболевания почек, требующие диализа, в 30 раз чаще, чем население в целом, развивают ПКР.[25]
Патофизиология
Опухоль возникает из клеток проксимальный почечный канальцевый эпителий.[1] Это считается аденокарцинома.[6] Выделяют два подтипа: спорадический (то есть ненаследственный) и наследственный.[1] Оба этих подтипа связаны с мутациями короткого плеча хромосома 3, при этом задействованные гены являются либо генами-супрессорами опухоли (ВХЛ и TSC ) или онкогены (например, c-Met ).[1]
Диагностика
Первыми шагами, предпринимаемыми для диагностики этого состояния, являются рассмотрение признаков и симптомов, а также история болезни (подробный медицинский обзор прошлого состояния здоровья) для оценки любых факторов риска. Исходя из представленных симптомов, ряд биохимический тесты (с использованием образцов крови и / или мочи) также могут рассматриваться как часть процесса скрининга, чтобы обеспечить достаточный количественный анализ любых различий в электролиты, функция почек и печени и время свертывания крови.[24] При физическом осмотре пальпация живота может выявить образование или увеличение органа.[26]
Хотя это заболевание не охарактеризовано на ранних стадиях развития опухоли, оно основано на различных клинических проявлениях, а также устойчивости к радиация и химиотерапия важные. Основными диагностическими инструментами для выявления почечно-клеточного рака являются: УЗИ, компьютерная томография (КТ) сканирование и магнитно-резонансная томография (МРТ) почек.[27]
Классификация
Почечно-клеточная карцинома (ПКР) - это не единое целое, а скорее совокупность различных типов опухоли, каждая из которых происходит от различных частей нефрон (эпителий или же почечные канальцы ) и обладающие отчетливыми генетическими характеристиками, гистологический особенности и, в некоторой степени, клинические фенотипы.[24]
| Классификация обыкновенных Гистологический Подтипы почечно-клеточной карциномы[24] | |||
|---|---|---|---|
| Подтип почечно-клеточной карциномы | Частота | Генетические аномалии | Характеристики |
Светлоклеточная почечно-клеточная карцинома (CCRCC)  Обычно клетки имеют четкое цитоплазма, окружены отчетливым клеточная мембрана и содержать круглые и однородные ядра. | 60–70% |
|
|
Папиллярная почечно-клеточная карцинома (PRCC)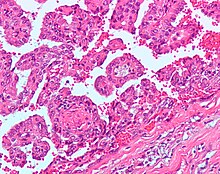 PRCC типа 1 состоит из сосочки покрытые одинарным или двойным слоем мелких кубовидные ячейки с мизерным цитоплазма и PRCC типа 2 состоят из сосочков, покрытых большими эозинофильный ячейки расположены нерегулярно или псевдостратифицированный манера. | 10–15% |
|
|
Хромофоб Почечно-клеточная карцинома (ChRCC) ChRCC состоит из опухолевых клеток с большим количеством эозинофильный цитоплазма (бледные клетки и эозинофильные клетки с перинуклеарным ореолом) и имеют в основном твердую структуру. | 3–5% |
|
|
| Клинические, патологические и генетические особенности необычных подтипов ПКР, включенные в Классификацию патологии ПКР ВОЗ 2004 г.[29][32] | ||||
|---|---|---|---|---|
| Подтип ПКР | Клинические признаки | Характеристики клеток / тканей | Генетика | Прогноз |
| Мультилокулярный кистозный ПКР |
| Прозрачный цитоплазма, маленький темный ядра | Делеция 3p, наблюдаемая при CCRCC |
|
| Карцинома собирательных протоков Беллини |
| Высококачественные опухолевые клетки с эозинофильный цитоплазма | Различные результаты: LOH на хромосомах 1q, 6p, 8p, 9p, 13q, 19q32 и 21q; амплификация c-erB2, связанная с неблагоприятным исходом |
|
| Медуллярная карцинома |
| Кровотечение и некроз, опухолевые клетки высокой степени злокачественности с эозинофильной цитоплазмой | Не четко определено |
|
| Xp11.2 Транслокационная карцинома |
|
| Хромосомная транслокация с участием TFE3 ген на Xp11.2, что приводит к чрезмерное выражение белка TFE3 |
|
| Муцинозный канальцевый веретеноклеточный рак |
| Канальцы внеклеточные муцин и веретенообразные клетки | Не четко определено; Сообщается о потерях хромосом 1, 4, 6, 8, 9, 11, 13, 14, 15, 18, 22; Изменения 3p и увеличение хромосомы 7 и 17 отсутствуют |
|
| Постнейробластома почечно-клеточная карцинома |
| Эозинофильные клетки с онкоцитоид функции (такие же, как CCRCC) | Не четко определено; Потеря нескольких хромосом места наблюдаемый | Подобен другим распространенным подтипам ПКР |
Кариотипирование на основе массива может использоваться для выявления характерных хромосомных аберраций в опухолях почек со сложной морфологией.[33][34] Кариотипирование на основе массива хорошо работает с парафиновыми опухолями[35] и поддается рутинному клиническому применению. Смотрите также Виртуальный кариотип для лабораторий, сертифицированных CLIA, предлагающих массивное кариотипирование солидных опухолей.
2004 год Всемирная организация здоровья (ВОЗ) классификация опухолей мочеполовой системы распознает более 40 подтипов новообразования почек. С момента публикации последней версии классификации ВОЗ в 2004 году было описано несколько новых подтипов опухолей почек:[36]
- Светлоклеточный папиллярный почечно-клеточный рак и Светлоклеточная почечно-клеточная карцинома со стромой гладких мышц[37]
- Муцинозная трубчатая и веретено-клеточная карцинома (МЦСС) [36]
- Мультилокулярная кистозно-светлоклеточная почечно-клеточная карцинома [36]
- Тубуло-кистозная почечно-клеточная карцинома
- Фолликулярная почечно-клеточная карцинома тироидоподобного типа
- Приобретенная почечно-клеточная карцинома, связанная с кистозной болезнью почек
- Почечно-клеточная карцинома с транслокацией t (6; 11) (TFEB)
- Гибридная онкоцитома / хромофобная почечно-клеточная карцинома
- Наследственный лейомиоматоз и почечно-клеточный рак (HLRCC)
Лабораторные тесты
Лабораторные анализы обычно проводятся при появлении у пациента признаков и симптомов, которые могут быть характерными для почечной недостаточности. Они не используются в первую очередь для диагностики рака почек из-за его бессимптомный природы и обычно обнаруживаются случайно во время тестов на другие болезни, такие как желчный пузырь болезнь.[38] Другими словами, эти виды рака обычно не обнаруживаются, потому что они не вызывают боли или дискомфорта при обнаружении. Лабораторный анализ может дать оценку общего состояния здоровья пациента и может предоставить информацию для определения стадии и степени метастаз на другие части тела (если почечный поражение был идентифицирован) до начала лечения.
Анализ мочи
Наличие крови в моче - частый предполагаемый признак почечно-клеточного рака. В гемоглобин Из-за крови моча становится ржавой, коричневой или красной. В качестве альтернативы, анализ мочи может проверить на сахар, белок и бактерии которые также могут служить индикаторами для рак. Полный анализ клеток крови также может предоставить дополнительную информацию о тяжести и распространении рак.[39]
Полный подсчет клеток крови
Общий анализ крови обеспечивает количественную оценку различных клеток в образце цельной крови пациента. К таким клеткам, исследуемым в этом тесте, относятся эритроциты (эритроциты ), белые кровяные клетки (лейкоциты ) и тромбоциты (тромбоциты ). Распространенным признаком почечно-клеточного рака является анемия в результате чего у пациента наблюдается дефицит красных кровяных телец.[40] Анализы CBC имеют жизненно важное значение как инструмент скрининга для проверки здоровья пациента перед операцией. Несоответствие количества тромбоцитов также часто встречается среди этих онкологических больных и при проведении дополнительных тестов на коагуляцию, включая Скорость оседания эритроцитов (СОЭ), протромбиновое время (ПВ), Активированное частичное тромбопластиновое время (APTT) следует учитывать.
Химия крови
Биохимические анализы крови проводятся при подозрении на почечно-клеточную карциному. рак может повышать уровень определенных химических веществ в крови. Например, печень ферменты Такие как аспартатаминотрансфераза [Стенд аланинаминотрансфераза [ALT] находятся на аномально высоком уровне.[41] Стадия рака также может быть определена по аномально повышенному уровню кальция, что позволяет предположить, что рак мог метастазировать в кости.[42] В этом случае следует попросить врача сделать компьютерную томографию. Биохимические анализы крови также позволяют оценить общую функцию почек и могут позволить врачу принять решение о дальнейших радиологических исследованиях.
Радиология
Характерным проявлением почечно-клеточного рака (ПКР) является твердое поражение почек, которое нарушает контур почек. Это часто будет иметь неправильный или дольчатый край и может быть замечено как шишка в нижней части таза или в области живота. Традиционно от 85 до 90% твердых образований в почках оказывается ПКР, но кистозные образования почек также могут быть вызваны ПКР.[43] Однако развитие диагностических методов позволяет случайно диагностировать большую часть пациентов с поражениями почек, которые могут казаться небольшими по размеру и доброкачественными. Десять процентов RCC будет содержать кальцификации, а некоторые содержат макроскопический жир (вероятно, из-за инвазии околопочечной жировой клетчатки).[44]Принятие решения о доброкачественный или же злокачественный Природа почечного образования на основе его локализованного размера является проблемой, поскольку почечно-клеточная карцинома также может быть кистозной. Поскольку существует несколько доброкачественных кистозных поражений почек (простая киста почек, геморрагический киста почек, мультилокулярная кистозная нефрома, поликистоз почек ), иногда радиологу может быть трудно дифференцировать доброкачественный кистозное поражение от злокачественного.[45] Система классификации Боснийской кисты почек поражения классифицирует их на группы, которые доброкачественный и те, кому нужно хирургическая резекция, основанный на определенных функциях изображения.[46]
Основными методами визуализации, выполняемыми для выявления почечно-клеточного рака, являются КТ органов малого таза и брюшной полости, ультразвуковые исследования почек (УЗИ), МРТ, внутривенная пиелограмма (ВВП) или почечная ангиография.[47] Среди этих основных диагностических тестов другие радиологические тесты, такие как экскреторные урография, позитронно-эмиссионная томография (ПЭТ) сканирование, ультразвуковая эхография, артериография, венография, и сканирование костей также может быть использовано для помощи в оценке стадий почечных масс и для дифференциации доброкачественных опухолей от злокачественных опухолей.
Компьютерная томография
С повышенной контрастностью компьютерная томография (КТ) сканирование обычно используется для определения стадии почечно-клеточного рака в брюшной и тазовый регионы. Компьютерная томография может отличать твердые образования от кистозных и может предоставить информацию о локализации, стадии или распространении рака на другие органы пациента. Ключевые части человеческого тела, которые исследуются на предмет метастатический вовлечение почечно-клеточной карциномы может включать почечная вена, лимфатический узел и участие нижняя полая вена.[48] Согласно исследованию, проведенному Sauk et al., Характеристики мультидетекторной компьютерной томографии находят применение в диагностике пациентов со светлоклеточной карциномой почек, отображая различия этих клеток на цитогенном уровне.[49]
УЗИ
Ультрасонографическое исследование может быть полезно при оценке сомнительных бессимптомный почка опухоли и кистозная почечная поражения если Компьютерная томография изображения неубедительны. Эта безопасная и неинвазивная радиологическая процедура использует высокочастотные звуковые волны для создания внутреннего изображения тела на мониторе компьютера. Изображение, созданное УЗИ может помочь диагностировать почечно-клеточную карциному на основании различий звуковых отражений на поверхности органов и аномальных масс тканей. По сути, ультразвуковые тесты могут определить, является ли состав почек в основном твердым или заполненным жидкостью.[47]
А Чрескожная биопсия может быть выполнено рентгенологом с использованием ультразвука или компьютерной томографии для отбора проб опухоли с целью диагностики с помощью патология. Однако это обычно не выполняется, потому что, когда присутствуют типичные особенности визуализации почечно-клеточного рака, возможность получения неверно отрицательного результата вместе с риском медицинских осложнений для пациента может сделать его неблагоприятным с точки зрения риска и пользы.[50] Тем не менее, биопсия для молекулярного анализа, позволяющая отличить доброкачественные опухоли от злокачественных, представляет исследовательский интерес.[50]
Магнитно-резонансная томография
Магнитно-резонансная томография (МРТ) сканирование позволяет получить изображение мягких тканей тела с помощью радиоволн и сильных магнитов. МРТ можно использовать вместо КТ, если у пациента проявляется аллергия на контрастное вещество, вводимое для теста.[51][52] Иногда перед МРТ внутривенный инъекция контрастного материала, называемого гадолиний дается для получения более детального изображения. Пациентам, находящимся на диализе, или пациентам с почечной недостаточностью следует избегать этого контрастного вещества, поскольку он может вызвать редкий, но серьезный побочный эффект, известный как нефрогенный системный фиброз.[53] Сканирование костей или визуализация головного мозга обычно не выполняются, если только признаки или симптомы не указывают на возможное метастатическое поражение этих областей. Для оценки также следует рассмотреть возможность проведения МРТ. опухоль расширение, которое выросло в крупных кровеносных сосудах, включая полая вена, в брюшной полости. МРТ можно использовать для наблюдения за возможным распространением рака на мозг или же спинной мозг если у пациента появляются симптомы, указывающие на это.
Внутривенная пиелограмма
Внутривенная пиелограмма (IVP) - полезная процедура для выявления аномального образования почек в мочеиспускательный канал. Эта процедура включает инъекцию контрастного красителя в руку пациента. Краситель попадает из кровотока в почки, которые со временем попадают в почки и мочевой пузырь. В этом тесте нет необходимости, если проводилась КТ или МРТ.[54]
Почечная ангиография
Почечный ангиография использует тот же принцип, что и IVP, так как этот тип рентгеновский снимок также использует контрастный краситель. Этот рентгенологический тест важен при диагностике почечно-клеточного рака как вспомогательное средство при обследовании. кровеносный сосуд в почках. Этот диагностический тест основан на контрастном веществе, которое вводится в почечную артерию и поглощается раковыми клетками.[55] Контрастный краситель дает более четкие очертания аномально ориентированных кровеносных сосудов, предположительно связанных с опухолью. Это обязательно для хирургов, так как позволяет картировать кровеносные сосуды пациента до операции.[48]
Постановка
В постановка почечно-клеточного рака является наиболее важным фактором в прогнозировании его прогноза.[56] Постановка может следовать Промежуточная система TNM, где размер и протяженность опухоли (T), поражение лимфатических узлов (N) и метастазы (M) классифицируются отдельно. Кроме того, он может использовать общую группировку этапов в этапы I – IV, с учетом версии AJCC 1997 года, описанной ниже:[56]
| I этап | Опухоль диаметром 7 см (около 2 3/4 дюйма) или меньше, ограниченная почкой. Нет поражения лимфатических узлов или метастазов в отдаленные органы. |
| II этап | Опухоль больше 7,0 см, но все еще ограничивается почкой. Нет поражения лимфатических узлов или метастазов в отдаленные органы. |
| III стадия любой из следующих | Опухоль любого размера с поражением ближайшего лимфатического узла, но без метастазов в отдаленные органы. Опухоль на этой стадии может распространяться на жировую ткань вокруг почки или без таковой, с распространением или без распространения в крупные вены, ведущие от почки к сердцу. |
| Опухоль, которая распространяется на жировую ткань вокруг почки и / или распространяется в крупные вены, ведущие от почки к сердцу, но не распространяется на лимфатические узлы или другие органы. | |
| IV этап любой из следующих | Опухоль, которая распространилась непосредственно через жировую ткань и связочную фасцию, окружающую почку. |
| Поражение более чем одного лимфатического узла около почки | |
| Поражение любого лимфатического узла за пределами почки | |
| Отдаленные метастазы, например, в легкие, кости или мозг. |
На момент постановки диагноза 30% почечно-клеточного рака распространились на ипсилатеральную почечную вену, а 5–10% продолжились в нижнюю полую вену.[57]
Гистопатология
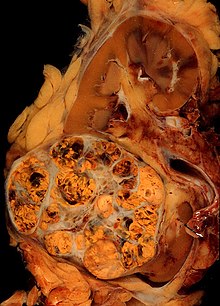

Макроскопический и микроскопический вид почечно-клеточного рака сильно различается. Почечно-клеточная карцинома может иметь покрасневшие участки, где кровеносный сосуд кровотечение и кисты, содержащие водянистую жидкость.[58] В теле опухоли видны крупные кровеносные сосуды, стенки которых состоят из раковых клеток.Общий экзамен часто показывает желтоватую многодолюбивую опухоль в почечная кора, который часто содержит зоны некроз, кровотечение и рубцевание. В контексте микроскопии существует четыре основных гистологических подтипа почечно-клеточного рака: светлоклеточный (обычный ПКР, 75%), папиллярный (15%), хромофобный (5%) и собирательный проток (2%). Саркоматоидные изменения (морфология и паттерны ИГХ, имитирующие саркому, веретенообразные клетки) могут наблюдаться при любом подтипе ПКР и связаны с более агрессивным клиническим течением и худшим прогнозом. Под световой микроскопией эти опухоль клетки могут выставлять сосочки, канальцы или гнезда, и они довольно большие, нетипичные и многоугольные.
Недавние исследования привлекли внимание к тесной связи типа раковых клеток с агрессивностью состояния. Некоторые исследования предполагают, что эти раковые клетки накапливают гликоген и липиды, их цитоплазма кажется «чистой», ядра остаются в середине клеток, а клеточная мембрана видна.[59] Некоторые клетки могут быть меньше, с эозинофильной цитоплазмой, напоминая нормальные тубулярные клетки. Строма уменьшена, но васкуляризована. Опухоль сдавливает окружающую паренхима, образуя псевдокапсулу.[60]
Наиболее распространенным типом клеток почечно-клеточного рака является чистая ячейка, который назван растворением высокого содержания липидов клеток в цитоплазме. Считается, что светлые клетки с наименьшей вероятностью распространятся и обычно более благоприятно реагируют на лечение. Однако большинство опухолей содержат смесь клеток. Считается, что наиболее агрессивной стадией рака почки является стадия смешанной опухоли, содержащей как светлые, так и гранулярные клетки.[61]
Рекомендуемой схемой гистологической классификации ПКР является система Фурмана (1982), которая представляет собой оценку, основанную на микроскопической морфологии новообразование с гематоксилин и эозин (Окрашивание H&E). Эта система классифицирует почечно-клеточную карциному на 1, 2, 3, 4 степень на основе ядерных характеристик. Подробная информация о системе оценок Fuhrman для RCC показана ниже:[62]
| Уровень оценки | Ядерные характеристики |
|---|---|
| I степень | Ядра кажутся округлыми и однородными, 10 мкм; ядрышки незаметны или отсутствуют. |
| II степень | Ядра имеют неправильный вид с признаками лопаточного образования, 15 мкм; ядрышки очевидны. |
| III степень | Ядра выглядят очень неправильными, 20 мкм; ядрышки крупные и выступающие. |
| IV степень | Ядра выглядят причудливыми и многолепестковыми, размером 20 мкм и более; ядрышки видны. |
Ядерная степень злокачественности считается одним из наиболее важных прогностических факторов у пациентов с почечно-клеточной карциномой.[24] Однако исследование Delahunt и другие. (2007) показали, что классификация Фурмана идеальна для светлоклеточной карциномы, но может не подходить для хромофобной почечно-клеточной карциномы и что стадирование рака (выполненное с помощью компьютерной томографии) является более благоприятным предиктором прогноза этого заболевания.[63] Что касается стадии рака почки, в 1976 г. была введена система классификации опухолей почек Гейдельберга как средство более полной корреляции гистопатологических характеристик с выявленными генетическими дефектами.[64]
Профилактика
Риск почечно-клеточной карциномы можно снизить, поддерживая нормальную массу тела.[65]
Управление

Тип лечения зависит от множества факторов и индивидуума, некоторые из которых включают стадию почечно-клеточной карциномы (пораженные / незатронутые органы и части тела), тип почечно-клеточной карциномы, ранее существовавшие или сопутствующие состояния и общее состояние здоровья и возраст человека.[9][66]Каждая форма лечения имеет как риски, так и преимущества; Специалист в области здравоохранения предложит наилучшие варианты, соответствующие индивидуальным обстоятельствам.
Если он распространился за пределы почек, часто в лимфатический узел, то легкие или главной вены почек, тогда используются несколько методов лечения, включая хирургическое вмешательство и лекарства. ПКР в большинстве случаев устойчив к химиотерапии и лучевой терапии, но хорошо поддается иммунотерапии интерлейкином-2 или интерфероном-альфа, биологической или таргетной терапии. На ранних стадиях предпочтительны криотерапия и хирургическое вмешательство.
Активное наблюдение
Активное наблюдение или «бдительное ожидание» становится все более распространенным явлением, поскольку обнаруживаются небольшие почечные образования или опухоли, а также у старшего поколения, когда операция не всегда подходит.[67] Активное наблюдение включает в себя выполнение различных диагностических процедур, анализов и визуализаций для отслеживания прогрессирования ПКР перед тем, как приступить к лечению с более высоким риском, например хирургическому вмешательству.[67] Это особенно полезно для пожилых людей, пациентов с сопутствующими заболеваниями и у плохих кандидатов на хирургическое вмешательство.
Хирургия
В зависимости от обстоятельств могут быть наиболее подходящими различные процедуры.
Рекомендуемое лечение почечно-клеточного рака: нефрэктомия или же частичная нефрэктомия, хирургическое удаление всей или части почки.[3] Это может включать некоторые из окружающих органов или тканей или лимфатических узлов. Если рак поражает только почки, что составляет около 60% случаев, его можно вылечить примерно в 90% случаев с помощью хирургия.
Небольшие опухоли почек (<4 см) все чаще лечат частичными методами. нефрэктомия когда возможно.[68][69][70] Большинство этих небольших образований почек проявляют вялотекущее биологическое поведение с прекрасным прогнозом.[71] Нефронсохраняющая частичная нефрэктомия используется, когда опухоль небольшая (менее 4 см в диаметре) или когда у пациента есть другие медицинские проблемы, такие как сахарный диабет или же гипертония.[9] Частичная нефрэктомия включает удаление только пораженной ткани с сохранением остальной почки, фасции Героты и регионарных лимфатических узлов. Это позволяет лучше сохранить почки по сравнению с радикальной нефрэктомией, и это может иметь положительные долгосрочные преимущества для здоровья.[72] Более крупные и сложные опухоли также могут лечить с помощью частичной нефрэктомии хирурги, имеющие большой опыт хирургии почек.[73]
Хирургический нефрэктомия может быть «радикальным», если процедура удаляет всю пораженную почку, включая Фасция Героты, то надпочечник который находится на той же стороне, что и пораженная почка, и регионарные забрюшинные лимфатические узлы одновременно.[9] Этот метод хоть и тяжелый, но эффективен. Но это не всегда целесообразно, поскольку это серьезная операция, которая содержит риск осложнений как во время, так и после операции и может иметь более длительное время восстановления.[74] Важно отметить, что другая почка должна быть полностью функциональной, и этот метод чаще всего используется, когда большая опухоль присутствует только в одной почке. В случаях, когда опухоль распространилась на почечную вену, нижнюю полую вену и, возможно, правое предсердие, эту часть опухоли также можно удалить хирургическим путем. В случаях известных метастазов хирургическая резекция почки («циторедуктивная нефрэктомия») может улучшить выживаемость.[75] а также резекция солитарного метастатического очага. Почки иногда эмболизированный перед операцией для минимизации кровопотери [76] (см. изображение).
Хирургия все чаще осуществляется через лапароскопический техники. Эта операция, обычно называемая хирургией с замочной скважиной, не имеет больших разрезов, наблюдаемых при классической радикальной или частичной нефрэктомии, но все же успешно удаляет всю или часть почки. Лапароскопическая операция связана с более коротким пребыванием в больнице и более быстрым временем восстановления, но все же существуют риски, связанные с хирургической процедурой. Их преимущество состоит в том, что они менее обременительны для пациента, а выживаемость без болезней сравнима с таковой при открытой операции.[3] При небольших экзофитных поражениях, не затрагивающих крупные сосуды или мочевыводящую систему, необходимо: частичная нефрэктомия (также называемая «хирургией по сохранению нефрона»). Это может включать временную остановку кровотока в почке на время удаления новообразования, а также охлаждение почек ледяной кашицей. Маннитол также можно вводить, чтобы ограничить повреждение почек. Обычно это делается через открытый разрез, хотя небольшие повреждения можно сделать лапароскопически с помощью робота или без него.
Лапароскопический криотерапия можно также сделать на небольших поражениях. Обычно во время лечения проводят биопсию. Интраоперационное ультразвуковое исследование может использоваться для помощи в размещении датчиков замораживания. Затем выполняются два цикла замораживания / оттаивания для уничтожения опухолевых клеток. Поскольку опухоль не удаляется, последующее наблюдение является более сложным (см. Ниже), и общие показатели безрезультатности заболевания не так хороши, как при хирургическом удалении.
Операция при метастатическом поражении: Если присутствует метастатическое заболевание, хирургическое лечение все еще может быть жизнеспособным вариантом. Радикальная и частичная нефрэктомия все еще возможна, а в некоторых случаях, если метастаз небольшой, его также можно удалить хирургическим путем.[9] Это зависит от того, на какой стадии роста и насколько далеко распространилось заболевание.
Чрескожная абляционная терапия
Чрескожный абляция терапии используют визуальное руководство радиологи для лечения локализованных опухолей, если хирургическая процедура не подходит. Хотя использование лапароскопических хирургических методов для полной нефрэктомии снизило некоторые риски, связанные с операцией,[77] Операция любого рода в некоторых случаях по-прежнему будет невозможна. Например, пожилые люди, люди, уже страдающие тяжелым нарушением функции почек, или люди, у которых несколько сопутствующие заболевания, хирургическое вмешательство любого рода не требуется.[78]
Зонд вводится через кожу в опухоль с использованием изображений кончика зонда и опухоли в реальном времени. компьютерная томография, УЗИ, или даже магнитно-резонансная томография руководство, а затем уничтожение опухоли теплом (радиочастотная абляция ) или холодный (криотерапия ). Эти методы находятся в невыгодном положении по сравнению с традиционной хирургией, поскольку невозможно патологическое подтверждение полного разрушения опухоли. Поэтому долгосрочное наблюдение имеет решающее значение для оценки полноты удаления опухоли.[79][80] В идеале чрескожная абляция ограничивается опухолями размером менее 3,5 см и направляет лечение. Однако в некоторых случаях абляция может применяться на опухолях большего размера.[78]
Два основных типа методов абляции, которые используются при почечно-клеточном раке: радиочастотная абляция и криоабляция.[78]
Радиочастотная абляция использует электрод зонд который вводится в пораженную ткань, чтобы посылать радиочастоты в ткань для генерации тепла за счет трения молекул воды. Тепло разрушает ткань опухоли.[9] Гибель клеток обычно наступает в течение нескольких минут после воздействия температуры выше 50 ° C.
Криоабляция также включает введение зонда в пораженный участок,[9] однако для уничтожения опухоли используется холод, а не тепло. Зонд охлаждается очень холодными химическими жидкостями. Низкие температуры вызывают гибель опухолевых клеток, вызывая осмотическая дегидратация, который вытягивает воду из клетки, разрушая фермент, органеллы, клеточная мембрана и замораживание цитоплазма.[78]
Целевые препараты
Рак часто разрастается безудержно, потому что он может уклоняться от иммунной системы.[8] Иммунотерапия - это метод, который активирует иммунную систему человека и использует ее в своих интересах.[8] Он был разработан после наблюдения, что в некоторых случаях имел место спонтанный регресс.[81] Иммунотерапия использует это явление и направлена на формирование иммунного ответа человека на раковые клетки.[81]
Другой таргетная терапия лекарства подавляют факторы роста, которые, как было доказано, способствуют росту и распространению опухолей.[82][83] Большинство этих лекарств были одобрены в течение последних десяти лет.[84] Эти методы лечения:[85]
- Ниволумаб[86]
- Акситиниб[87]
- Сунитиниб[88]
- Кабозантиниб[86]
- Эверолимус
- Ленватиниб
- Пазопаниб
- Бевацизумаб
- Сорафениб
- Тивозаниб
- Темсиролимус[89]
- Интерлейкин-2 (IL-2) вызвал «стойкую ремиссию» у небольшого числа пациентов, но со значительной токсичностью.[90]
- Интерферон-α
Также сообщалось об активности ипилимумаб[91] но это не одобренный препарат от рака почек.[92]
Ожидается, что в ближайшем будущем появится больше лекарств, поскольку в настоящее время проводится несколько клинических испытаний новых целевых методов лечения.[93] включая: атезолизумаб, варлилумаб, дурвалумаб, авелумаб, LAG525, MBG453, TRC105, и саволитиниб.
Химиотерапия
Химиотерапия и лучевая терапия не так успешны в случае RCC. ПКР в большинстве случаев резистентен, но вероятность успеха составляет около 4–5%, но это часто недолговечно с последующим развитием большего количества опухолей и новообразований.[9]
Адъювантная и неоадъювантная терапия
Адъювантная терапия, который относится к терапии, проводимой после первичной хирургической операции, не был признан эффективным при почечно-клеточном раке.[94] Наоборот, неоадъювантная терапия вводится до предполагаемого основного или основного лечения. В некоторых случаях было показано, что неоадъювантная терапия уменьшает размер и стадию ПКР, что позволяет затем удалить его хирургическим путем.[83] Это новая форма лечения, эффективность которой все еще оценивается в клинические испытания.
Метастаз
Метастатическая почечно-клеточная карцинома (мПКР) - это распространение первичной почечно-клеточной карциномы из почек в другие органы. 25–30% людей имеют это метастатическое распространение к тому времени, когда им будет поставлен диагноз почечно-клеточная карцинома.[95] Столь высокая доля объясняется тем, что клинические признаки обычно незначительны, пока болезнь не перейдет в более тяжелое состояние.[96] Наиболее частыми участками метастазов являются лимфатические узлы, легкие, кости, печень и мозг.[10] Как это распространение влияет на стадию заболевания и, следовательно, на прогноз, обсуждается в разделах «Диагностика» и «Прогноз».
MRCC имеет плохой прогноз по сравнению с другими видами рака, хотя средняя продолжительность жизни увеличилась за последние несколько лет благодаря прогрессу в лечении. Средняя продолжительность жизни в 2008 г. при метастатической форме заболевания составила менее года.[97] а к 2013 году этот показатель увеличился до 22 месяцев.[98] Несмотря на это улучшение, 5-летняя выживаемость мПКР остается ниже 10%.[99] и 20–25% страдающих остаются невосприимчивыми ко всем видам лечения, и в этих случаях болезнь быстро прогрессирует.[98]
Доступные методы лечения ПКР, обсуждаемые в разделе «Лечение», также актуальны для метастатической формы заболевания. Варианты включают интерлейкин-2, который является стандартной терапией для прогрессирующей почечно-клеточной карциномы.[94] С 2007 по 2013 год было одобрено семь новых препаратов для лечения мПКР (сунитиниб, темсиролимус, бевацизумаб, сорафениб, эверолимус, пазопаниб и акситиниб).[7] Эти новые методы лечения основаны на том факте, что почечно-клеточная карцинома очень сосудистая опухоль - она содержит большое количество кровеносных сосудов. Лекарства нацелены на подавление роста новых кровеносных сосудов в опухолях, тем самым замедляя рост, а в некоторых случаях уменьшая размер опухолей.[100]К сожалению, побочные эффекты у этих методов лечения довольно распространены и включают:[101]
- Желудочно-кишечные эффекты - тошнота, рвота, диарея, анорексия.
- Респираторные эффекты - кашель, одышка (затрудненное дыхание).
- Сердечно-сосудистые эффекты - гипертония (высокое кровяное давление)
- Неврологические эффекты - внутричерепное кровоизлияние (кровотечение в мозг), тромбоз (образование тромбов) в головном мозге.
- Воздействие на кожу и слизистые оболочки - высыпания, синдром ладони-стопы, стоматит
- Подавление костного мозга - приводит к снижению количества лейкоцитов, увеличению риска инфекций, анемии и снижению тромбоцитов.
- Почечные эффекты - нарушение функции почек
- Усталость.
Лучевая терапия и химиотерапия чаще используются при метастатической форме ПКР для воздействия на вторичные опухоли в костях, печени, головном мозге и других органах. Хотя эти методы лечения не являются лечебными, они действительно помогают людям, страдающим от симптомов, связанных с распространением опухолей.[98]
Прогноз
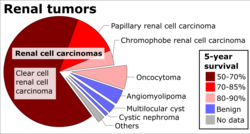
На прогноз влияют несколько факторов, включая размер опухоли, степень инвазии и метастазирования, гистологический тип и ядерную степень.[24] Стадия является наиболее важным фактором исхода почечно-клеточного рака. Следующие цифры основаны на пациентах, впервые диагностированных в 2001 и 2002 годах Национальной базой данных рака:[102]
| Этап | Описание | 5-летняя выживаемость |
|---|---|---|
| я | Прикован к почке | 81% |
| II | Распространение через почечную капсулу, ограниченную фасцией Героты. | 74% |
| III | Включите почечную вену или прикорневые лимфатические узлы. | 53% |
| IV | Включая опухоли, поражающие соседние органы (кроме надпочечников), или отдаленные метастазы. | 8% |
Корейское исследование оценило специфический для болезни общий 5-летняя выживаемость 85%.[103] В целом, если заболевание ограничивается почкой, только у 20–30% развиваются метастазы после нефрэктомии.[104] Более конкретные подмножества показывают пятилетняя выживаемость около 90–95% для опухолей менее 4 см. Для более крупных опухолей, ограниченных почкой без венозной инвазии, выживаемость все еще относительно хорошая и составляет 80–85%.[нужна цитата ] Для опухолей, которые распространяются через почечную капсулу и выходят за пределы местного фасциальный вложений, живучесть снижается почти до 60%.[нужна цитата ] На выживаемость влияют такие факторы, как общее состояние здоровья и физическая форма или тяжесть их симптомов. Например, у более молодых людей (в возрасте 20–40 лет) исход лучше, несмотря на наличие большего количества симптомов при обращении, возможно, из-за более низкой скорости распространения рака на лимфатические узлы (стадия III).
Гистологический класс связан с агрессивностью рака и классифицируется по 4 классам, из которых 1 имеет лучший прогноз (5-летняя выживаемость более 89%), а 4 - худший прогноз (46% 5-летней выживаемости).
У некоторых людей почечно-клеточный рак обнаруживается до появления симптомов (случайно) из-за компьютерная томография (Компьютерная томография) или УЗИ. Случайно диагностированный почечно-клеточный рак (без симптомов) отличается по внешнему виду от тех, которые диагностированы после появления симптомов почечно-клеточного рака или метастазов. Пятилетняя выживаемость была выше для случайных, чем для симптоматических опухолей: 85,3% против 62,5%. Случайные поражения были значительно более низкой стадией, чем те, которые вызывают симптомы, так как 62,1% пациентов с эпизодической почечно-клеточной карциномой наблюдались с поражениями стадии I, против 23% были обнаружены симптоматическая почечно-клеточная карцинома.[105]
Если он метастазировал в лимфатические узлы, 5-летняя выживаемость составляет от 5% до 15%. Для метастатической почечно-клеточной карциномы факторы, которые могут представлять плохой прогноз, включают низкий Карновский результативно-статусная оценка (стандартный способ измерения функциональных нарушений у онкологических больных), низкая гемоглобин уровень, высокий уровень сывороточной лактатдегидрогеназы и высокий скорректированный уровень сывороточного кальция.[106][107] Для неметастатических случаев алгоритм оценки Лейбовича может использоваться для прогнозирования послеоперационного прогрессирования заболевания.[108]
Почечно-клеточная карцинома является одним из видов рака, наиболее сильно связанных с паранеопластические синдромы, чаще всего из-за выработки опухолью эктопического гормона. Лечение этих осложнений ПКР обычно ограничивается лечением основного рака.
Эпидемиология
Частота заболевания варьируется в зависимости от географических, демографических и, в меньшей степени, наследственных факторов. Есть некоторые известные факторы риска, однако значение других потенциальных факторов риска остается более спорным. Заболеваемость раком во всем мире увеличивается примерно на 2–3% за десятилетие.[97] до последних нескольких лет, когда число новых случаев не стабилизировалось.[16]
Заболеваемость ПКР варьируется в зависимости от пола, возраста, расы и географического положения по всему миру. Заболеваемость у мужчин выше, чем у женщин (примерно 1,6: 1).[94] и подавляющее большинство из них диагностируется после 65 лет.[94] Сообщается, что азиаты имеют значительно более низкую заболеваемость ПКР, чем белые, и в то время как африканские страны имеют самый низкий зарегистрированный уровень заболеваемости, афроамериканцы имеют самую высокую заболеваемость среди населения в Соединенных Штатах.[16] В развитых странах заболеваемость выше, чем в развивающихся странах, с самыми высокими показателями в Северной Америке, Европе и Австралии / Новой Зеландии.[109]
История
Даниэль Сеннерт сделал первую ссылку, предлагающую опухоль возникающий в почка в его тексте Practicae Medicinae, впервые опубликовано в 1613 году.[110]
Мирил опубликовал самый ранний однозначный случай почечной недостаточности. карцинома в 1810 г.[111] Он описал случай с Франсуазой Левелли, 35-летней женщиной, которая поступила в Брестскую городскую больницу 6 апреля 1809 года, предположительно на поздних сроках беременности.[110]
Кениг опубликовал первую классификацию опухолей почек, основанную на макроскопической морфологии, в 1826 году. Кениг разделил опухоли на скиррозные, стеатомные, грибовидные и медуллярные формы.[112]
Споры о гипернефроме
После классификации опухоли исследователи попытались определить ткань, из которой возникла карцинома почек.
В патогенез эпителиальных опухолей почек обсуждались десятилетиями. Инициатором дискуссии стал Пол Гравиц когда в 1883 году он опубликовал свои наблюдения за морфологией маленьких желтых почечных опухоли. Гравиц пришел к выводу, что только альвеолярные опухоли надпочечник происхождения, тогда как папиллярные опухоли произошли от почечный ткань.[110]
В 1893 году Пол Судек поставил под сомнение теорию, постулированную Гравицем, опубликовав описания опухолей почек, в которых он идентифицировал атипичные особенности внутри. почечные канальцы и отметил градацию этих нетипичных признаков между канальцами и соседними злокачественная опухоль. В 1894 г. Отто Любарш, который поддержал теорию, постулированную Grawitz ввел термин гипернефроидная опухоль, который был изменен на гипернефрома к Феликс Виктор Берч-Хиршфельд чтобы описать эти опухоли.[113]
Яростную критику Гравица в 1908 году дал Оскар Штурк, считавший надпочечник происхождение опухолей почек не доказано. Несмотря на убедительные аргументы против теории, постулируемой Гравитцем, термин гипернефрома с ассоциированным с ним надпочечниковым оттенком сохранился в литературе.[110]
Фут и Хамфрис, и Фут и др. ввел термин Почечно-клеточная карцинома подчеркнуть почечный трубчатый происхождение этих опухоли. Их обозначение было немного изменено Феттером на теперь широко распространенный термин. Карцинома почек.[114]
Убедительные доказательства для разрешения спора были предложены Оберлингом и др. в 1959 г., изучавший ультраструктура светлых клеток из восьми почечных карциномы. Они обнаружили, что опухолевая клетка цитоплазма содержал многочисленные митохондрии и депозиты гликоген и жир. Они определили цитоплазматические мембраны вставляется перпендикулярно на базальная мембрана с отдельными ячейками, содержащими микроворсинки вдоль свободных границ. Они пришли к выводу, что эти особенности указывают на то, что опухоли возникли из эпителиальный ячейки извитые почечные канальцы, решив, наконец, один из самых обсуждаемых вопросов в опухоль патология.[110][115]
Смотрите также
Рекомендации
- ^ а б c d е ж грамм Курти, Б; Яна, BRP; Джавид, М; Махоул, I; Сачдева, К; Ху, Вт; Перри, М; Талавера, Ф (26 февраля 2014 г.). Харрис, Дж. Э. (ред.). "Карцинома почек". Ссылка на Medscape. WebMD. В архиве из оригинала 7 марта 2014 г.. Получено 7 марта 2014.
- ^ «Рекомендации EAU: почечно-клеточная карцинома». Получено 24 апреля 2020.
- ^ а б c Рини Б.И., Ратмелл В.К., Годли П. (2008). "Карцинома почек". Curr Opin Oncol. 20 (3): 300–6. Дои:10.1097 / CCO.0b013e3282f9782b. PMID 18391630.
- ^ «Рак почки». nhs.uk. 2017-10-23. В архиве из оригинала 3 октября 2017 г.. Получено 19 марта 2018.
- ^ Фаусто, V; Аббас, А; Фаусто, Н. (2004). Патологические основы болезни Роббинса и Котрана (7-е изд.). Филадельфия, Пенсильвания: Эльзевьер / Сондерс. ISBN 978-0721601878.
- ^ а б c Магистр В.А. (ноябрь 2013 г.). "Карцинома почек". Руководство Merck Professional. Merck Sharp & Dohme Corp. В архиве из оригинала 7 марта 2014 г.. Получено 7 марта 2014.
- ^ а б Певец Эрик А .; Gupta, Gopal N .; Маршалик, Даниил; Шринивасан, Рамапрасад (2013). «Развивающиеся терапевтические цели при почечно-клеточной карциноме». Текущее мнение в области онкологии. 25 (3): 273–80. Дои:10.1097 / CCO.0b013e32835fc857. PMID 23455028.
- ^ а б c Синь Николай Л; Teng, Michele W L; Мок, Тони С. К.; Су, Росс А. (2017). «De-novo и приобретенная устойчивость к нацеливанию на иммунные контрольные точки». Ланцет онкологии. 18 (12): e731 – e741. Дои:10.1016 / с1470-2045 (17) 30607-1. PMID 29208439.
- ^ а б c d е ж грамм час я j k л м Коэн, Герберт Т .; Макговерн, Фрэнсис Дж. (2005). "Карцинома почек". Медицинский журнал Новой Англии. 353 (23): 2477–90. Дои:10.1056 / NEJMra043172. PMID 16339096.
- ^ а б c d е Motzer, Роберт Дж .; Bander, Neil H .; Нанус, Дэвид М. (1996). "Карцинома почек". Медицинский журнал Новой Англии. 335 (12): 865–75. Дои:10.1056 / NEJM199609193351207. PMID 8778606.
- ^ а б c Kim, Hyung L .; Belldegrun, Arie S .; Freitas, Danielo G .; Bui, Мэтью H.T .; Хан, КЕН-РЮ; Дори, Фредерик Дж .; Фиглин, Роберт А. (2003). «Паранеопластические признаки и симптомы почечно-клеточного рака: значение для прогноза». Журнал урологии. 170 (5): 1742–6. Дои:10.1097 / 01.ju.0000092764.81308.6a. PMID 14532767.
- ^ Бирхаузер; Крегер, Пантак (2013). «Этиология почечно-клеточного рака: заболеваемость, демография и факторы окружающей среды». Клиническое лечение почечно-клеточного рака. Humana Pr Inc., стр. 3–22. ISBN 978-1-62703-061-8.
- ^ Лейн, Брайан Р. (2013). «Прогностические факторы для локализованной почечно-клеточной карциномы». Карцинома почек. С. 83–102. Дои:10.1007/978-1-62703-062-5_5. ISBN 978-1-62703-061-8.
- ^ Мец; Дэвис (2013). «Паллиативная и поддерживающая терапия при раке почки». Клиническое лечение почечно-клеточного рака. Humana. С. 339–348. ISBN 978-1-62703-061-8.
- ^ Хэггстрем, Кристель; Рапп, Килиан; Акции, Таня; Манжер, Йонас; Бьёрге, Тон; Ульмер, Ханно; Энгеланд, Андерс; Альмквист, Мартин; Кончин, Ганс; Selmer, R; Ljungberg, B; Третли, S; Нагель, G; Холлманс, G; Jonsson, H; Статтин, П (2013). Миллер, Тодд В. (ред.). «Метаболические факторы, связанные с риском почечно-клеточного рака». PLOS ONE. 8 (2): e57475. Bibcode:2013PLoSO ... 857475H. Дои:10.1371 / journal.pone.0057475. ЧВК 3585341. PMID 23468995.
- ^ а б c Юнгберг, Бёрье; Кэмпбелл, Стивен С.; Чой, Хан Ён; Жакмин, Дидье; Ли, Чон Ын; Вайкерт, Штеффен; Кимени, Ламбертус А. (2011). «Эпидемиология почечно-клеточного рака». Европейская урология. 60 (4): 615–21. Дои:10.1016 / j.eururo.2011.06.049. PMID 21741761.
- ^ Dhôte, R .; Pellicer-Coeuret, M .; Thiounn, N .; Debré, B .; Видаль-Трекан, Г. (2007). «Факторы риска почечно-клеточного рака у взрослых: систематический обзор и значение для профилактики». BJU International. 86 (1): 20–7. Дои:10.1046 / j.1464-410x.2000.00708.x. PMID 10886077.
- ^ Boffetta, P .; Fontana, L .; Стюарт, П .; Заридзе, Д .; Szeszenia-Dabrowska, N .; Janout, V .; Bencko, V .; Форетова, Л .; Jinga, V .; Матвеев, В .; Колларова, Х .; Ferro, G .; Чоу, W.-H .; Rothman, N .; Van Bemmel, D .; Карами, С .; Brennan, P .; Мур, Л. Э. (2011). «Профессиональное воздействие мышьяка, кадмия, хрома, свинца и никеля и почечно-клеточная карцинома: исследование случай-контроль из Центральной и Восточной Европы». Медицина труда и окружающей среды. 68 (10): 723–8. Дои:10.1136 / oem.2010.056341. PMID 21217163.
- ^ Чо, Ынён; Curhan, G; Hankinson, SE; Кантофф, П; Аткинс, МБ; Штампфер, М; Choueiri, TK (2011). «Проспективная оценка использования анальгетиков и риска почечно-клеточного рака». Архивы внутренней медицины. 171 (16): 1487–93. Дои:10.1001 / archinternmed.2011.356. ЧВК 3691864. PMID 21911634.
- ^ Цуккетто, Антонелла; Таламини, Ренато; Даль Мазо, Луиджино; Негри, Ева; Полесель, Джерри; Рамазотти, Валерио; Монтелла, Маурицио; Канцоньери, Винченцо; Серрайно, Диего; Ла Веккья, Карло; Франчески, Сильвия (2008). «Репродуктивные, менструальные и другие факторы, связанные с гормонами, и риск почечно-клеточного рака». Международный журнал рака. 123 (9): 2213–6. Дои:10.1002 / ijc.23750. PMID 18711701.
- ^ Bellocco, R .; Pasquali, E .; Rota, M .; Bagnardi, V .; Tramacere, I .; Scotti, L .; Pelucchi, C .; Boffetta, P .; Коррао, Г. (01.09.2012). «Употребление алкоголя и риск почечно-клеточного рака: результаты метаанализа». Анналы онкологии. 23 (9): 2235–2244. Дои:10.1093 / annonc / mds022. ISSN 1569-8041. PMID 22398178.
- ^ Lipworth, L; Tarone, RE; Лунд, L; Маклафлин, Дж. К. (2009). «Эпидемиологические характеристики и факторы риска почечно-клеточного рака». Клиническая эпидемиология. 1: 33–43. Дои:10.2147 / clep.s4759. ЧВК 2943168. PMID 20865085.
- ^ Павлович, Кристиан П .; Шмидт, Лаура С. (2004). «Поиск наследственных причин почечно-клеточного рака». Обзоры природы Рак. 4 (5): 381–93. Дои:10.1038 / nrc1364. PMID 15122209.
- ^ а б c d е ж Рини, Брайан I; Кэмпбелл, Стивен С; Эскудье, Бернар (2009). "Карцинома почек". Ланцет. 373 (9669): 1119–1132. Дои:10.1016 / S0140-6736 (09) 60229-4. PMID 19269025.
- ^ Baldewijns, Marcella M.L .; Van Vlodrop, Iris J.H .; Schouten, Leo J .; Soetekouw, Patricia M.M.B .; De Bruïne, Adriaan P .; Ван Энгеланд, Манон (2008). «Генетика и эпигенетика почечно-клеточного рака». Biochimica et Biophysica Acta (BBA) - Обзоры на рак. 1785 (2): 133–155. Дои:10.1016 / j.bbcan.2007.12.002. PMID 18187049.
- ^ Тьяден, Кристин; Вернер, Йенс; Бюхлер, Маркус У .; Хаккерт, Тило (2011). «Реактивная гипертрофия добавочной селезенки, имитирующая рецидив опухоли метастатической почечно-клеточной карциномы». Азиатский журнал хирургии. 34 (1): 50–2. Дои:10.1016 / S1015-9584 (11) 60019-5. PMID 21515214.
- ^ Элизабет Д Агабеги; Агабеги, Стивен С. (2008). Шаг вперед к медицине (серия Step-Up). Хагерствон, доктор медицины: Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-7153-5.
- ^ Catto, James W.F .; Шариат, Шахрох Ф. (2013). «Меняющееся лицо почечно-клеточной карциномы: влияние систематического генетического секвенирования на наше понимание биологии этой опухоли». Европейская урология. 63 (5): 855–7, обсуждение 857–8. Дои:10.1016 / j.eururo.2012.09.049. PMID 23026395.
- ^ а б c d е ж грамм Чжоу, Мин; Хэ, Хуэйин (2013). «Патология почечно-клеточного рака». Карцинома почек. С. 23–41. Дои:10.1007/978-1-62703-062-5_2. ISBN 978-1-62703-061-8.
- ^ Патологические основы болезни Роббинса и Котрана (Девятое изд.). Эльзевир. п. 954. ISBN 9780808924500.
- ^ Патологические основы болезни Роббинса и Котрана (Девятое изд.). п. 954. ISBN 9780808924500.
- ^ Лопес-Бельтран, Антонио; Скарпелли, Марина; Монтирони, Родольфо; Киркали, Зия (2006). «Классификация почечных опухолей у взрослых ВОЗ 2004 г.». Европейская урология. 49 (5): 798–805. Дои:10.1016 / j.eururo.2005.11.035. PMID 16442207.
- ^ Hagenkord, Jill M; Парвани, Анил V; Лайонс-Вейлер, Морин А; Альварес, Карла; Амато, Роберт; Гаталица, Зоран; Гонсалес-Берджон, Хосе М; Петерсон, Лейф; Дхир, Раджив; Монзон, Федерико А (2008). «Виртуальное кариотипирование с помощью микрочипов SNP снижает неопределенность в диагностике опухолей почечного эпителия». Диагностическая патология. 3: 44. Дои:10.1186/1746-1596-3-44. ЧВК 2588560. PMID 18990225.
- ^ Монзон, Федерико А; Hagenkord, Jill M; Лайонс-Вейлер, Морин А; Balani, Jyoti P; Парвани, Анил V; Sciulli, Christin M; Ли, Цзя; Чандран, Ума Р.; Бастаки, Шелдон I; Дхир, Раджив (2008). «Полногеномные массивы SNP как потенциальный диагностический инструмент для обнаружения характерных хромосомных аберраций в опухолях почечного эпителия». Современная патология. 21 (5): 599–608. Дои:10.1038 / modpathol.2008.20. PMID 18246049.
- ^ Lyons-Weiler M, Hagenkord J, Sciulli C, Dhir R, Monzon FA (2008). «Оптимизация анализа Affymetrix GeneChip Mapping 10K 2.0 для рутинного клинического использования на фиксированных формалином тканях, залитых парафином». Диаг. Мол. Патол. 17 (1): 3–13. Дои:10.1097 / PDM.0b013e31815aca30. PMID 18303412.
- ^ а б c Crumley, S.M .; Диватия, М; Чыонг, L; Шен, S; Ayala, A. G .; Ро, Дж. Ю. (2013). «Почечно-клеточная карцинома: развивающиеся и появляющиеся подтипы». Всемирный журнал клинических случаев. 1 (9): 262–275. Дои:10.12998 / wjcc.v1.i9.262. ЧВК 3868710. PMID 24364021.
- ^ Рохан, С. М .; Сяо, Y; Лян, Y; Dudas, M.E .; Al-Ahmadie, H.A .; Хорошо, S. W .; Гопалан, А; Reuter, V. E .; Розенблюм, М. К .; Руссо, П; Тикоо, С. К. (2011). «Светлоклеточная папиллярная почечно-клеточная карцинома: молекулярный и иммуногистохимический анализ с акцентом на ген фон Хиппель-Линдау и белки, связанные с путями индуцируемого гипоксией фактора». Современная патология. 24 (9): 1207–20. Дои:10.1038 / modpathol.2011.80. PMID 21602815.
- ^ Вуд, Лаура С. (30 ноября 2009 г.). "Карцинома почек". Клинический журнал медсестер онкологии. 13: 3–7. Дои:10.1188 / 09.CJON.S2.3-7. PMID 19948453.
- ^ Бонн, Дороти (31 января 2004 г.). «Анализ мочи на почечно-клеточный рак». Ланцет онкологии. 5 (2): 72. Дои:10.1016 / S1470-2045 (04) 01368-3. PMID 14974475.
- ^ Иоганн, Дональд Дж .; Вэй, Бих-Ронг; Prieto, Darue A .; Чан, король С .; Е, Сяин; Валера, Владимир А .; Симпсон, Р. Марк; Rudnick, Paul A .; Сяо, Чжэнь; Issaq, Haleem J .; Линехан, У. Марстон; Stein, Stephen E .; Винстра, Тимоти Д .; Blonder, Йосип (2010). «Комбинированный анализ крови / ткани для обнаружения биомаркеров рака: применение к почечно-клеточной карциноме». Аналитическая химия. 82 (5): 1584–8. Дои:10.1021 / ac902204k. ЧВК 3251958. PMID 20121140.
- ^ Хацарас, Иоаннис; Gleisner, Ana L .; Пулитано, Карло; Сандрусси, Шарбель; Хиросе, Кензо; Хайдер, Омар; Вольфганг, Кристофер Л .; Альдригетти, Лука; Кроуфорд, Майкл; Choti, Michael A .; Павлик, Тимоти М. (2012). «Многопрофильный анализ результатов хирургии, направленной на печень, при метастатическом почечно-клеточном раке». Е.П.Б.. 14 (8): 532–8. Дои:10.1111 / j.1477-2574.2012.00495.x. ЧВК 3406350. PMID 22762401.
- ^ Motzer, RJ (1 апреля 2003 г.). «Почечно-клеточная карцинома: злокачественная опухоль, приоритетная для разработки и изучения новых методов лечения». Журнал клинической онкологии. 21 (7): 1193–4. Дои:10.1200 / JCO.2003.12.072. PMID 12663704.
- ^ Сахни, В.А. (1 января 2009 г.). «ОБЗОР: Биопсия почечных масс: когда и почему». Визуализация рака. 9 (1): 44–55. Дои:10.1102/1470-7330.2009.0005. ЧВК 2739685. PMID 19602467.
- ^ Nakada, G; Мачида, Т; Масуда, Ф; Ониши, Т; Ямазаки, Н; Киёта, H; Сузуки, М; Гото, H (1983). «Случай артериовенозной фистулы вторичной почечно-клеточной карциномы, сопровождающейся застойной сердечной недостаточностью». Hinyokika Kiyo. Acta Urologica Japonica. 29 (8): 901–5. PMID 6675440.
- ^ Паттамапаспонг, Нуттайя; Муттарак (малайский); Сивасомбун, Шат (2011). «Туберкулезный артрит и теносиновит». Семинары по костно-мышечной радиологии. 15 (5): 459–69. Дои:10.1055 / с-0031-1293492. PMID 22081281.
- ^ Израиль, Гэри М .; Босняк, Мортон А. (2005). «Как я это делаю: оценка новообразований почек1». Радиология. 236 (2): 441–50. Дои:10.1148 / радиол.2362040218. PMID 16040900.
- ^ а б Юбелирер, SJ; Рубин, М (1993). «Использование современных радиологических методов для выявления побочного почечно-клеточного рака». Медицинский журнал Западной Вирджинии. 89 (1): 21–3. PMID 8421912.
- ^ а б Бек, AD (октябрь 1997 г.). «Почечно-клеточная карцинома с поражением нижней полой вены: рентгенологическая оценка и хирургическое лечение». Журнал урологии. 118 (4): 533–7. Дои:10.1016 / S0022-5347 (17) 58098-2. PMID 916043.
- ^ Sauk, Steven C .; Hsu, Margaret S .; Margolis, Daniel J. A .; Лу, Дэвид С. К .; Rao, Nagesh P .; Belldegrun, Arie S .; Пантак, Аллан Дж .; Раман, Стивен С. (2011). «Светлоклеточная почечно-клеточная карцинома: многофазная мультидетекторная КТ-визуализация помогает предсказать генетические кариотипы». Радиология. 261 (3): 854–62. Дои:10.1148 / радиол.11101508. PMID 22025734.
- ^ а б Lane, Brian R .; Сампласки, Мэри К .; Herts, Brian R .; Чжоу, Мин; Новик, Эндрю С .; Кэмпбелл, Стивен С. (2008). «Массовая биопсия почек - Возрождение?». Журнал урологии. 179 (1): 20–7. Дои:10.1016 / j.juro.2007.08.124. PMID 17997455.
- ^ Hricak, H; Димас, BE; Уильямс, РД; McNamara, MT; Hedgcock, МВт; Amparo, EG; Танаго, EA (1985). «Магнитно-резонансная томография в диагностике и стадировании почечных и околопочечных новообразований». Радиология. 154 (3): 709–15. Дои:10.1148 / радиология.154.3.3969475. PMID 3969475.
- ^ Янус, CL; Мендельсон, Д.С. (1991). «Сравнение МРТ и КТ для исследования почечных и околопочечных масс». Критические обзоры в диагностической визуализации. 32 (2): 69–118. PMID 1863349.
- ^ Нисимура, Кадзуо; Хида, Шуичи; Окада, Кеничиро; Йошида, Осаму; Нисимуара, Казумаса (1988). «Постановка и дифференциальная диагностика почечно-клеточного рака: сравнение магнитно-резонансной томографии (МРТ) и компьютерной томографии (КТ)». Acta Urologica Japonica. 34 (8): 1323–31. HDL:2433/119684. PMID 3195400.
- ^ Резнек, Р.Х. (14 февраля 2004 г.). «КТ / МРТ в стадии почечно-клеточного рака». Визуализация рака. 4 Спецификация № A (Спецификация № A): S25–32. Дои:10.1102/1470-7330.2004.0012. ЧВК 1435344. PMID 18215972.
- ^ Коджак, Мехмет; Судаков, Гэри С .; Эриксон, Скотт; Бегун, Фрэнк; Датта, Милтон (2001). «Использование МР-ангиографии для хирургического планирования при почечно-клеточной карциноме тазовых почек». Американский журнал рентгенологии. 177 (3): 659–60. Дои:10.2214 / ajr.177.3.1770659. PMID 11517066.
- ^ а б Рак почки / Общая информация В архиве 2011-11-01 на Wayback Machine в Медицинском колледже Вейл Корнелл, Фонд Джеймса Бьюкенена Брэди, отделение урологии
- ^ Ото, А; Герц, B R; Ремер, ЭМ; Новик, А.С. (1998). «Тромб опухоли нижней полой вены в почечно-клеточной карциноме: постановка с помощью МРТ и влияние на хирургическое лечение». Американский журнал рентгенологии. 171 (6): 1619–24. Дои:10.2214 / ajr.171.6.9843299. PMID 9843299.
- ^ «Светлоклеточная карцинома, гипернефроидная опухоль или гипернефрома». В архиве из оригинала 07.05.2010. Получено 2010-03-31.
- ^ Васильева Н.Н.; Корякина, РФ (1976). «Морфологическая диагностика почечно-клеточного рака. Гистоцитологические параллели». Архив Патологии. 38 (12): 12–7. PMID 1016084.
- ^ «Светлоклеточная карцинома почки (опухоль Гравица)». Атлас патологии. 30 января 2009 г. В архиве с оригинала от 10 марта 2009 г.
- ^ Лопес, JI (март 2013 г.). «Опухоли почек со светлыми клетками. Обзор». Патология, исследования и практика. 209 (3): 137–46. Дои:10.1016 / j.prp.2013.01.007. PMID 23433880.
- ^ Риу-Леклерк, Натали (ноябрь 2006 г.). "Le grade nucléaire de fuhrman, facteur pronostique du Cancer du rein depuis 25 ans" [Система оценок Фурмана для прогноза рака почки]. Progrès en Urologie (На французском). 16 (4): 5–8. PMID 17183964. ИНИСТ:18271804.
- ^ Делахант, Бретт; Сика-Паотону, Дайанна; Бетуэйт, Питер Б.; Маккреди, Маргарет Р. Э .; Мартинони, Гвидо; Eble, John N .; Джордан, Т. (2007). «Оценка Фурмана не подходит для хромофобной почечно-клеточной карциномы». Американский журнал хирургической патологии. 31 (6): 957–60. Дои:10.1097 / 01.pas.0000249446.28713.53. PMID 17527087.
- ^ Ковач, Дьюла; Ахтар, Мохаммед; Беквит, Брюс Дж .; Бугерт, Питер; Купер, Колин С .; Делахант, Бретт; Eble, John N .; Флеминг, Стюарт; Юнгберг, Бёрье; Медейрос, Л. Джеффри; Мох, Хольгер; Reuter, Victor E .; Ритц, Эберхард; Роос, Горан; Шмидт, Дитмар; Srigley, John R .; Штёркель, Стефан; Ван Ден Берг, Ева; Збар, Берт (1997). «Гейдельбергская классификация почечно-клеточных опухолей». Журнал патологии. 183 (2): 131–3. Дои:10.1002 / (SICI) 1096-9896 (199710) 183: 2 <131 :: AID-PATH931> 3.0.CO; 2-G. PMID 9390023.
- ^ Лауби-Секретан, B; Скоччанти, С; Лумис, Д. Гросс, Й; Bianchini, F; Straif, K; Рабочая группа Международного агентства по изучению рака (25 августа 2016 г.). «Жирность и рак - точка зрения рабочей группы МАИР». Медицинский журнал Новой Англии. 375 (8): 794–798. Дои:10.1056 / неймср1606602. ЧВК 6754861. PMID 27557308.
- ^ Симмонс; Кэмпбелл (26 сентября 2012 г.). «Оценка онкологического риска клинической стадии опухолей почек T1». Клиническое лечение почечно-клеточного рака. Humana Pr Inc., стр. 105–118. ISBN 978-1-62703-061-8.
- ^ а б Smaldone, Marc C .; Кантер, Даниэль; Кутиков Александр; Уззо, Роберт Г. (2013). «Активное наблюдение за малой почечной массой». Карцинома почек. С. 167–94. Дои:10.1007/978-1-62703-062-5_10. ISBN 978-1-62703-061-8.
- ^ Novick AC (сентябрь 1998 г.). «Нефронсохраняющая хирургия почечно-клеточного рака». Br J Urol. 82 (3): 321–4. Дои:10.1046 / j.1464-410X.1998.00751.x. PMID 9772865.
- ^ Herr HW (январь 1999 г.). «Частичная нефрэктомия по поводу одностороннего рака почки и нормальной контралатеральной почки: наблюдение через 10 лет». Дж. Урол. 161 (1): 33–4, обсуждение 34–5. Дои:10.1016 / S0022-5347 (01) 62052-4. PMID 10037361.
- ^ Ван Поппель Х., Бамелис Б., Ойен Р., Барт Л. (сентябрь 1998 г.). «Частичная нефрэктомия при почечно-клеточном раке может обеспечить длительный контроль опухоли». Дж. Урол. 160 (3 Pt 1): 674–8. Дои:10.1016 / S0022-5347 (01) 62751-4. PMID 9720519.
- ^ Маттар К., Джуэтт Массачусетс (январь 2008 г.). «Настороженное ожидание небольших образований в почках». Curr Urol Rep. 9 (1): 22–5. Дои:10.1007 / s11934-008-0006-3. PMID 18366970.
- ^ Вес, Кристофер Дж .; Ларсон, Бенджамин Т .; Ферганы, Амр Ф .; Гао, Тяньминь; Lane, Brian R .; Кэмпбелл, Стивен С.; Kaouk, Jihad H .; Klein, Eric A .; Новик, Эндрю С. (2010). «Хроническая почечная недостаточность, вызванная нефрэктомией, связана с повышенным риском сердечно-сосудистой смерти и смерти от любой причины у пациентов с локализованными почечными массами cT1b». Журнал урологии. 183 (4): 1317–23. Дои:10.1016 / j.juro.2009.12.030. PMID 20171688.
- ^ Вес, Кристофер Дж .; Криспен, Пол Л .; Бро, Родни Х .; Ким, Саймон П .; Lohse, Christine M .; Boorjian, Stephen A .; Томпсон, Р. Хьюстон; Лейбович, Брэдли С. (2013). «Практика и характеристики хирурга сильно влияют на решение о выполнении частичной нефрэктомии среди хирургов Американской ассоциации урологов». BJU International. 111 (5): 731–8. Дои:10.1111 / j.1464-410X.2012.11112.x. PMID 22502641.
- ^ Casey, R.G .; Raheem, O.A .; Elmusharaf, E .; Madhavan, P .; Толан, М .; Линч, Т. (2013). «Почечно-клеточная карцинома с НПВ и тромбом предсердий: 10-летний хирургический опыт в одном центре». Хирург. 11 (6): 295–9. Дои:10.1016 / j.surge.2013.02.007. PMID 23510704.
- ^ Flanigan RC, Mickisch G, Sylvester R, Tangen C, Van Poppel H, Crawford ED (март 2004 г.). «Циторедуктивная нефрэктомия у больных метастатическим раком почек: комбинированный анализ». Дж. Урол. 171 (3): 1071–6. CiteSeerX 10.1.1.469.2497. Дои:10.1097 / 01.ju.0000110610.61545.ae. PMID 14767273.
- ^ Малдерс П.Ф., Брауэрс А.Х., Хульсберген-ван дер Каа, Калифорния, ван Лин Э.Н., Осанто С., де Малдер PH (февраль 2008 г.). «[Руководство« Почечно-клеточный рак »]». Nederlands Tijdschrift voor Geneeskunde (на голландском). 152 (7): 376–80. PMID 18380384.
- ^ Руссо (2013). «Радикальная нефрэктомия при локализованных опухолях почек: онкологические и функциональные аспекты почек». Клиническое лечение почечно-клеточного рака. Humana Pr Inc., стр. 119–132. ISBN 978-1-62703-061-8.
- ^ а б c d Утренник; Ахрар (2013). «Термическая абляция». Клиническое лечение почечно-клеточного рака. Humana. С. 155–166. ISBN 978-1-62703-061-8.
- ^ Могами Т., Харада Дж., Кисимото К., Сумида С. (апрель 2007 г.). «Чрескожная криоаблация под МРТ при злокачественных новообразованиях с акцентом на почечно-клеточную карциному». Int. J. Clin. Онкол. 12 (2): 79–84. Дои:10.1007 / s10147-006-0654-6. PMID 17443274.
- ^ Босс А., Класен С., Кучик М., Шик Ф., Перейра П.Л. (март 2007 г.). «Радиочастотная абляция почечно-клеточного рака под визуальным контролем». Eur Radiol. 17 (3): 725–33. Дои:10.1007 / s00330-006-0415-у. PMID 17021704.
- ^ а б Давар; Фентон; Эпплман (2013). «Иммунотерапия почечно-клеточного рака». Клиническое лечение почечно-клеточного рака. Humana. С. 279–302. ISBN 978-1-62703-061-8.
- ^ Santoni, M; Де Турси, М; Felici, A; Lo Re, G; Ricotta, R; Ruggeri, EM; Sabbatini, R; Сантини, D; Vaccaro, V; Милелла, М. (июнь 2013 г.). «Ведение пациентов с метастатическим почечно-клеточным раком с признаками низкого риска: текущее состояние и перспективы на будущее». Экспертный обзор противоопухолевой терапии. 13 (6): 697–709. Дои:10.1586 / эра.13.52. PMID 23773104.
- ^ а б Строуп (2013). «Неоадъювантная таргетная терапия и консолидирующая хирургия». Клиническое лечение почечно-клеточного рака. Humana. С. 219–230. ISBN 978-1-62703-061-8.
- ^ Сёдзи, S; Накано, М; Сато, H; Тан, XY; Осамура, Ю. Р.; Терачи, Т; Учида, Т; Такея, К. (январь 2014 г.). «Текущее состояние индивидуальной медицины с молекулярными биомаркерами для пациентов со светлоклеточным почечно-клеточным раком». Клинические и экспериментальные метастазы. 31 (1): 111–34. Дои:10.1007 / s10585-013-9612-7. PMID 23959576.
- ^ Jonasch, E; Futreal, PA; Дэвис, Эй Джей; Бейли, ST; Ким, Вайоминг; Brugarolas, J; Giaccia, AJ; Курбан, Г; Пауза, А; Фридман, Дж; Зурита, AJ; Рини, Б.И.; Шарма, П; Аткинс, МБ; Уокер, CL; Ратмелл, WK (июль 2012 г.). «Состояние науки: последние данные о почечно-клеточном раке». Молекулярные исследования рака. 10 (7): 859–80. Дои:10.1158 / 1541-7786.MCR-12-0117. ЧВК 3399969. PMID 22638109.
- ^ а б Куинн Д.И., Лара П.Н. (2015). «Почечно-клеточный рак - поражение иммунной контрольной точки или множественных киназ». N. Engl. J. Med. 373 (19): 1872–4. Дои:10.1056 / NEJMe1511252. PMID 26406149.
- ^ Драницарис, G; Schmitz, S; Broom, RJ (ноябрь 2013 г.). «Таргетная терапия с использованием малых молекул для лечения второй линии метастатической почечно-клеточной карциномы: систематический обзор и косвенное сравнение безопасности и эффективности». Журнал исследований рака и клинической онкологии. 139 (11): 1917–26. Дои:10.1007 / s00432-013-1510-5. PMID 24037486.
- ^ Motzer, Роберт Дж .; Hutson, Thomas E .; Томчак, Петр; Майклсон, М. Дрор; Буковски, Рональд М .; Рикс, Оливье; Удар, Стефан; Негриер, Сильви; Щилик, Цезары; Ким, Синди Т .; Чен, Исан; Bycott, Paul W .; Баум, Чарльз М .; Фиглин, Роберт А. (2007). «Сунитиниб против интерферона альфа при метастатической почечно-клеточной карциноме». Медицинский журнал Новой Англии. 356 (2): 115–124. Дои:10.1056 / NEJMoa065044. ISSN 0028-4793. PMID 17215529.
- ^ «TORISEL® (темсиролимус) - Информация по безопасности - Лечение почечно-клеточного рака». www.torisel.com. В архиве из оригинала 13 апреля 2018 г.. Получено 19 марта 2018.
- ^ Карцинома почек В архиве 2016-07-05 в Wayback Machine Медицинская энциклопедия MedlinePlus. Проверено 10 сентября 2010 г.
- ^ Ян Дж. К., Хьюз М., Каммула Ю., Роял Р., Шерри Р. М., Топалян С. Л., Сури К. Б., Леви С., Аллен Т., Маврукакис С., Лоуи И., Уайт Д. Е., Розенберг С.А. (2007). «Ипилимумаб (антитело против CTLA4) вызывает регрессию метастатического почечно-клеточного рака, связанного с энтеритом и гипофизитом». J. Immunother. 30 (8): 825–30. Дои:10.1097 / CJI.0b013e318156e47e. ЧВК 2134980. PMID 18049334.
- ^ «Архивная копия» (PDF). В архиве (PDF) из оригинала от 06.02.2015. Получено 2014-10-29.CS1 maint: заархивированная копия как заголовок (связь)
- ^ «Рак почки». Институт исследования рака. В архиве из оригинала 24 декабря 2017 г.. Получено 19 марта 2018.
- ^ а б c d Коэн, Герберт Т .; Макговерн, Фрэнсис Дж. (2005). "Карцинома почек". Медицинский журнал Новой Англии. 353 (23): 2477–90. Дои:10.1056 / NEJMra043172. PMID 16339096.
- ^ Лам, Джон С .; Лепперт, Джон Т .; Belldegrun, Arie S .; Фиглин, Роберт А. (2005). «Новые подходы в терапии метастатической почечно-клеточной карциномы». Всемирный журнал урологии. 23 (3): 202–12. Дои:10.1007 / s00345-004-0466-0. PMID 15812574.
- ^ Юнгберг, Бёрье; Hanbury, Damian C .; Kuczyk, Marcus A .; Merseburger, Axel S .; Малдерс, Питер Ф.А.; Патар, Жан-Жак; Sinescu, Ioanel C .; Группа рекомендаций Европейской ассоциации урологов по почечно-клеточной карциноме (2007 г.). «Руководство по почечно-клеточной карциноме». Европейская урология. 51 (6): 1502–10. Дои:10.1016 / j.eururo.2007.03.035. PMID 17408850.
- ^ а б Гупта, Киран; Миллер, Джеффри Д .; Ли, Джим З .; Рассел, Мейсон У .; Шарбонно, Клоди (2008). «Эпидемиологическое и социально-экономическое бремя метастатической почечно-клеточной карциномы (мПКР): обзор литературы». Отзывы о лечении рака. 34 (3): 193–205. Дои:10.1016 / j.ctrv.2007.12.001. PMID 18313224.
- ^ а б c Бути, Себастьяно; Берсанелли, Мелисса; Сикокис, Анжелика; Мэн, Франческа; Факкинетти, Франческо; Бриа, Эмилио; Ардиццони, Андреа; Тортора, Джампаоло; Массари, Франческо (2013). «Химиотерапия при метастатической почечно-клеточной карциноме сегодня? Систематический обзор». Противораковые препараты. 24 (6): 535–54. Дои:10.1097 / CAD.0b013e3283609ec1. PMID 23552469.
- ^ Патил, Суджата; Манола, Юдифь; Элсон, Пол; Негриер, Сильви; Эскудье, Бернар; Эйзен, Тим; Аткинс, Майкл; Буковски, Рональд; Моцер, Роберт Дж. (2012). «Улучшение общей выживаемости пациентов с прогрессирующей почечно-клеточной карциномой: анализ тенденций прогностических факторов из международного набора данных клинических испытаний». Журнал урологии. 188 (6): 2095–100. Дои:10.1016 / j.juro.2012.08.026. PMID 23083849.
- ^ Кальво, Эмилиано; Раво, Ален; Белльмант, Жоаким (2013). «Какая оптимальная терапия для пациентов с метастатической почечно-клеточной карциномой, у которых прогрессирует исходный VEGFr-TKI?». Отзывы о лечении рака. 39 (4): 366–74. Дои:10.1016 / j.ctrv.2012.06.010. PMID 22832091.
- ^ Аляскер, Ахмед; Мескави, Малек; Солнце, Максин; Исмаил, Салима; Ханна, Навар; Хансен, Йенс; Тиан, Чжэ; Бьянки, Марко; Перротт, Поль; Каракевич, Пьер И. (2013). «Современное обновление показателей и управления токсичностью таргетных методов лечения метастатической почечно-клеточной карциномы». Отзывы о лечении рака. 39 (4): 388–401. Дои:10.1016 / j.ctrv.2012.12.006. PMID 23317510.
- ^ Рак почки (взрослый) - почечно-клеточная карцинома В архиве 2016-04-05 в Wayback Machine Американское онкологическое общество. Проверено 10 сентября 2010 г.
- ^ "В ЭТОМ ВЫПУСКЕ". Японский журнал клинической онкологии. 41 (1): НП. 2010 г. Дои:10.1093 / jjco / hyq238. ISSN 0368-2811.
- ^ [1] В архиве 2015-12-05 в Wayback Machine Причины, симптомы, лечение рака почки. eMedicine Health. Проверено 10 сентября 2010 г.
- ^ Цуй К.Х., Шварц О., Смит Р.Б., Фиглин Р., де Кернион Дж. Б., Беллдегрун А. (февраль 2000 г.). «Почечно-клеточный рак: прогностическое значение случайно обнаруженных опухолей». Журнал урологии. 163 (2): 426–30. Дои:10.1016 / s0022-5347 (05) 67892-5. PMID 10647646.
- ^ Motzer, R.J .; Bacik, J; Шварц, LH; Reuter, V; Руссо, П; Марион, S; Мазумдар, М. (2003). «Прогностические факторы выживаемости у ранее леченных пациентов с метастатической почечно-клеточной карциномой». Журнал клинической онкологии. 22 (3): 454–63. Дои:10.1200 / JCO.2004.06.132. PMID 14752067.
- ^ Motzer, RJ; Мазумдар, М; Bacik, J; Берг, Вт; Амстердам, А; Феррара, Дж (1999). «Выживаемость и прогностическая стратификация 670 пациентов с запущенной почечно-клеточной карциномой». Журнал клинической онкологии. 17 (8): 2530–40. Дои:10.1200 / jco.1999.17.8.2530. PMID 10561319.
- ^ Лейбович, Брэдли С.; Blute, Michael L .; Cheville, John C .; Lohse, Christine M .; Франк, Игорь; Kwon, Eugene D .; Уивер, Эми Л .; Паркер, Александр С .; Зинке, Хорст (2003). «Прогнозирование прогрессирования после радикальной нефрэктомии у пациентов со светлоклеточным почечно-клеточным раком». Рак. 97 (7): 1663–71. Дои:10.1002 / cncr.11234. PMID 12655523.
- ^ Birkhäuser, Frédéric D .; Крегер, Нильс; Пантак, Аллан Дж. (2013). «Этиология почечно-клеточного рака: заболеваемость, демография и факторы окружающей среды». Карцинома почек. С. 3–22. Дои:10.1007/978-1-62703-062-5_1. ISBN 978-1-62703-061-8.
- ^ а б c d е Делахант, Бретт (8 марта 2009 г.). «История неоплазии почек» (PDF). Ежегодное собрание Академии патологии США и Канады, 2009 г..[мертвая ссылка ]
- ^ Делахант, Бретт; Торнтон А (1996). «Почечно-клеточная карцинома. Историческая перспектива». Дж Урол Патол. 4: 31–49.
- ^ Делахант, Бретт; Эбл, Джон Н. (2005). «История создания классификации почечно-клеточной неоплазии». Клиники лабораторной медицины. 25 (2): 231–46, т. Дои:10.1016 / j.cll.2005.01.007. PMID 15848734.
- ^ Джадд, Э. Старр (1929). «Рак почечной коры с факторами, влияющими на прогноз». Архивы внутренней медицины. 44 (5): 746. Дои:10.1001 / archinte.1929.00140050123011.
- ^ Стопа, NC; Хамфрис, Джорджия; Уитмор, У. Ф. (1951). «Опухоли почек: патология и прогноз в 295 случаях». Журнал урологии. 66 (2): 190–200. Дои:10.1016 / S0022-5347 (17) 74326-1. PMID 14861941.
- ^ Оберлинг, Швейцария; Ривьер, М .; Haguenau, FR. (1960). «Ультраструктура светлых клеток в почечных карциномах и ее важность для демонстрации их почечного происхождения». Природа. 186 (4722): 402–403. Bibcode:1960Натура.186..402O. Дои:10.1038 / 186402a0. PMID 14428164.
- ^ Валладарес Айербес, Мануэль; Апарисио Гальего, Гваделупе; Диас Прадо, Сильвия; Хименес Фонсека, Паула; Гарсиа Кампело, Росарио; Антон Апарисио, Луис Мигель (2008). «Происхождение почечно-клеточного рака». Клиническая и трансляционная онкология. 10 (11): 697–712. Дои:10.1007 / s12094-008-0276-8. PMID 19015066.
внешняя ссылка
| Классификация | |
|---|---|
| Внешние ресурсы |
