Фосфоглицератмутаза - Phosphoglycerate mutase

| Семейство фосфоглицератмутаз | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||
| Символ | PGAM | ||||||||||
| Pfam | PF00300 | ||||||||||
| ИнтерПро | IPR013078 | ||||||||||
| PROSITE | PDOC00158 | ||||||||||
| SCOP2 | 3 пг / мин / Объем / СУПФАМ | ||||||||||
| |||||||||||
| фосфоглицератмутаза 1 (мозг) | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Идентификаторы | |||||||
| Символ | PGAM1 | ||||||
| Альт. символы | PGAMA | ||||||
| Ген NCBI | 5223 | ||||||
| HGNC | 8888 | ||||||
| OMIM | 172250 | ||||||
| RefSeq | NM_002629 | ||||||
| UniProt | P18669 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 5.4.2.11 | ||||||
| Locus | Chr. 10 q25.3 | ||||||
| |||||||
| фосфоглицератмутаза 2 (мышца) | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Символ | PGAM2 | ||||||
| Ген NCBI | 5224 | ||||||
| HGNC | 8889 | ||||||
| OMIM | 261670 | ||||||
| RefSeq | NM_000290 | ||||||
| UniProt | P15259 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 5.4.2.11 | ||||||
| Locus | Chr. 7 p13-p12 | ||||||
| |||||||
- Этот фермент не следует путать с Бисфосфоглицерат мутаза который катализирует превращение 1,3-бисфосфоглицерат к 2,3-бисфосфоглицерат.
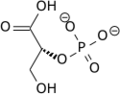
Фосфоглицератмутаза (PGM) любой фермент который катализирует шаг 8 из гликолиз. Они катализируют внутренний перенос фосфатной группы от C-3 к C-2, что приводит к превращению 3-фосфоглицерат (3PG) в 2-фосфоглицерат (2PG) через промежуточное соединение 2,3-бисфосфоглицерат. Эти ферменты делятся на два разных класса: кофактор -зависимый (dPGM) или независимый от кофактора (iPGM).[1] Фермент dPGM (EC 5.4.2.11 ) состоит примерно из 250 аминокислот и встречается у всех позвоночных, а также у некоторых беспозвоночных, грибов и бактерий. IPGM (EC 5.4.2.12 ) класс обнаружен у всех растений и водорослей, а также у некоторых беспозвоночных, грибов и грамположительных бактерий.[2] Этот класс ферментов PGM имеет то же суперсемейство, что и щелочная фосфатаза.[3]
Механизм
PGM - это изомераза фермент, эффективно переносящий фосфатная группа (PO43−) из углерода С-3 3-фосфоглицерат с углеродом C-2, образующим 2-фосфоглицерат. Всего dPGM может катализировать три реакции: мутазная реакция, приводящая к превращению 3PG в 2PG и наоборот,[4][5] фосфатазная реакция с образованием фосфоглицерата из 2,3-бисфосфоглицерата,[6][7] и синтазная реакция с образованием 2,3-бисфосфоглицерата из 1,3-бисфосфоглицерата, аналогичного ферменту бисфосфоглицератмутазе[нужна цитата ]. Кинетические и структурные исследования предоставили доказательства, указывающие на dPGM и бисфосфоглицератмутаза находятся паралогичный конструкции.[6] Оба фермента содержатся в надсемейство который также содержит фосфатазную часть фосфофруктокиназа 2 и фосфатаза простатической кислоты.[8]
Катализируемая мутазная реакция включает две отдельные фосфорильные группы, и конечный фосфат на 2-углеродном атоме не является тем же фосфатом, удаленным с 3-го углерода.
В зависимости от кофактора исходное состояние фермента, то активный сайт содержит фосфогистидиновый комплекс, образованный фосфорилирование конкретного гистидин остаток.[9] Когда 3-фосфоглицерат входит в активный сайт, фосфогистидиновый комплекс позиционируется как способствующий переносу фосфата от фермента к субстрату C-2, создавая 2,3-бисфосфоглицерат средний.
Дефосфорилирование из фермент гистидин вызывает локальное аллостерическое изменение в конфигурации фермента, которое теперь выравнивает 3-C фосфатную группу субстратов с фермент активный сайт гистидин и облегчает перенос фосфатов, возвращая фермент в исходное фосфорилированное состояние и высвобождает продукт 2-фосфоглицерат. 2,3-бисфосфоглицерат является кофактором dPGM. Напротив, класс iPGM не зависит от 2,3-бисфосфоглицерата и катализирует внутримолекулярный перенос фосфатной группы на монофосфоглицераты с использованием промежуточного соединения фосфосерина.[10]
Резюме реакции
3PG + P-фермент → 2,3BPG + фермент → 2PG + P-фермент
Промежуточный 3-фосфоглицерат 2-фосфоглицерат
ΔG ° ′ = + 1,1 ккал / моль
Изоферменты
Фосфоглицератмутаза существует в основном в виде димера двух идентичных или близкородственных субъединиц размером около 32 кДа. Фермент содержится в таких простых организмах, как дрожжи. Homo sapiens и его структура полностью сохраняется. (Дрожжевые PGM ≈ 74% консервативных по сравнению с формой млекопитающих).
У млекопитающих субъединицы фермента, по-видимому, представляют собой либо мышечную форму (m-тип), либо другую ткань (b-тип для мозга, из которого изначально был выделен b-изофермент). Таким образом, существующий в виде димера фермент имеет 3 изофермента, в зависимости от того, какие субъединицы образуют всю молекулу (mm, bb или mb). MM-тип встречается в основном в гладких мышцах почти исключительно. Изофермент mb находится в сердечных и скелетных мышцах, а bb-тип - в остальных тканях.[11] Хотя все три изофермента могут быть обнаружены в любой ткани, приведенное выше распределение основано на распространенности в каждой.
Интерактивная карта проезда
Нажмите на гены, белки и метаболиты ниже, чтобы ссылки на соответствующие статьи.[§ 1]
- ^ Интерактивную карту путей можно редактировать на WikiPathways: «ГликолизГлюконеогенез_WP534».
Регулирование
Фосфоглицератмутаза имеет небольшую положительную свободную энергию Гиббса, и эта реакция легко протекает в обоих направлениях. Поскольку это обратимая реакция, она не является участком основных механизмов регуляции или схем регуляции гликолитического пути.
Анионный молекулы, такие как ванадат,[12] ацетат, хлорид-ион, фосфат, 2-фосфогликолят и N- [трис (гидроксиметил) метил-2-амино] этансульфонат известны ингибиторы мутазной активности dPGM. Исследования показали, что dPGM чувствителен к изменениям ионной концентрации, при этом увеличение концентрации солей приводит к активации активности фосфатазы фермента при одновременном ингибировании его мутазной активности. Известно, что некоторые соли, такие как KCl, являются конкурентными ингибиторами в отношении активности 2-фосфоглицерата и мутазы.[13] Как фосфат, так и 2-фосфогликолят являются конкурентными ингибиторами мутазной активности в отношении субстратов 2-фосфоглицерата и 2,3-бисфосфоглицерата.[14]
Клиническое значение
У человека ген PGAM2, кодирующий этот фермент, расположен на коротком плече хромосомы 7.
Причины дефицита фосфоглицератмутазы болезнь накопления гликогена типа X редкое аутосомно-рецессивное генетическое заболевание с симптомами от легкой до умеренной; не считается опасным для жизни, и с ним можно справиться, изменив образ жизни.[нужна цитата ] Это проявляется как метаболическая миопатия и является одной из многих форм синдромов, ранее называвшихся мышечной дистрофией.[нужна цитата ] Дефицит PGAM1 влияет на печень, а дефицит PGAM2 влияет на мышцы.
Начало обычно отмечается в детстве или раннем взрослении, хотя некоторые, кто может быть слегка затронут этим расстройством, могут не знать, что у них оно есть. Пациенты с дефицитом PGAM обычно протекают бессимптомно, за исключением случаев, когда они предпринимают короткие, напряженные усилия, которые могут вызвать миалгии, судороги, некроз мышц и миоглобинурию.[15] Необычной патологической особенностью дефицита PGAM является ассоциация с тубулярными агрегатами. Симптомы - непереносимость физических нагрузок или активности, судороги и мышечные боли. Постоянная слабость встречается редко. Заболевание не прогрессирует и имеет отличный прогноз.[нужна цитата ]
Белки человека, содержащие этот домен
BPGM; PFKFB1; PFKFB2; PFKFB3; PFKFB4; PGAM1; PGAM2; PGAM4; PGAM5; STS1; УБАШ3А;
Рекомендации
- ^ Johnsen, U; Schönheit, P (сентябрь 2007 г.). «Характеристика кофактор-зависимых и кофакторнезависимых фосфоглицерат мутаз из архей». Экстремофилы: жизнь в экстремальных условиях. 11 (5): 647–57. Дои:10.1007 / s00792-007-0094-х. PMID 17576516. S2CID 5836321.
- ^ Jedrzejas, MJ (2000). «Структура, функция и эволюция фосфоглицерат мутаз: сравнение с фруктозо-2,6-бисфосфатазой, кислой фосфатазой и щелочной фосфатазой». Прогресс в биофизике и молекулярной биологии. 73 (2–4): 263–87. Дои:10.1016 / с0079-6107 (00) 00007-9. PMID 10958932.
- ^ Гальперин М.Ю .; Байрох, А; Кунин, Е.В. (август 1998 г.). «Суперсемейство металлоферментов объединяет фосфопентомутазу и кофакторнезависимую фосфоглицератмутазу с щелочными фосфатазами и сульфатазами». Белковая наука. 7 (8): 1829–35. Дои:10.1002 / pro.5560070819. ЧВК 2144072. PMID 10082381.
- ^ Сасаки, Р. Уцуми, S; Сугимото, Э; Чиба, H (15 июля 1976 г.). «Субъединичная структура и многофункциональные свойства дрожжевой фосфоглицеромутазы». Европейский журнал биохимии / FEBS. 66 (3): 523–33. Дои:10.1111 / j.1432-1033.1976.tb10578.x. PMID 182494.
- ^ Роза, ZB; Дубе, С. (25 августа 1976 г.). «Скорость фосфорилирования и дефосфорилирования фосфоглицерат мутазы и бисфосфоглицератсинтазы». Журнал биологической химии. 251 (16): 4817–22. PMID 8447.
- ^ а б Роза, ZB; Дубе, S (10 декабря 1978 г.). «Фосфоглицератмутаза. Кинетика и влияние солей на активность мутазы и бисфосфоглицератфосфатазы фермента из мышц куриной грудки». Журнал биологической химии. 253 (23): 8583–92. PMID 213437.
- ^ Сасаки, Р. Hirose, M; Сугимото, Э; Чиба, H (10 марта 1971 г.). «Исследования роли активности 2,3-дифосфоглицератфосфатазы в фосфоглицератмутазной реакции дрожжей». Biochimica et Biophysica Acta (BBA) - Энзимология. 227 (3): 595–607. Дои:10.1016/0005-2744(71)90010-6. PMID 4328052.
- ^ Ван, Y; Wei, Z; Лю, L; Cheng, Z; Линь, У; Ji, F; Гонг, Вт (17 июня 2005 г.). «Кристаллическая структура человеческой фосфоглицератмутазы B-типа, связанной с цитратом». Сообщения о биохимических и биофизических исследованиях. 331 (4): 1207–15. Дои:10.1016 / j.bbrc.2005.03.243. PMID 15883004.
- ^ Britton, HG; Кларк, Дж. Б. (март 1969 г.). «Механизм фосфоглицератмутазной реакции». Биохимический журнал. 112 (1): 10П – 11П. Дои:10.1042 / bj1120010pb. ЧВК 1187664. PMID 5774486.
- ^ Jedrzejas, MJ; Чандер, М; Setlow, P; Кришнасами, Г. (28 июля 2000 г.). «Механизм катализа кофакторнезависимой фосфоглицератмутазы из Bacillus stearothermophilus. Кристаллическая структура комплекса с 2-фосфоглицератом». Журнал биологической химии. 275 (30): 23146–53. Дои:10.1074 / jbc.m002544200. PMID 10764795.
- ^ Оменн, GS; Cheung, SC (май 1974 г.). «Маркер изофермента фосфоглицератмутазы для тканевой дифференциации у человека». Американский журнал генетики человека. 26 (3): 393–9. ЧВК 1762627. PMID 4827367.
- ^ Песня, L; Сюй, Z; Ю, X (август 2007 г.). «Молекулярное клонирование и характеристика гена фосфоглицерат мутазы из Clonorchis sinensis». Паразитологические исследования. 101 (3): 709–14. Дои:10.1007 / s00436-007-0540-9. PMID 17468884. S2CID 104159.
- ^ Гризолия, S; Tecson, J (11 января 1967 г.). «Ртуть-индуцированное обратимое повышение 2,3-дифосфоглицератфосфатазы и сопутствующее снижение мутазной активности фосфоглицератмутаз животных». Biochimica et Biophysica Acta (BBA) - Энзимология. 132 (1): 56–67. Дои:10.1016 / 0005-2744 (67) 90191-х. PMID 4291574.
- ^ Гризолия, S; Клеланд, WW (март 1968 г.). «Влияние концентрации соли, субстрата и кофактора на кинетическое и механическое поведение фосфоглицератмутазы». Биохимия. 7 (3): 1115–21. Дои:10.1021 / bi00843a032. PMID 5690561.
- ^ Саламе Дж., Гоял Н., Чоудри Р., Камело-Пирагуа С., Чонг П.С. (июль 2012 г.). «Дефицит фосфоглицератмутазы с трубчатыми агрегатами у пациента из панамы» (PDF). Мышечный нерв. 47 (1): 138–40. Дои:10.1002 / mus.23527. HDL:2027.42/95158. PMID 23169535. S2CID 34151935.
внешняя ссылка
- Фосфоглицерат + мутаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- PDBe-KB предоставляет обзор всей структурной информации, доступной в PDB для человеческой фосфоглицератмутазы 1