Фруктозо-1,6-бисфосфатаза - Fructose 1,6-bisphosphatase
| фруктозо-1,6-бисфосфатаза 1 | |||||||
|---|---|---|---|---|---|---|---|
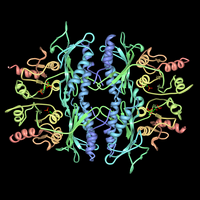 Фруктозо-1,6-бисфосфатаза и ее фруктозо-2,6-бисфосфатный комплекс. Отрисовано из PDB 3ФБП. | |||||||
| Идентификаторы | |||||||
| Символ | FBP1 | ||||||
| Альт. символы | FBP | ||||||
| Ген NCBI | 2203 | ||||||
| HGNC | 3606 | ||||||
| OMIM | 229700 | ||||||
| RefSeq | NM_000507 | ||||||
| UniProt | P09467 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 3.1.3.11 | ||||||
| Locus | Chr. 9 q22.3 | ||||||
| |||||||
| Фруктозо-1-6-бисфосфатаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 кристаллическая структура фруктозо-1,6-бисфосфатазы печени кролика при разрешении 2,3 ангстрем | |||||||||
| Идентификаторы | |||||||||
| Символ | FBPase | ||||||||
| Pfam | PF00316 | ||||||||
| Pfam клан | CL0171 | ||||||||
| ИнтерПро | IPR000146 | ||||||||
| PROSITE | PDOC00114 | ||||||||
| SCOP2 | 1frp / Объем / СУПФАМ | ||||||||
| |||||||||
| Фирмикут фруктозо-1,6-бисфосфатаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | FBPase_2 | ||||||||
| Pfam | PF06874 | ||||||||
| Pfam клан | CL0163 | ||||||||
| ИнтерПро | IPR009164 | ||||||||
| |||||||||
| Фруктозо-1,6-бисфосфатаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 кристаллическая структура фруктозо-1,6-бисфосфатазы | |||||||||
| Идентификаторы | |||||||||
| Символ | FBPase_3 | ||||||||
| Pfam | PF01950 | ||||||||
| ИнтерПро | IPR002803 | ||||||||
| SCOP2 | 1 мкм / Объем / СУПФАМ | ||||||||
| |||||||||
Фруктозобисфосфатаза (EC 3.1.3.11 ) является фермент что обращает фруктозо-1,6-бисфосфат к фруктозо-6-фосфат в глюконеогенез и Цикл Кальвина которые оба анаболические пути. Фруктозобисфосфатаза катализирует превращение фруктозо-1,6-бисфосфата во фруктозо-6-фосфат, что является обратной реакцией, которая катализируется фосфофруктокиназа в гликолиз.[1][2] Эти ферменты катализируют реакцию только в одном направлении и регулируются такими метаболитами, как 2,6-бисфосфат фруктозы так что высокая активность одного из двух ферментов сопровождается низкой активностью другого. Более конкретно, фруктозо 2,6-бисфосфат аллостерически ингибирует фруктозо-1,6-бисфосфатазу, но активирует фосфофруктокиназу-I. Фруктозо-1,6-бисфосфатаза участвует во многих различных метаболические пути и найдено в большинстве организмы. FBPase требует металла ионы для катализа (Mg2+ и Mn2+ является предпочтительным), и фермент сильно ингибируется Ли+.
Структура
В складывать фруктозо-1,6-бисфосфатазы из свиньи было отмечено, что он идентичен таковому инозитол-1-фосфатазы (IMPase).[3] Инозитол полифосфат-1-фосфатаза (IPPase), IMPase и FBPase имеют общий мотив последовательности (Жерех -Pro -Иль /Лея -Asp-Gly /Сер -Thr / Ser), который был показан связывать металл ионы и участвовать в катализе. Этот мотив также встречается в отдаленно связанных грибковый, бактериальный и дрожжи IMPase гомологи. Было высказано предположение, что эти белки определить древний структурно консервативная семья участвует в разнообразных метаболический пути, включая передачу сигналов инозита, глюконеогенез, ассимиляцию сульфатов и, возможно, хинон метаболизм.[4]
Распространение видов
Три разные группы FBPases были идентифицированы в эукариоты и бактерии (FBPase I-III).[5] Ни одна из этих групп не обнаружена в археи до сих пор, хотя новая группа FBPases (FBPase IV), которая также показывает инозитол монофосфатаза активность недавно была обнаружена у архей.[6]
Новая группа FBPases (FBPase V) обнаружена в теплолюбивый археи и гипертермофильные бактерия Aquifex aeolicus.[7] Охарактеризованные члены этой группы демонстрируют строгие субстратная специфичность для FBP, и в этих организмы.[7][8] А структурный исследование предполагает, что у FBPase V есть новый складывать для сахар фосфатаза, образуя четырехслойный бутерброд альфа-бета-бета-альфа, в отличие от более обычного пятислойного расположения альфа-бета-альфа-бета-альфа.[8] Расположение каталитический боковые цепи и металл лиганды оказался совместимым с трехметаллическим ион механизм вспомогательного катализа, предложенный для других FBPases.
Фруктозо-1,6-бисфосфатазы, обнаруженные в Фирмикуты (низкий GC Грамположительный бактерии) не обнаруживают каких-либо значительных последовательность сходство с ферменты От других организмы. В Bacillus subtilis фермент ингибируется AMP, хотя это можно преодолеть фосфоенолпируват, и зависит от Mn (2+).[9][10] Мутанты без этого фермента, по-видимому, все еще могут расти на глюконеогенных субстратах для роста, таких как малат и глицерин.
Интерактивная карта проезда
Нажмите на гены, белки и метаболиты ниже, чтобы ссылки на соответствующие статьи.[§ 1]
- ^ Интерактивную карту путей можно редактировать на WikiPathways: «ГликолизГлюконеогенез_WP534».
Спячка и холодная адаптация
Фруктозо-1,6-бисфосфатаза также играет ключевую роль в спячка, что требует строгого регулирования метаболический процессы для облегчения перехода в режим гибернации, обслуживания, выхода из режима гибернации и настройки, позволяющие покой.[11][12][13] Во время гибернации скорость метаболизма животного может снизиться примерно до 1/25 его эвтермический скорость метаболизма в покое.[12][13][14] FBPase модифицируется у животных, находящихся в спячке, чтобы быть более чувствительными к температуре, чем у умерших животных.[11][13][14] FBPase в печени летучих мышей в спячке показала снижение K на 75%.м для его субстрата FBP при 5 ° C, чем при 37 ° C.[11] Однако у эутермных летучих мышей это снижение составило всего 25%, демонстрируя разницу в температурной чувствительности между зимующими и эвтермическими летучими мышами.[11] Когда чувствительность к аллостерический ингибиторы, такие как AMP, АДФ, неорганический фосфат и фруктозо-2,6-бисфосфат были исследованы, FBPase от зимующих летучих мышей была намного более чувствительна к ингибиторам при низкой температуре, чем у умерших летучих мышей.[11][15][16]
Во время гибернации резко снижается и дыхание, в результате чего возникают условия относительной аноксия в тканях. Аноксические условия подавляют глюконеогенез, и, следовательно, FBPase, стимулируя гликолиз, и это еще одна причина снижения активности FBPase у гибернационных животных.[17] Субстрат FBPase, фруктозо-1,6-бисфосфат, также, как было показано, активирует пируваткиназа в гликолизе, связывая усиление гликолиза со снижением глюконеогенеза, когда активность FBPase снижается во время гибернации.[13]
Помимо гибернации, есть свидетельства того, что активность FBPase значительно варьируется между теплым и холодным сезонами даже у животных, которые не впадают в спячку.[18]У кроликов, подвергавшихся воздействию низких температур, активность FBPase снижалась на протяжении всего времени воздействия холода и возрастала, когда температура снова становилась теплее.[18] Считается, что механизм этого ингибирования FBPase заключается в переваривании FBPase посредством лизосомный протеазы, которые высвобождаются на более высоких уровнях в более холодные периоды.[18] Ингибирование FBPase через протеолитический пищеварение снижает глюконеогенез по сравнению с гликолизом в холодные периоды, аналогично спячке.[18]
Фруктозо-1,6-бисфосфатальдолаза - еще один температурно-зависимый фермент, который играет важную роль в регуляции гликолиза и глюконеогенеза во время гибернации.[14] Его основная роль заключается в гликолизе, а не в глюконеогенезе, но его субстрат такая же, как у FBPase, поэтому ее активность влияет на активность FBPase в глюконеогенезе. Альдолаза показывает аналогичные изменения активности с FBPase при более низких температурах, такие как сдвиг в сторону повышения оптимума pH при более низких температурах. Эта адаптация позволяет ферментам, таким как FBPase и фруктозо-1,6-бисфосфатальдолаза, отслеживать внутриклеточные изменения pH у гибернирующих животных и согласовывать диапазоны их активности с этими изменениями.[14] Альдолаза также дополняет активность FBPase в аноксических условиях (обсужденных выше), увеличивая гликолитический выход, в то время как ингибирование FBPase снижает активность глюконеогенеза.[19]
Сахарный диабет

Фруктозо-1,6-бисфосфатаза также играет ключевую роль в лечении диабет 2 типа. При этом заболевании гипергликемия вызывает множество серьезных проблем, и лечение часто направлено на снижение уровня сахара в крови.[20][21][22] Глюконеогенез в печени является основной причиной гиперпродукции глюкозы у этих пациентов, поэтому ингибирование глюконеогенеза является разумным способом лечения диабета 2 типа. FBPase является хорошим ферментом для нацеливания на путь глюконеогенеза, поскольку он ограничивает скорость и контролирует включение всех трехуглеродных субстратов в глюкозу, но не участвует в распаде гликогена и удаляется из митохондриальных стадий пути.[20][21][22] Это означает, что изменение его активности может иметь большое влияние на глюконеогенез, снижая при этом риск гипогликемия и другие возможные побочные эффекты от изменения других ферментов глюконеогенеза.[20][21]
Были разработаны препараты-кандидаты, имитирующие ингибирующую активность AMP в отношении FBPase.[20][22] Были предприняты попытки имитировать аллостерические ингибирующие эффекты AMP, делая лекарство как можно более структурно отличным от него.[22] В настоящее время разработаны ингибиторы FBPase второго поколения, которые показали хорошие результаты в клинических испытаниях на млекопитающих, а теперь и на людях.[20][23]
Смотрите также
Рекомендации
- ^ Маркус Ф., Харрш ПБ (май 1990 г.). «Аминокислотная последовательность фруктозо-1,6-бисфосфатазы хлоропластов шпината». Архивы биохимии и биофизики. 279 (1): 151–7. Дои:10.1016 / 0003-9861 (90) 90475-Е. PMID 2159755.
- ^ Маркус Ф., Гонтеро Б., Харрш ПБ, Риттенхаус Дж. (Март 1986 г.). «Гомология аминокислотной последовательности фруктозо-1,6-бисфосфатаз». Сообщения о биохимических и биофизических исследованиях. 135 (2): 374–81. Дои:10.1016 / 0006-291X (86) 90005-7. PMID 3008716.
- ^ Чжан Ю., Лян Дж.Й., Липскомб В.Н. (февраль 1993 г.). «Структурное сходство между фруктозо-1,6-бисфосфатазой и инозитолмонофосфатазой». Сообщения о биохимических и биофизических исследованиях. 190 (3): 1080–3. Дои:10.1006 / bbrc.1993.1159. PMID 8382485.
- ^ Йорк JD, Ponder JW, Majerus PW (май 1995 г.). «Определение семейства металл-зависимых / Li (+) - ингибированных фосфомоноэстераз на основе консервативной трехмерной структуры ядра». Труды Национальной академии наук Соединенных Штатов Америки. 92 (11): 5149–53. Bibcode:1995PNAS ... 92.5149Y. Дои:10.1073 / пнас.92.11.5149. ЧВК 41866. PMID 7761465.
- ^ Донахью Дж. Л., Баунас Дж. Л., Нихаус В. Г., Ларсон Т. Дж. (Октябрь 2000 г.). «Очистка и характеристика глюкозо-1,6-бисфосфатазы, кодируемой glpX, нового фермента глицерин-3-фосфатного регулона Escherichia coli». Журнал бактериологии. 182 (19): 5624–7. Дои:10.1128 / jb.182.19.5624-5627.2000. ЧВК 111013. PMID 10986273.
- ^ Стец Б., Ян Х., Джонсон К.А., Чен Л., Робертс М.Ф. (ноябрь 2000 г.). «MJ0109 представляет собой фермент, который одновременно является инозитолмонофосфатазой и« отсутствующей »фруктозо-1,6-бисфосфатазой архей». Структурная биология природы. 7 (11): 1046–50. Дои:10.1038/80968. PMID 11062561. S2CID 7617099.
- ^ а б Рашид Н., Иманака Х., Канаи Т., Фукуи Т., Атоми Х., Иманака Т. (август 2002 г.). «Новый кандидат на истинную фруктозо-1,6-бисфосфатазу в архее». Журнал биологической химии. 277 (34): 30649–55. Дои:10.1074 / jbc.M202868200. PMID 12065581.
- ^ а б Нисимасу Х., Фушинобу С., Шоун Х., Вакаги Т. (июнь 2004 г.). «Первая кристаллическая структура нового класса фруктозо-1,6-бисфосфатазы, присутствующая в термофильных архее». Структура. 12 (6): 949–59. Дои:10.1016 / j.str.2004.03.026. PMID 15274916.
- ^ Fujita Y, Freese E (июнь 1979 г.). «Очистка и свойства фруктозо-1,6-бисфосфатазы Bacillus subtilis». Журнал биологической химии. 254 (12): 5340–9. PMID 221467.
- ^ Fujita Y, Yoshida K, Miwa Y, Yanai N, Nagakawa E, Kasahara Y (август 1998 г.). «Идентификация и экспрессия гена фруктозы-1,6-бисфосфатазы (fbp) Bacillus subtilis». Журнал бактериологии. 180 (16): 4309–13. Дои:10.1128 / JB.180.16.4309-4313.1998. ЧВК 107433. PMID 9696785.
- ^ а б c d е Стори КБ (декабрь 1997 г.). «Метаболическая регуляция в спячке млекопитающих: ферментные и белковые адаптации». Сравнительная биохимия и физиология. Часть A, физиология. 118 (4): 1115–24. Дои:10.1016 / S0300-9629 (97) 00238-7. PMID 9505421.
- ^ а б Хельдмайер Г., Ортманн С., Элверт Р. (август 2004 г.). «Естественный гипометаболизм во время гибернации и ежедневного оцепенения у млекопитающих». Респираторная физиология и нейробиология. 141 (3): 317–29. Дои:10.1016 / j.resp.2004.03.014. PMID 15288602. S2CID 32940046.
- ^ а б c d Брукс С.П., Стори КБ (январь 1992 г.). «Механизмы гликолитического контроля во время гибернации у суслика Spermophilus lateralis». Журнал сравнительной физиологии B. 162 (1): 23–28. Дои:10.1007 / BF00257932. S2CID 1881399.
- ^ а б c d Макдональд Дж. А., Стори КБ (декабрь 2002 г.). «Очистка и характеристика фруктозобисфосфатальдолазы из суслика, Spermophilus lateralis: роль фермента в гибернации млекопитающих». Архивы биохимии и биофизики. 408 (2): 279–85. Дои:10.1016 / S0003-9861 (02) 00579-9. PMID 12464282.
- ^ Экдал К.Н., Экман П. (февраль 1984 г.). «Влияние фруктозо-2,6-бисфосфата и АМФ на активность фосфорилированной и нефосфорилированной фруктозо-1,6-бисфосфатазы из печени крысы». Письма FEBS. 167 (2): 203–9. Дои:10.1016/0014-5793(84)80127-1. PMID 6321241. S2CID 22515761.
- ^ Такета К., Погелл Б.М. (февраль 1965 г.). "Аллостерическое ингибирование фруктозо-1,6-дифосфатазы печени крыс аденозин-5'-монофосфатом". Журнал биологической химии. 240: 651–62. PMID 14275118.
- ^ Андервуд А. Х., Ньюсхолм Е. А. (июль 1967 г.). «Контроль гликолиза и глюконеогенеза в срезах коры почек крыс». Биохимический журнал. 104 (1): 300–5. Дои:10.1042 / bj1040300. ЧВК 1270577. PMID 4292000.
- ^ а б c d Фишер Э. Х., Кребс Э. Г., Нейрат Х, Штадтман Э. Р., ред. (1974). Метаболическая взаимопревращение ферментов, 1973 г. Третий международный симпозиум, проведенный в Сиэтле 5-8 июня 1973 г.. Берлин, Гейдельберг: Springer. ISBN 978-3-642-80817-3.
- ^ Доусон Нью-Джерси, Биггар К.К., Стори КБ (2013). «Характеристика фруктозо-1,6-бисфосфатальдолазы во время аноксии у толерантной черепахи, Trachemys scripta elegans: оценка активности, экспрессии и структуры ферментов». PLOS ONE. 8 (7): e68830. Bibcode:2013PLoSO ... 868830D. Дои:10.1371 / journal.pone.0068830. ЧВК 3715522. PMID 23874782.
- ^ а б c d е Данг Кью, PD Van Poelje, MD Эрион (2012). «Глава 11: Открытие и разработка MB07803, ингибитора фруктозо-1,6-бисфосфатазы второго поколения с улучшенными фармакокинетическими свойствами, как потенциальное средство лечения диабета 2 типа». В Джонс Р.М. (ред.). Новые терапевтические стратегии при диабете 2 типа: подходы с использованием малых молекул. Кембридж: Королевское химическое общество. Дои:10.1039/9781849735322-00306. ISBN 978-1-84973-414-1.
- ^ а б c Arch JR (2011). «Термогенез и связанные с ним метаболические цели в антидиабетической терапии». В Schwanstecher M (ред.). Диабет - перспективы медикаментозной терапии (1-е изд.). Берлин, Гейдельберг: Springer. п. 203. ISBN 978-3-642-17214-4.
- ^ а б c d ван Поэлье PD, Potter SC, Chandramouli VC, Landau BR, Dang Q, Erion MD (июнь 2006 г.). «Ингибирование фруктозо-1,6-бисфосфатазы снижает чрезмерное производство эндогенной глюкозы и снижает гипергликемию у крыс с диабетом Цукера». Сахарный диабет. 55 (6): 1747–54. Дои:10.2337 / db05-1443. PMID 16731838.
- ^ Каур Р., Дахия Л., Кумар М. (декабрь 2017 г.). «Ингибиторы фруктозо-1,6-бисфосфатазы: новый действенный подход к лечению сахарного диабета 2 типа». Европейский журнал медицинской химии. 141: 473–505. Дои:10.1016 / j.ejmech.2017.09.029. PMID 29055870.
дальнейшее чтение
- Берг Дж. М., Тимочко Дж. Л., Страйер Л. (2002). «Гликолиз и глюконеогенез». В Сьюзан Моран (ред.). Биохимия (5-е изд.). 41 Мэдисон-авеню, Нью-Йорк, Нью-Йорк: У. Х. Фриман и компания. ISBN 0-7167-3051-0.CS1 maint: location (связь)
внешняя ссылка
- Фруктозо-1,6-бифосфатаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)