Эндотелиальная липаза - Endothelial lipase
| Эндотелиальная липаза | |
|---|---|
| Идентификаторы | |
| Символ | LIPG |
| Альт. символы | EL |
Эндотелиальная липаза (LIPG) это форма липаза секретируется сосудистым эндотелиальный клетки в тканях с высоким уровнем метаболизма и васкуляризации, таких как печень, легкие, почки и щитовидная железа.[1] Фермент LIPG является жизненно важным компонентом многих биологических процессов. Эти процессы включают липопротеин метаболизм, цитокин экспрессия и липидный состав в клетках.[1] В отличие от липаз, гидролизующих Триглицериды, эндотелиальная липаза в первую очередь гидролизует фосфолипиды.[1] Благодаря специфичности гидролиза, эндотелиальная липаза участвует во многих жизненно важных системах организма. В отличие от полезных ролей, которые LIPG играет в организме, считается, что эндотелиальная липаза играет потенциальную роль в развитии рака и воспаления.[1] Знания, полученные in vitro и in vivo, предполагают связь с этими условиями, но знания о человеческом взаимодействии отсутствуют из-за недавнего открытия эндотелиальной липазы.[2] Эндотелиальная липаза была впервые охарактеризована в 1999 году.[3] Две независимые исследовательские группы, известные этим открытием, клонировали ген эндотелиальной липазы и идентифицировали новую липазу, секретируемую эндотелиальными клетками.[2] Анти-Атеросклероз возможность за счет уменьшения закупорки зубным налетом и предполагаемой способности поднять Липопротеины высокой плотности (HDL) получили признание эндотелиальной липазы.[4]
Открытие

В 1999 г. идентификация эндотелиальной липазы была независимо обнаружена двумя исследовательскими группами.[2]
Первая группа в Rhone-Poulenc Rorer клонировала и охарактеризовала нового члена семейства триацилглиеролов (TG). Когда эта новая эндотелиальная липаза была сверхэкспрессирована у мышей, концентрации ЛПВП Холестерин и аполипопротеин A-I в плазме снизился.[3]
Вторая группа в Стэнфордском университете самостоятельно клонированный та же самая эндотелиальная липаза из эндотелиальных клеток пупочной вены человека, эндотелиальных клеток коронарных артерий человека и желточных мешков, подобных эндотелию грызунов.[5] Подавление субтрактивной гибридизации был использован для выделения генов.[5] Затем гены сравнивали и выравнивали. Два фрагмента кДНК экспрессировали ген липазы и эндотелиальные свойства.[5] Нозерн-блот анализ задокументировал образцы.[5] Предполагаемая связь с метаболизмом и сосудистыми заболеваниями была приписана тканевой селективной экспрессии в эндотелиальных клетках.[5]
Структура
Эндотелиальная липаза - это белок, относящийся к категории триглицеридных липаз.[1] Этот белок кодируется геном LIPG.[1] Эндотелиальная липаза секретируется эндотелиальными клетками сосудов и является единственной липазой на сегодняшний день.[3] Первичная секреция - это белок 55 кДа, который секретируется белком 68 кДа после посттрансляционного Гликозилирование.[1] LIPG функционирует, поскольку он связывается с Протеогликаны.[1] LIPG также может дополнительно расщепляться.[1] Дополнительное расщепление привело бы к неактивности N-конца белка 40 кДа, 40 кДа и С-конца 28 кДа.[1] LIPG имеет возможность формировать димер белка до секреции, которая вызывает появление димеризации.[1] Реакция присоединения того же соединения и молекул повышает устойчивость к расщеплению, и ограниченная активность сохраняется.[1]

Биологическая функция
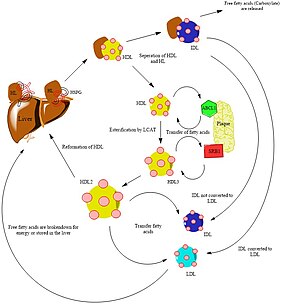
Метаболизм
Участком ферментативной активности эндотелиальной липазы является поверхность эндотелиальных клеток. LIPG регулирует метаболизм липопротеинов посредством гидролиза фосфолипдов ЛПВП.[4] Этот липопротеин высокой плотности представляет собой амфипатический липид, что означает, что липид состоит как из гидрофобного, так и из гидрофильного компонентов.[6] Холестерин имеет четырехкольцевую структуру и изопреноид углеводороды на основе.[6] Хотя холестерину не хватает головной фосфатной группы, гидроксильный компонент холестерина взаимодействует с водой, классифицируя холестерин как амфипатический.[6] Холестерин ЛПВП приносит огромную пользу организму и жизненно важен для поддержания текучести естественных мембран.[6] Холестерин ЛПВП необходимо поддерживать на определенном уровне для обеспечения нормального роста и размножения клеток. Способность ЛПВП абсорбировать холестерин и транспортировать его в печень способствует удалению холестерина из организма.[7] Напротив, Липопротеин низкой плотности (ЛПНП) холестерин работает противоположно. Холестерин ЛПНП не выводит холестерин из организма, а скорее служит основой для накопления холестерина.[7] Необходимо поддерживать низкий уровень ЛПНП в организме, чтобы избежать накопления холестерина в артериях. Когда ЛПВП гидролизуются, скорость обновления ЛПВП увеличивается, а уровень холестерина в плазме снижается.[4] Этот гидролиз позволяет ускорить или продолжить выведение холестерина из организма, чтобы избежать его накопления. После гидролиза ЛПВП происходит поглощение предшественников липидов свободных жирных кислот.[1] Эти липиды затем используются в других фосфолипидах. катаболизм.[1] Таким образом, эндотелиальная липаза считается ключевым компонентом метаболизма за счет гидролиза липопротеинов высокой плотности. d
Сосудистая биология
Эндотелиальная липаза связана с потенциальным лечением и улучшением атеросклероза. Атеросклероз - это сосудистое заболевание, которое вызывается накоплением артериальных бляшек.[8] Холестерин, жир, кальций и другие компоненты способствуют образованию налета в крови.[8] Зубной налет вреден для здоровья сосудов, поскольку он сужает и укрепляет артерии, вызывая недостаток богатого кислородом кровотока.[8] Увеличение ЛПВП служит лечением атеросклероза. Гидролиз HDL приводит к транспортировке холестерина в печень.[7] Система фильтрации печени помогает вывести холестерин из организма. Следовательно, уровень холестерина в плазме снизится. Таким образом, синтез эндотелиальной липазы HDL может предоставить адекватную возможность для повышения уровня HDL. Данные предполагают, что ингибирование эндотелиальной липазы должно повышать уровень ЛПВП в плазме, в первую очередь у пациентов с низким уровнем ХС-ЛПВП.[4] Повышенный риск атеросклероза связан с низким уровнем ЛПВП.[4] Хотя функциональную корреляцию можно провести, клинических данных, подтверждающих предполагаемые потенциальные преимущества в патофизиологии сосудов, мало.
Рекомендации
- ^ а б c d е ж грамм час я j k л м п Ю Дже, Хан Си, Вольфсон Б., Чжоу Кью (январь 2018 г.). «Роль эндотелиальной липазы в метаболизме липидов, воспалении и раке». Гистология и гистопатология. 33 (1): 1–10. Дои:10.14670 / HH-11-905. ЧВК 5858721. PMID 28540715.
- ^ а б c Paradis ME, Lamarche B (февраль 2006 г.). «Эндотелиальная липаза: ее роль в сердечно-сосудистых заболеваниях». Канадский журнал кардиологии. 22 Дополнение B (Дополнение B): 31B – 34B. Дои:10.1016 / S0828-282X (06) 70984-9. ЧВК 2780840. PMID 16498510.
- ^ а б c Джей М., Линч К.Дж., Кравец Дж., Маршадье Д., Модж С., Доан К., Саут Ви, Амин Д., Перрон М., Рейдер Д.Д. (апрель 1999 г.). «Новая липаза эндотелиального происхождения, которая модулирует метаболизм ЛПВП». Природа Генетика. 21 (4): 424–8. Дои:10.1038/7766. PMID 10192396. S2CID 20658953.
- ^ а б c d е Дэрроу А.Л., Олсон М.В., Синь Х, Берк С.Л., Смит К., Шалк-Хихи С., Уильямс Р., Байуми С.С., Декман И.С., Тодд М.Дж., Дамиано Б.П., Коннелли М.А. (февраль 2011 г.). «Новый флуорогенный субстрат для измерения активности эндотелиальной липазы». Журнал липидных исследований. 52 (2): 374–82. Дои:10.1194 / мл. D007971. ЧВК 3023558. PMID 21062953.
- ^ а б c d е Хирата К., Дичек Х. Л., Чоффи Дж. А., Чой С. Ю., Липер Н. Дж., Кинтана Л., Кронмал Г. С., Купер А. Д., Quertermous T (май 1999 г.). «Клонирование уникальной липазы из эндотелиальных клеток расширяет семейство генов липаз». Журнал биологической химии. 274 (20): 14170–5. Дои:10.1074 / jbc.274.20.14170. PMID 10318835.
- ^ а б c d Лодиш Х, Берк А, Кайзер С, Кригер М, Бретчер А, Плоег Х, Амон А, Мартин К. (2016). Молекулярная клеточная биология (8-е изд.). Нью-Йорк: W.H. Фримен и компания. С. 273–282. ISBN 9781464183393. OCLC 1003278428.
- ^ а б c CDC (2017-10-31). «Холестерин ЛПНП и ЛПВП:« Плохой »и« Хороший »Холестерин». Центры по контролю и профилактике заболеваний. Получено 2019-04-11.
- ^ а б c «Атеросклероз | Национальный институт сердца, легких и крови (NHLBI)». www.nhlbi.nih.gov. Получено 2019-04-11.
внешняя ссылка
- эндотелиальный + липаза, + человеческий в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
| Клеточная биология |
|---|
