Бета-пропеллерная фитаза - Beta-propeller phytase
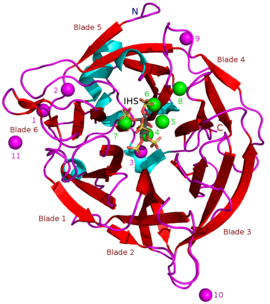
β-пропеллерные фитазы (BPPs) являются группой ферменты (т.е. белковое суперсемейство ) с круглым бета-винт структура. БПП фитазы, что означает, что они могут удалить (гидролизовать ) фосфат группы из фитиновая кислота и его фитатные соли.[2] Гидролиз происходит ступенчато и обычно заканчивается мио-Инозитолтрифосфатный продукт, который имеет три фосфатные группы, все еще связанные с ним.[3] Настоящий субстрат БПП является кальций фитат[4] и чтобы его гидролизовать, БПП должны иметь Ca2+ ионы связаны с собой. BPP являются наиболее широко встречающимся суперсемейством фитаз в окружающей среде, и считается, что они играют важную роль в круговороте фитат-фосфор в почве и воде.[5] Как их альтернативное название щелочная фитаза предполагает, что BPP лучше всего работают в базовый (или нейтральная) среда. Их pH optima 6–9,[2] который является уникальным среди фитаз.[5]
Возможное использование
По состоянию на апрель 2018 года BPP не используются в коммерческих целях, но могут иметь потенциал для такого использования. Фитазы гистидиновой кислоты (HAP) - единственная группа фитаз, которая в настоящее время используется в кормах для животных.
Корма для животных
Рекомбинантный фитазы обычно добавляются в сельское хозяйство к корма для животных из однокамерный животные для увеличения питательных веществ корма биодоступность.[6] Эти питательные вещества включают: фосфор который связан с фитатами в виде их фосфат группы. В отличие от жвачные животные подобно крупный рогатый скот, кишечные бактерии животных с однокамерным желудком, таких как свиньи и куры не могут должным образом гидролизовать эти группы, чтобы пищеварительная система животного могла использовать фосфор. Таким образом, неабсорбированный фосфор теряется и может попадать в окружающую среду у животных. навоз через сельскохозяйственные стоки и причины эвтрофикация. Фитиновая кислота также может работать как антинутриент: может хелат кальция из корма и уменьшить его биодоступность до 60–70% общего содержания кальция в корме. Добавление фитазы улучшает доступность кальция, а также может улучшить биодоступность утюг и цинк. Это также может увеличить доступность медь и марганец. Аминокислота биодоступность существенно не увеличивается.[7]
По сравнению с фитазами гистидиновой кислоты (HAP), которые часто нестабильны при температурах выше 65 ° C, BPP естественным образом могут выдерживать высокие температуры 80–85 ° C. Такие температуры обычно используются в гранулирование из корма для животных во время его изготовления. В отличие от HAP, BPP имеют нейтральный или щелочной оптимум pH, что позволяет использовать их в нейтральной или щелочной среде. Это расширяет возможности применения фитазов.[2] BPP можно использовать в кормах для водных животных, потому что многие из этих животных любят Рыбы и креветки иметь нейтральный или щелочной желудочно-кишечный тракт.[8] BPP также являются фитат-специфичными, в отличие от HAP,[5] которые гидролизуют также другие фосфатсодержащие молекулы, такие как ADP, GTP и НАДН.[9] Однако БПП каталитически более чем в 2–60 раз медленнее, чем современные ГП. HAP имеют удельная каталитическая активность из 100–3000 U мг−1. БПП обычно обладают удельной каталитической активностью менее 50 Ед. Мг.−1.[2] Из-за такой низкой активности практическое использование БПП требует гораздо больше исследований.[5]
Структура
По состоянию на апрель 2018 г., 7 БПП кристаллические структуры были известны: 3AMR, 3 утра, 1H6L, 1POO, 2POO, 1CVM и 1QLG.
Масса известных БПП составляет примерно 35–68 kДа.[5] Их конструкция β-пропеллера в форме пончика состоит из 6 антипараллельных бета-лист конструкции или «лопасти». Одна из этих лопаток имеет 5 β-листов (№ 5 на рисунке в начале статьи), а остальные 4 β-листа. Между этими лопастями существует гидрофобное взаимодействие, которое, как считается, удерживает структуру гребного винта вместе. Эти лезвия образуют туннельное отверстие через фермент. Этот туннель связывает некоторые молекулы воды. Перед туннелем находится ферментный активный сайт который в целом заряжен положительно из-за Ca2+ ионы, которые он связывает, и определенные положительные аминокислотные остатки. Этот участок связывает отрицательно заряженный фитат кальция и гидролизует из него фосфаты.[2]
Мотивы

Исследование, проведенное в 2008 году Huang et al. по сравнению 66 BPP пептидные последовательности и обнаружил, что последовательность мотивов DA [A / T / E] DDPA [I / L / V] W и NN [V / I] D [I / L / V] R [Y / D / Q] были сохранены во всех изученных BPP. R [Y / D / Q], например, означает, что р и Y, D или же Q были найдены в последовательности, то есть RY или RD или RQ.[10] 2014 исследование Kumar et al. сравнили 44 BPP и нашли 10 мотивов. Два из них, DDPAIW [VI] [HN] PK [DN] P [ESA] KS и NN [F / V] D [I / V / L], были обнаружены во всех изученных BPP. Было отмечено, что они аналогичны тем, которые были обнаружены в исследовании 2008 года, проведенном Huang et al.[5]
Кальциевая зависимость и ингибиторы
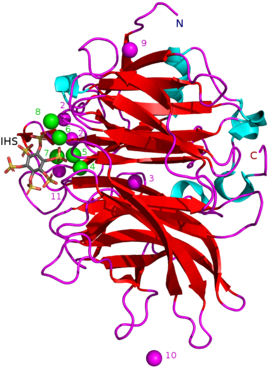
BPP зависят от кальция металлопротеины. Их активный сайт имеет много кальция катионы (Ca2+) связаны с ним через отрицательно заряженные аминокислота карбоксилат группы. Положительные ионы кальция необходимы, чтобы сделать связывание отрицательного фитата электрически благоприятным. Связывание происходит через отрицательно заряженные фосфатные группы фитата вместе с определенными положительными аминокислотными остатками BPP, которые связываются непосредственно с фитатом.[1] Ca2+ концентрации также влияют на BPP pH Оптима и термостабильность: например, с Bacillus sp. ХУ-10 БПП активность самая высокая - 10 мM добавленных CaCl2 при 60 ° C и pH 6–9,5. Без добавления CaCl2 максимальная активность pH наблюдается при 40 ° C и pH 6,5–8,5.[5]
Удаление Са2+ приводит к потере каталитической активности, поэтому Ca2+ хелатирующий EDTA подавляет BPP. Определенный точечные мутации кальций-связывающих аминокислот также останавливает функцию ферментов. Двухвалентный ионы как CD2+, Mn2+, Cu2+, Ба2+, Hg2+, Zn2+, Co2+ и Fe2+ ингибируют BPP, заменяя Ca2+ внутри фермента.[5] Вероятно, это связано с тем, что эти катионы слишком малы по сравнению с Ca2+ ионы, которые имеют Радиус Ван-дер-Ваальса (WDV) 0,99 Å. Co2+ имеет VDW 0,74 Å, например, и, следовательно, вероятно, слишком мал для выполнения тех же задач, что и Ca2+ может. Однако Sr2+ ионы могут заменить Ca2+ по крайней мере, в некоторых случаях без полной потери каталитической функции. Sr2+ Радиус VDW составляет 1,12 Å и аналогичен радиусу Ca2+.[4] Подобную совместимость между разными ионами можно увидеть и в некоторых других ферментах.[11]
Высокий Ca2+ концентрация может повысить скорость катализа BPP до предела. Когда Ca2+ концентрация превышает этот предел, лишний Ca2+ ионы начинают работать как конкурентные ингибиторы. Высокие концентрации свободного фитата, не связанного с Ca2+ также подавляет BPP. Это происходит, возможно, за счет хелатирования кальция, опосредованного свободным фитатом.2+ привязаны к BPP.[4]
Другие типы ингибиторов включают: оксианионный (связывание кислорода) молибдат, вольфрамат и ванадат. Было высказано предположение, что ингибирование этими оксианионами происходит потому, что они образуют тригонально-бипирамидный комплексы в активном центре фермента, похожие на переходное состояние фосфатной группы фитата во время его гидролиза. Ортофосфат который высвобождается из фитиновой кислоты, работает как конкурентный ингибитор BPP.[9] Аналог фитиновой кислоты мио-Инозитол-гексасульфат (IHS) ингибирует BPP, и это было использовано в качестве вспомогательного средства в структурных исследованиях BPP из-за его сходства с фитиновой кислотой (см. 3AMR ).[2]
Механизм гидролиза
В гидролиз механизм, предложенный в 2001 году Shin et al. в Ca2+ ионы, связанные с BPP, делятся на гидролиз и сайт сходства ионы. В центре гидролиза Ca2+ помочь фосфату, который должен быть удален, соединиться с активный сайт. Они также активируют молекулу воды, которая участвует в гидролизе, превращая ее в ОЙ− ион и стабилизировать переходное состояние во время катализа. Ионы области сродства увеличивают сродство фитата к активному центру и удерживают фитат неподвижным во время гидролиза от других его фосфатных групп. Гидролиз повторяют ступенчато до тех пор, пока мио-инозитол получается продукт с тремя фосфатами.[3] Другие исследования подтверждают наличие продукта с тремя фосфатами,[12][13][14][15] но больше фосфатов может быть удалено в экстремальных условиях, таких как высокая концентрация BPP и увеличенное время инкубации.[13]

Фактический гидролиз, предложенный Shin et al. происходит в два этапа. Второй медленнее и ограничивает общую скорость реакции. На первом этапе карбонильная группа отводит электроны от фосфора фосфата, делая его бедным электронами, то есть оставляя его с положительным зарядом. Одновременно ОН− отдает пару электронов номинально положительному фосфору в фосфате. А тригонально-бипирамидный промежуточное состояние. На втором этапе фосфоэфирная связь расщепляется, когда кислотный аминокислотный остаток (BH+) отдает протон кислороду в связи. Таким образом, отщепляется фосфатная группа.[3]
Маршруты гидролиза
Существует несколько предлагаемых маршрутов гидролиза, но неясно, какой из них правильный или существует несколько маршрутов. Эти пути гидролиза кратко описаны ниже.

Смотрите также
Рекомендации
- ^ а б Цзэн Ю.Ф., Ко Т.П., Лай Х.Л., Ченг Ю.С., Ву ТХ, Ма И, Чен С.К., Янг С.С., Ченг К.Дж., Хуан С.Х., Го РТ, Лю Дж.Р. (июнь 2011 г.). «Кристаллические структуры щелочной фитазы Bacillus в комплексе с ионами двухвалентных металлов и гексасульфатом инозита». Журнал молекулярной биологии. 409 (2): 214–24. Дои:10.1016 / j.jmb.2011.03.063. PMID 21463636.
- ^ а б c d е ж Чен С., Ченг К., Ко Т, Го Р. (01.04.2015). «Текущие достижения в исследованиях фитазы: трехмерная структура и белковая инженерия». ChemBioEng Обзоры. 2 (2): 76–86. Дои:10.1002 / cben.201400026.
- ^ а б c d Shin S, Ha NC, Oh BC, Oh TK, Oh BH (сентябрь 2001 г.). «Ферментный механизм и каталитические свойства бета-пропеллерной фитазы». Структура. 9 (9): 851–8. Дои:10.1016 / S0969-2126 (01) 00637-2. PMID 11566134.
- ^ а б c Ha NC, Oh BC, Shin S, Kim HJ, Oh TK, Kim YO, Choi KY, Oh BH (февраль 2000 г.). «Кристаллические структуры новой термостабильной фитазы в частично или полностью загруженных кальцием состояниях». Структурная биология природы. 7 (2): 147–53. Дои:10.1038/72421. PMID 10655618.
- ^ а б c d е ж грамм час Кумар В., Ядав А.Н., Верма П., Сангван П., Саксена А., Кумар К., Сингх Б. (май 2017 г.). «β-Пропеллерные фитазы: разнообразие, каталитические свойства, текущие разработки и потенциальные биотехнологические применения». Международный журнал биологических макромолекул. 98: 595–609. Дои:10.1016 / j.ijbiomac.2017.01.134. PMID 28174082.
- ^ Gifre L, Arís A, Bach A., Garcia-Fruitós E (март 2017 г.). «Тенденции использования рекомбинантного белка в животноводстве». Фабрики микробных клеток. 16 (1): 40. Дои:10.1186 / s12934-017-0654-4. ЧВК 5336677. PMID 28259156.
- ^ Lei XG, Weaver JD, Mullaney E., Ullah AH, Azain MJ (январь 2013 г.). «Фитаза, новая жизнь для« старого »фермента». Ежегодный обзор биологических наук о животных. 1 (1): 283–309. Дои:10.1146 / annurev-animal-031412-103717. PMID 25387021.
- ^ Виадер-Сальвадо Ю.М., Гальегос-Лопес Ю.А., Карреон-Тревиньо Ю.Г., Кастильо-Гальван М., Рохо-Домингес А., Герреро-Оласаран М. (октябрь 2010 г.). «Разработка термостабильных бета-пропеллерных фитаз с активностью в широком диапазоне pH и их избыточное производство Pichia pastoris». Прикладная и экологическая микробиология. 76 (19): 6423–30. Дои:10.1128 / AEM.00253-10. ЧВК 2950461. PMID 20693453.
- ^ а б c Konietzny U, Greiner R (2002). «Молекулярные и каталитические свойства фитат-разлагающих ферментов (фитаз)». Международный журнал пищевой науки и технологий. 37 (7): 791–812. Дои:10.1046 / j.1365-2621.2002.00617.x.
- ^ а б Хуан Х, Шао Н, Ван И, Ло Х, Ян П, Чжоу З, Чжань З, Яо Б. (май 2009 г.). «Новая бета-пропеллерная фитаза из Pedobacter nyackensis MJ11 CGMCC 2503 с потенциалом в качестве добавки к корму для водных животных». Прикладная микробиология и биотехнология. 83 (2): 249–59. Дои:10.1007 / s00253-008-1835-1. PMID 19139877.
- ^ Дёберейнер А., Шмид А., Людвиг А., Гебель В., Бенц Р. (сентябрь 1996 г.). «Влияние кальция и других поливалентных катионов на формирование каналов альфа-гемолизином Escherichia coli в эритроцитах и липидных двухслойных мембранах». Европейский журнал биохимии. 240 (2): 454–60. Дои:10.1111 / j.1432-1033.1996.0454h.x. PMID 8841412.
- ^ а б Керовуо Дж., Рувинен Дж., Хацак Ф. (декабрь 2000 г.). «Анализ гидролиза мио-инозитолгексакисфосфата фитазой Bacillus: указание на новый механизм реакции». Биохимический журнал. 352 Pt 3 (Pt 3): 623–8. ЧВК 1221497. PMID 11104666.
- ^ а б c d Greiner R, Larsson Alminger M, Carlsson N, Muzquiz M, Burbano C, Cuadrado C, Pedrosa MM, Goyoaga C (2002). «Путь дефосфорилирования гексакисфосфата мио-инозитола фитазами семян бобовых культур». Журнал сельскохозяйственной и пищевой химии. 50 (23): 6865–6870. Дои:10.1021 / jf025620t.
- ^ а б Oh BC, Kim MH, Yun BS, Choi WC, Park SC, Bae SC, Oh TK (август 2006 г.). «Хелатирование Ca (2 +) - инозитолфосфата опосредует субстратную специфичность бета-пропеллерной фитазы». Биохимия. 45 (31): 9531–9. Дои:10.1021 / bi0603118. PMID 16878987.
- ^ а б Nam SJ, Kim YO, Ko TK, Kang JK, Chun KH, Auh JH, Lee CS, Lee IK, Park S, Oh BC (октябрь 2014 г.). «Молекулярные и биохимические характеристики β-пропеллерной фитазы из морских Pseudomonas sp. BS10-3 и ее потенциальное применение в кормовых добавках для животных». Журнал микробиологии и биотехнологии. 24 (10): 1413–20. Дои:10.4014 / jmb.1407.07063. PMID 25112322.
