Металлопротеин - Metalloprotein

Металлопротеин общий термин для белок который содержит ион металла кофактор.[1][2] Большая часть всех белков относится к этой категории. Например, как минимум 1000 белков человека (из ~ 20 000) содержат цинк-связывающий белковые домены[3] хотя может быть до 3000 металлопротеинов цинка человека.[4]
Изобилие
По оценкам, примерно половина всех белки содержать металл.[5] По другой оценке, предполагается, что от четверти до одной трети всех белков требуют металлов для выполнения своих функций.[6] Таким образом, металлопротеины выполняют множество различных функций в клетки, например, хранение и транспортировка белков, ферменты и преобразование сигнала белки, или инфекционные заболевания.[7] Обилие металлсвязывающих белков может быть присуще аминокислотам, которые используют белки, поскольку даже искусственные белки без эволюционной истории легко связывают металлы.[8]
Большинство металлов в человеческое тело связаны с белками. Например, относительно высокая концентрация железа в организме человека в основном связана с железом в гемоглобин.
| Печень | Почка | Легкое | Сердце | Мозг | Мышцы | |
|---|---|---|---|---|---|---|
| Mn (марганец ) | 138 | 79 | 29 | 27 | 22 | <4-40 |
| Fe (утюг ) | 16,769 | 7,168 | 24,967 | 5530 | 4100 | 3,500 |
| Co (кобальт ) | <2-13 | <2 | <2-8 | --- | <2 | 150 (?) |
| Ni (никель ) | <5 | <5-12 | <5 | <5 | <5 | <15 |
| Cu (медь ) | 882 | 379 | 220 | 350 | 401 | 85-305 |
| Zn (цинк ) | 5,543 | 5,018 | 1,470 | 2,772 | 915 | 4,688 |
Принципы координационной химии
В металлопротеинах ионы металлов обычно координируются азот, кислород или сера центры, принадлежащие аминокислота остатки белка. Эти донорные группы часто представлены боковыми цепями на аминокислотных остатках. Особенно важны имидазол заместитель в гистидин остатки, тиолат заместители в цистеин остатки и карбоксилат группы, предоставленные аспартат. Учитывая разнообразие металлопротеом было показано, что практически все аминокислотные остатки связывают центры металлов. Пептидный остов также обеспечивает донорные группы; к ним относятся депротонированные амиды и амид карбонил кислородные центры. Проведен обзор связывания свинца (II) в природных и искусственных белках.[10]
Помимо донорных групп, которые представлены аминокислотными остатками, многие органические кофакторы действуют как лиганды. Возможно, наиболее известными являются тетрадентатный N4 макроциклический лиганды включены в гем белок. Также распространены неорганические лиганды, такие как сульфид и оксид.
Хранение и транспортировка металлопротеинов
Это продукты второй стадии гидролиза белка, полученные обработкой немного более сильными кислотами и щелочами.
Кислородные носители
Гемоглобин, который является основным переносчиком кислорода у человека, имеет четыре субъединицы, в которых утюг Ион (II) координирован плоским макроциклический лиганд протопорфирин IX (PIX) и имидазол атом азота гистидин остаток. Шестой координационный сайт содержит воды молекула или дикислород молекула. Напротив, белок миоглобин, нашел в мышечные клетки, есть только один такой блок. Активный сайт находится в гидрофобный карман. Это важно, поскольку без него железо (II) необратимо окисленный в железо (III). В константа равновесия для образования HbO2 таков, что кислород поглощается или высвобождается в зависимости от частичное давление кислорода в легкие или в мышце. В гемоглобине четыре субъединицы демонстрируют эффект кооперативности, который позволяет легко переносить кислород от гемоглобина к миоглобину.[11]
В обоих гемоглобин и миоглобин иногда неправильно утверждают, что оксигенированные частицы содержат железо (III). Теперь известно, что диамагнитный природа этих разновидностей заключается в том, что атом железа (II) находится в низкоскоростной штат. В оксигемоглобин атом железа расположен в плоскости порфиринового кольца, но в парамагнитный дезоксигемоглобин атом железа лежит выше плоскости кольца.[11] Это изменение спинового состояния является кооперативным эффектом из-за более высокой расщепление кристаллического поля и меньше ионный радиус Fe2+ в фрагменте оксигемоглобина.
Гемеритрин - еще один железосодержащий переносчик кислорода. Сайт связывания кислорода представляет собой двухъядерный центр железа. Атомы железа координируются с белком через карбоксилат боковые цепи глутамат и аспартат и пять гистидин остатки. Поглощение O2 гемеритрином сопровождается двухэлектронным окислением восстановленного биядерного центра с образованием связанного перекись (OOH−). Детально проработан механизм поглощения и выделения кислорода.[12][13]
Гемоцианины переносят кислород в кровь большинства моллюски, и немного членистоногие такой как подковообразный краб. Они уступают только гемоглобину по биологической популярности использования в транспорте кислорода. По оксигенации два медь (I) атомы в активном центре окисляются до меди (II), а молекулы диоксида восстанавливаются до пероксида, О2−
2.[14][15]
Хлорокруорин (поскольку более крупный перевозчик эритрокруорин ) представляет собой связывающий кислород гемепротеин, присутствующий в плазма крови из многих кольчатые червя, особенно некоторые морские полихеты.
Цитохромы
Окисление и сокращение реакции не распространены в органическая химия как мало органических молекул могут действовать как окисляющий или восстановители. Утюг (II), с другой стороны, легко окисляется до железа (III). Эта функция используется в цитохромы, которые функционируют как электронный перенос векторы. Наличие иона металла позволяет металлоферменты для выполнения таких функций, как окислительно-восстановительные реакции что не может быть легко выполнено ограниченным набором функциональные группы нашел в аминокислоты.[16] Атом железа в большинстве цитохромов содержится в гем группа. Различия между этими цитохромами заключаются в разных боковых цепях. Например, цитохром а имеет гем а простетическая группа и цитохром b имеет гем б протезная группа. Эти различия приводят к разному Fe2+/ Fe3+ окислительно-восстановительные потенциалы таким образом, что различные цитохромы участвуют в митохондриальный электронная транспортная цепь.[17]
Цитохром P450 Ферменты выполняют функцию вставки атома кислорода в связь C-H, реакцию окисления.[18][19]

Рубредоксин
Рубредоксин электрон-носитель, обнаруженный в сера -метаболизирующий бактерии и археи. Активный центр содержит ион железа, координированный атомами серы четырех цистеин остатки, образующие почти регулярную тетраэдр. Рубредоксины осуществляют процессы одноэлектронного переноса. В степень окисления атома железа меняется между состояниями +2 и +3. В обоих состояниях окисления металл высокое вращение, что помогает минимизировать структурные изменения.
Пластоцианин
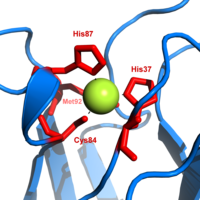
Пластоцианин относится к семейству синих белки меди которые участвуют в перенос электронов реакции. В медь -сайт привязки описан как искаженный тригонально-пирамидальный.[20] Тригональная плоскость пирамидального основания состоит из двух атомов азота (N1 и н2) из отдельных гистидинов и серы (S1) из цистеина. Сера (S2) из аксиального метионина образует апекс. Искажение происходит в длинах связей между лигандами меди и серы. Cu − S1 контакт короче (207вечера ), чем Cu − S2 (282 пм). Удлиненный Cu − S2 связывание дестабилизирует форму Cu (II) и увеличивает редокс потенциал белка. Синий цвет (597нм пиковое поглощение) связано с Cu-S1 связь, где S (pπ) к Cu (dИкс2−у2) происходит перенос заряда.[21]
В восстановленной форме пластоцианина, Его -87 станет протонированным с пKа из 4.4. Протонирование не позволяет ему действовать как лиганд и геометрия медного узла становится тригонально плоский.
Хранение и перенос ионов металлов
Утюг
Утюг хранится в виде железа (III) в ферритин. Точная природа сайта связывания еще не определена. Утюг выглядит как гидролиз такой продукт, как FeO (OH). Железо транспортируется трансферрин чей сайт связывания состоит из двух тирозины, один аспарагиновая кислота и один гистидин.[22] В организме человека нет механизма выведения железа.[нужна цитата ] Это может привести к железная перегрузка проблемы у пациентов, лечившихся переливание крови, как, например, с β-талассемия. Железо фактически выводится с мочой[23] а также концентрируется в желчи[24] который выводится с калом.[25]
Медь
Церулоплазмин является основным медь -носящий белок в крови. Церулоплазмин проявляет оксидазную активность, которая связана с возможным окислением Fe (II) до Fe (III), что способствует его транспортировке в плазма крови в сочетании с трансферрином, который может переносить железо только в состоянии Fe (III).
Кальций
Остеопонтин участвует в минерализации внеклеточного матрикса костей и зубов.
Металлоферменты
Все металлоферменты имеют одну общую черту, а именно, что ион металла связан с белком одним лабильный координация сайт. Как и все ферменты, форма активный сайт это важно. Ион металла обычно находится в кармане, форма которого соответствует форме подложки. Ион металла катализирует реакции, которые трудно достичь в органическая химия.
Карбоангидраза
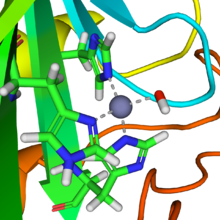
В водный раствор, углекислый газ формы угольная кислота
- CO2 + H2O ⇌ H2CO3
Эта реакция протекает очень медленно в отсутствие катализатора, но довольно быстро в присутствии гидроксид ион
- CO2 + ОН− ⇌ HCO−
3
Подобная реакция происходит почти мгновенно с карбоангидраза. Структура активного центра в карбонатных ангидразах хорошо известна из ряда кристаллических структур. Он состоит из цинк ион координирован тремя имидазол атомы азота из трех гистидин единицы. Четвертый координационный узел занимает молекула воды. Координационная сфера иона цинка приблизительно равна четырехгранный. Положительно заряженный ион цинка поляризует координированную молекулу воды, и нуклеофильный Атака отрицательно заряженной части гидроксида на диоксид углерода (углекислый ангидрид) происходит быстро. Каталитический цикл производит ион бикарбоната и ион водорода.[2] как равновесие
- ЧАС2CO3 ⇌ HCO−
3 + H+
способствует разобщению угольная кислота на биологическом pH значения.[26]
Витамин B12-зависимые ферменты
В кобальт -содержащий Витамин B12 (также известный как кобаламин) катализирует перенос метил (-CH3) групп между двумя молекулами, что приводит к нарушению Связи C − C, процесс, который является энергетически дорогим в органических реакциях. Ион металла снижает энергия активации для процесса за счет образования переходной Co − CH3 связь.[27] Структура кофермент был классно определен Дороти Ходжкин и коллег, за что она получила Нобелевская премия по химии.[28] Он состоит из иона кобальта (II), координированного с четырьмя атомами азота Коррин кольцо и пятый атом азота от имидазол группа. В состоянии покоя находится Co − C сигма-облигация с 5 'атомом углерода аденозин.[29] Это естественный металлоорганический соединение, что объясняет его функцию в транс-реакции метилирования, такие как реакция, проводимая метионинсинтаза.
Нитрогеназа (азотфиксация)
В фиксация атмосферного азота это очень энергоемкий процесс, так как он включает в себя нарушение очень стабильной тройная связь между атомами азота. Фермент нитрогеназа один из немногих ферментов, способных катализировать этот процесс. Фермент встречается в Ризобий бактерии. Его действие состоит из трех компонентов: молибден атом на активном сайте, железо-серные кластеры которые участвуют в транспортировке электронов, необходимых для восстановления азота, и богатый источник энергии в виде магний АТФ. Последнее обеспечивается симбиотический отношения между бактериями и растением-хозяином, часто бобовые. Отношения симбиотические, потому что растение снабжает энергией фотосинтез и преимущества за счет получения фиксированного азота. Реакцию можно символически записать как
где Pя означает неорганический фосфат. Точную структуру активного сайта определить сложно. Похоже, он содержит MoFe7S8 кластер, способный связывать молекулу диазота и, предположительно, дать возможность начать процесс восстановления.[30] Электроны переносятся связанным кластером "P", который содержит два кубический Fe4S4 кластеры соединены серными мостиками.[31]
Супероксиддисмутаза

В супероксид ион О−
2 образуется в биологических системах за счет уменьшения молекулярных кислород. Имеет непарный электрон, поэтому он ведет себя как свободный радикал. Это мощный окислитель. Эти свойства делают супероксид-ион очень токсичный и используются с выгодой фагоциты убить вторжение микроорганизмы. В противном случае ион супероксида должен быть разрушен, прежде чем он нанесет нежелательный ущерб клетке. В супероксиддисмутаза ферменты очень эффективно выполняют эту функцию.[32]
Формальный степень окисления атомов кислорода -1⁄2. В растворах при нейтральной pH, супероксид-ион непропорционально к молекулярному кислороду и пероксид водорода.
- 2 О−
2 + 2 часа+ → O2 + H2О2
В биологии такой тип реакции называется дисмутация реакция. Он включает как окисление, так и восстановление ионов супероксида. В супероксиддисмутаза (SOD) группа ферментов увеличивает скорость реакции чтобы приблизиться к скорости, ограниченной диффузией.[33] Ключом к действию этих ферментов является ион металла с переменной степенью окисления, который может действовать как окислитель или как восстановитель.
- Окисление: M(п+1)+ + О−
2 → Mп+ + O2 - Сокращение: Mп+ + О−
2 + 2 часа+ → M(п+1)+ + H2О2.
В SOD человека активным металлом является медь, как Cu (II) или Cu (I), координированный тетраэдрически на четыре гистидин остатки. Этот фермент также содержит цинк ионами для стабилизации и активируется шапероном меди для супероксиддисмутазы (CCS ). Другой изоферменты может содержать утюг, марганец или никель. Ni-SOD особенно интересен, поскольку он включает никель (III), необычную степень окисления для этого элемента. Геометрия никеля активного центра циклов от квадратный плоский Ni (II) с тиолатом (Cys2 и Cys6) и основной азот (His1 и Cys2) лиганды, чтобы квадратно-пирамидальный Ni (III) с добавлением аксиального His1 лиганд боковой цепи.[34]
Хлорофилл-содержащие белки

Хлорофилл играет решающую роль в фотосинтез. Он содержит магний заключен в хлорин звенеть. Однако ион магния не участвует напрямую в фотосинтетической функции и может быть заменен другими двухвалентными ионами с небольшой потерей активности. Скорее фотон поглощается хлориновым кольцом, электронная структура которого хорошо приспособлена для этой цели.
Первоначально поглощение фотона вызывает электрон быть возбужденным в синглетное состояние Q-диапазона. В возбужденное состояние подвергается межсистемный переход из синглетного состояния в триплетное состояние в котором есть два электрона с параллельными вращение. Этот вид, по сути, является свободный радикал, и очень реактивен и позволяет переносить электрон на акцепторы, которые находятся рядом с хлорофиллом в хлоропласт. При этом хлорофилл окисляется. Позже в фотосинтетическом цикле хлорофилл снова восстанавливается. Это восстановление в конечном итоге притягивает электроны из воды, давая молекулярный кислород в качестве конечного продукта окисления.
Гидрогеназа
Гидрогеназы делятся на три различных типа в зависимости от содержания металла в активном центре: гидрогеназа железо-железо, гидрогеназа никель-железо и гидрогеназа железа.[35] Все гидрогеназы катализируют обратимые ЧАС2 поглощение, но в то время как гидрогеназы [FeFe] и [NiFe] верны редокс катализаторы, за рулем H2 окисление и H+ сокращение
- ЧАС2 ⇌ 2 часа+ + 2 е−
[Fe] гидрогеназы катализируют обратимое гетеролитическое расщепление H2.
- ЧАС2 ⇌ H+ + H−
Рибозим и дезоксирибозим
С момента открытия рибозимы к Томас Чех и Сидни Альтман в начале 1980-х было показано, что рибозимы представляют собой отдельный класс металлоферментов.[36] Многие рибозимы требуют наличия ионов металлов в их активных центрах для химического катализа; поэтому их называют металлоферментами. Кроме того, ионы металлов необходимы для структурной стабилизации рибозимов. Интрон группы I - наиболее изученный рибозим, в катализе которого участвуют три металла.[37] Другие известные рибозимы включают: интрон группы II, РНКаза P, и несколько небольших вирусных рибозимов (например, молот, заколка для волос, HDV, и VS ) и большая субъединица рибосом. Недавно были открыты четыре новых класса рибозимов (названных твистер, сестра твистера, пистолет и топор), которые являются саморасщепляющимися рибозимами.[38]
Дезоксирибозимы, также называемые ДНКзимами или каталитической ДНК, представляют собой искусственные каталитические молекулы ДНК, которые были впервые произведены в 1994 году. [39] с тех пор интерес к нему резко возрос. Практически всем ДНКзимам для функционирования необходимы ионы металлов; таким образом, они классифицируются как металлоферменты. Хотя рибозимы в основном катализируют расщепление РНК-субстратов, ДНКзимы могут катализировать различные реакции, включая расщепление РНК / ДНК, лигирование РНК / ДНК, фосфорилирование и дефосфорилирование аминокислот, а также образование углерод-углеродных связей.[40] Тем не менее, ДНКзимы, которые катализируют реакцию расщепления РНК, являются наиболее изученными. ДНКзим 10-23, открытый в 1997 году, является одной из наиболее изученных каталитических ДНК с клиническим применением в качестве терапевтического агента.[41] Сообщалось о нескольких металло-специфичных ДНКзимах, включая ДНКзим GR-5 (вести -специфический),[42] ДНКзимы CA1-3 (медь -специфический), ДНКзим 39E (уранил -конкретный)[43] и ДНКзим NaA43 (натрий -специфический).[44]
Сигнально-трансдукционные металлопротеины
Кальмодулин
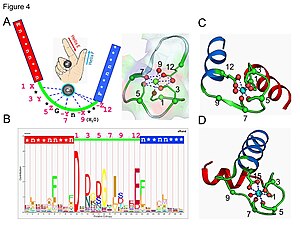
Кальмодулин представляет собой пример белка передачи сигнала. Это небольшой белок, содержащий четыре EF-рука мотивы, каждый из которых способен связать Ca2+ ион.
В петле EF-руки ион кальция имеет пентагональную бипирамидальную конфигурацию. Шесть глютаминовая кислота и аспарагиновая кислота остатки, участвующие в связывании, находятся в положениях 1, 3, 5, 7 и 9 полипептидной цепи. В положении 12 находится глутаматный или аспартатный лиганд, который ведет себя как (бидентатный лиганд), обеспечивая два атома кислорода. Девятый остаток в петле обязательно глицин из-за конформационных требований магистрали. Координационная сфера иона кальция содержит только карбоксилатные атомы кислорода и не содержит атомов азота. Это согласуется с жесткий природа иона кальция.
Белок имеет два примерно симметричных домена, разделенных гибкой «шарнирной» областью. Связывание кальция вызывает конформационные изменения в белке. Кальмодулин участвует в внутриклеточная передача сигналов система, действуя как распространяемый вторичный посланник исходных стимулов.[45][46]
Тропонин
В обоих сердечный и скелетные мышцы производство мышечной силы в первую очередь контролируется изменениями внутриклеточного кальций концентрация. В общем, когда уровень кальция повышается, мышцы сокращаются, а когда кальций падает, мышцы расслабляются. Тропонин, вместе с актин и тропомиозин, представляет собой белковый комплекс, с которым связывается кальций, чтобы вызвать выработку мышечной силы.
Факторы транскрипции
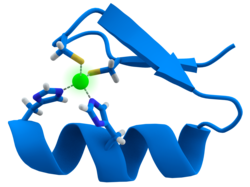
Много факторы транскрипции содержат структуру, известную как цинковый палец, это структурный модуль, в котором участок белка сворачивается вокруг иона цинка. Цинк не контактирует напрямую с ДНК с которыми связываются эти белки. Напротив, кофактор необходим для стабильности плотно свернутой белковой цепи.[47] В этих белках ион цинка обычно координируется парами боковых цепей цистеина и гистидина.
Другие металлоферменты
Есть два типа угарный газ дегидрогеназа: один содержит железо и молибден, другой - железо и никель. Были рассмотрены параллели и различия в каталитических стратегиях.[48]
Pb2+ (свинец) может заменить Ca2+ (кальций) как, например, с кальмодулин или Zn2+ (цинк) как с металлокарбоксипептидазы[49]
Некоторые другие металлоферменты приведены в следующей таблице в зависимости от используемого металла.
Смотрите также
Рекомендации
- ^ Banci L (2013). Sigel A, Sigel H, Sigel RK (ред.). Металломика и клетка. Ионы металлов в науках о жизни. 12. Springer. С. 1–13. Дои:10.1007/978-94-007-5561-1_1. ISBN 978-94-007-5561-1. PMID 23595668.
- ^ а б Шрайвер Д.Ф., Аткинс П.В. (1999). «Чарпер 19, Биоинорганическая химия». Неорганическая химия (3-е изд.). Издательство Оксфордского университета. ISBN 978-0-19-850330-9.
- ^ Эталонный протеом человека в Uniprot, по состоянию на 12 января 2018 г.
- ^ Андреини С., Банчи Л., Бертини И., Розато А. (ноябрь 2006 г.). «Цинк в трех сферах жизни». Журнал протеомных исследований. 5 (11): 3173–8. Дои:10.1021 / pr0603699. PMID 17081069.
- ^ Томсон AJ, Грей HB (1998). «Биоинорганическая химия» (PDF). Современное мнение в области химической биологии. 2 (2): 155–158. Дои:10.1016 / S1367-5931 (98) 80056-2. PMID 9667942.
- ^ Уолдрон К.Дж., Робинсон Нью-Джерси (январь 2009 г.). «Как бактериальные клетки гарантируют, что металлопротеины получают нужный металл?». Обзоры природы. Микробиология. 7 (1): 25–35. Дои:10.1038 / nrmicro2057. PMID 19079350. S2CID 7253420.
- ^ Карвер П.Л. (2013). «Глава 1. Ионы металлов и инфекционные заболевания. Обзор из клиники». В Sigel A, Sigel H, Sigel RK (ред.). Взаимосвязь между ионами эссенциальных металлов и заболеваниями человека. Ионы металлов в науках о жизни. 13. Springer. С. 1–28. Дои:10.1007/978-94-007-7500-8_1. ISBN 978-94-007-7499-5. PMID 24470087.
- ^ Wang, MS; Hoegler, KH; Хехт, М (2019). «Невзаимодействующие белки De Novo имеют врожденную склонность связывать переходные металлы». Жизнь. 9 (8): 8. Дои:10.3390 / life9010008. ЧВК 6463171. PMID 30634485.
- ^ Марет В. (февраль 2010 г.). «Металлопротеомика, металлопротеомы и аннотация металлопротеинов». Металломика. 2 (2): 117–25. Дои:10.1039 / b915804a. PMID 21069142.
- ^ Кангелози В., Рактонг Л., Пекораро В. Л. (2017). «Глава 10. Связывание свинца (II) в природных и искусственных белках». В Astrid S, Helmut S, Sigel RK (ред.). Свинец: его влияние на окружающую среду и здоровье. Ионы металлов в науках о жизни. 17. де Грюйтер. С. 271–318. Дои:10.1515/9783110434330-010. ISBN 9783110434330. ЧВК 5771651. PMID 28731303.
- ^ а б Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8. Фиг.25.7, p 1100 иллюстрирует структуру дезоксигемоглобина.
- ^ Стенкамп, Р. Э. (1994). «Кислород и гемеритрин». Chem. Ред. 94 (3): 715–726. Дои:10.1021 / cr00027a008.
- ^ Wirstam M, Lippard SJ, Friesner RA (апрель 2003 г.). «Обратимое связывание дикислорода с гемеритрином». Журнал Американского химического общества. 125 (13): 3980–7. Дои:10.1021 / ja017692r. PMID 12656634.
- ^ Карлин К., Круз Р.В., Гультне Ю., Фарук А., Хейс Дж. К., Зубиета Дж. (1987). «Реакционная способность кислорода и меди. Обратимое связывание O2 и СО к комплексу дикоппера (I) с феноксомостиковой связью ». Варенье. Chem. Soc. 109 (9): 2668–2679. Дои:10.1021 / ja00243a019.
- ^ Китадзима Н., Фудзисава К., Фудзимото С., Моруока Ю., Хашимото С., Китагава Т., Торими К., Тацуми К., Накамура А. (1992). "Новая модель связывания двуокиси кислорода в гемоцианине. Синтез, характеристика и молекулярная структура μ-η2:η2-пероксоядерные комплексы меди (II), [Cu (Hb (3,5-R2pz)3)]2(O2) (R = изопропил и Ph) ". Варенье. Chem. Soc. 114 (4): 1277–1291. Дои:10.1021 / ja00030a025.
- ^ Мессершмидт А, Хубер Р., Вигардт К., Поулос Т. (2001). Справочник по металлопротеинам. Вайли. ISBN 978-0-471-62743-2.
- ^ Мур Г.Р., Петтигрю Г.В. (1990). Цитохром с: структурные и физико-химические аспекты. Берлин: Springer.
- ^ Sigel A, Sigel H, Sigel RK, ред. (2007). Повсеместная роль белков цитохрома 450. Ионы металлов в науках о жизни. 3. Вайли. ISBN 978-0-470-01672-5.
- ^ Ортис де Монтельяно П. (2005). Структура, механизм и биохимия цитохрома P450 (3-е изд.). Springer. ISBN 978-0-306-48324-0.
- ^ Колман П.М., Freeman HC, Гусс Дж. М., Мурата М., Норрис В. А., Рамшоу Дж. А., Венкатаппа М. П. (1978). «Рентгеноструктурный анализ пластоцианина при разрешении 2,7 Å». Природа. 272 (5651): 319–324. Bibcode:1978Натура.272..319C. Дои:10.1038 / 272319a0. S2CID 4226644.
- ^ Соломон Э.И., Гевирт А.А., Коэн С.Л. (1986). Спектроскопические исследования активных сайтов. Синяя медь и электронные структурные аналоги. Серия симпозиумов ACS. 307. С. 236–266. Дои:10.1021 / bk-1986-0307.ch016. ISBN 978-0-8412-0971-8.
- ^ Андерсон Б.Ф., Бейкер Х.М., Додсон Э.Дж., Норрис Г.Е., Рамбол С.В., Уотерс Дж.М., Бейкер EN (апрель 1987 г.). «Структура человеческого лактоферрина при разрешении 3,2-A». Труды Национальной академии наук Соединенных Штатов Америки. 84 (7): 1769–73. Дои:10.1073 / pnas.84.7.1769. ЧВК 304522. PMID 3470756.
- ^ Родригес Э., Диас С. (декабрь 1995 г.). «Уровни железа, меди и цинка в моче: взаимосвязь с различными индивидуальными факторами». Журнал микроэлементов в медицине и биологии. 9 (4): 200–9. Дои:10.1016 / S0946-672X (11) 80025-8. PMID 8808191.
- ^ Шюманн К., Шефер С.Г., Форт В. (1986). «Абсорбция железа и выделение трансферрина с желчью у крыс». Исследования в области экспериментальной медицины. Zeitschrift für die Gesamte Experimentelle Medizin Einschliesslich Experimenteller Chirurgie. 186 (3): 215–9. Дои:10.1007 / BF01852047. PMID 3738220. S2CID 7925719.
- ^ «Выведение продуктов жизнедеятельности с желчью». Архивировано из оригинал на 2017-03-26. Получено 2017-03-24.
- ^ Линдског С (1997). «Строение и механизм карбоангидразы». Фармакология и терапия. 74 (1): 1–20. Дои:10.1016 / S0163-7258 (96) 00198-2. PMID 9336012.
- ^ Sigel A, Sigel H, Sigel RK, ред. (2008). Связи металл – углерод в ферментах и кофакторах. Ионы металлов в науках о жизни. 6. Вайли. ISBN 978-1-84755-915-9.
- ^ "Нобелевская премия по химии 1964 г.". Nobelprize.org. Получено 2008-10-06.
- ^ Ходжкин, Д. К. (1965). «Структура ядра Коррина по данным рентгеновского анализа». Proc. Рой. Soc. А. 288 (1414): 294–305. Bibcode:1965RSPSA.288..294H. Дои:10.1098 / RSPA.1965.0219. S2CID 95235740.
- ^ Орм-Джонсон, В. Х. (1993). Steifel, E. I .; Coucouvannis, D .; Ньютон, Д. К. (ред.). Молибденовые ферменты, кофакторы и модельные системы. Успехи химии, серия симпозиумов, No. 535. Вашингтон, округ Колумбия: Американское химическое общество. стр.257.
- ^ Чан МК, Ким Дж, Рис, округ Колумбия (май 1993 г.). «Нитрогеназа FeMo-кофактор и пара P-кластеров: 2.2 структуры разрешения». Наука. 260 (5109): 792–4. Дои:10.1126 / science.8484118. PMID 8484118.
- ^ Пакер, Л. (редактор) (2002). Супероксиддисмутаза: 349 (методы в энзимологии). Академическая пресса. ISBN 978-0-12-182252-1.CS1 maint: дополнительный текст: список авторов (ссылка на сайт)
- ^ Генрих П., Леффлер Г., Петридес П.Е. (2006). Биохимия и патобиохимия (на немецком). Берлин: Springer. п. 123. ISBN 978-3-540-32680-9.
- ^ Барондо Д.П., Кассманн С.Дж., Брунс К.К., Тайнер Ю.А., Getzoff ED (Июнь 2004 г.). «Структура и механизм супероксиддисмутазы никеля». Биохимия. 43 (25): 8038–47. Дои:10.1021 / bi0496081. PMID 15209499.
- ^ Паркин, Элисон (2014). «Глава 5. Понимание и использование гидрогеназ, биологических дигидрогенных катализаторов». В Кронеке, Питер М. Х .; Соса Торрес, Марта Э. (ред.). Металлическая биогеохимия газообразных соединений окружающей среды. Ионы металлов в науках о жизни. 14. Springer. С. 99–124. Дои:10.1007/978-94-017-9269-1_5. ISBN 978-94-017-9268-4. PMID 25416392.
- ^ Пайл AM (август 1993 г.). «Рибозимы: особый класс металлоферментов». Наука. 261 (5122): 709–14. Bibcode:1993Наука ... 261..709П. Дои:10.1126 / science.7688142. PMID 7688142.
- ^ Шан С., Йошида А., Сан С., Пиччирилли Дж. А., Хершлаг Д. (октябрь 1999 г.). «Три иона металла в активном центре рибозима группы I Tetrahymena». Труды Национальной академии наук Соединенных Штатов Америки. 96 (22): 12299–304. Bibcode:1999PNAS ... 9612299S. Дои:10.1073 / пнас.96.22.12299. ЧВК 22911. PMID 10535916.
- ^ Вайнберг З., Ким ПБ, Чен Т.Х., Ли С., Харрис К.А., Люнсе К.Э., Брейкер Р.Р. (август 2015 г.). «Новые классы саморасщепляющихся рибозимов, выявленные сравнительным геномным анализом». Природа Химическая Биология. 11 (8): 606–10. Дои:10.1038 / nchembio.1846. ЧВК 4509812. PMID 26167874.
- ^ Брейкер Р.Р., Джойс Г.Ф. (декабрь 1994 г.). «Фермент ДНК, расщепляющий РНК». Химия и биология. 1 (4): 223–9. Дои:10.1016/1074-5521(94)90014-0. PMID 9383394.
- ^ Сильверман СК (май 2015 г.). «Поиск катализаторов ДНК для модификации белков». Отчеты о химических исследованиях. 48 (5): 1369–79. Дои:10.1021 / acs.accounts.5b00090. ЧВК 4439366. PMID 25939889.
- ^ Санторо SW, Джойс Г.Ф. (апрель 1997 г.). «Универсальный ДНК-фермент, расщепляющий РНК». Труды Национальной академии наук Соединенных Штатов Америки. 94 (9): 4262–6. Bibcode:1997PNAS ... 94.4262S. Дои:10.1073 / пнас.94.9.4262. ЧВК 20710. PMID 9113977.
- ^ Брейкер Р.Р., Джойс Г.Ф. (декабрь 1994 г.). «Фермент ДНК, расщепляющий РНК». Химия и биология. 1 (4): 223–9. Дои:10.1016/1074-5521(94)90014-0. PMID 9383394.
- ^ Лю Дж., Браун А. К., Мэн Х, Кропек Д. М., Исток Д. Д., Уотсон Д. Б., Лу Ю. (февраль 2007 г.). «Каталитический радиомаяк для урана с чувствительностью в триллионных долях и селективностью в миллион раз». Труды Национальной академии наук Соединенных Штатов Америки. 104 (7): 2056–61. Bibcode:2007PNAS..104.2056L. Дои:10.1073 / pnas.0607875104. ЧВК 1892917. PMID 17284609.
- ^ Тораби С.Ф., Ву П., МакГи К.Э., Чен Л., Хван К., Чжэн Н., Ченг Дж., Лу И (май 2015 г.). «Выбор in vitro натрий-специфического ДНКзима и его применение во внутриклеточном зондировании». Труды Национальной академии наук Соединенных Штатов Америки. 112 (19): 5903–8. Bibcode:2015ПНАС..112.5903Т. Дои:10.1073 / pnas.1420361112. ЧВК 4434688. PMID 25918425.
- ^ Стивенс (август 1983 г.). «Кальмодулин: введение». Канадский журнал биохимии и клеточной биологии. 61 (8): 906–10. Дои:10.1139 / o83-115. PMID 6313166.
- ^ Чин Д., Средство AR (август 2000 г.). «Кальмодулин: прототип датчика кальция». Тенденции в клеточной биологии. 10 (8): 322–8. Дои:10.1016 / S0962-8924 (00) 01800-6. PMID 10884684.
- ^ Берг Дж. М. (1990). «Домены цинковых пальцев: гипотезы и текущие знания». Ежегодный обзор биофизики и биофизической химии. 19 (1): 405–21. Дои:10.1146 / annurev.bb.19.060190.002201. PMID 2114117.
- ^ Джунг Дж, Фесселер Дж, Гетцл С., Доббек Х (2014). «Глава 3. Окись углерода. Токсичный газ и топливо для анаэробов и аэробов: дегидрогеназы окиси углерода». В Kroneck PM, Sosa Torres ME (ред.). Металлическая биогеохимия газообразных соединений окружающей среды. Ионы металлов в науках о жизни. 14. Springer. С. 37–69. Дои:10.1007/978-94-017-9269-1_3. ISBN 978-94-017-9268-4. PMID 25416390.
- ^ Аоки К., Мураяма К., Ху Н. (2017). «Глава 7. Твердотельные структуры комплексов свинца, актуальные для биологических систем». В Astrid S, Helmut S, Sigel RK (ред.). Свинец: его влияние на окружающую среду и здоровье. Ионы металлов в науках о жизни. 17. де Грюйтер. С. 123–200. Дои:10.1515/9783110434330-007. ISBN 9783110434330. PMID 28731300.
- ^ Романи, Андреа М. П. (2013). «Глава 4. Гомеостаз магния в клетках млекопитающих». В Банчи, Лючия (ред.). Металломика и клетка. Ионы металлов в науках о жизни. 12. Springer. С. 69–118. Дои:10.1007/978-94-007-5561-1_4. ISBN 978-94-007-5561-1. ISSN 1868-0402. PMID 23595671.
- ^ Рот Дж, Понзони С, Ашнер М (2013). «Глава 6. Гомеостаз марганца и транспорт». В Banci L (ред.). Металломика и клетка. Ионы металлов в науках о жизни. 12. Springer. С. 169–201. Дои:10.1007/978-94-007-5561-1_6. ISBN 978-94-007-5561-1. ISSN 1868-0402. ЧВК 6542352. PMID 23595673.
- ^ Dlouhy AC, Outten CE (2013). «Глава 8. Металлом железа в эукариотических организмах». В Banci L (ред.). Металломика и клетка. Ионы металлов в науках о жизни. 12. Springer. С. 241–78. Дои:10.1007/978-94-007-5561-1_8. ISBN 978-94-007-5561-1. ISSN 1868-0402. ЧВК 3924584. PMID 23595675.
- ^ Cracan V, Banerjee R (2013). «Глава 10 Транспорт и биохимия кобальта и корриноидов». В Banci L (ред.). Металломика и клетка. Ионы металлов в науках о жизни. 12. Springer. Дои:10.1007/978-94-007-5561-10_10 (неактивно 10.09.2020). ISBN 978-94-007-5561-1. ISSN 1868-0402.CS1 maint: DOI неактивен по состоянию на сентябрь 2020 г. (ссылка на сайт)
- ^ Sigel A, Sigel H, Sigel RK, ред. (2008). Никель и его удивительное воздействие на природу. Ионы металлов в науках о жизни. 2. Вайли. ISBN 978-0-470-01671-8.
- ^ Сидор А.М., Замби ДБ (2013). «Глава 11. Металломика никеля: общие темы, управляющие гомеостазом никеля». В Banci L (ред.). Металломика и клетка. Ионы металлов в науках о жизни. 12. Springer. Дои:10.1007/978-94-007-5561-10_11 (неактивно 10.09.2020). ISBN 978-94-007-5561-1. ISSN 1868-0402.CS1 maint: DOI неактивен по состоянию на сентябрь 2020 г. (ссылка на сайт)
- ^ Жилет KE, Hashemi HF, Cobine PA (2013). «Глава 13. Медный металлом в эукариотических клетках». В Banci L (ред.). Металломика и клетка. Ионы металлов в науках о жизни. 12. Springer. Дои:10.1007/978-94-007-5561-10_12 (неактивно 10.09.2020). ISBN 978-94-007-5561-1. ISSN 1868-0402.CS1 maint: DOI неактивен по состоянию на сентябрь 2020 г. (ссылка на сайт)
- ^ Марет В. (2013). «Глава 14 Цинк и цинковый протеом». В Banci L (ред.). Металломика и клетка. Ионы металлов в науках о жизни. 12. Springer. Дои:10.1007/978-94-007-5561-10_14 (неактивно 10.09.2020). ISBN 978-94-007-5561-1. ISSN 1868-0402.CS1 maint: DOI неактивен по состоянию на сентябрь 2020 г. (ссылка на сайт)
- ^ Павлин А.Ф., Пекораро V (2013). «Глава 10. Натуральные и искусственные белки, содержащие кадмий». В Sigel A, Sigel H, Sigel RK (ред.). Кадмий: от токсикологии к сущности. Ионы металлов в науках о жизни. 11. Springer. С. 303–337. Дои:10.1007/978-94-007-5179-8_10. ISBN 978-94-007-5178-1. PMID 23430777.
- ^ Фрайзингер Э. Ф., Васак М (2013). «Глава 11. Кадмий в металлотионеинах». В Sigel A, Sigel H, Sigel RK (ред.). Кадмий: от токсикологии к сущности. Ионы металлов в науках о жизни. 11. Springer. С. 339–372. Дои:10.1007/978-94-007-5179-8_11. ISBN 978-94-007-5178-1. PMID 23430778.
- ^ Мендель, Ральф Р. (2013). «Глава 15. Метаболизм молибдена». В Банчи, Лючия (ред.). Металломика и клетка. Ионы металлов в науках о жизни. 12. Springer. Дои:10.1007/978-94-007-5561-10_15 (неактивно 10.09.2020). ISBN 978-94-007-5561-1. ISSN 1868-0402.CS1 maint: DOI неактивен по состоянию на сентябрь 2020 г. (ссылка на сайт)
- ^ десять граней, Феликс (2014). «Глава 2. Жизнь на ацетилене. Первозданный источник энергии». В Кронеке, Питер М. Х .; Соса Торрес, Марта Э. (ред.). Металлическая биогеохимия газообразных соединений окружающей среды. Ионы металлов в науках о жизни. 14. Springer. С. 15–35. Дои:10.1007/978-94-017-9269-1_2. ISBN 978-94-017-9268-4. PMID 25416389.
внешняя ссылка
- Металлопротеин в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Семинар Екатерины Дреннан: Снимки металлопротеинов
