Гидроксид - Википедия - Hydroxide
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Систематическое название ИЮПАК Гидроксид | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| ОЙ− | |||
| Молярная масса | 17.007 г · моль−1 | ||
| Конъюгированная кислота | Вода | ||
| Основание конъюгата | Оксид анион | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Гидроксид это двухатомный анион с химическая формула ОЙ−. Он состоит из кислород и водород атом удерживается Ковалентная связь, и несет отрицательный электрический заряд. Это важно, но обычно второстепенный компонент воды. Он функционирует как основание, а лиганд, а нуклеофил, а катализатор. Ион гидроксида образует соли, некоторые из которых диссоциировать в водном растворе, высвобождая сольватированные гидроксид-ионы. Едкий натр это многомиллионные тонны в год товарная химия. Гидроксид, прикрепленный к сильно электроположительный центр может сам ионизироваться,[нужна цитата ] освобождение катион водорода (ЧАС+), что делает исходное соединение кислота.
Соответствующие электрически нейтрален соединение HO• это гидроксильный радикал. Соответствующие ковалентно граница группа –OH атомов - это гидроксильная группа Ион гидроксида и гидроксильная группа нуклеофилы и может действовать как катализатор в органическая химия.
Много неорганический вещества, которые несут слово гидроксид в их именах нет ионные соединения гидроксид-иона, но ковалентные соединения, содержащие гидроксильные группы.
Гидроксид-ион
Ион гидроксида является естественной частью воды из-за самоионизация реакция, в которой его дополняют, гидроксоний, пропускается водород:[1]
- ЧАС3О+ + ОН− ⇌ 2H2О
В константа равновесия для этой реакции, определяемой как
- Kш = [H+][ОЙ−][примечание 1]
имеет значение, близкое к 10−14 при 25 ° C, поэтому концентрация гидроксид-ионов в чистой воде близко к 10−7 моль ∙ дм−3, чтобы удовлетворить ограничение равного заряда. В pH решения равно десятичной одеколон из катион водорода концентрация;[заметка 2] pH чистой воды близок к 7 при температуре окружающей среды. Концентрация гидроксид-ионов может быть выражена через pOH, что близко к (14 - pH),[заметка 3] Таким образом, pOH чистой воды также близко к 7. Добавление основания к воде снижает концентрацию катионов водорода и, следовательно, увеличивает концентрацию гидроксид-иона (увеличивает pH, снижает pOH), даже если само основание не содержит гидроксида. Например, аммиак растворы имеют pH более 7 из-за реакции NH3 + H+ ⇌ NH+
4, что снижает концентрацию катионов водорода, что увеличивает концентрацию гидроксид-иона. pOH можно поддерживать на почти постоянном уровне с различными буферные растворы.

В водный раствор[3] гидроксид-ион представляет собой основание в Brønsted – Lowry смысл, как он может принимать протон[примечание 4] из кислоты Бренстеда – Лоури с образованием молекулы воды. Он также может действовать как База Льюиса отдав пару электронов кислоте Льюиса. В водном растворе ионы водорода и гидроксида сильно сольватированы, с водородные связи между атомами кислорода и водорода. Действительно, ион бигидроксида ЧАС
3О−
2 был охарактеризован в твердом состоянии. Это соединение центросимметрично и имеет очень короткую водородную связь (114,5вечера ), которая аналогична длине в бифторид ион HF−
2 (114 вечера).[2] В водном растворе ион гидроксида образует прочные водородные связи с молекулами воды. Следствием этого является то, что концентрированные растворы гидроксида натрия имеют высокую вязкость за счет образования протяженной сети водородных связей, как в фтороводород решения.
В растворе на воздухе гидроксид-ион быстро реагирует с атмосферным углекислый газ, действуя как кислота, первоначально с образованием бикарбонат ион.
- ОЙ− + CO2 ⇌ HCO−
3
В константа равновесия для этой реакции можно указать либо реакцию с растворенным диоксидом углерода, либо реакцию с газообразным диоксидом углерода (см. Угольная кислота для значений и деталей). При нейтральном или кислом pH реакция протекает медленно, но катализируется фермент карбоангидраза, который эффективно создает ионы гидроксида в активном центре.
Растворы, содержащие гидроксид-ионную атаку стекло. В этом случае силикаты в стекле действуют как кислоты. Основные гидроксиды, твердые или в растворе, хранятся в герметичный пластиковые контейнеры.
Ион гидроксида может действовать как типичный донор электронных пар. лиганд, образуя такие комплексы, как тетрагидроксоалюминат / тетрагидроксидоалюминат [Al (OH)4]−. Он также часто встречается в смешанных лигандных комплексах типа [MLИкс(ОЙ)у]z+, где L - лиганд. Ион гидроксида часто служит мостиковый лиганд, отдавая одну пару электронов каждому из атомов, соединяемых мостиком. Как показано в [Pb2(ОЙ)]3+, гидроксиды металлов часто записываются в упрощенном формате. Он может даже действовать как донор 3-электронных пар, как в тетрамере [PtMe3(ОЙ)]4.[4]
При связывании с сильно электроноакцепторным металлическим центром гидроксидные лиганды имеют тенденцию к ионизировать в оксидные лиганды. Например, бихромат-ион [HCrO4]− диссоциирует согласно
- [O3CrO – H]− ⇌ [CrO4]2− + H+
с пKа около 5,9.[5]
Колебательные спектры
В инфракрасные спектры соединений, содержащих ОН функциональная группа иметь сильный полосы поглощения в районе с центром около 3500 см−1.[6] Высокая частота молекулярная вибрация является следствием небольшой массы атома водорода по сравнению с массой атома кислорода, и это делает обнаружение гидроксильных групп с помощью инфракрасной спектроскопии относительно простым. Полоса из-за группы ОН имеет тенденцию быть резкой. Тем не менее пропускная способность увеличивается, когда группа ОН участвует в водородной связи. Молекула воды имеет изгибную моду HOH на высоте около 1600 см.−1, поэтому отсутствие этой полосы можно использовать для отличия группы ОН от молекулы воды.
Когда группа ОН связана с ионом металла в координационный комплекс можно наблюдать изгибную моду M-OH. Например, в [Sn (OH)6]2− это происходит на 1065 см−1. Изгибной режим для мостикового гидроксида имеет тенденцию быть на более низкой частоте, как в [(бипиридин ) Cu (OH)2Cu (бипиридин )]2+ (955 см−1).[7] Валентные колебания M-OH происходят ниже примерно 600 см−1. Например, четырехгранный ион [Zn (OH)4]2− имеет полосы на 470 см−1 (Раман -активный, поляризованный) и 420 см−1 (инфракрасный). Этот же ион имеет изгибное колебание (HO) –Zn– (OH) на высоте 300 см−1.[8]
Приложения
Едкий натр решения, также известные как щелочь и каустическая сода, используются при производстве мякоть и бумага, текстиль, питьевая вода, мыло и моющие средства, и как очиститель слива. Мировое производство в 2004 году составило около 60 миллионов тонны.[9] Основным методом изготовления является хлористо-щелочной процесс.
Растворы, содержащие ион гидроксида, образуются, когда соль слабая кислота растворяется в воде. Карбонат натрия используется как щелочь, например, в силу гидролиз реакция
- CO2−
3 + H2O ⇌ HCO−
3 + ОН− (пKа2 = 10,33 при 25 ° C и нуле ионная сила )
Хотя основная сила растворов карбоната натрия ниже, чем у концентрированного раствора гидроксида натрия, они имеют то преимущество, что они являются твердыми. Он также производится в огромных количествах (42 миллиона тонн в 2005 году). Сольвеевский процесс.[10] Пример использования карбоната натрия в качестве щелочи: стиральная сода (другое название карбоната натрия) действует на нерастворимые эфиры, такие как триглицериды, широко известные как жиры, чтобы гидролизовать их и сделать их растворимыми.
Бокситы, основной гидроксид алюминий, это основная руда, из которой производится металл.[11] По аналогии, гетит (α-FeO (OH)) и лепидокрокит (γ-FeO (OH)), основные гидроксиды утюг, являются одними из основных руд, используемых для производства металлического железа.[12] Многочисленные другие применения можно найти в статьях об отдельных гидроксидах.
Неорганические гидроксиды
Щелочных металлов
Помимо NaOH и KOH, которые находят применение в очень широком масштабе, также можно использовать гидроксиды других щелочных металлов. Гидроксид лития сильная база, с пKб −0,36.[13] Гидроксид лития используется в дыхательный газ системы очистки для космический корабль, подводные лодки, и ребризеры удалять углекислый газ от выдыхаемого газа.[14]
- 2 LiOH + CO2 → Ли2CO3 + H2О
Гидроксид лития предпочтительнее гидроксида натрия из-за его меньшей массы. Едкий натр, гидроксид калия, а гидроксиды других щелочных металлов являются также сильные основы.[15]
Щелочноземельные металлы


Молекулы воды, присоединенные к Be, опущены.
Гидроксид бериллия Будь (ОН)2 является амфотерный.[16] Сам гидроксид нерастворимый в воде, с произведение растворимости бревноK*зр −11,7. Добавление кислоты дает растворимый гидролиз продукты, включая тримерный ион [Be3(ОЙ)3(ЧАС2O)6]3+, который имеет группы ОН, соединяющие пары ионов бериллия, образующие 6-членное кольцо.[17] При очень низком pH акваион [Be (H2O)4]2+ сформирован. Добавление гидроксида к Be (OH)2 дает растворимый тетрагидроксобериллат / тетрагидроксидобериллат анион, [Be (OH)4]2−.
Растворимость в воде других гидроксидов этой группы увеличивается с увеличением атомный номер.[18] Гидроксид магния Mg (OH)2 является сильным основанием (до предела его растворимости, который очень низок в чистой воде), как и гидроксиды более тяжелых щелочноземельных металлов: гидроксид кальция, гидроксид стронция, и гидроксид бария. Раствор или суспензия гидроксида кальция известен как лимонад и может использоваться для проверки слабая кислота углекислый газ. Реакция Ca (OH)2 + CO2 ⇌ Ca2+ + HCO−
3 + ОН− иллюстрирует основность гидроксида кальция. Газировка со вкусом лайма, представляющий собой смесь сильных оснований NaOH и KOH с Ca (OH)2, используется как СО2 абсорбент.
Элементы группы бора

Простейший гидроксид бора B (OH)3, известный как борная кислота, это кислота. В отличие от гидроксидов гидроксидов щелочных и щелочноземельных металлов, он не диссоциирует в водном растворе. Вместо этого он реагирует с молекулами воды, действующими как кислота Льюиса, высвобождая протоны.
- В (ОН)3 + H2O ⇌ В (ОН)−
4 + H+
Разнообразие оксианионы бора, которые в протонированной форме содержат гидроксидные группы.[19]

алюминат (III) ион
Гидроксид алюминия Al (ОН)3 амфотерный и растворяется в щелочном растворе.[16]
- Al (ОН)3 (твердый) + OH− (водн.) ⇌ Al (ОН)−
4 (водн.)
в Процесс Байера[20] для производства чистого оксида алюминия из боксит минералы это равновесие регулируется тщательным контролем температуры и концентрации щелочи. На первом этапе алюминий растворяется в горячем щелочном растворе в виде Al (ОН)−
4, но другие гидроксиды, обычно присутствующие в минерале, такие как гидроксиды железа, не растворяются, потому что они не амфотерные. После удаления нерастворимых веществ так называемый красная грязь Чистый гидроксид алюминия осаждается за счет снижения температуры и добавления воды к экстракту, что за счет разбавления щелочи снижает pH раствора. Основной гидроксид алюминия AlO (OH), который может присутствовать в боксите, также является амфотерным.
В слабокислых растворах гидроксо / гидроксидные комплексы, образованные алюминием, несколько отличаются от комплексов бора, что отражает больший размер Al (III) по сравнению с B (III). Концентрация видов [Al13(ОЙ)32]7+ очень зависит от общей концентрации алюминия. Различные другие гидроксокомплексы находятся в кристаллических соединениях. Возможно, наиболее важным из них является основной гидроксид AlO (OH), полимерный материал, известный под названиями минеральных форм. бемит или же диаспора, в зависимости от кристаллической структуры. Гидроксид галлия,[16] гидроксид индия, и гидроксид таллия (III) также амфотерные. Гидроксид таллия (I) прочная база.[21]
Элементы группы углерода
Углерод не образует простых гидроксидов. Гипотетическое соединение C (OH)4 (ортокарбоновая кислота или метанететрол) в водном растворе нестабилен:[22]
- С (ОН)4 → HCO−
3 + H3О+ - HCO−
3 + H+ ⇌ H2CO3
Углекислый газ также известен как угольный ангидрид, что означает, что он образуется при дегидратации угольная кислота ЧАС2CO3 (OC (OH)2).[23]
Кремниевая кислота это название, данное множеству соединений с общей формулой [SiOИкс(ОЙ)4−2Икс]п.[24][25] Ортокремниевая кислота был обнаружен в очень разбавленном водном растворе. Это слабая кислота с pKа1 = 9,84, пKа2 = 13,2 при 25 ° C. Обычно записывается как H4SiO4, но формула Si (OH)4 общепринято.[5][сомнительный ] Другие кремниевые кислоты, такие как метасиликоновая кислота (ЧАС2SiO3), дисиликоновая кислота (ЧАС2Si2О5), и кремниевая кислота (ЧАС6Si2О7) были охарактеризованы. Эти кислоты также имеют гидроксидные группы, присоединенные к кремнию; формулы предполагают, что эти кислоты представляют собой протонированные формы полиоксианионы.
Немногочисленные гидроксокомплексы германий были охарактеризованы. Гидроксид олова (II) Sn (ОН)2 был приготовлен в безводной среде. Когда оксид олова (II) обрабатывается щелочью пирамидальный гидроксокомплекс Sn (ОН)−
3 сформирован. Когда растворы, содержащие этот ион, подкисляются, ион [Sn3(ОЙ)4]2+ образуется вместе с некоторыми основными гидроксокомплексами. Структура [Sn3(ОЙ)4]2+ имеет треугольник из атомов олова, соединенных мостиковыми гидроксидными группами.[26] Гидроксид олова (IV) неизвестен, но его можно рассматривать как гипотетическую кислоту, из которой образуются станнаты, с формулой [Sn (OH)6]2−, получаются реакцией с основным гидроксид-ионом (Льюиса).[27]
Гидролиз Pb2+ в водном растворе сопровождается образованием различных гидроксосодержащих комплексов, некоторые из которых нерастворимы. Основной гидроксокомплекс [Pb6О (ОН)6]4+ представляет собой кластер из шести центров свинца со связями металл – металл, окружающий центральный ион оксида. Шесть гидроксидных групп лежат на гранях двух внешних Pb4 тетраэдры. Растворим в сильнощелочных растворах отвес образуются ионы, в том числе [Pb (OH)6]2−.[28]
Другие элементы основной группы
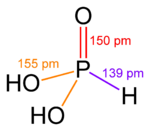 |  |  |  |  |  |
| Фосфорная кислота | Фосфорная кислота | Серная кислота | Теллуровая кислота | Орто-периодная кислота | Ксениновая кислота |
В более высоких степенях окисления пниктогены, халькогены, галогены, и благородные газы есть оксикислоты, в которых центральный атом присоединен к ионам оксида и ионам гидроксида. Примеры включают фосфорная кислота ЧАС3PO4, и серная кислота ЧАС2ТАК4. В этих соединениях одна или несколько гидроксидных групп могут диссоциировать с выделением катионов водорода как в стандартном Brønsted – Lowry кислота. Известно много оксокислот серы, и все они содержат группы ОН, которые могут диссоциировать.[29]
Теллуровая кислота часто записывается формулой H2TeO4· 2H2O, но структурно лучше описывается как Te (OH)6.[30]
Орто-периодная кислота[примечание 6] может потерять все свои протоны, в конечном итоге образуя периодат-ион [IO4]−. Его также можно протонировать в сильнокислой среде с образованием октаэдрического иона [I (OH)6]+, завершая изоэлектронный серия, [E (OH)6]z, E = Sn, Sb, Te, I; z = −2, −1, 0, +1. Известны и другие кислоты йода (VII), содержащие гидроксидные группы, в частности, в солях, таких как мезопериодат-ион, который встречается в K4[Я2О8(ОЙ)2] · 8H2О.[31]
Как это часто бывает за пределами щелочных металлов, гидроксиды элементов в более низких степенях окисления сложны. Например, фосфористая кислота ЧАС3PO3 преимущественно имеет структуру OP (H) (OH)2, в равновесии с небольшим количеством P (OH)3.[32][33]
Оксокислоты хлор, бром, и йод имеют формулу Oп−1/2A (OH), где п это степень окисления: +1, +3, +5 или +7, и A = Cl, Br или I. Единственная оксокислота фтор есть F (OH), гипофтористая кислота. Когда эти кислоты нейтрализуются, атом водорода удаляется из гидроксидной группы.[34]
Переходные и постпереходные металлы
Гидроксиды переходные металлы и постпереходные металлы обычно металл находится в степени окисления +2 (M = Mn, Fe, Co, Ni, Cu, Zn) или +3 (M = Fe, Ru, Rh, Ir). Ни один из них не растворим в воде, и многие из них плохо определены. Одной из сложных особенностей гидроксидов является их тенденция к дальнейшей конденсации с образованием оксидов, процесс, называемый олация. Гидроксиды металлов в степени окисления +1 также плохо определены или нестабильны. Например, гидроксид серебра Ag (OH) самопроизвольно разлагается на оксид (Ag2О). Гидроксиды меди (I) и золота (I) также нестабильны, хотя известны стабильные аддукты CuOH и AuOH.[35] Полимерные соединения M (OH)2 и M (OH)3 обычно получают путем увеличения pH водных растворов соответствующих катионов металлов до тех пор, пока гидроксид осаждает из решения. Наоборот, гидроксиды растворяются в кислом растворе. Гидроксид цинка Zn (OH)2 амфотерный, образуя тетрагидроксидоцинкат ион Zn (OH)2−
4 в сильнощелочном растворе.[16]
Существуют многочисленные смешанные лигандные комплексы этих металлов с гидроксид-ионом. Фактически, они, как правило, лучше определены, чем более простые производные. Многие из них могут быть получены депротонированием соответствующего металл aquo комплекс.
- LпМ (ОН2) + B ⇌ LпМ (ОН) + BH+ (L = лиганд, B = основание)
Ванадиевая кислота ЧАС3VO4 показывает сходство с фосфорной кислотой H3PO4 хотя он имеет гораздо более сложный ванадат оксоанионная химия. Хромовая кислота ЧАС2CrO4, имеет сходство с серной кислотой H2ТАК4; например, обе формы кислотные соли А+[HMO4]−. Некоторые металлы, например V, Cr, Nb, Ta, Mo, W, как правило, находятся в высокой степени окисления. Вместо того, чтобы образовывать гидроксиды в водном растворе, они превращаются в оксокластеры в процессе олация, формируя полиоксометаллаты.[36]
Основные соли, содержащие гидроксид
В некоторых случаях продукты частичного гидролиза иона металла, описанные выше, могут быть обнаружены в кристаллических соединениях. Яркий пример - цирконий (IV). Из-за высокой степени окисления соли Zr4+ сильно гидролизуются в воде даже при низком pH. Соединение, изначально сформулированное как ZrOCl2· 8H2О оказался хлоридной солью тетрамерный катион [Zr4(ОЙ)8(ЧАС2O)16]8+ в котором есть квадрат Zr4+ ионы с двумя гидроксидными группами, соединяющими атомы Zr с каждой стороны квадрата, и с четырьмя молекулами воды, прикрепленными к каждому атому Zr.[37]
Минерал малахит является типичным примером основного карбоната. Формула Cu2CO3(ОЙ)2 показывает, что это на полпути между карбонат меди и гидроксид меди. Действительно, раньше формулу записывали как CuCO3· Cu (OH)2. В Кристальная структура состоит из ионов меди, карбоната и гидроксида.[37] Минерал атакамит является примером основного хлорида. Он имеет формулу Cu2Cl (ОН)3. В этом случае состав ближе к гидроксиду, чем хлорид CuCl.2· 3Cu (OH)2.[38] Медь образует гидроксифосфат (либетенит ), арсенат (оливенит ), сульфат (брошантит ) и нитратных соединений. Белый свинец является основным вести карбонат, (PbCO3)2· Pb (OH)2, который использовался как белый пигмент из-за его непрозрачного качества, хотя его использование сейчас ограничено, потому что он может быть источником отравление свинцом.[37]
Структурная химия
Ион гидроксида, по-видимому, свободно вращается в кристаллах гидроксидов более тяжелых щелочных металлов при более высоких температурах, так что он представляет собой сферический ион с эффективным ионный радиус около 153 часов.[39] Таким образом, высокотемпературные формы KOH и NaOH имеют хлорид натрия структура,[40] который постепенно застывает в моноклинно деформированной структуре хлорида натрия при температурах ниже примерно 300 ° C. Группы ОН все еще вращаются даже при комнатной температуре вокруг своих осей симметрии и, следовательно, не могут быть обнаружены с помощью дифракция рентгеновских лучей.[41] Форма NaOH при комнатной температуре имеет йодид таллия структура. LiOH, однако, имеет слоистую структуру, состоящую из тетраэдрического Li (OH)4 и (OH) Li4 единицы.[39] Это согласуется со слабоосновным характером LiOH в растворе, указывая на то, что связь Li – OH имеет сильно ковалентный характер.
Ион гидроксида проявляет цилиндрическую симметрию в гидроксидах двухвалентных металлов Ca, Cd, Mn, Fe и Co. Например, гидроксид магния Mg (OH)2 (брусит ) кристаллизуется с йодид кадмия слоистая структура с своеобразной плотной упаковкой ионов магния и гидроксида.[39][42]
В амфотерный гидроксид Al (OH)3 имеет четыре основные кристаллические формы: гиббсит (наиболее стабильный), байерит, нордстрандит, и дойлит.[примечание 7]Все эти полиморфы состоят из двойных слоев гидроксид-ионов - атомов алюминия на двух третях октаэдрических отверстий между двумя слоями - и отличаются только последовательностью укладки слоев.[43] Структуры подобны структуре брусита. Однако, в то время как структуру брусита можно описать как структуру с плотной упаковкой в гиббсите, группы ОН на нижней стороне одного слоя опираются на группы нижележащего слоя. Такое расположение привело к предположению, что между группами ОН в соседних слоях существуют направленные связи.[44] Это необычная форма водородная связь поскольку ожидается, что два задействованных гидроксид-иона будут указывать друг от друга. Атомы водорода были обнаружены нейтронная дифракция эксперименты с α-AlO (OH) (диаспора ). Расстояние O – H – O очень короткое, 265 пм; водород находится не на одинаковом расстоянии между атомами кислорода, а короткая связь ОН составляет угол 12 ° с линией О – О.[45] Подобный тип водородной связи был предложен для других амфотерных гидроксидов, включая Be (OH).2, Zn (OH)2, и Fe (OH)3.[39]
Известен ряд смешанных гидроксидов со стехиометрией A3MIII(ОЙ)6, А2MIV(ОЙ)6, и AMV(ОЙ)6. Как следует из формулы, эти вещества содержат M (OH)6 октаэдрические структурные единицы.[46] Слоистые двойные гидроксиды может быть представлен формулой [Mz+
1−ИксM3+
Икс(ОЙ)
2]q+(ИКСп−)
q⁄п·уЧАС
2О. Наиболее часто, z = 2 и M2+ = Ca2+, Mg2+, Mn2+, Fe2+, Co2+, Ni2+, Cu2+, или Zn2+; следовательно q = Икс.
В органических реакциях
Гидроксид калия и едкий натр два хорошо известных реагенты в органическая химия.
Базовый катализ
Ион гидроксида может действовать как базовый катализатор.[47] Основание отрывает протон от слабой кислоты, чтобы получить промежуточное соединение, которое продолжает реагировать с другим реагентом. Обычными субстратами для отрыва протонов являются спирты, фенолы, амины, и угольные кислоты. В пKа значение диссоциации связи C – H чрезвычайно велико, но pKа альфа-водороды карбонильного соединения примерно на 3 логарифмических единицы ниже. Типичный pKа значения 16,7 для ацетальдегид и 19 для ацетон.[48] Диссоциация может происходить в присутствии подходящего основания.
- RC (O) CH2R '+ B ⇌ RC (O) CH−R '+ BH+
База должна иметь pKа значение не менее чем примерно на 4 единицы меньше, иначе равновесие будет почти полностью слева.
Ион гидроксида сам по себе не является достаточно сильным основанием, но его можно превратить в одно, добавив гидроксид натрия к этиловый спирт
- ОЙ− + EtOH ⇌ EtO− + H2О
производить этоксид ион. В pKа для самодиссоциации этанола составляет около 16, поэтому ион алкоксида является достаточно сильным основанием.[49] Добавление спирта к альдегиду с образованием полуацеталь представляет собой пример реакции, которую можно катализировать в присутствии гидроксида. Гидроксид также может действовать как катализатор на основе основания Льюиса.[50]
Как нуклеофильный реагент

Ион гидроксида занимает промежуточное положение в нуклеофильность между фторид ион F−, а амид ион NH−
2.[51] Гидролиз сложный эфир
- р1C (O) ИЛИ2 + H2O ⇌ R1C (O) OH + HOR2
также известный как омыление является примером нуклеофильное ацильное замещение с гидроксид-ионом, действующим как нуклеофил. В этом случае уходящей группой является алкоксид ион, который немедленно удаляет протон из молекулы воды с образованием алкоголь. При изготовлении мыла хлорид натрия добавляют в высолить натриевая соль карбоновой кислоты; это пример применения общий ионный эффект.
Другие случаи, когда гидроксид может действовать как нуклеофильный реагент: амид гидролиз, Канниццаро реакция, нуклеофильное алифатическое замещение, нуклеофильное ароматическое замещение, И в реакции элиминации. Реакционной средой для КОН и NaOH обычно является вода, но с катализатор межфазного переноса анион гидроксида также может быть переведен в органический растворитель, например, при образовании реакционноспособного промежуточного продукта дихлоркарбен.
Примечания
- ^ [ЧАС+] обозначает концентрацию катионы водорода и [OH−] концентрация гидроксид-ионов
- ^ Строго говоря, pH - это одеколон катиона водорода. Мероприятия
- ^ pOH означает минус логарифм с основанием 10 [OH−], или логарифм 1/[ОЙ−]
- ^ В этом контексте протон - это термин, используемый для сольватированного катиона водорода.
- ^ В водном растворе лиганды L представляют собой молекулы воды, но они могут быть заменены другими лигандами.
- ^ Имя нет происходит от «периода», но от «йода»: надйодновая кислота (сравните йодная кислота, хлорная кислота ), и поэтому произносится как периодический /ˌпɜːrаɪˈɒdɪk/ Полиуретан-глаз-OD-ik, а не как /ˌпɪərɪ-/ ВГЛЯДЕТЬСЯ-ee-.
- ^ Кристаллические структуры проиллюстрированы веб-минералом: Гиббсит, Байерит, Норстрандит и Дойлит
Рекомендации
- ^ Geissler, P.L .; Dellago, C .; Chandler, D .; Hutter, J .; Парринелло, М. (2001). «Автоионизация в жидкой воде» (PDF). Наука. 291 (5511): 2121–2124. Bibcode:2001Научный ... 291.2121G. CiteSeerX 10.1.1.6.4964. Дои:10.1126 / science.1056991. PMID 11251111. Архивировано из оригинал (PDF) на 2007-06-25. Получено 2017-10-25.
- ^ а б Камаль Абу-Дари; Кеннет Н. Раймонд; Дерек П. Фрейберг (1979). «Бигидроксид (ЧАС
3О−
2) анион. Очень короткая симметричная водородная связь ». Варенье. Chem. Soc. 101 (13): 3688–3689. Дои:10.1021 / ja00507a059. - ^ Маркс, Д .; Чандра, А; Такерман, M.E. (2010). «Основные водные растворы: сольватация гидроксидов, структурная диффузия и сравнение с гидратированным протоном». Chem. Rev. 110 (4): 2174–2216. Дои:10.1021 / cr900233f. PMID 20170203.
- ^ Гринвуд, стр. 1168
- ^ а б База данных ИЮПАК SC Обширная база данных опубликованных данных о константах равновесия комплексов металлов и лигандов.
- ^ Накамото, К. (1997). Инфракрасные и рамановские спектры неорганических и координационных соединений. Часть А (5-е изд.). Вайли. ISBN 978-0-471-16394-7.
- ^ Накамото, Часть B, стр. 57
- ^ Адамс, Д. (1967). Металл-лиганд и связанные с ним колебания. Лондон: Эдвард Арнольд. Глава 5.
- ^ Цетин Курт, Юрген Биттнер. "Едкий натр". Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a24_345.pub2.
- ^ Kostick, Деннис (2006). "Кальцинированной соды", глава в Ежегодник полезных ископаемых 2005 г., Геологическая служба США.
- ^ Эмсли, Джон (2001). «Алюминий». Строительные блоки природы: руководство по элементам от А до Я. Оксфорд, Великобритания: Издательство Оксфордского университета. п.24. ISBN 978-0-19-850340-8.
- ^ Эмсли, Джон (2001). «Алюминий». Строительные блоки природы: руководство по элементам от А до Я. Оксфорд, Великобритания: Издательство Оксфордского университета. п.209. ISBN 978-0-19-850340-8.
- ^ Лью. Кристи., Кислоты и основания (основная химия). Издание информационной базы (2009 г.). стр.43.
- ^ Jaunsen, JR (1989). «Поведение и возможности скрубберов из гидроксида лития и диоксида углерода в глубоководной среде». Технический отчет Военно-морской академии США. УСНА-ЦПР-157. Архивировано из оригинал на 2009-08-24. Получено 2008-06-17.
- ^ Холлеман, стр. 1108
- ^ а б c d Томас Р. Дульски Пособие по химическому анализу металлов, ASTM International, 1996 г., ISBN 0-8031-2066-4 п. 100
- ^ Алдериги, L; Dominguez, S .; Gans, P .; Midollini, S .; Sabatini, A .; Вакка, А. (2009). «Связывание бериллия с аденозин-5'-фосфатами в водном растворе при 25 ° C». J. Coord. Chem. 62 (1): 14–22. Дои:10.1080/00958970802474862.
- ^ Housecroft, p. 241
- ^ Housectroft, p. 263
- ^ Технологическая химия Байера
- ^ Джеймс И. Хаус Неорганическая химия, Academic Press, 2008 г., ISBN 0-12-356786-6, п. 764
- ^ Бём, Станислав; Антипова, Диана; Кутан, Йозеф (1997). «Исследование дегидратации метантетраола до угольной кислоты». Международный журнал квантовой химии. 62 (3): 315–322. Дои:10.1002 / (SICI) 1097-461X (1997) 62: 3 <315 :: AID-QUA10> 3.0.CO; 2-8. ISSN 1097-461X.
- ^ Гринвуд, стр. 310
- ^ Гринвуд, стр. 346
- ^ Р. К. Илер, Химия кремнезема, Уайли, Нью-Йорк, 1979. ISBN 0-471-02404-X
- ^ Гринвуд, стр. 384
- ^ Гринвуд, стр. 383–384.
- ^ Гринвуд, стр. 395
- ^ Гринвуд, стр. 705
- ^ Гринвуд, стр. 781
- ^ Гринвуд, стр. 873–874.
- ^ М. Н. Соколов; Е. В. Чубарова; Коваленко К.А. Миронов И.В.; А. В. Вировец; Е. Пересыпкина; В. П. Федин (2005). «Стабилизация таутомерных форм P (OH)3 и HP (OH)2 и их производные по координации с атомами палладия и никеля в гетерометаллических кластерах с Пн
3MQ4+
4 сердечник (M = Ni, Pd; Q = S, Se) ". Российский химический вестник. 54 (3): 615. Дои:10.1007 / s11172-005-0296-1. - ^ Холлеман, стр. 711–718.
- ^ Гринвуд, стр. 853
- ^ Фортман, Джордж С .; Славин, Александра М. З .; Нолан, Стивен П. (2010). «Универсальный синтон меди: [Cu (IPr) (OH)] (IPr = 1,3 бис (диизопропилфенил) имидазол-2-илиден)». Металлоорганические соединения. 29 (17): 3966–3972. Дои:10.1021 / om100733n.
- ^ Хуан Х. Боррас-Альменар, Эухенио Коронадо, Ахим Мюллер Полиоксометаллат Молекулярная наука, Springer, 2003 г., ISBN 1-4020-1242-X, п. 4
- ^ а б c Уэллс, стр. 561
- ^ Уэллс, стр. 393
- ^ а б c d Уэллс, стр. 548
- ^ Виктория М. Нилд, Дэвид А. Кин Диффузное рассеяние нейтронов кристаллическими материалами, Oxford University Press, 2001 г. ISBN 0-19-851790-4, п. 276
- ^ Jacobs, H .; Kockelkorn, J .; Tacke, Th. (1985). "Hydroxide des Natriums, Kalium und Rubidiums: Einkristallzüchtung und röntgenographische Strukturbestimmung an der bei Raumtemperatur stabilen Modifikation". Zeitschrift für Anorganische und Allgemeine Chemie. 531 (12): 119. Дои:10.1002 / zaac.19855311217.
- ^ Еноки, Тошиаки; Цудзикава, Икудзи (1975). «Магнитное поведение случайного магнита, NiпMg1−п(ОЙ)2". Журнал Физического общества Японии. 39 (2): 317. Bibcode:1975JPSJ ... 39..317E. Дои:10.1143 / JPSJ.39.317.
- ^ Афанасиос К. Карамалидис, Давид А. Джомбак Моделирование поверхностного комплексообразования: Гиббсит, Джон Уайли и сыновья, 2010 г. ISBN 0-470-58768-7 стр. 15 и далее
- ^ Bernal, J.D .; Megaw, H.D. (1935). «Функция водорода в межмолекулярных силах». Proc. Рой. Soc. А. 151 (873): 384–420. Bibcode:1935RSPSA.151..384B. Дои:10.1098 / rspa.1935.0157.
- ^ Уэллс, стр. 557
- ^ Уэллс, стр. 555
- ^ Hattori, H .; Misono, M .; Оно, Ю. (редакторы) (1994). Кислотно-основной катализ II. Эльзевир. ISBN 978-0-444-98655-9.CS1 maint: дополнительный текст: список авторов (связь)
- ^ Уэллетт, Р.Дж. и Rawn, J.D. "Органическая химия", 1-е изд. Prentice-Hall, Inc., 1996: Нью-Джерси. ISBN 0-02-390171-3.
- ^ Pine, S.H .; Хендриксон, J.B .; Cram, D.J .; Хаммонд, Г.С. (1980). Органическая химия. Макгроу – Хилл. п.206. ISBN 978-0-07-050115-7.
- ^ Дания, S.E .; Бейтн, Г. Л. (2008). "Основание Льюиса катализ в органическом синтезе". Angewandte Chemie International Edition. 47 (9): 1560–1638. Дои:10.1002 / anie.200604943. PMID 18236505.
- ^ Маллинз, Дж. Дж. (2008). «Шесть столпов органической химии». J. Chem. Образовательный. 85 (1): 83. Bibcode:2008JChEd..85 ... 83M. Дои:10.1021 / ed085p83.pdf В архиве 2011-07-07 на Wayback Machine
Библиография
- Holleman, A.F .; Wiberg, E .; Виберг, Н. (2001). Неорганическая химия. Академическая пресса. ISBN 978-0-12-352651-9.
- Housecroft, C.E .; Шарп, А. Г. (2008). Неорганическая химия (3-е изд.). Прентис Холл. ISBN 978-0-13-175553-6.
- Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- Шрайвер, Д.Ф .; Аткинс, П. В. (1999). Неорганическая химия (3-е изд.). Оксфорд: Издательство Оксфордского университета. ISBN 978-0-19-850330-9.
- Уэллс, А.Ф. (1962). Структурная неорганическая химия (3-е изд.). Оксфорд: Clarendon Press. ISBN 978-0-19-855125-6.


