Пирофосфат тиамина - Thiamine pyrophosphate
Эта статья нужны дополнительные цитаты для проверка. (Сентябрь 2014 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 2- [3 - [(4-амино-2-метилпиримидин-5-ил) метил] -4-метил-1,3-тиазол-3-иум-5-ил] этилфосфоно гидрофосфат | |
| Другие имена Дифосфат тиамина | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| MeSH | Тиамин + пирофосфат |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C12ЧАС19N4О7п2S+ | |
| Молярная масса | 425,314382 г / моль |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Пирофосфат тиамина (ТЭС или же ThPP), или же тиаминдифосфат (ThDP), или же кокарбоксилаза[1] это тиамин (витамин B1) производная который производится фермент тиаминдифосфокиназа. Пирофосфат тиамина - это кофактор который присутствует во всех живых системах, в которых он катализирует несколько биохимический реакции.
Пирофосфат тиамина синтезируется в цитозоле и необходим в цитозоле для активности транскетолазы и в митохондриях для активности пируват-, оксоглутарат- и дегидрогеназ кетокислот с разветвленной цепью. На сегодняшний день дрожжевой переносчик ThPP (Tpc1p) человеческий Tpc и Drosophila melanogaster были идентифицированы как ответственные за митохондриальный транспорт ThPP и ThMP.[2][3][4] Впервые он был обнаружен как необходимое питательное вещество (витамин ) у людей через его связь с периферическая нервная система болезнь бери-бери, что является результатом дефицита тиамина в рацион питания.[5]
ТЭС работает как кофермент во многих ферментативных реакциях, таких как:
- Пируватдегидрогеназа сложный[6]
- Пируват декарбоксилаза в ферментация этанола
- Альфа-кетоглутаратдегидрогеназа сложный
- Дегидрогеназа аминокислот с разветвленной цепью сложный
- 2-гидроксифитаноил-CoA лиаза
- Транскетолаза
Химия
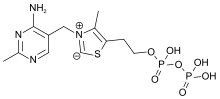
Химически ТЭС состоит из пиримидин кольцо, которое подключено к тиазол кольцо, которое, в свою очередь, связано с пирофосфат (дифосфат) функциональная группа.
Часть молекулы TPP, которая чаще всего участвует в реакциях, - это тиазольное кольцо, которое содержит азот и сера. Таким образом, тиазольное кольцо является «реагентной частью» молекулы. C2 этого кольца может действовать как кислота пожертвовав протон и формирование карбанион. Обычно реакции, которые образуют карбанионы, крайне неблагоприятны, но положительный заряд четырехвалентного азота, непосредственно примыкающего к карбаниону, стабилизирует отрицательный заряд, делая реакцию намного более благоприятной. (Соединение с положительными и отрицательными зарядами на соседних атомах называется илида, поэтому иногда карбанионную форму TPP называют «илидной формой»).[5][7]
Механизмы реакции
В нескольких реакциях, включая реакцию пируватдегидрогеназы, альфа-кетоглутаратдегидрогеназы и транскетолазы, TPP катализирует реакцию обратимого декарбоксилирования (также известного как расщепление соединения-субстрата по углерод-углеродной связи, соединяющей карбонильная группа к соседней реактивной группе - обычно карбоновая кислота или алкоголь ). Это достигается за четыре основных шага:
- Карбанион илид ТЭС нуклеофильно атакует карбонильная группа на подложке. (Это образует одинарную связь между TPP и подложкой.)
- Связь мишени на подложке разрывается, и ее электроны выталкиваются в сторону TPP. Это создает двойную связь между углеродом подложки и углеродом TPP и толкает электроны в двойной связи N-C в TPP полностью на атом азота, переводя его из положительной в нейтральную форму.
- В том, что по существу является обратным шагу два, электроны отталкиваются в противоположном направлении, образуя новую связь между углеродом подложки и другим атомом. (В случае декарбоксилаз это создает новую связь углерод-водород. В случае транскетолазы она атакует новую молекулу субстрата, образуя новую связь углерод-углерод.)
- В том, что по существу является обратным шагу один, связь ТФП-подложка разрывается, реформируя ТФФ-илид и карбонил подложки.


Тиазолиевое кольцо TPP может быть депротонировано по C2, чтобы стать илидом.

Полный вид ТЭС. Стрелка указывает на кислый протон.
Рекомендации
- ^ Петрзак I (1995). «[Витаминные нарушения при хронической почечной недостаточности. I. Водорастворимые витамины]». Przegla̧D Lekarski (по польски). 52 (10): 522–5. PMID 8834846.
- ^ Marobbio, C.M.T .; Vozza, A .; Harding, M .; Bisaccia, F .; Palmieri, F .; Уокер, Дж. Э. (2002-11-01). «Идентификация и реконструкция дрожжевого митохондриального переносчика тиаминпирофосфата». Журнал EMBO. 21 (21): 5653–5661. Дои:10.1093 / emboj / cdf583. ISSN 0261-4189. ЧВК 131080. PMID 12411483.
- ^ Якопетта, Доменико; Карризи, Кьяра; Де Филиппис, Джузеппина; Calcagnile, Valeria M .; Каппелло, Анна Р .; Чименто, Адель; Курчо, Розита; Санторо, Антонелла; Воцца, Анджело (01.03.2010). «Биохимические свойства митохондриального переносчика тиаминпирофосфата из Drosophila melanogaster». Журнал FEBS. 277 (5): 1172–1181. Дои:10.1111 / j.1742-4658.2009.07550.x. ISSN 1742-4658. PMID 20121944.
- ^ Линдхерст, Марджори Дж .; Фиермонте, Джузеппе; Песня, Шивэй; Стройс, Эдуард; Леонардис, Франческо Де; Schwartzberg, Pamela L .; Чен, Эми; Кастенья, Алессандра; Верховен, Нанда (24 октября 2006 г.). «Нокаут Slc25a19 вызывает истощение митохондриального тиаминпирофосфата, эмбриональную летальность, пороки развития ЦНС и анемию». Труды Национальной академии наук. 103 (43): 15927–15932. Дои:10.1073 / pnas.0607661103. ISSN 0027-8424. ЧВК 1595310. PMID 17035501.
- ^ а б Павия, Дональд Л., Гэри М. Лэмпман, Джордж С. Криц, Рэндалл Г. Энгель (2006). Введение в органические лабораторные методы (4-е изд.). Томсон Брукс / Коул. С. 304–5. ISBN 978-0-495-28069-9.CS1 maint: несколько имен: список авторов (связь)
- ^ «PDB для биохимии». Государственный университет Джорджии. Архивировано из оригинал на 2011-07-16. Получено 2009-02-07.
- ^ Воет, Дональд; Джудит Воет; Шарлотта Пратт (2008). Основы биохимии. John Wiley & Sons Inc. стр.508. ISBN 978-0-470-12930-2.


