РНК-индуцированный комплекс сайленсинга - RNA-induced silencing complex
В РНК-индуцированный комплекс сайленсинга, или же RISC, это мультипротеиновый комплекс, в частности рибонуклеопротеин, который включает одну нить одноцепочечного РНК (оцРНК) фрагмент, такой как микроРНК (miRNA) или двухцепочечный малая интерферирующая РНК (миРНК).[1] Одна нить действует как шаблон для распознавания RISC дополнительный информационная РНК (мРНК) стенограмма. После обнаружения один из белков в RISC, названный Аргонавт, активирует и расщепляет мРНК. Этот процесс называется РНК-интерференция (РНКи) и встречается во многих эукариоты; это ключевой процесс в подавление гена и защита от вирусные инфекции.[2][3]
Открытие
В биохимический идентификация RISC проводилась Грегори Хэннон и его коллеги по Лаборатория Колд-Спринг-Харбор.[4] Это произошло всего через пару лет после открытия РНК-интерференции в 1998 г. Эндрю Файер и Крейг Мелло, которые разделили 2006 Нобелевская премия по физиологии и медицине.[2]

Хэннон и его коллеги попытались определить механизмы РНКи, участвующие в ген подавление дцРНК в Дрозофила клетки. Дрозофила Клетки S2 мы трансфицированный с lacZ вектор выражения количественно оценить экспрессия гена с β-галактозидаза Мероприятия. Их результаты показали котрансфекцию с lacZ дцРНК значительно снижает активность β-галактозидазы по сравнению с контрольной дцРНК. Следовательно, дцРНК контролируют экспрессию генов через последовательность взаимодополняемость.
Затем клетки S2 трансфицировали Дрозофила циклин E дцРНК. Циклин E является важным геном для клеточный цикл продвижение в S фаза. Циклин E дцРНК остановил клеточный цикл в грамм1 фаза (до фазы S). Следовательно, РНКи могут нацеливаться эндогенный гены.
Кроме того, дцРНК циклина E только уменьшала РНК циклина E - аналогичный результат был также показан с использованием дцРНК, соответствующей циклин А который действует в S, грамм2 и M фазы клеточного цикла. Это показывает характерный признак РНКи: пониженные уровни мРНК соответствуют уровням добавленной дцРНК.
Чтобы проверить, было ли их наблюдение снижения уровней мРНК результатом прямого нацеливания на мРНК (как предполагают данные из других систем), Дрозофила Клетки S2 трансфицировали либо Дрозофила дцРНК циклина E или lacZ дцРНК, а затем инкубировали с синтетическими мРНК для циклина E или lacZ.
Клетки, трансфицированные дцРНК циклина E, демонстрировали деградацию только транскриптов циклина E - lacZ транскрипты были стабильными. И наоборот, клетки, трансфицированные lacZ дцРНК демонстрировали деградацию только в lacZ транскрипты, а не транскрипты циклина E. Их результаты заставили Хэннона и его коллег предположить, что РНКи разрушает целевую мРНК посредством `` специфичной для последовательности '' нуклеаза Мероприятия'. Они назвали нуклеазой фермент RISC.[4]
Функция в интерференции РНК

Загрузка дцРНК
В РНКаза III Дайсер помогает RISC в РНК-интерференции, расщепляя дцРНК на 21-23 нуклеотид длинные фрагменты с двухнуклеотидом 3' свес.[5][6] Эти фрагменты дцРНК загружаются в RISC, и каждая цепь имеет разную судьбу на основе феномена правила асимметрии.[7][8][9]
- Прядь с менее устойчивой 5 'конец выбирается белком Аргонавт и интегрирован в RISC.[9][10] Эта прядь известна как направляющая.
- Другая цепь, известная как пассажирская цепь, разрушается с помощью RISC.[11]

Генная регуляция
RISC использует связанную направляющую нить для нацеливания на дополнительные 3'-непереведенные области (3'UTR) транскриптов мРНК через Базовая пара Уотсона-Крика.[12][13] RISC теперь может регулировать экспрессию генов транскрипта мРНК несколькими способами.
деградация мРНК
Наиболее понятной функцией RISC является разрушение мРНК-мишени, что снижает уровни транскрипта, доступного для трансляции с помощью рибосомы. Есть два основных требования для деградации мРНК:
- почти идеальное комплементарное соответствие между направляющей цепью и последовательностью целевой мРНК, и
- каталитически активный белок Argonaute, называемый «слайсер», для расщепления целевой мРНК.[13]
Деградация мРНК локализована в цитоплазматический тел позвонил П-тела.[14]
Трансляционная репрессия
RISC может модулировать загрузку рибосом и дополнительных факторов в перевод к подавлять экспрессия связанного транскрипта мРНК. Репрессия трансляции требует только частичного совпадения последовательностей между направляющей цепью и целевой мРНК.[13]
Перевод можно регулировать на этапе инициации:
- предотвращение связывания фактор инициации трансляции эукариот (eIF) в Крышка 5 футов. Было отмечено, что RISC может деаденилат 3 ' поли (А) хвост что может способствовать репрессиям через 5-футовый колпачок.[1][12]
- предотвращение связывания 60S рибосомная субъединица связывание с мРНК может подавлять трансляцию.[15]
Перевод может регулироваться на этапах после инициации:
- способствование преждевременному прекращению трансляции рибосом,[16] или же,
- замедление удлинения.[17]
Все еще существуют предположения о том, является ли репрессия трансляции через инициацию и пост-инициацию взаимоисключающей.
Образование гетерохроматина
Некоторые RISC могут напрямую нацеливаться на геном путем набора гистоновые метилтрансферазы формировать гетерохроматин у гена локус и, таким образом, подавление гена. Эти RISC имеют форму РНК-индуцированный комплекс подавления транскрипции (РИТС). Лучше всего изучен пример с дрожжи РИТС.[13][18][19]
Механизм не совсем понятен, но RITS разрушают растущие транскрипты мРНК. Было высказано предположение, что этот механизм действует как самоусиливающийся Обратная связь 'поскольку деградированные зарождающиеся транскрипты используются РНК-зависимая РНК-полимераза (RdRp) для генерации большего количества миРНК.[20]
Удаление ДНК
RISC, кажется, играют роль в деградации ДНК во время соматический макронуклеус развитие в простейшие Тетрахимена. Это похоже на образование гетерохроматина и подразумевается как защита от вторжения генетических элементов.[21]
RISC-ассоциированные белки
Полная структура RISC все еще не решена. Во многих исследованиях сообщается о диапазоне размеров и компонентов для RISC, но не совсем ясно, связано ли это с наличием ряда комплексов RISC или с различными источниками, которые используют разные исследования.[22]
| Сложный | Источник | Известные / очевидные компоненты | Примерный размер | Видимая функция в пути РНКи |
|---|---|---|---|---|
| Dcr2-R2D2[23] | D. melanogaster Клетки S2 | Dcr2, R2D2 | ~ 250 кДа | процессинг дцРНК, связывание миРНК |
| RLC (А)[24][25] | D. melanogaster эмбрионы | Dcr2, R2D2 | NR | Процессинг дцРНК, связывание миРНК, предшественник RISC |
| Holo-RISC[24][25] | D. melanogaster эмбрионы | Назад 2, Dcr1, Dcr2, Fmr1 /Fxr, R2D2, Цн, Виг | ~ 80С | Связывание и расщепление целевой РНК |
| RISC[4][26][27][28] | D. melanogaster Клетки S2 | Ago2, Fmr1 / Fxr, Цн, Виг | ~ 500 кДа | Связывание и расщепление целевой РНК |
| RISC[29] | D. melanogaster Клетки S2 | Назад2 | ~ 140 кДа | Связывание и расщепление целевой РНК |
| Fmr1-ассоциированный комплекс[30] | D. melanogaster Клетки S2 | L5, L11, 5S рРНК, Fmr1 / Fxr, Назад2, Dmp68 | NR | Возможное связывание и расщепление целевой РНК |
| Минимальный RISC[31][32][33][34] | HeLa клетки | eIF2C1 (назад1) или eIF2C2 (назад2) | ~ 160 кДа | Связывание и расщепление целевой РНК |
| miRNP[35][36] | Клетки HeLa | eIF2C2 (назад2), Близнецы3, Близнецы4 | ~ 550 кДа | ассоциация miRNA, связывание и расщепление целевой РНК |
Аго, Аргонавт; Dcr, Dicer; Dmp68, D. melanogaster ортолог развиндазы РНК p68 млекопитающих; eIF2C1, фактор инициации трансляции эукариот 2C1; eIF2C2, фактор инициации трансляции эукариот 2C2; Fmr1 / Fxr, D. melanogaster ортолог белка умственной отсталости fragile-X; miRNP, комплекс miRNA-белок; NR, не сообщается; Цн, Тюдор-стафилококковая нуклеаза; Vig, интронный ген vasa.

Несмотря на это, очевидно, что белки Argonaute присутствуют и необходимы для функционирования. Кроме того, есть сведения о некоторых ключевых белках (помимо Argonaute) внутри комплекса, которые позволяют RISC выполнять свои функции.
Белки аргонавта
Белки аргонавта - это семейство белков, обнаруженных в прокариоты и эукариоты. Их функция у прокариот неизвестна, но у эукариот они отвечают за РНКи.[37] У человека Argonautes есть восемь членов семейства, из которых только Argonaute 2 участвует исключительно в целевом расщеплении РНК в RISC.[34]

RISC-погрузочный комплекс
Комплекс загрузки RISC (RLC) является важной структурой, необходимой для загрузки фрагментов дцРНК в RISC для нацеливания на мРНК. RLC состоит из dicer, трансактивирующего ответного РНК-связывающего белка (TRBP ) и Аргонавт 2.
- Дайсер РНКаза III эндонуклеаза который генерирует загружаемые фрагменты дцРНК, которые направляют РНКи.
- TRBP представляет собой белок с тремя двухцепочечными РНК-связывающими домены.
- Аргонавт 2 представляет собой РНКазу и является каталитическим центром RISC.
Dicer связывается с TRBP и Argonaute 2, чтобы облегчить перенос фрагментов дцРНК, генерируемых Dicer, в Argonaute 2.[38][39]
Более поздние исследования показали, что человек РНК геликаза А может помочь облегчить RLC.[40]
Другие белки
Недавно идентифицированные члены RISC: SND1 и MTDH.[41] SND1 и MTDH являются онкогенами и регулируют экспрессию различных генов.[42]
| Протеин | Виды белка |
|---|---|
| Dcr1[24] | D. melanogaster |
| Dcr2[23][24][25] | D. melanogaster |
| R2D2[24][25] | D. melanogaster |
| Назад2[24][26][29][30] | D. melanogaster |
| Dmp68[30] | D. melanogaster |
| Fmr1 / Fxr[24][27][30] | D. melanogaster |
| Цн[24][28] | D. melanogaster |
| Виг[24][27] | D. melanogaster |
| Полирибосомы, компоненты рибосомы[4][24][26][30][43] | D. melanogaster, Т. brucei |
| eIF2C1 (назад1)[31] | Х. сапиенс |
| eIF2C2 (назад2)[31][32][34][36] | Х. сапиенс |
| Близнецы3[35][36] | Х. сапиенс |
| Близнецы4[35][36] | Х. сапиенс |
Аго, Аргонавт; Dcr, Dicer; Dmp68, D. melanogaster ортолог развиндазы РНК p68 млекопитающих; eIF2C1, фактор инициации трансляции эукариот 2C1; eIF2C2, фактор инициации трансляции эукариот 2C2; Fmr1 / Fxr, D. melanogaster ортолог белка умственной отсталости fragile-X; Цн, Тюдор-стафилококковая нуклеаза; Vig, интронный ген vasa.
Связывание мРНК
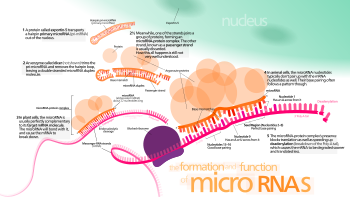
Пока неясно, как активированный комплекс RISC определяет местонахождение мРНК-мишеней в клетке, хотя было показано, что этот процесс может происходить в ситуациях вне текущей трансляции белка с мРНК.[44]
Эндогенно экспрессируемая миРНК в многоклеточные животные обычно не полностью комплементарны большому количеству генов и, таким образом, они модулируют экспрессию посредством репрессии трансляции.[45][46] Однако в растения, этот процесс имеет гораздо большую специфичность в отношении мРНК-мишени, и обычно каждая миРНК связывается только с одной мРНК. Более высокая специфичность означает, что деградация мРНК более вероятна.[47]
Смотрите также
Рекомендации
- ^ а б Филипович В., Бхаттачарья С.Н., Зоненбер Н. (2008). «Механизмы посттранскрипционной регуляции микроРНК: есть ли ответы?». Природа Обзоры Генетика. 9 (2): 102–114. Дои:10.1038 / nrg2290. PMID 18197166.
- ^ а б Огонь А., Сюй С., Монтгомери М.К., Костас С.А., Драйвер С.Е., Мелло СС (1998). "Сильное и специфическое генетическое вмешательство двухцепочечной РНК в Caenorhabditis elegans". Природа. 391 (6669): 806–811. Дои:10.1038/35888. PMID 9486653.
- ^ Уотсон, Джеймс Д. (2008). Молекулярная биология гена. Сан-Франциско, Калифорния: Лаборатория издательства Колд-Спринг-Харбор. С. 641–648. ISBN 978-0-8053-9592-1.
- ^ а б c d Хаммонд С. М., Бернштейн Э, Бич Д., Хэннон Г. Дж. (2000). "РНК-направленная нуклеаза опосредует посттранскрипционное молчание генов в Дрозофила клетки ». Природа. 404 (6775): 293–296. Дои:10.1038/35005107. PMID 10749213.
- ^ Заморе П.Д., Тушл Т., Шарп П.А., Бартель Д.П. (2000). «РНКи: двухцепочечная РНК управляет АТФ-зависимым расщеплением мРНК с интервалами от 21 до 23 нуклеотидов». Клетка. 101 (1): 25–33. Дои:10.1016 / S0092-8674 (00) 80620-0. PMID 10778853.
- ^ Вермёлен А., Белен Л., Рейнольдс А., Вольфсон А., Маршалл В., Карпилов Дж., Хворова А. (2005). «Вклад структуры дцРНК в специфичность и эффективность Dicer». РНК. 11 (5): 674–682. Дои:10.1261 / rna.7272305. ЧВК 1370754. PMID 15811921.
- ^ Schwarz DS, Hutvágner G, Du T, Xu Z, Aronin N, Zamore PD (2003). «Асимметрия в сборке ферментного комплекса РНКи». Клетка. 115 (2): 199–208. Дои:10.1016 / S0092-8674 (03) 00759-1. PMID 14567917.
- ^ Хворова А., Рейнольдс А., Джаясена С.Д. (2003). «Функциональные миРНК и миРНК демонстрируют смещение цепи». Клетка. 115 (2): 209–216. Дои:10.1016 / S0092-8674 (03) 00801-8. PMID 14567918.
- ^ а б Сиоми Х., Сиоми М.С. (2009). «На пути к чтению кода РНК-интерференции». Природа. 457 (7228): 396–404. Дои:10.1038 / природа07754. PMID 19158785.
- ^ Preall JB, He Z, Gorra JM, Sontheimer EJ (2006). «Отбор короткой интерферирующей цепи РНК не зависит от полярности процессинга дцРНК во время РНКи в Дрозофила". Текущая биология. 16 (5): 530–535. Дои:10.1016 / j.cub.2006.01.061. PMID 16527750.
- ^ Грегори Р.И., Чендримада Т.П., Куч Н., Шихаттар Р. (2005). «Человеческий RISC сочетает биогенез микроРНК и посттранскрипционное молчание генов». Клетка. 123 (4): 631–640. Дои:10.1016 / j.cell.2005.10.022. PMID 16271387.
- ^ а б Вакияма М., Такимото К., Охара О, Ёкояма С. (2007). «Let-7 microRNA-опосредованное деаденилирование мРНК и репрессия трансляции в бесклеточной системе млекопитающих». Гены и развитие. 21 (15): 1857–1862. Дои:10.1101 / gad.1566707. ЧВК 1935024. PMID 17671087.
- ^ а б c d Пратт AJ, Макрей IJ (2009). «РНК-индуцированный комплекс подавления звука: универсальная машина подавления генов». Журнал биологической химии. 284 (27): 17897–17901. Дои:10.1074 / jbc.R900012200. ЧВК 2709356. PMID 19342379.
- ^ Сен Г.Л., Блау Х.М. (2005). «Argonaute2 / RISC находится в сайтах распада мРНК млекопитающих, известных как цитоплазматические тельца». Природа клеточной биологии. 7 (6): 633–636. Дои:10.1038 / ncb1265. PMID 15908945.
- ^ Chendrimada TP, Finn KJ, Ji X, Baillat D, Gregory RI, Liebhaber SA, Pasquinelli AE, Shiekhattar R (2007). «Молчание микроРНК посредством привлечения RISC eIF6». Природа. 447 (7146): 823–828. Дои:10.1038 / природа05841.
- ^ Петерсен CP, Bordeleau ME, Pelletier J, Sharp PA (2006). «Короткие РНК репрессируют трансляцию после инициации в клетках млекопитающих». Молекулярная клетка. 21 (4): 533–542. Дои:10.1016 / j.molcel.2006.01.031. PMID 16483934.
- ^ Maroney PA, Yu Y, Fisher J, Nilsen TW (2006). «Доказательства того, что микроРНК связаны с трансляцией информационных РНК в клетках человека». Структурная и молекулярная биология природы. 13 (12): 1102–1107. Дои:10.1038 / nsmb1174.
- ^ Вердел А., Джиа С., Гербер С., Сугияма Т., Гайги С., Гревал С.И., Моазед Д. (2004). «РНКи-опосредованное нацеливание на гетерхроматин комплексом RITS». Наука. 303 (5658): 672–676. Дои:10.1126 / science.1093686. ЧВК 3244756. PMID 14704433.
- ^ Вердел А., Джиа С., Гербер С., Сугияма Т., Гайги С., Гревал С.И., Моазед Д. (2004). "RITS действует в СНГ способствовать транскрипции, опосредованной РНК-интерференцией, и посттранскрипционному молчанию ". Природа Генетика. 36 (11): 1174–1180. Дои:10,1038 / ng1452. PMID 15475954.
- ^ Сугияма Т., Кам Х., Вердел А., Моазед Д., Гревал С.И. (2005). «РНК-зависимая РНК-полимераза является важным компонентом самоусиливающейся петли, связывающей сборку гетерохроматина с производством миРНК». Труды Национальной академии наук Соединенных Штатов Америки. 102 (1): 152–157. Дои:10.1073 / pnas.0407641102. ЧВК 544066. PMID 15615848.
- ^ Мочизуки К., Горовский М.А. (2004). "Малые РНК в структуре генома в Тетрахимена". Текущее мнение в области генетики и развития. 14 (2): 181–187. Дои:10.1016 / j.gde.2004.01.004.
- ^ а б c Sontheimer EJ (2005). «Сборка и функция комплексов сайленсинга РНК». Обзоры природы Молекулярная клеточная биология. 6 (2): 127–138. Дои:10.1038 / nrm1568.
- ^ а б Лю Кью, Рэнд Т.А., Калидас С., Ду Ф, Ким Х.Э., Смит Д.П., Ван Х (2003). "R2D2, мост между инициирующим и исполнительным этапами Дрозофила Путь РНКи ». Наука. 301 (5641): 1921–1925. Дои:10.1126 / science.1088710. PMID 14512631.
- ^ а б c d е ж грамм час я j Фам Дж. У., Пеллио Дж. Л., Ли Ю. С., Картью Р. У., Сонтхаймер Э. Дж. (2004). «Dicer-2-зависимый 80S комплекс расщепляет целевые мРНК во время РНКи в Дрозофила". Клетка. 117 (1): 83–94. Дои:10.1016 / S0092-8674 (04) 00258-2.
- ^ а б c d Томари Й, Ду Т, Хейли Б., Шварц Д.С., Беннетт Р., Кук Х.А., Коппетч Б.С., Тёркауф В.Е., Замор П.Д. (2004). «Дефекты сборки RISC в Дрозофила Мутант РНКи Armitage". Клетка. 116 (6): 831–841. Дои:10.1016 / S0092-8674 (04) 00218-1. PMID 15035985.
- ^ а б c Хаммонд С.М., Ботчер С., Кауди А.А., Кобаяши Р., Хэннон Г.Дж. (2001). «Argonaute2, связующее звено между генетическим и биохимическим анализом РНКи». Наука. 293 (5532): 1146–1150. Дои:10.1126 / science.1064023. PMID 11498593.
- ^ а б c Кауди А.А., Майерс М., Хэннон Г.Дж., Хаммонд С.М. (2002). «Хрупкий X-родственный белок и VIG связаны с механизмом интерференции РНК». Гены и развитие. 16 (19): 2491–2496. Дои:10.1101 / гад.1025202. ЧВК 187452. PMID 12368260.
- ^ а б Кауди А.А., Кеттинг Р.Ф., Хаммонд С.М., Денли А.М., Батхорн А.М., Топс Б.Б., Сильва Дж.М., Майерс М.М., Хэннон Г.Дж., Пластерк Р. «Гомолог микрококковой нуклеазы в эффекторных комплексах РНКи». Природа. 425 (6956): 411–414. Дои:10.1038 / природа01956. PMID 14508492.
- ^ а б Рэнд Т.А., Гинальский К., Гришин Н.В., Ван X (2004). «Биохимическая идентификация Argonaute 2 как единственного белка, необходимого для РНК-индуцированной активности комплекса сайленсинга». Труды Национальной академии наук Соединенных Штатов Америки. 101 (40): 14385–14389. Дои:10.1073 / pnas.0405913101. ЧВК 521941. PMID 15452342.
- ^ а б c d е Исидзука А., Сиоми М.К., Сиоми Х. (2002). "А Дрозофила хрупкий белок X взаимодействует с компонентами РНКи и рибосомных белков ». Гены и развитие. 16 (19): 2497–2508. Дои:10.1101 / gad.1022002. ЧВК 187455. PMID 12368261.
- ^ а б c Мартинес Дж., Патканиовска А., Урлауб Х., Лурманн Р., Тушл Т. (2002). «Одноцепочечные антисмысловые миРНК направляют расщепление РНК-мишени в РНКи». Клетка. 110 (5): 563–574. Дои:10.1016 / S0092-8674 (02) 00908-X. HDL:11858 / 00-001M-0000-0012-F2FD-2. PMID 12230974.
- ^ а б Лю Дж., Кармелл М.А., Ривас Ф.В., Марсден К.Г., Томсон Дж. М., Сонг Дж. Дж., Хаммонд С. М., Джошуа-Тор Л., Хэннон Г. Дж. (2004). «Argonaute2 - это каталитический двигатель РНКи млекопитающих». Наука. 305 (5689): 1437–1441. Дои:10.1126 / science.1102513. PMID 15284456.
- ^ Мартинес Дж., Тушл Т. (2004). «RISC представляет собой 5'-фосфомоноэфир-продуцирующую РНК-эндонуклеазу». Гены и развитие. 18 (9): 975–980. Дои:10.1101 / gad.1187904. ЧВК 406288. PMID 15105377.
- ^ а б c Мейстер Г., Ландталер М., Патканиовска А., Дорсетт И., Тенг Г., Тушл Т. (2004). «Человеческий Argonaute2 опосредует расщепление РНК, нацеленное на миРНК и миРНК». Молекулярная клетка. 15 (2): 1403–1408. Дои:10.1016 / j.molcel.2004.07.007. PMID 15260970.
- ^ а б c Mourelatos Z, Dostie J, Paushkin S, Sharma A, Charroux B, Abel L, Rappsilber J, Mann M, Dreyfuss G (2002). «miRNPs: новый класс рибонуклеопротеидов, содержащий множество микроРНК». Гены и развитие. 16 (6): 720–728. Дои:10.1101 / gad.974702. ЧВК 155365. PMID 11914277.
- ^ а б c d Хутвагнер Г., Заморе П.Д. (2002). «МикроРНК в многооборотном ферментном комплексе РНКи». Наука. 297 (5589): 2056–2060. Дои:10.1126 / science.1073827. PMID 12154197.
- ^ Холл ТМ (2005). «Структура и функция белков Argonaute». Клетка. 13 (10): 1403–1408. Дои:10.1016 / j.str.2005.08.005.
- ^ Чендримада Т.П., Грегори Р.И., Кумарасвами Э., Норман Дж., Куч Н., Нишикура К., Шихаттер Р. (2005). «TRBP привлекает комплекс Dicer к Ago2 для обработки микроРНК и подавления гена». Природа. 436 (7051): 740–744. Дои:10.1038 / природа03868. ЧВК 2944926. PMID 15973356.
- ^ Ван Х.В., Ноланд С., Сиридечадилок Б., Тейлор Д.В., Ма Э., Фельдерер К., Дудна Д.А., Ногалес Э. (2009). «Структурные сведения о процессинге РНК человеческим RISC-загрузочным комплексом». Структурная и молекулярная биология природы. 16 (11): 1148–1153. Дои:10.1038 / nsmb.1673. ЧВК 2845538. PMID 19820710.
- ^ Фу Кью, Юань Я. (2013). «Структурное понимание сборки RISC при помощи дцРНК-связывающих доменов спиралей РНК человека A (DHX9)». Исследования нуклеиновых кислот. 41 (5): 3457–3470. Дои:10.1093 / nar / gkt042. ЧВК 3597700. PMID 23361462.
- ^ Ю Б.К., Сантекадур П.К., Гредлер Р., Чен Д., Эмдад Л., Бхутиа С., Паннелл Л., Фишер П. Б., Саркар Д. (2011). «Повышенная активность РНК-индуцированного комплекса сайленсинга (RISC) способствует развитию гепатоцеллюлярной карциномы». Гепатология. 53 (5): 1538–1548. Дои:10.1002 / hep.24216. ЧВК 3081619. PMID 21520169.
- ^ Ю Б.К., Эмдад Л., Ли С.Г., Су З., Сантекадур П., Чен Д., Гредлер Р., Фишер ПБ, Саркар Д. (2011). «Ген повышения астроцитов (AEG-1): многофункциональный регулятор нормальной и патологической физиологии». Фармакология и терапия. 130 (1): 1–8. Дои:10.1016 / j.pharmthera.2011.01.008. ЧВК 3043119. PMID 21256156.
- ^ Джикенг А., Ши Х, Чуди С., Шен С., Уллу Е. (2003). «Рибонуклеопротеин siRNA обнаружен, связанный с полирибосомами в Trypanosoma brucei". РНК. 9 (7): 802–808. Дои:10.1261 / rna.5270203. ЧВК 1370447. PMID 12810914.
- ^ Сен Г.Л., Верман Т.С., Блау Х.М. (2005). «Трансляция мРНК не является предпосылкой для опосредованного небольшими интерферирующими РНК расщепления мРНК». Дифференциация. 73 (6): 287–293. Дои:10.1111 / j.1432-0436.2005.00029.x. PMID 16138829.
- ^ Саумет А., Леселье СН (2006). «Антивирусное подавление РНК: мы похожи на растения?». Ретровирология. 3: 3. Дои:10.1186/1742-4690-3-3. ЧВК 1363733. PMID 16409629.
- ^ Бартель Д.П. (2009). «МикроРНК: распознавание мишеней и регуляторные функции». Клетка. 136 (2): 215–233. Дои:10.1016 / j.cell.2009.01.002. ЧВК 3794896. PMID 19167326.
- ^ Джонс-Роудс MW, Бартель Д.П., Бартель Б (2006). «МикроРНК и их роль регулятора в растениях». Ежегодный обзор биологии растений. 57: 19–53. Дои:10.1146 / annurev.arplant.57.032905.105218. PMID 16669754.
дальнейшее чтение
- Sontheimer, EJ (2005). «Сборка и функция комплексов сайленсинга РНК». Обзоры природы Молекулярная клеточная биология. 6 (2): 127–138. Дои:10.1038 / nrm1568.
- Фу Цюй, Юань Я. (март 2013 г.). «Структурное понимание сборки RISC при помощи дцРНК-связывающих доменов человеческой РНК-геликазы A (DHX9)». Исследования нуклеиновых кислот. 41 (5): 3457–70. Дои:10.1093 / nar / gkt042. ЧВК 3597700. PMID 23361462.
- Шварц Д.С., Томари Ю., Заморе П.Д. (2004). "РНК-индуцированный комплекс сайленсинга представляет собой Mg2+-зависимая эндонуклеаза ». Текущая биология. 14 (9): 787–91. Дои:10.1016 / j.cub.2004.03.008. PMID 15120070.
внешняя ссылка
- РНК-индуцированный + молчание + комплекс в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
