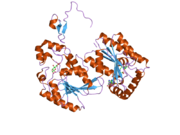PFKFB3 - PFKFB3
PFKFB3 это ген который кодирует 6-фосфофрукто-2-киназа / фруктозо-2,6-бифосфатаза 3 фермент в людях.[5][6][7] Это один из 4 тканеспецифичных изоферментов PFKFB, идентифицированных в настоящее время (PFKFB1-4).[8]
Ген
Ген PFKFB3 картирован в единственном локусе на хромосоме 10 (10p15-p14).[5][6] Он охватывает область размером 32,5 КБ с открытой рамкой считывания длиной 5675 ПБ. По оценкам, он состоит из 19 экзонов, из которых 15 экспрессируются регулярно.[8] Наблюдался альтернативный сплайсинг вариабельного, COOH-концевого домена, что привело к образованию 6 различных изоформ, названных UBI2K1 - UBI2K6 у людей.[9] Другая номенклатура также распознает две широкие категории изоформ PFKFB3, называемые «индуцибельными» и «повсеместными».[10] Индуцибельная изоформа белка iPFK2 названа так, потому что было показано, что ее экспрессия индуцируется гипоксическими условиями.
Предполагается, что промотор PFKFB3 содержит несколько сайтов связывания, включая сайты связывания Sp-1 и AP-2. Он также содержит мотивы связывания E-бокса, ядерного фактора-1 (NF-1) и элемента ответа на прогестерон. Показано, что экспрессия промотора индуцируется сложными эфирами форбола и передачей сигналов циклической АМФ-зависимой протеинкиназы.[10]
Структура
Четыре изоформы PFKFB обладают высокой (85%) гомологией последовательности «2-Kase / 2-Pase core», но имеют разные свойства, основанные на вариабельных N- и C-концевых регуляторных доменах и вариациях в остатках, окружающих активные сайты.[11] Индуцируемая изоформа PFKFB3 обладает более высокой активностью «2-казы» (киназы), чем другие изоформы, из-за фосфорилирования Ser-460 с помощью PKA или AMP-зависимой протеинкиназы.[11] Высокая «2-каазная» активность PFKFB3 также обусловлена отсутствием специфического Ser, который фосфорилируется в других изоформах PFKFB для снижения киназной активности.[12]
Первичный белок, кодируемый PFKFB3, iPFK2, состоит из 590 аминокислот. Его расчетная молекулярная масса составляет 66,9 кДа, а изоэлектрическая точка - 8,64.[8] Кристаллическая структура была определена в 2006 году:[11]
- Исследователь обнаружил, что iPFK2 имеет N-концевую структуру бета-шпильки, которая обеспечивает связывание фруктозо-6-фосфата с активным сайтом посредством взаимодействия с доменом «2-Pase» белка. Внутри iPFK2 есть два активных кармана для фруктозо-2,6-бисфосфатазы и 6-фосфофрукто-2-киназы, которые отличаются по структуре. Активный центр F-2,6-BP структурно открыт, в то время как активный карман 6-фосфофрукто-2-киназы более жесткий. Эта жесткость обеспечивает независимое связывание F-6-P и АТФ с повышенным сродством по сравнению с другими изоформами.
Функция
iPFK2 превращает фруктозо-6-фосфат во фруктозо-2,6-бисP (F2,6BP). F2,6BP представляет собой «мощный» аллостерический активатор 6-фосфофруктокиназы-1 (PFK-1), стимулирующий гликолиз. Нажмите, чтобы увидеть изображение функции PFFKB3[постоянная мертвая ссылка ].
Роль в нейрональной эксайтотоксичности
В нейронах метаболизм глюкозы посредством гликолиза обычно низок по сравнению с астроцитами. Согласно гипотезе лактатного челнока от астроцитов к нейронам, захват глюкозы паренхимой головного мозга происходит преимущественно в астроцитах, которые впоследствии выделяют лактат для использования нейронами.[13] В нейронах глюкоза в основном метаболизируется через пентозофосфатный путь (PPP), который необходим для регенерации NADPH (H +) и поддержания окислительно-восстановительного статуса нейронов. Этот нейрональный метаболический переключатель диктуется активностью PFKFB3. В нейронах изобилие белка PFKFB3 незначительно из-за непрерывной протеасомной деградации фермента.[14]Однако перевозбуждение подтипа глутаматных рецепторов N-метил-D-аспартата (NMDAR), известное как эксайтотоксичность, стабилизирует белок PFKFB3 в нейронах, что приводит к перенаправлению потока глюкозы от PPP к гликолизу с последующей низкой доступностью NADPH (H +) для правильная регенерация GSH; в конечном итоге это приводит к окислительному стрессу и гибели нейронов. Молчание PFKFB3 с помощью малой интерферирующей РНК в нейронах in vitro предотвращает увеличение ROS и апоптотическую гибель, вызванную эксайтотоксическим стимулом.[15] Фармакологическое ингибирование PFKFB3 in vitro также защищает нейроны от апоптоза, вызванного перевозбуждением NMDAR, а также от нейротоксичности, вызванной амилоид-β-пептидом. При использовании in vivo на мышиной модели ишемического инсульта ингибитор PFKFB3 облегчает моторную дискоординацию и повреждение инфаркта головного мозга. [16]
Связь с раком
Эффект Варбурга
В Эффект варбурга, предложенный Отто Варбагом в 1956 году,[17] описывает активацию гликолиза в большинстве раковых клеток даже в присутствии кислорода. Высокая скорость гликолиза сопровождается повышенной ферментацией молочной кислоты, обеспечивая дополнительные питательные вещества для роста раковых клеток и туморогенеза.
PFKFB3 связан с эффектом Варбурга, поскольку его активность увеличивает скорость гликолиза. Было обнаружено, что PFKFB3 активируется при многих формах рака, включая рак толстой кишки, груди, яичников и щитовидной железы.[18] Сниженное метилирование PFKFB3 также обнаруживается при некоторых видах рака, вызывая переход к гликолитическому пути, поддерживающему раковый рост.[19]
Сигнальный путь гипоксии
Экспрессия PFKFB3 индуцируется гипоксией.[20] Промотор PFKFB3 содержит сайты связывания, называемые элементами ответа на гипоксию (HRE), которые рекрутируют связывание фактор, индуцируемый гипоксией-1 (HIF-1).[21]
Передача сигналов гипоксии посредством стабилизации HIF-1α активирует транскрипцию генов, которые обеспечивают выживание в условиях низкого содержания кислорода. Эти гены включают ферменты гликолиза, такие как PFKFB3, которые позволяют синтез АТФ без кислорода, и фактор роста эндотелия сосудов (VEGF), который способствует ангиогенезу.
Клеточный цикл и апоптоз
Совсем недавно было обнаружено, что PFKFB3 способствует развитию клеточного цикла (пролиферации клеток) и подавляет апоптоз, регулируя циклин-зависимая киназа 1 (КДК-1). Было обнаружено, что синтез PFKFB3 F2,6BP в ядре регулирует Cdk-1, тогда как цитозольный PFKFB3 активирует PFK-1. Ядерный PFKFB3 активирует Cdk1 для фосфорилирования сайта Thr-187 p27, вызывая снижение уровней p27.[22][23] (См. Сводный рисунок ). Снижение уровня p27 вызывает защиту от апоптоза и прогрессирования клеток через контрольную точку фазы G1 / S. Эти данные установили значительную связь между выживаемостью и пролиферацией раковых клеток PFKFB3.
Циркадные часы
Циркадные часы нарушение регуляции связано со многими типами рака.[24] Экспрессия PFKFB3 проявляет циркадную ритмичность, которая различается для раковых и незлокачественных клеток.[25] В частности, было обнаружено, что циркадный фактор транскрипции «ЧАСЫ 'Связывается с промотором PFKFB3 на подлинном сайте «E-box» для увеличения транскрипции в раковых клетках.
- Ингибирование PFKFB3 с использованием 3PO было успешным в снижении роста рака и усилении апоптоза, но только в определенные моменты времени в пределах циркадного цикла. Это открытие подчеркивает необходимость временного ингибирования PFKFB3 при лечении рака. Роль ингибирования PFKFB3 в этом процессе теперь следует рассмотреть, принимая во внимание недавнюю информацию о том, что 3PO, как было показано, не является ингибитором PFKFB3 (3PO был неактивен в анализе ингибирования киназы PFKFB3 (IC50> 100 мкМ)) [26] (см. соответствующее обсуждение в § Низкомолекулярные ингибиторы PFKFB3 )
Дополнительные связи рака
- PFKFB3 - это активирован прогестины в клетках рака груди[27]
- PFKFB3 продвигает ангиогенез
- Молчание PFKFB3 нарушает ангиогенез. Гликолиз, управляемый PFKFB3, преобладает над активностью Notch по защите стеблей. PFKFB3 регулирует поведение клеток кончика и ножки и разделяется с F-актином.[28]
Стратегия противораковой терапии
Ингибирование PFKFB3 анализируется как потенциальная противораковая терапия. Наиболее ярким примером является клиническое испытание Advanced Cancer Therapeutics (ACT) с участием PFK158, улучшенная версия 3PO, ингибитор PFKFB3. Однако, похоже, что дальнейшее развитие прекращено из-за неутешительных результатов фазы I (см. также обсуждение соединений ACT в § Низкомолекулярные ингибиторы PFKFB3 ).
Низкомолекулярные ингибиторы PFKFB3
Несколько низкомолекулярных ингибиторов PFKFB3 в настоящее время находятся в разработке.
Долгое время небольшая молекула 3- (3-пиридинил) -1- (4-пиридинил) -2-пропен-1-он (3PO) считалась ингибитором PFKFB3 и использовалась в качестве ингибитора PFKFB3 во многих научных публикациях. . 3PO снижает поглощение глюкозы и увеличивает аутофагию.[29] В настоящее время проводятся исследования различных производных 3PO (например, PFKF15).[30] в попытке повысить их эффективность в качестве противораковой терапии, но данные о производных 3PO, которые на самом деле являются ингибиторами PFKFB3, также отсутствуют.
Недавнее исследование одной из ведущих фармацевтических компаний АстраЗенека и CRT Discovery Laboratories крупнейшего в мире независимого благотворительного фонда исследований рака Cancer Research UK показали, что 3PO был неактивен в анализе ингибирования киназы PFKFB3 (IC50> 100 мкМ).[26] Кристаллические структуры 3PO, а также его аналогов PFK15 и PFK158 с ферментом PFKFB3 также отсутствуют. Выводы АстраЗенека и Cancer Research UK в отношении 3PO не оспариваются ни разработчиками 3PO с 7 апреля 2015 года.
Эффективность двух известных ингибиторов PFKFB3, а именно AZ67 (от АстраЗенека и CRT Discovery Laboratories [26]), и PFK158, улучшенное, но близкое по структуре производное 3PO, были недавно исследованы на предмет их способности снижать продукцию F2,6BP в клетках A549. Оба соединения (AZ67 и PFK158) были способны снижать клеточные уровни F2,6BP дозозависимым образом с IC50 0,51 мкМ и 5,90 мкМ соответственно. Чтобы увидеть, является ли снижение клеточных уровней F2,6BP результатом прямого ингибирования PFKFB3, оба соединения были опробованы в ферментативном бесклеточном анализе. Исследование показало, что AZ67 ингибирует ферментативную активность PFKFB3 с IC50 0,018 мкМ, что соответствует ранее опубликованным результатам. Однако PFK158 не влиял на ферментативную активность PFKFB3 при любой из протестированных концентраций (до 100 мкМ). Соответственно, хотя PFK158 способен уменьшать F2,6BP и гликолитический поток, эксперименты показывают, что эти эффекты не связаны с ферментативным ингибированием PFKFB3.[16]
Вместе эти результаты ставят под сомнение ряд научных исследований и публикаций, в которых 3PO и его производные (такие как PFKF158) использовались в качестве ингибитора PFKFB3.
В 2018 г. Kancera сообщили о разработке и характеристике KAN0438241 (и его пролекарства KAN0438757) как мощного и высокоселективного ингибитора PFKFB3 и радиосенсибилизатора.[31]
Другие пути с участием PFKFB3
Аутофагия
Повышенная активность PFKFB3 ускоряет производство ROS как конечного продукта гликолиза и, таким образом, увеличивает аутофагию. Аналогичным образом было обнаружено, что ингибирование PFKFB3 вызывает аутофагию.[32][33] Увидеть сводное изображение.
Аутофагия может продлить выживание клеток в условиях низкой энергии. Это открытие было обнаружено в отношении ревматоидного артрита.[34] Было обнаружено, что Т-клетки RA не способны активировать аутофагию, и в экспериментах с нокаутом PFKFB3 был установлен в качестве вышестоящего регулятора этого процесса.
Инсулиновый сигнальный путь
PFKFB3 был идентифицирован в киномном скрининге как регулятор инсулина / IGF-1. Было обнаружено, что подавление PFKFB3 снижает инсулино-стимулированное поглощение глюкозы, транслокацию GLUT4 и передачу сигналов Akt в адипоцитах 3T3-L1. Сверхэкспрессия вызывает инсулинозависимое фосфорилирование субстратов Akt и Akt.[35]
Экспрессия PFKFB3 увеличивается в жировых тканях во время адипогенез, но было показано, что длительное воздействие инсулина снижает экспрессию PFKFB3. Считается, что это происходит из-за механизма отрицательной обратной связи с участием инсулина.[36]
p38 / MK2 Путь передачи сигналов стресса
Было обнаружено, что p38 MAPK увеличивает активность PFKFB3 посредством (1) транскрипционной активации PFKFB3 в ответ на стрессовые стимулы и (2) посттрансляционного фосфорилирования iPFK2 по Ser-461.[37][38]
Увидеть сводная цифра.[38]
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000170525 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000026773 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б Николл Дж., Гамильтон Дж. А., Сазерленд Г. Р., Сазерленд Р. Л., Уоттс К. К. (апрель 1997 г.). «Третья человеческая изоформа 6-фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы (PFKFB3) отображает позицию 10p14-p15». Хромосомные исследования. 5 (2): 150. Дои:10.1023 / А: 1018482511456. PMID 9146922. S2CID 34088792.
- ^ а б Manzano A, Rosa JL, Ventura F, Pérez JX, Nadal M, Estivill X и др. (Март 1999 г.). «Молекулярное клонирование, экспрессия и хромосомная локализация повсеместно экспрессируемого человеческого гена 6-фосфофрукто-2-киназы / фруктозы-2,6-бисфосфатазы (PFKFB3)». Цитогенетика и клеточная генетика. 83 (3–4): 214–7. Дои:10.1159/000015181. PMID 10072580. S2CID 23221556.
- ^ «Ген Entrez: 6-фосфофрукто-2-киназа / фруктозо-2,6-бифосфатаза 3 PFKFB3».
- ^ а б c Mahlknecht U, Chesney J, Hoelzer D, Bucala R (октябрь 2003 г.). «Клонирование и хромосомная характеристика гена 6-фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы-3 (PFKFB3, iPFK2)». Международный журнал онкологии. 23 (4): 883–91. Дои:10.3892 / ijo.23.4.883. PMID 12963966.
- ^ Кесслер Р., Эшрих К. (март 2001 г.). «Сплайс изоформ повсеместно распространенной 6-фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы в мозге человека». Исследование мозга. Молекулярные исследования мозга. 87 (2): 190–5. Дои:10.1016 / s0169-328x (01) 00014-6. PMID 11245921.
- ^ а б Наварро-Сабате А., Манзано А., Риера Л., Роза Д. Л., Вентура Ф., Бартронс Р. (февраль 2001 г.). «Человеческий вездесущий ген 6-фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы (PFKFB3): характеристика промотора и геномная структура». Ген. 264 (1): 131–8. Дои:10.1016 / S0378-1119 (00) 00591-6. PMID 11245987.
- ^ а б c Ким С.Г., Манес Н.П., Эль-Маграби М.Р., Ли Й.Х. (февраль 2006 г.). «Кристаллическая структура индуцируемой гипоксией формы 6-фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы (PFKFB3): возможная новая мишень для лечения рака». Журнал биологической химии. 281 (5): 2939–44. Дои:10.1074 / jbc.M511019200. PMID 16316985.
- ^ Сакакибара Р., Като М., Окамура Н., Накагава Т., Комада Ю., Томинага Н. и др. (Июль 1997 г.). «Характеристика человеческой плацентарной фруктозо-6-фосфат, 2-киназы / фруктозо-2,6-бисфосфатазы». Журнал биохимии. 122 (1): 122–8. Дои:10.1093 / oxfordjournals.jbchem.a021719. PMID 9276680.
- ^ Magistretti PJ, Sorg O, Yu N, Martin JL, Pellerin L (1993). «Нейротрансмиттеры регулируют энергетический обмен в астроцитах: влияние на обмен веществ между нервными клетками». Dev Neurosci. 15 (3–51): 306–12. Дои:10.1159/000111349. PMID 7805583.
- ^ Эрреро-Мендес А., Алмейда А., Фернандес Е., Маэстре С., Монкада С., Боланьос, JP (июнь 2009 г.). «Биоэнергетический и антиоксидантный статус нейронов контролируется непрерывной деградацией ключевого гликолитического фермента под действием APC / C-Cdh1». Nat Cell Biol. 11 (6): 747–52. Дои:10.1038 / ncb1881. PMID 19448625. S2CID 19519317.
- ^ Родригес-Родригес П., Фернандес Э., Алмейда А., Боланьос Дж. П. (октябрь 2012 г.). «Эксайтотоксический стимул стабилизирует PFKFB3, вызывая пентозофосфатный путь к переключению гликолиза и нейродегенерации». Разница в гибели клеток. 19 (10): 1582–9. Дои:10.1038 / cdd.2012.33. ЧВК 3438489. PMID 22421967.
- ^ а б Бурмистрова О., Олиас-Арджона А., Лапреса Р., Хименес-Бласко Д., Еремеева Т., Шишов Д. и др. (Август 2019 г.). «Нацеливание на PFKFB3 облегчает церебральную ишемию-реперфузию у мышей». Научные отчеты. 9 (1): 11670. Дои:10.1038 / s41598-019-48196-z. ЧВК 6691133. PMID 31406177.
 Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0.
Материал был скопирован из этого источника, который доступен под Международная лицензия Creative Commons Attribution 4.0. - ^ Варбург О (февраль 1956 г.). «О происхождении раковых клеток». Наука. 123 (3191): 309–14. Дои:10.1126 / science.123.3191.309. PMID 13298683.
- ^ Ацуми Т., Чесни Дж., Мец К., Ленг Л., Доннелли С., Макита З. и др. (Октябрь 2002 г.). «Высокая экспрессия индуцибельной 6-фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы (iPFK-2; PFKFB3) при раке человека». Исследования рака. 62 (20): 5881–7. PMID 12384552.
- ^ Ямамото Т., Такано Н., Исивата К., Омура М., Нагахата Ю., Мацуура Т. и др. (Март 2014 г.). «Пониженное метилирование PFKFB3 в раковых клетках шунтирует глюкозу в направлении пентозофосфатного пути». Nature Communications. 5: 3480. Дои:10.1038 / ncomms4480. ЧВК 3959213. PMID 24633012.
- ^ Минченко А., Лещинский И., Опентанова И., Санг Н., Сринивас В., Армстед В., Каро Дж. (Февраль 2002 г.). «Гипоксия-индуцируемая фактор-1-опосредованная экспрессия гена 6-фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы-3 (PFKFB3). Его возможная роль в эффекте Варбурга». Журнал биологической химии. 277 (8): 6183–7. Дои:10.1074 / jbc.M110978200. ЧВК 4518871. PMID 11744734.
- ^ Обач М., Наварро-Сабате А., Каро Дж., Конг Х, Дюран Дж., Гомес М. и др. (Декабрь 2004 г.). «Промотор гена 6-фосфофрукто-2-киназы (pfkfb3) содержит сайты связывания индуцируемого гипоксией фактора-1, необходимые для трансактивации в ответ на гипоксию». Журнал биологической химии. 279 (51): 53562–70. Дои:10.1074 / jbc.M406096200. PMID 15466858.
- ^ Ялцин А., Клем Б.Ф., Симмонс А., Дорожка А, Нельсон К., Клем А.Л. и др. (Сентябрь 2009 г.). «Ядерное нацеливание 6-фосфофрукто-2-киназы (PFKFB3) увеличивает пролиферацию с помощью циклин-зависимых киназ». Журнал биологической химии. 284 (36): 24223–32. Дои:10.1074 / jbc.M109.016816. ЧВК 2782016. PMID 19473963.
- ^ Ялчин А., Клем Б.Ф., Имберт-Фернандес Ю., Озкан С.К., Пекер С., О'Нил Дж. И др. (Июль 2014 г.). «6-Фосфофрукто-2-киназа (PFKFB3) способствует прогрессированию клеточного цикла и подавляет апоптоз посредством Cdk1-опосредованного фосфорилирования p27». Смерть и болезнь клеток. 5 (7): e1337. Дои:10.1038 / cddis.2014.292. ЧВК 4123086. PMID 25032860.
- ^ Саввидис К., Кутсильерис М. (декабрь 2012 г.). «Нарушение циркадных ритмов в биологии рака». Молекулярная медицина. 18 (1): 1249–60. Дои:10.2119 / молмед.2012.00077. ЧВК 3521792. PMID 22811066.
- ^ Чен Л., Чжао Дж., Тан Ц., Ли Х, Чжан Ц., Ю Р и др. (Апрель 2016 г.). «PFKFB3 Контроль роста рака путем реагирования на выходные сигналы циркадных часов». Научные отчеты. 6: 24324. Дои:10.1038 / srep24324. ЧВК 4832144. PMID 27079271.
- ^ а б c Boyd S, Brookfield JL, Critchlow SE, Cumming IA, Curtis NJ, Debreczeni J, et al. (Апрель 2015 г.). «Структурный дизайн сильнодействующих и селективных ингибиторов метаболической киназы PFKFB3». Журнал медицинской химии. 58 (8): 3611–25. Дои:10.1021 / acs.jmedchem.5b00352. PMID 25849762.
- ^ Novellasdemunt L, Obach M, Millán-Ariño L, Manzano A, Ventura F, Rosa JL и др. (Март 2012 г.). «Прогестины активируют 6-фосфофрукто-2-киназу / фруктозо-2,6-бисфосфатазу 3 (PFKFB3) в клетках рака груди». Биохимический журнал. 442 (2): 345–56. Дои:10.1042 / BJ20111418. HDL:10261/87967. PMID 22115192.
- ^ Де Бок К., Георгиаду М., Скурс С., Кучнио А., Вонг Б.В., Кантельмо А.Р. и др. (Август 2013). «Роль гликолиза, вызванного PFKFB3, в прорастании сосудов». Ячейка. 154 (3): 651–63. Дои:10.1016 / j.cell.2013.06.037. PMID 23911327.
- ^ Кларер А.С., О'Нил Дж., Имберт-Фернандес Й., Клем А., Эллис С.Р., Кларк Дж. И др. (Январь 2014). «Ингибирование 6-фосфофрукто-2-киназы (PFKFB3) вызывает аутофагию как механизм выживания». Рак и метаболизм. 2 (1): 2. Дои:10.1186/2049-3002-2-2. ЧВК 3913946. PMID 24451478.
- ^ Клем Б.Ф., О'Нил Дж., Тапольски Г., Клем А.Л., Имберт-Фернандес И., Керр Д.А. и др. (Август 2013). «Нацеливание на 6-фосфофрукто-2-киназу (PFKFB3) в качестве терапевтической стратегии против рака». Молекулярная терапия рака. 12 (8): 1461–70. Дои:10.1158 / 1535-7163.MCT-13-0097. ЧВК 3742633. PMID 23674815.
- ^ Gustafsson NM, Färnegårdh K, Bonagas N, Ninou AH, Groth P, Wiita E, et al. (Сентябрь 2018 г.). «Нацеливание на PFKFB3 повышает радиочувствительность раковых клеток и подавляет гомологичную рекомбинацию». Nature Communications. 9 (1): 3872. Дои:10.1038 / с41467-018-06287-х. ЧВК 6155239. PMID 30250201.
- ^ Кларер А.С., О'Нил Дж., Имберт-Фернандес Й., Клем А., Эллис С.Р., Кларк Дж. И др. (Январь 2014). «Ингибирование 6-фосфофрукто-2-киназы (PFKFB3) вызывает аутофагию как механизм выживания». Рак и метаболизм. 2 (1): 2. Дои:10.1186/2049-3002-2-2. ЧВК 3913946. PMID 24451478.
- ^ Ян З., Горонзи Дж. Дж., Вейанд К. М. (февраль 2014 г.). «Гликолитический фермент PFKFB3 / фосфофруктокиназа регулирует аутофагию». Аутофагия. 10 (2): 382–3. Дои:10.4161 / авто.27345. ЧВК 5079104. PMID 24351650.
- ^ Ян З., Фуджи Х., Мохан С.В., Горонзи Дж.Дж., Вейанд С.М. (сентябрь 2013 г.). «Дефицит фосфофруктокиназы нарушает выработку АТФ, аутофагию и окислительно-восстановительный баланс в Т-клетках ревматоидного артрита». Журнал экспериментальной медицины. 210 (10): 2119–34. Дои:10.1084 / jem.20130252. ЧВК 3782046. PMID 24043759.
- ^ Trefely S, Khoo PS, Krycer JR, Chaudhuri R, Fazakerley DJ, Parker BL и др. (Октябрь 2015 г.). «Kinome Screen определяет PFKFB3 и метаболизм глюкозы как важные регуляторы инсулин / инсулиноподобного фактора роста (IGF) -1 сигнального пути». Журнал биологической химии. 290 (43): 25834–46. Дои:10.1074 / jbc.M115.658815. ЧВК 4646237. PMID 26342081.
- ^ Ацуми Т., Нишио Т., Нива Х., Такеучи Дж., Бандо Х., Симидзу С. и др. (Декабрь 2005 г.). «Экспрессия индуцибельных изоформ 6-фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы / PFKFB3 в адипоцитах и их потенциальная роль в регуляции гликолита». Сахарный диабет. 54 (12): 3349–57. Дои:10.2337 / диабет.54.12.3349. PMID 16306349.
- ^ Novellasdemunt L, Bultot L, Manzano A, Ventura F, Rosa JL, Vertommen D и др. (Июнь 2013). «Активация PFKFB3 в раковых клетках по пути p38 / MK2 в ответ на стрессовые стимулы». Биохимический журнал. 452 (3): 531–43. Дои:10.1042 / bj20121886. PMID 23548149.
- ^ а б Боланьос JP (июнь 2013 г.). «Адаптация гликолиза к пролиферации раковых клеток: путь MAPK фокусируется на PFKFB3». Биохимический журнал. 452 (3): e7-9. Дои:10.1042 / bj20130560. PMID 23725459.
дальнейшее чтение
- Сакаи А., Като М., Фукасава М., Исигуро М., Фуруя Е., Сакакибара Р. (март 1996 г.). «Клонирование кДНК, кодирующей новый изофермент фруктозо-6-фосфата, 2-киназы / фруктозо-2,6-бисфосфатазы из плаценты человека». Журнал биохимии. 119 (3): 506–11. Дои:10.1093 / oxfordjournals.jbchem.a021270. PMID 8830046.
- Гамильтон Дж. А., Каллаган М. Дж., Сазерленд Р. Л., Уоттс К. К. (апрель 1997 г.). «Идентификация PRG1, нового чувствительного к прогестину гена с гомологией последовательности с 6-фосфофрукто-2-киназой / фруктозо-2,6-бисфосфатазой». Молекулярная эндокринология. 11 (4): 490–502. Дои:10.1210 / me.11.4.490. PMID 9092801.
- Сакакибара Р., Като М., Окамура Н., Накагава Т., Комада Ю., Томинага Н. и др. (Июль 1997 г.). «Характеристика человеческой плацентарной фруктозо-6-фосфат, 2-киназы / фруктозо-2,6-бисфосфатазы». Журнал биохимии. 122 (1): 122–8. Дои:10.1093 / oxfordjournals.jbchem.a021719. PMID 9276680.
- Scanlan MJ, Gordan JD, Williamson B., Stockert E, Bander NH, Jongeneel V, et al. (Ноябрь 1999 г.). «Антигены, распознаваемые аутологичными антителами у пациентов с почечно-клеточной карциномой». Международный журнал рака. 83 (4): 456–64. Дои:10.1002 / (SICI) 1097-0215 (19991112) 83: 4 <456 :: AID-IJC4> 3.0.CO; 2-5. PMID 10508479.
- Фукасава М., Такаяма Э., Шиномия Н., Окумура А., Рокутанда М., Ямамото Н., Сакакибара Р. (январь 2000 г.). «Идентификация промоторной области гена плацентарной 6-фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы человека». Сообщения о биохимических и биофизических исследованиях. 267 (3): 703–8. Дои:10.1006 / bbrc.1999.2022. PMID 10673355.
- Кесслер Р., Эшрих К. (март 2001 г.). «Сплайс изоформ повсеместно распространенной 6-фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы в мозге человека». Исследование мозга. Молекулярные исследования мозга. 87 (2): 190–5. Дои:10.1016 / S0169-328X (01) 00014-6. PMID 11245921.
- Риера Л., Обач М., Наварро-Сабате А., Дюран Дж., Пералес Дж. К., Виньялс Ф. и др. (Август 2003 г.). «Регулирование повсеместной 6-фосфофрукто-2-киназы с помощью протеолитического пути убиквитин-протеасома во время миогенной дифференцировки клеток C2C12». Письма FEBS. 550 (1–3): 23–9. Дои:10.1016 / S0014-5793 (03) 00808-1. PMID 12935880. S2CID 41726316.
- Обач М., Наварро-Сабате А., Каро Дж., Конг Х, Дюран Дж., Гомес М. и др. (Декабрь 2004 г.). «Промотор гена 6-фосфофрукто-2-киназы (pfkfb3) содержит сайты связывания индуцируемого гипоксией фактора-1, необходимые для трансактивации в ответ на гипоксию». Журнал биологической химии. 279 (51): 53562–70. Дои:10.1074 / jbc.M406096200. PMID 15466858.
- Манес Н.П., Эль-Маграби М.Р. (июнь 2005 г.). «Киназная активность 6-фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы головного мозга человека регулируется посредством ингибирования фосфоенолпируватом». Архивы биохимии и биофизики. 438 (2): 125–36. Дои:10.1016 / j.abb.2005.04.011. PMID 15896703.
- Минченко О.Г., Огура Т., Опентанова И.Л., Минченко Д.О., Эсуми Н. (декабрь 2005 г.). «Сплайс-изоформа 6-фосфофрукто-2-киназы / фруктозо-2,6-бисфосфатазы-4: экспрессия и регуляция гипоксии». Молекулярная и клеточная биохимия. 280 (1–2): 227–34. Дои:10.1007 / s11010-005-8009-6. PMID 16311927. S2CID 23500518.