Масляная кислота - Butyric acid
| |||
 | |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Бутановая кислота[1] | |||
| Другие имена | |||
| Идентификаторы | |||
3D модель (JSmol ) |
| ||
| ЧЭБИ |
| ||
| ЧЭМБЛ |
| ||
| ChemSpider | |||
| DrugBank |
| ||
| ECHA InfoCard | 100.003.212 | ||
| Номер ЕС |
| ||
| |||
| КЕГГ |
| ||
| MeSH | Масляная + кислота | ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII |
| ||
| Номер ООН | 2820 | ||
| |||
| |||
| |||
| Характеристики | |||
| C 3ЧАС 7COOH | |||
| Молярная масса | 88.106 г · моль−1 | ||
| Внешность | Бесцветная жидкость | ||
| Запах | Неприятный, похожий на рвоту или запах тела | ||
| Плотность | 1,135 г / см3 (-43 ° С)[2] 0,9528 г / см3 (25 ° С)[3] | ||
| Температура плавления | -5,1 ° С (22,8 ° F, 268,0 К)[3] | ||
| Точка кипения | 163,75 ° С (326,75 ° F, 436,90 К)[3] | ||
| Возгорается при -35 ° C ΔsublЧАС | |||
| Смешиваемый | |||
| Растворимость | Смешивается с этиловый спирт, эфир. Слабо растворим в CCl4 | ||
| бревно п | 0.79 | ||
| Давление газа | 0,112 кПа (20 ° C) 0,74 кПа (50 ° C) 9,62 кПа (100 ° C)[4] | ||
Закон Генри постоянный (kЧАС) | 5.35·10−4 Л · атм / моль | ||
| Кислотность (пKа) | 4.82 | ||
| -55.10·10−6 см3/ моль | |||
| Теплопроводность | 1.46·105 Вт / м · К | ||
| 1,398 (20 ° С)[3] | |||
| Вязкость | 1.814 сп (15 ° С)[5] 1,426 сП (25 ° C) | ||
| Структура | |||
| Моноклиника (-43 ° С)[2] | |||
| C2 / м[2] | |||
а = 8,01 Å, б = 6,82 Å, c = 10,14 Å[2] α = 90 °, β = 111,45 °, γ = 90 ° | |||
| 0,93 Д (20 ° С)[5] | |||
| Термохимия | |||
Теплоемкость (C) | 178,6 Дж / моль · К[4] | ||
Стандартный моляр энтропия (S | 222,2 Дж / моль · К[5] | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | −533,9 кДж / моль[4] | ||
Станд. Энтальпия горение (ΔcЧАС⦵298) | 2183,5 кДж / моль[4] | ||
| Опасности | |||
| Паспорт безопасности | Внешний паспорт безопасности материалов | ||
| Пиктограммы GHS |  [6] [6] | ||
| Сигнальное слово GHS | Опасность | ||
| H314[6] | |||
| P280, P305 + 351 + 338, P310[6] | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | От 71 до 72 ° C (от 160 до 162 ° F, от 344 до 345 K)[6] | ||
| 440 ° С (824 ° F, 713 К)[6] | |||
| Пределы взрываемости | 2.2–13.4% | ||
| Смертельная доза или концентрация (LD, LC): | |||
LD50 (средняя доза ) | 2000 мг / кг (перорально, крыса) | ||
| Родственные соединения | |||
Связанный Карбоновые кислоты | Пропионовая кислота, Пентановая кислота | ||
Родственные соединения | 1-бутанол Бутиральдегид Метилбутират | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Масляная кислота (из Древнегреческий: βούτῡρον, что означает «масло»), также известный под систематическим названием бутановая кислота, прямая цепь алкил карбоновая кислота с химическая формула CH3CH2CH2CO2H. Это маслянистая бесцветная жидкость с неприятный запах. Изомасляная кислота (2-метилпропановая кислота) представляет собой изомер. Соли и сложные эфиры масляной кислоты известны как бутираты или же бутаноаты. Кислота не встречается широко в природе, но ее сложные эфиры широко распространены. Это обычный промышленный химикат.[7] и важный компонент в кишечнике млекопитающих.
История
Масляная кислота была впервые обнаружена в нечистой форме в 1814 году французским химиком. Мишель Эжен Шеврёль. К 1818 году он достаточно очистил его, чтобы описать его. Однако Шеврёль не опубликовал свои ранние исследования масляной кислоты; вместо этого он сдал свои выводы в виде рукописи секретарю Академия Наук в Париже, Франция. Анри Браконно Французский химик также исследовал состав масла и публиковал свои открытия, что привело к спорам о приоритете. Еще в 1815 году Шеврёль утверждал, что он обнаружил вещество, ответственное за запах масла.[8] К 1817 году он опубликовал некоторые из своих открытий относительно свойств масляной кислоты и назвал ее.[9] Однако только в 1823 году он подробно описал свойства масляной кислоты.[10] Название масляная кислота происходит от Древнегреческий: βούτῡρον, что означает «масло», вещество, в котором оно было впервые обнаружено. Латинское название Butyrum (или же бутурум) похож.
Вхождение
Триглицериды масляной кислоты составляют 3–4% масла. Когда масло становится прогорклым, масляная кислота высвобождается из глицерида путем гидролиз.[11] Это одна из подгруппы жирных кислот, называемых короткоцепочечные жирные кислоты. Масляная кислота является типичным карбоновая кислота реагирует с основаниями и влияет на многие металлы.[12]Он находится в животный жир и растительные масла, бык молоко, грудное молоко, масло сливочное, сыр пармезан, запах тела, рвота, и как продукт анаэробного ферментация (в том числе в двоеточие ).[13][14] Оно имеет вкус что-то вроде масла и неприятного запах. Млекопитающие с хорошими способностями обнаружения запаха, такими как собаки, может обнаружить его на 10 частей на миллиард, в то время как люди может обнаруживать его только в концентрациях выше 10 частей на миллион. В производство продуктов питания, он используется как ароматизатор.[15]
У людей масляная кислота является одним из двух основных эндогенные агонисты человека рецептор гидроксикарбоновой кислоты 2 (HCA2), а граммввод / вывод-связанный Рецептор, связанный с G-белком.[16][17]
Масляная кислота присутствует в качестве октиловый эфир в пастернак (Pastinaca sativa)[18] и в семени дерево гинкго.[19]
Производство
Промышленное
В промышленности масляную кислоту производят гидроформилирование из пропен и синтез-газ, формируя масляный альдегид, который окисленный к конечному продукту.[7]
- ЧАС2 + CO + CH3CH = CH2 → CH3CH2CH2CHO → масляная кислота
Его можно отделить от водных растворов путем насыщения солями, такими как хлорид кальция. Кальциевая соль Ca (C4ЧАС7О2)2·ЧАС2О менее растворяется в горячей воде, чем в холодной.
Микробный биосинтез
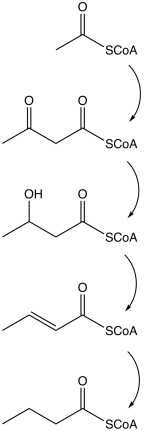
Бутират производится несколькими процессами ферментации, выполняемыми обязать анаэробный бактерии.[20] Этот путь ферментации был открыт Луи Пастер в 1861 г. Примеры производства бутирата разновидность бактерий:
- Clostridium butyricum
- Clostridium kluyveri
- Clostridium pasteurianum
- Faecalibacterium prausnitzii
- Fusobacterium nucleatum
- Butyrivibrio fibrisolvens
- Eubacterium limosum
Путь начинается с гликолитический расщепление глюкоза до двух молекулы из пируват, как это происходит у большинства организмов. Пируват окисленный в ацетилкофермент А катализируется пируват: ферредоксин оксидоредуктаза. Две молекулы углекислый газ (CO2) и две молекулы элементарного водород (ЧАС2) образуются как отходы. Впоследствии АТФ производится на последней стадии ферментации. На каждую молекулу глюкозы вырабатываются три молекулы АТФ, что дает относительно высокий выход. Сбалансированное уравнение для этого брожения:
- C6ЧАС12О6 → С4ЧАС8О2 + 2 СО2 + 2 часа2
Другие пути образования бутирата включают восстановление сукцината и диспропорционирование кротоната.
| Действие | Ответственный фермент |
|---|---|
| Ацетил-коэнзим А превращается в ацетоацетил-кофермент А | ацетил-КоА-ацетилтрансфераза |
| Кофермент Ацетоацетил превращается в β-гидроксибутирил КоА | β-гидроксибутирил-КоА дегидрогеназа |
| β-гидроксибутирил-КоА превращается в кротонил КоА | кротоназа |
| Кротонил-КоА превращается в бутирил КоА (CH3CH2CH2C = O-CoA) | бутирил-КоА дегидрогеназа |
| А фосфат группа заменяет CoA на формирование бутирилфосфат | фосфобутирилаза |
| Присоединяется фосфатная группа ADP формировать АТФ и бутират | бутираткиназа |
Форма нескольких видов ацетон и п-бутанол в альтернативном пути, который начинается как бутиратное брожение. Некоторые из этих видов:
- Clostridium acetobutylicum, самый известный производитель ацетона и бутанола, также используется в промышленности
- Clostridium beijerinckii
- Clostridium tetanomorphum
- Clostridium aurantibutyricum
Эти бактерии начинают ферментацию бутирата, как описано выше, но когда pH падает ниже 5, они переключаются на производство бутанола и ацетона, чтобы предотвратить дальнейшее снижение pH. На каждую молекулу ацетона образуется две молекулы бутанола.
Изменение пути происходит после образования ацетоацетил-КоА. Затем это промежуточное звено принимает два возможных пути:
- ацетоацетил-КоА → ацетоацетат → ацетон
- ацетоацетил-КоА → бутирил-КоА → бутиральдегид → бутанол
Источники ферментируемого волокна
Остатки сильно ферментируемых волокон, например, из устойчивый крахмал, овсяные отруби, пектин, и гуар преобразованы кишечные бактерии в короткоцепочечные жирные кислоты (SCFA), включая бутират, производящий больше SCFA, чем менее ферментируемые волокна, такие как целлюлозы.[14][21] Одно исследование показало, что устойчивый крахмал неизменно производит больше бутирата, чем другие типы пищевые волокна.[22] Производство SCFA из волокон в жвачный животные, такие как крупный рогатый скот, ответственны за содержание бутирата в молоке и масле.[13][23]
Фруктаны - еще один источник растворимых пищевых волокон пребиотиков, которые могут перевариваться с образованием бутирата.[24] Они часто встречаются в растворимых волокнах продуктов с высоким содержанием сера, такой как лук и крестоцветные овощи. Источники фруктанов включают пшеница (хотя некоторые сорта пшеницы, такие как пишется содержат меньшее количество),[25] рожь, ячмень, лук, чеснок, Иерусалим и глобус артишок, спаржа, свекла, цикорий, листья одуванчика, лук-порей, радиккио, белая часть зеленый лук, брокколи, брюссельская капуста, капуста, фенхель и пребиотики, такие как фруктоолигосахариды (FOS ), олигофруктоза, и инулин.[26][27]
Реакции
Масляная кислота реагирует как обычная карбоновая кислота: она может образовывать амид, сложный эфир, ангидрид, и хлористый производные.[28] Последний, бутирилхлорид обычно используется как промежуточное звено для получения других.
Использует
Масляная кислота используется для получения различных сложных эфиров бутирата. Он используется для производства бутират ацетата целлюлозы (CAB), который используется в широком спектре инструментов, красок и покрытий и более устойчив к разрушению, чем ацетат целлюлозы.[29] Однако CAB может разлагаться под воздействием тепла и влаги с выделением масляной кислоты.[30]
Низкомолекулярные эфиры масляной кислоты, такие как метилбутират, имеют в основном приятный аромат или вкус.[7] Как следствие, они используются как пищевые и парфюмерные добавки. Это одобренный пищевой ароматизатор в ЕС. База данных FLAVIS (номер 08.005).
Из-за сильного запаха его также использовали в качестве добавки к рыболовной наживке.[31] Многие из имеющихся в продаже ароматизаторов, используемых в карп (Cyprinus carpio) приманки используют масляную кислоту в качестве сложноэфирной основы; однако неясно, привлекает ли рыбу сама масляная кислота или добавленные к ней вещества. Однако масляная кислота была одной из немногих органических кислот, которые оказались вкусными для обоих. линь и горький.[32] Вещество также использовалось как вонючая бомба к Общество охраны морских пастухов разрушить японский китобойный промысел экипажи.[33]
Фармакология
| Ингибированный фермент | IC50 (нМ) | Въездная записка |
|---|---|---|
| HDAC1 | 16,000 | |
| HDAC2 | 12,000 | |
| HDAC3 | 9,000 | |
| HDAC4 | 2,000,000 | Нижняя граница |
| HDAC5 | 2,000,000 | Нижняя граница |
| HDAC6 | 2,000,000 | Нижняя граница |
| HDAC7 | 2,000,000 | Нижняя граница |
| HDAC8 | 15,000 | |
| HDAC9 | 2,000,000 | Нижняя граница |
| CA1 | 511,000 | |
| CA2 | 1,032,000 | |
| GPCR цель | pEC50 | Въездная записка |
| FFAR2 | 2.9–4.6 | Полный агонист |
| FFAR3 | 3.8–4.9 | Полный агонист |
| HCA2 | 2.8 | Агонист |
Фармакодинамика
Масляная кислота (pKа 4.82) полностью ионизированный в физиологический pH, так что это анион - это материал, который в основном используется в биологических системах. Это один из двух основных эндогенные агонисты человека рецептор гидроксикарбоновой кислоты 2 (HCA2, он же GPR109A), а граммввод / вывод-связанный Рецептор, связанный с G-белком (GPCR),[16][17]
Как и другие короткоцепочечные жирные кислоты (SCFAs), бутират является агонистом рецепторы свободных жирных кислот FFAR2 и FFAR3, которые функционируют как датчики питательных веществ, способствующие гомеостатический контроль энергетического баланса; однако среди группы SCFA только бутират является агонистом HCA2.[36][37][38] Это также Ингибитор HDAC (в частности, HDAC1, HDAC2, HDAC3 и HDAC8),[34][35] препарат, подавляющий функцию гистоновая деацетилаза ферментов, тем самым способствуя ацетилированному состоянию гистоны в камерах.[38] Ацетилирование гистонов разрыхляет структуру хроматин за счет сокращения электростатический притяжение между гистонами и ДНК.[38] В целом считается, что факторы транскрипции не сможет получить доступ к областям, в которых гистоны тесно связаны с ДНК (т.е. не ацетилированы, например, гетерохроматин).[требуется медицинская цитата ] Следовательно, считается, что масляная кислота усиливает транскрипционную активность промоторов,[38] которые обычно подавляются или подавляются из-за активности гистондеацетилазы.
Фармакокинетика
Бутират, который вырабатывается в толстой кишке в результате микробной ферментации пищевых волокон, в первую очередь абсорбируется и метаболизируется колоноцитами и печенью.[примечание 1] для выработки АТФ при энергетическом обмене; однако некоторое количество бутирата всасывается в дистальный отдел толстой кишки, которая не связана с воротной веной, что позволяет системное распространение бутирата в системы многих органов через систему кровообращения.[38] Бутират, попавший в системный кровоток, может легко пересечь гематоэнцефалический барьер через переносчики монокарбоксилатов (то есть некоторые члены Группа транспортеров SLC16A ).[39][40] Другие переносчики, которые опосредуют прохождение бутирата через липидные мембраны, включают: SLC5A8 (SMCT1), SLC27A1 (FATP1) и SLC27A4 (FATP4).[34][40]
Метаболизм
Масляная кислота метаболизируется различными человеческими XM-лигазы (ACSM1, ACSM2B, ASCM3, ACSM4, ACSM5 и ACSM6), также известная как бутират-CoA лигаза.[41][42] Метаболит, образующийся в результате этой реакции, бутирил-КоА, и производится следующим образом:[41]
- Аденозинтрифосфат + масляная кислота + кофермент А → аденозинмонофосфат + пирофосфат + бутирил-КоА
Как короткоцепочечная жирная кислота, бутират метаболизируется митохондрии как энергия (т.е. аденозинтрифосфат или ATP) источник через метаболизм жирных кислот.[38] В частности, это важный источник энергии для клеток млекопитающих. двоеточие (колоноциты).[24] Без бутиратов клетки толстой кишки подвергаются аутофагия (т.е. самопереваривание) и умрут.[43]
У людей предшественник бутирата трибутирин, который естественным образом присутствует в масле, метаболизируется триацилглицерин липаза в дибутирин и бутилировать через реакцию:[44]
- Трибутирин + H2O → дибутирин + масляная кислота
Биохимия
Бутират оказывает множество эффектов на энергетический гомеостаз и родственные болезни (сахарный диабет и ожирение ), воспаление, и иммунная функция (например, произносится противомикробный и антиканцерогенный эффекты) у людей. Эти эффекты происходят через его метаболизм в митохондриях с образованием АТФ в течение метаболизм жирных кислот или через один или несколько своих гистон-модифицирующий фермент цели (т.е. гистоновые деацетилазы I класса ) и Рецептор, связанный с G-белком цели (т.е. FFAR2, FFAR3, и HCA2 ).[36][45]
В кишечнике млекопитающих
Бутират необходим для поддержания иммунного гомеостаза.[36] Хотя роль и значение бутирата в кишечнике до конца не изучены, многие исследователи утверждают, что истощение запасов бутират-продуцирующих бактерий у пациентов с несколькими васкулитами имеет важное значение для патогенеза этих заболеваний. Истощение бутирата в кишечнике обычно вызвано отсутствием или истощением бактерий, продуцирующих бутират (BPB). Это истощение BPB приводит к микробному дисбактериоз. Это характеризуется общим низким биоразнообразием и истощением основных элементов, производящих бутират. Бутират является важным микробным метаболитом, который играет жизненно важную роль в качестве модулятора правильной иммунной функции хозяина. Было показано, что дети с дефицитом ДПБ более подвержены аллергическим заболеваниям.[46] и диабет 1 типа.[47] Бутират играет ключевую роль в поддержании иммунного гомеостаза как локально (в кишечнике), так и системно (через циркулирующий бутират). Было показано, что он способствует дифференциации регуляторные Т-клетки. В частности, циркулирующий бутират вызывает образование экстратимических регуляторных Т-клеток. Низкие уровни бутирата у людей могут способствовать снижению контроля, опосредованного регуляторными Т-клетками, тем самым способствуя мощному иммунопатологическому ответу Т-клеток.[48] С другой стороны, кишечный бутират ингибирует местные провоспалительные цитокины. Поэтому отсутствие или истощение этих BPB в кишечнике может быть возможным помощником в чрезмерно активной воспалительной реакции. Бутират в кишечнике также защищает целостность кишечного эпителиального барьера. Следовательно, снижение уровня бутирата приводит к повреждению или дисфункции кишечного эпителиального барьера.[49]
В исследовании 2013 года, проведенном Furusawa et al., Было обнаружено, что бутират микробного происхождения играет важную роль в индукции дифференцировки регуляторных Т-клеток толстой кишки у мышей. Это имеет большое значение и, возможно, имеет отношение к патогенезу и васкулиту, связанному со многими воспалительными заболеваниями, поскольку регуляторные Т-клетки играют центральную роль в подавлении воспалительных и аллергических реакций.[50] В нескольких исследованиях было продемонстрировано, что бутират индуцирует дифференцировку регуляторных Т-клеток in vitro и in vivo.[51] Противовоспалительная способность бутирата была тщательно проанализирована и подтверждена многими исследованиями. Было обнаружено, что бутират, продуцируемый микроорганизмами, ускоряет производство регуляторных Т-клеток, хотя конкретный механизм, с помощью которого это происходит, неясен.[52] Совсем недавно было показано, что бутират играет важную и прямую роль в модуляции экспрессии генов цитотоксических Т-клеток.[53] Бутират также оказывает противовоспалительное действие на нейтрофилы, уменьшая их миграцию в раны. Этот эффект опосредован рецептором HCA1[54]
Иммуномодуляция и воспаление
Воздействие бутирата на иммунную систему опосредовано ингибированием класса I гистоновые деацетилазы и активация его Рецептор, связанный с G-белком цели: HCA2 (GPR109A), FFAR2 (GPR43) и FFAR3 (GPR41).[37][55] Среди короткоцепочечные жирные кислоты, бутират является наиболее мощным промотором регуляторных Т-клеток кишечника. in vitro и единственная в группе, которая является HCA2 лиганд.[37] Было показано, что он является важным медиатором воспалительной реакции толстой кишки. Он обладает как профилактическим, так и терапевтическим потенциалом для противодействия воспалению. язвенный колит и колоректальный рак.
Бутират обладает антимикробными свойствами у людей, которые опосредуются через антимикробный пептид LL-37, который он индуцирует через HDAC ингибирование гистона H3.[55][56][57] In vitro бутират увеличивается экспрессия гена из FOXP3 (в регулятор транскрипции за Tregs) и способствует развитию толстой кишки регуляторные Т-клетки (Tregs) через ингибирование класса I гистоновые деацетилазы;[37][55] благодаря этим действиям он увеличивает выражение интерлейкин 10, противовоспалительное цитокин.[55][37] Бутират также подавляет воспаление толстой кишки, подавляя IFN-γ –STAT1 сигнальные пути, которые частично опосредуются через ингибирование гистондеацетилазы. В то время как временная передача сигналов IFN-γ обычно связана с нормальным хозяином иммунная реакция, хроническая передача сигналов IFN-γ часто связана с хроническим воспалением. Было показано, что бутират ингибирует активность HDAC1, который связан с промотором гена Fas в Т-клетках, что приводит к гиперацетилированию промотора Fas и усилению регуляции Fas рецептор на поверхности Т-клеток.[58]
Похож на другие HCA2 изученные агонисты, бутират также оказывает заметное противовоспалительное действие в различных тканях, включая мозг, желудочно-кишечный тракт, кожу и сосудистая ткань.[59][60][61] Связывание бутирата в FFAR3 индуцирует нейропептид Y выпускает и продвигает функционал гомеостаз слизистой оболочки толстой кишки и кишечной иммунной системы.[62]
Рак
Было показано, что бутират является важным медиатором воспалительной реакции толстой кишки. Он отвечает за около 70% энергии колоноцитов, являясь важным SCFA в толстой кишке. гомеостаз.[63] Бутират обладает как профилактическим, так и терапевтическим потенциалом в борьбе с воспалением. язвенный колит (UC) и колоректальный рак.[64] Он оказывает различное воздействие на здоровые и раковые клетки: это известно как «парадокс бутирата». В частности, бутират подавляет опухолевые клетки толстой кишки и стимулирует пролиферацию здоровых эпителиальных клеток толстой кишки.[65][66]Объяснение того, почему бутират является источником энергии для нормальных колоноцитов и вызывает апоптоз в рак толстой кишки клетки, это Эффект варбурга в раковых клетках, что приводит к нарушению метаболизма бутирата. Это явление приводит к накоплению бутирата в ядре, действующего как гистоновая деацетилаза (HDAC) ингибитор.[67] Одним из механизмов, лежащих в основе функции бутирата при подавлении воспаления толстой кишки, является ингибирование IFN-γ /STAT1 сигнальные пути. Было показано, что бутират подавляет активность HDAC1 это связано с Ген Fas промоутер в Т-клетки, что приводит к гиперацетилированию промотора Fas и усилению регуляции рецептора Fas на поверхности Т-клеток. Таким образом, предполагается, что бутират увеличивает апоптоз Т-лимфоцитов в ткани толстой кишки и тем самым устраняет источник воспаления (продукция IFN-γ).[68] Бутират подавляет ангиогенез путем инактивации Фактор транскрипции Sp1 активность и подавление фактор роста эндотелия сосудов экспрессия гена.[69]
Таким образом, производство летучие жирные кислоты такие как бутират из ферментируемых волокон, может способствовать роли пищевых волокон при раке толстой кишки. Короткоцепочечные жирные кислоты, в состав которых входит масляная кислота, производятся полезными кишечные бактерии (пробиотики ), которые питаются или ферментируют пребиотики, которые представляют собой растительные продукты, содержащие пищевые волокна. Эти короткоцепочечные жирные кислоты приносят пользу колоноцитам, увеличивая выработку энергии, и могут защищать от рака толстой кишки, подавляя пролиферацию клеток.[21]
И наоборот, некоторые исследователи пытались исключить бутират и считать его потенциальным возбудителем рака.[70] Исследования на мышах показывают, что он стимулирует трансформацию MSH2-дефицитный эпителиальные клетки толстой кишки.[71]
Возможные способы лечения восстановления бутирата
Ввиду важности бутирата как регулятора воспаления и фактора, способствующего развитию иммунной системы, истощение запасов бутирата может быть ключевым фактором, влияющим на патогенез многих заболеваний. васкулитный условия. Таким образом, важно поддерживать здоровый уровень бутирата в кишечнике. Пересадка фекальной микробиоты (для восстановления BPB и симбиоз в кишечнике) может быть эффективным путем пополнения уровня бутирата. При этом лечении здоровый человек сдает свой стул для трансплантации человеку с дисбактериозом. Менее инвазивным вариантом лечения является введение бутирата в виде пероральных добавок или клизм, которые оказались очень эффективными в купировании симптомов воспаления с минимальными побочными эффектами или их отсутствием. В исследовании, в котором пациентов с язвенным колитом лечили клизмами с бутиратом, воспаление значительно уменьшилось, и кровотечение полностью прекратилось после введения бутирата.[72]
Зависимость
Масляная кислота - это HDAC ингибитор, который является селективным по отношению к HDAC класса I у человека.[34] HDAC ферменты, модифицирующие гистоны которые могут вызывать деацетилирование гистонов и подавление экспрессии генов. HDAC являются важными регуляторами синаптического образования, синаптическая пластичность, и Долгосрочная память формирование.Известно, что HDAC класса I участвуют в опосредовании развития зависимость.[73][74][75] Масляная кислота и другие ингибиторы HDAC использовались в доклинических исследованиях для оценки транскрипционных, нервных и поведенческих эффектов ингибирования HDAC у животных, зависимых от наркотиков.[75][76][77]
Бутиратные соли и сложные эфиры
В бутират или же бутаноат, ион является C2ЧАС5CО О−, то сопряженное основание масляной кислоты. Это форма, встречающаяся в биологических системах на физиологический pH. Масляное или бутановое соединение представляет собой карбоксилатная соль или же сложный эфир масляной кислоты.
Примеры
Соли
Сложные эфиры
- Бутилбутират
- Бутирил-КоА
- Бутират ацетата целлюлозы (авиационный допинг)
- Бутират бензоата эстрадиола
- Этилбутират
- Метилбутират
- Пентилбутират
- Трибутирин
Смотрите также
Примечания
- ^ Большая часть бутирата, всасываемого в плазма крови из толстой кишки попадает в кровеносную систему через воротная вена; большая часть бутирата, попадающего в кровеносную систему этим путем, поглощается печенью.[38]
Рекомендации
![]() В эту статью включен текст из публикации, которая сейчас находится в всеобщее достояние: Чисхолм, Хью, изд. (1911). "Масляная кислота ". Британская энциклопедия (11-е изд.). Издательство Кембриджского университета.
В эту статью включен текст из публикации, которая сейчас находится в всеобщее достояние: Чисхолм, Хью, изд. (1911). "Масляная кислота ". Британская энциклопедия (11-е изд.). Издательство Кембриджского университета.
- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 746. Дои:10.1039/9781849733069-00648. ISBN 978-0-85404-182-4.
- ^ а б c d Стритер Ф.Дж., Темплтон Д.Х. (1962). «Кристаллическая структура масляной кислоты» (PDF). Acta Crystallographica. 15 (12): 1240–1244. Дои:10.1107 / S0365110X6200328X.
- ^ а б c d Лиде, Дэвид Р., изд. (2009). CRC Справочник по химии и физике (90-е изд.). Бока-Ратон, Флорида: CRC Press. ISBN 978-1-4200-9084-0.
- ^ а б c d е Бутановая кислота в Linstrom, Peter J .; Маллард, Уильям Г. (ред.); Веб-книга NIST Chemistry, стандартная справочная база данных NIST номер 69, Национальный институт стандартов и технологий, Гейтерсбург (Мэриленд), http://webbook.nist.gov (Проверено 27 октября 2020 г.)
- ^ а б c «Бутановая кислота». Chemister.ru. 19 марта 2007 г.. Получено 27 октября 2020.
- ^ а б c d е Сигма-Олдрич Ко., Масляная кислота. Проверено 27 октября, 2020.
- ^ а б c Рименшнайдер, Вильгельм (2002). «Карбоновые кислоты алифатические». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a05_235.
- ^ Шеврёль (1815) "Lettre de M. Chevreul à MM. Les rédacteurs des Annales de chimie" (Письмо г-на Шеврёля в редакцию Annals of Chemistry), Annales de chimie, 94 : 73–79; в сноске на страницах 75–76 он упоминает, что обнаружил вещество, которое отвечает за запах масла.
- ^ Шеврёль (1817 г.) "Extrait d'une lettre de M. Chevreul à MM. Les Rédacteurs du Journal de Pharmacie" (Выдержка из письма г-на Шеврёля в редакцию Journal of Pharmacy), Journal de Pharmacie et des Sciences accessoires, 3 : 79–81. На стр. 81, он назвал масляную кислоту: "Ce principe, que j'ai appelé depuis acid butérique,…" (Этот принцип [т.е. составляющий], который я с тех пор назвал «масляная кислота»,…)
- ^ Э. Шеврёль, Recherches chimiques sur les corps gras d'origine animale [Химические исследования жирных веществ животного происхождения] (Париж, Франция: F.G. Levrault, 1823 г.), страницы 115–133.
- ^ Woo, A.H .; Линдси, Р. (1983). «Пошаговый дискриминантный анализ профилей свободных жирных кислот для определения источников липолитических ферментов в прогорклом масле». Журнал молочной науки. 66 (10): 2070–2075. Дои:10.3168 / jds.S0022-0302 (83) 82052-9.
- ^ ICSC 1334 - Масляная кислота. Inchem.org (23 ноября 1998 г.). Проверено 27 октября 2020.
- ^ а б McNabney, S.M .; Хенаган, Т. М. (2017). «Короткоцепочечные жирные кислоты в толстой кишке и периферических тканях: внимание к бутирату, раку толстой кишки, ожирению и резистентности к инсулину». Питательные вещества. 9 (12): 1348. Дои:10.3390 / nu9121348. ЧВК 5748798. PMID 29231905.
- ^ а б Моррисон, Д. Дж .; Престон, Т. (2016). «Образование короткоцепочечных жирных кислот микробиотой кишечника и их влияние на метаболизм человека». Кишечные микробы. 7 (3): 189–200. Дои:10.1080/19490976.2015.1134082. ЧВК 4939913. PMID 26963409.
- ^ "Масляная кислота". Компания Good Scents. Получено 26 октября 2020.
- ^ а б Offermanns S, Colletti SL, Lovenberg TW, Semple G, Wise A, IJzerman AP (июнь 2011 г.). «Международный союз фундаментальной и клинической фармакологии. LXXXII: Номенклатура и классификация рецепторов гидроксикарбоновых кислот (GPR81, GPR109A и GPR109B)». Фармакологические обзоры. 63 (2): 269–90. Дои:10.1124 / пр.110.003301. PMID 21454438.
- ^ а б Offermanns S, Colletti SL, IJzerman AP, Lovenberg TW, Semple G, Wise A, Waters MG. «Рецепторы гидроксикарбоновой кислоты». IUPHAR / BPS Руководство по фармакологии. Международный союз фундаментальной и клинической фармакологии. Получено 13 июля 2018.
- ^ Кэрролл, Марк Дж .; Беренбаум, Мэй Р. (2002). «Поведенческие реакции паутинного червя на перенос летучих веществ растений». Журнал химической экологии. 28 (11): 2191–2201. Дои:10.1023 / А: 1021093114663. PMID 12523562. S2CID 23512190.
- ^ Рэйвен, Питер Х.; Эверт, Рэй Ф .; Эйххорн, Сьюзен Э. (2005). Биология растений. Компания W.H. Freemanand. стр.429 –431. ISBN 978-0-7167-1007-3. Получено 11 октября 2018.
- ^ Зеедорф, H .; Fricke, W. F .; Veith, B .; Bruggemann, H .; Liesegang, H .; Strittmatter, A .; Miethke, M .; Buckel, W .; Hinderberger, J .; Li, F .; Hagemeier, C .; Thauer, R.K .; Готшалк, Г. (2008). "Геном Clostridium kluyveri, строгий анаэроб с уникальными метаболическими особенностями ". Труды Национальной академии наук. 105 (6): 2128–2133. Bibcode:2008ПНАС..105.2128С. Дои:10.1073 / pnas.0711093105. ЧВК 2542871. PMID 18218779.
- ^ а б Луптон-младший (февраль 2004 г.). «Продукты микробной деградации влияют на риск рака толстой кишки: споры о бутирате». Журнал питания. 134 (2): 479–82. Дои:10.1093 / jn / 134.2.479. PMID 14747692.
- ^ Каммингс Дж. Х., Макфарлейн ГТ, Энглист Х. Н. (февраль 2001 г.). «Пребиотическое пищеварение и ферментация». Американский журнал клинического питания. 73 (2 доп.): 415S – 420S. Дои:10.1093 / ajcn / 73.2.415s. PMID 11157351.
- ^ Груммер Р.Р. (сентябрь 1991 г.). «Влияние кормов на состав молочного жира». Журнал молочной науки. 74 (9): 3244–57. Дои:10.3168 / jds.S0022-0302 (91) 78510-X. PMID 1779073.
- ^ а б Ривьер, Одри; Селак, Мария; Лантин, Дэвид; Леруа, Фредерик; Де Вуйст, Люк (2016). «Бифидобактерии и бактерии толстой кишки, продуцирующие бутираты: важность и стратегии их стимуляции в кишечнике человека». Границы микробиологии. 7: 979. Дои:10.3389 / fmicb.2016.00979. ЧВК 4923077. PMID 27446020.
- ^ «Часто задаваемые вопросы о диете и СРК». Кафедра гастроэнтерологии, переводческое питание, Университет Монаш, Виктория, Австралия. Получено 24 марта 2016.
- ^ Гибсон, Питер Р .; Шеперд, Сьюзан Дж. (1 февраля 2010 г.). «Основанное на фактических данных диетическое управление функциональными желудочно-кишечными симптомами: подход FODMAP». Журнал гастроэнтерологии и гепатологии. 25 (2): 252–258. Дои:10.1111 / j.1440-1746.2009.06149.x. ISSN 1440-1746. PMID 20136989. S2CID 20666740.
- ^ Гибсон, Питер Р .; Варни, Джейн; Малакар, Шрипурна; Мьюир, Джейн Г. (1 мая 2015 г.). «Пищевые компоненты и синдром раздраженного кишечника». Гастроэнтерология. 148 (6): 1158–1174.e4. Дои:10.1053 / j.gastro.2015.02.005. ISSN 1528-0012. PMID 25680668.
- ^ Дженкинс, П. Р. (1985). «Карбоновые кислоты и производные». Общие и синтетические методы. 7. С. 96–160. Дои:10.1039/9781847556196-00096. ISBN 978-0-85186-884-4.
- ^ Локенсгард, Эрик (2015). Промышленные пластмассы: теория и применение (6-е изд.). Cengage Learning.
- ^ Уильямс, Р. Скотт. «Уход за пластмассами: злокачественные пластики». Информационный бюллетень WAAC. 24 (1). Сохранение онлайн. Получено 29 мая 2017.
- ^ Морозильные приманки В архиве 25 января 2010 г. Wayback Machine, nutrabaits.net
- ^ Касумян А, Дёвинг К (2003). «Вкусовые предпочтения к рыбе». Рыба и рыболовство. 4 (4): 289–347. Дои:10.1046 / j.1467-2979.2003.00121.x.
- ^ Японские китобои ранены активистами, поджигающими кислоту В архиве 8 июня 2010 г. Wayback Machine, newser.com, 10 февраля 2010 г.
- ^ а б c d "Масляная кислота". IUPHAR / BPS Руководство по фармакологии. Международный союз фундаментальной и клинической фармакологии. Получено 13 июля 2018.
- ^ а б «Бутановая кислота и бутират натрия». BindingDB. База данных привязки. Получено 27 октября 2020.
- ^ а б c Касубучи М., Хасегава С., Хирамацу Т., Ичимура А., Кимура И. (2015). «Диетические кишечные микробные метаболиты, короткоцепочечные жирные кислоты и регуляция метаболизма хозяина». Питательные вещества. 7 (4): 2839–49. Дои:10.3390 / nu7042839. ЧВК 4425176. PMID 25875123.
Короткоцепочечные жирные кислоты (SCFA), такие как ацетат, бутират и пропионат, которые продуцируются микробной ферментацией пищевых волокон кишечником, считаются основными источниками энергии хозяина и действуют как молекулы передачи сигнала через рецепторы, связанные с G-белком (FFAR2, FFAR3, OLFR78, GPR109A) и в качестве эпигенетических регуляторов экспрессии генов путем ингибирования гистондеацетилазы (HDAC). Недавние данные свидетельствуют о том, что пищевые волокна и SCFA, полученные из кишечных микробов, оказывают множество положительных эффектов на энергетический метаболизм хозяина не только за счет улучшения кишечной среды, но также путем прямого воздействия на различные периферические ткани хозяина.
- ^ а б c d е Hoeppli RE, Wu D, Cook L, Levings MK (февраль 2015 г.). «Среда регуляторной биологии Т-клеток: цитокины, метаболиты и микробиом». Фронт Иммунол. 6: 61. Дои:10.3389 / fimmu.2015.00061. ЧВК 4332351. PMID 25741338.
Рисунок 1: Молекулы микробного происхождения способствуют дифференцировке Treg в толстой кишке. - ^ а б c d е ж грамм Бурасса М.В., Алим И., Бултман С.Дж., Ратан Р.Р. (июнь 2016 г.). «Бутират, нейроэпигенетика и микробиом кишечника: может ли диета с высоким содержанием клетчатки улучшить здоровье мозга?». Neurosci. Латыш. 625: 56–63. Дои:10.1016 / j.neulet.2016.02.009. ЧВК 4903954. PMID 26868600.
- ^ Цудзи А (2005). «Передача малых молекулярных лекарств через гематоэнцефалический барьер через транспортные системы, опосредованные переносчиками». NeuroRx. 2 (1): 54–62. Дои:10.1602 / нейрох.2.1.54. ЧВК 539320. PMID 15717057.
Другие исследования in vivo в наших лабораториях показали, что несколько соединений, включая ацетат, пропионат, бутират, бензойную кислоту, салициловую кислоту, никотиновую кислоту и некоторые β-лактамные антибиотики, могут транспортироваться MCT в BBB.21 ... Поглощение вальпроевой кислоты снижалось в присутствии жирных кислот со средней длиной цепи, таких как гексаноат, октаноат и деканоат, но не пропионата или бутирата, что указывает на то, что вальпроевая кислота попадает в мозг через транспортную систему для средне- жирные кислоты с цепочкой, а не с короткоцепочечными жирными кислотами.
- ^ а б Виджей Н., Моррис МЭ (2014). «Роль переносчиков монокарбоксилатов в доставке лекарств в мозг». Curr. Pharm. Des. 20 (10): 1487–98. Дои:10.2174/13816128113199990462. ЧВК 4084603. PMID 23789956.
Транспортеры монокарбоксилатов (MCT), как известно, опосредуют транспорт монокарбоксилатов с короткой цепью, таких как лактат, пируват и бутират. ... MCT1 и MCT4 также связаны с транспортом короткоцепочечных жирных кислот, таких как ацетат и формиат, которые затем метаболизируются в астроцитах [78]. ... SLC5A8 экспрессируется в нормальной ткани толстой кишки и действует как опухолевый супрессор в толстой кишке человека с подавлением этого гена, происходящим при карциноме толстой кишки. Этот транспортер участвует в концентрированном поглощении бутирата и пирувата, образующихся в результате ферментации бактериями толстой кишки.
- ^ а б "Масляная кислота". База данных метаболома человека. Университет Альберты. Получено 15 августа 2015.
- ^ «Метаболизм бутаноата - контрольный путь». Киотская энциклопедия генов и геномов. Kanehisa Laboratories. 1 ноября 2017 г.. Получено 1 февраля 2018.
- ^ Донохо, Даллас Р .; Гарге, Нихил; Чжан, Синьсинь; Солнце, Вэй; О’Коннелл, Томас М .; Бангер, Морин К .; Бултман, Скотт Дж. (4 мая 2011 г.). «Микробиом и бутират регулируют энергетический метаболизм и аутофагию в толстой кишке млекопитающих». Клеточный метаболизм. 13 (5): 517–526. Дои:10.1016 / j.cmet.2011.02.018. ISSN 1550-4131. ЧВК 3099420. PMID 21531334.
- ^ «триацилглицерин липаза - Homo sapiens». БРЕНДА. Technische Universität Брауншвейг. Получено 25 мая 2015.
- ^ Тилг Х., Мошен А.Р. (сентябрь 2014 г.). «Микробиота и диабет: развивающиеся отношения». Кишечник. 63 (9): 1513–1521. Дои:10.1136 / gutjnl-2014-306928. PMID 24833634. S2CID 22633025.
- ^ Кейт, Алисса; Карденас, Эрик (декабрь 2019 г.). «Снижение генетического потенциала ферментации бутирата в микробиоме кишечника младенцев, у которых развивается аллергическая сенсибилизация». Журнал аллергии и клинической иммунологии. 144 (6): 1638-1647. E3. Дои:10.1016 / j.jaci.2019.06.029. PMID 31279007.
- ^ Ватанен, Т .; Franzosa, E.A .; Schwager, R .; и другие. (2018). «Микробиом кишечника человека при диабете типа 1 с ранним началом по результатам исследования TEDDY». Природа. 562 (7728): 589–594. Bibcode:2018Натура.562..589V. Дои:10.1038 / s41586-018-0620-2. ЧВК 6296767. PMID 30356183.
- ^ Консоланди, Кларисса; Туррони, Сильвия; Эмми, Джакомо; и другие. (Апрель 2015 г.). «Пациенты с синдромом Бехчета демонстрируют специфический микробиом». Отзывы об аутоиммунности. 14 (4): 269–276. Дои:10.1016 / j.autrev.2014.11.009. PMID 25435420.
- ^ Е, Зи; Чжан, Ни; Ву, Чуньян; и другие. (4 августа 2018 г.). «Метагеномное исследование микробиома кишечника при болезни Бехчета». Микробиом. 6 (1): 135. Дои:10.1186 / s40168-018-0520-6. ЧВК 6091101. PMID 30077182.
- ^ Кейт, Алисса; Хьюз, Майкл Р. (май 2018 г.). «Аллергическое воспаление легких, вызванное микробиомом, облегчается за счет короткоцепочечных жирных кислот». Иммунология слизистой оболочки. 11 (3): 785–796. Дои:10.1038 / миль.2017.75.
- ^ Фурусава, Юкихиро; Обата, Юки; Фукуда, Синдзи; и другие. (13 ноября 2013 г.). «Бутират комменсального микроба индуцирует дифференцировку регуляторных Т-клеток толстой кишки». Природа. 504 (7480): 446–450. Bibcode:2013Натура.504..446F. Дои:10.1038 / природа12721. PMID 24226770. S2CID 4408815.
- ^ Арпая, Николай; Кэмпбелл, Кларисса; Фань, Сиин; и другие. (13 ноября 2013 г.). «Метаболиты, продуцируемые комменсальными бактериями, способствуют образованию периферических регуляторных Т-клеток». Природа. 504 (7480): 451–455. Bibcode:2013Натура.504..451A. Дои:10.1038 / природа12726. ЧВК 3869884. PMID 24226773.
- ^ Луу, Майк; Вейганд, Катарина; Веди, Фатана; и другие. (26 сентября 2018 г.). «Регулирование эффекторной функции CD8 + Т-клеток с помощью бутирата метаболита кишечной микробиоты». Научные отчеты. 8 (1): 14430. Bibcode:2018НатСР ... 814430Л. Дои:10.1038 / с41598-018-32860-х. ЧВК 6158259. PMID 30258117.
- ^ Чолан, Прадип Манунидхи; Хан, Элвин; Вуди, Брэд Р .; Вочон, Максин; Курц, Анджела Р.М.; Laird, Angela S .; Britton, Warwick J .; Е, Лихуа; Холмс, Захари С .; McCann, Jessica R .; Дэвид, Лоуренс А. (9 ноября 2020 г.). «Сохраненные противовоспалительные эффекты и ощущение бутирата у рыбок данио». Кишечные микробы. 12 (1): 1–11. Дои:10.1080/19490976.2020.1824563. ISSN 1949-0976. ЧВК 7575005. PMID 33064972.
- ^ а б c d Ван Г (2014). «Антимикробные пептиды и белки человека». Фармацевтика (Базель). 7 (5): 545–94. Дои:10.3390 / ph7050545. ЧВК 4035769. PMID 24828484.
Таблица 3: Выберите антимикробные пептиды человека и их предполагаемые мишени
Таблица 4: Некоторые известные факторы, которые вызывают экспрессию антимикробного пептида - ^ Ёнэдзава Х, Осаки Т, Ханава Т, Курата С., Заман С., Ву ТД, Такахаши М., Мацубара С., Каваками Х, Очиай К., Камия С. (2012). «Разрушительное действие бутирата на клеточную оболочку Helicobacter pylori». J. Med. Микробиол. 61 (Pt 4): 582–9. Дои:10.1099 / jmm.0.039040-0. PMID 22194341.
- ^ McGee DJ, Джордж AE, Trainor EA, Horton KE, Hildebrandt E, Testerman TL (2011). «Холестерин повышает устойчивость Helicobacter pylori к антибиотикам и LL-37». Антимикробный. Агенты Chemother. 55 (6): 2897–904. Дои:10.1128 / AAC.00016-11. ЧВК 3101455. PMID 21464244.
- ^ Циммерман М.А., Сингх Н., Мартин П.М., Тангараджу М., Ганапати В., Уоллер Д.Л., Ши Х., Робертсон К.Д., Манн Д.Х., Лю К. (2012). «Бутират подавляет воспаление толстой кишки за счет HDAC1-зависимой активации Fas и Fas-опосредованного апоптоза Т-клеток». Являюсь. J. Physiol. Гастроинтест. Физиология печени. 302 (12): G1405–15. Дои:10.1152 / ajpgi.00543.2011. ЧВК 3378095. PMID 22517765.
- ^ Offermanns S, Schwaninger M (2015). «Пищевая или фармакологическая активация ГКА (2) уменьшает нейровоспаление». Тенденции Мол Мед. 21 (4): 245–255. Дои:10.1016 / j.molmed.2015.02.002. PMID 25766751.
- ^ Чай Дж. Т., Дигби Дж. Э., Чоудхури Р. П. (май 2013 г.). «GPR109A и сосудистое воспаление». Карр Атеросклер Представитель. 15 (5): 325. Дои:10.1007 / s11883-013-0325-9. ЧВК 3631117. PMID 23526298.
- ^ Графф Е.К., Фанг Х., Вандерс Д., Джадд Р.Л. (февраль 2016 г.). «Противовоспалительные эффекты рецептора гидроксикарбоновой кислоты 2». Метаб. Clin. Опыт. 65 (2): 102–113. Дои:10.1016 / j.metabol.2015.10.001. PMID 26773933.
- ^ Фарци А, Райхманн Ф, Хольцер П. (2015). «Гомеостатическая роль нейропептида Y в иммунной функции и его влияние на настроение и поведение». Acta Physiol (Oxf). 213 (3): 603–27. Дои:10.1111 / apha.12445. ЧВК 4353849. PMID 25545642.
- ^ Цзэн, Huawei; Лазарова, ДЛ; Бордонаро, М (2014). «Механизмы, связывающие пищевые волокна, микробиоту кишечника и профилактику рака толстой кишки». Всемирный журнал онкологии желудочно-кишечного тракта. 6 (2): 41–51. Дои:10.4251 / wjgo.v6.i2.41. ЧВК 3926973. PMID 24567795.
- ^ Чен, Цзечжун; Чжао, Конг-Нан; Витетта, Луис (2019). «Влияние бутирата, разработанного кишечными микробами на онкогенные сигнальные пути» (pdf). Питательные вещества. 11 (5): 1026. Дои:10.3390 / nu11051026. ЧВК 6566851. PMID 31067776. S2CID 148568580.
- ^ Клампфер Л., Хуанг Дж., Сасадзуки Т., Ширасава С., Аугенлихт Л. (август 2004 г.). «Онкогенный Ras способствует апоптозу, вызванному бутиратом, за счет ингибирования экспрессии гельсолина». Журнал биологической химии. 279 (35): 36680–8. Дои:10.1074 / jbc.M405197200. PMID 15213223.
- ^ Ванхаутвин С.А., Трост Ф.Дж., Хамер Х.М., Линдси П.Дж., Кук Г.Х., Йонкерс Д.М., Кодде А., Венема К., Брюммер Р.Дж. (2009). Бересвилл С (ред.). «Бутират-индуцированные транскрипционные изменения в слизистой оболочке толстой кишки человека». PLOS ONE. 4 (8): e6759. Bibcode:2009PLoSO ... 4.6759V. Дои:10.1371 / journal.pone.0006759. ЧВК 2727000. PMID 19707587.
- ^ Encarnação, J.C .; Abrantes, A.M .; Pires, A. S .; и другие. (30 июля 2015 г.). «Вернемся к диетической клетчатке при колоректальном раке: бутират и его роль в профилактике и лечении». Обзоры рака и метастазов. 34 (3): 465–478. Дои:10.1007 / s10555-015-9578-9. PMID 26224132. S2CID 18573671.
- ^ Циммерман, Мэри А .; Сингх, Нагендра; Мартин, Памела М .; и другие. (15 июня 2012 г.). «Бутират подавляет воспаление толстой кишки за счет HDAC1-зависимой активации Fas и Fas-опосредованного апоптоза Т-клеток». Американский журнал физиологии. Физиология желудочно-кишечного тракта и печени. 302 (12): G1405 – G1415. Дои:10.1152 / ajpgi.00543.2011. ЧВК 3378095. PMID 22517765.
- ^ Prasanna Kumar, S .; Thippeswamy, G .; Sheela, M.L .; и другие. (Октябрь 2008 г.). «Бутират-индуцированная фосфатаза регулирует VEGF и ангиогенез через Sp1». Архивы биохимии и биофизики. 478 (1): 85–95. Дои:10.1016 / j.abb.2008.07.004. PMID 18655767.
- ^ «Низкоуглеводная диета снижает риск рака толстой кишки, - говорится в исследовании | Пресс-центр Университета Торонто». media.utoronto.ca. Получено 4 мая 2016.
- ^ Бельчева, Антоанета; Irrazabal, Thergiory; Робертсон, Сьюзен Дж .; Штрейткер, Екатерина; Моэн, Хизер; Рубино, Стивен; Морияма, Эдуардо Х .; Copeland, Julia K .; Кумар, Сачин (17 июля 2014 г.). «Микробный метаболизм кишечника стимулирует трансформацию эпителиальных клеток толстой кишки с дефицитом MSH2». Клетка. 158 (2): 288–299. Дои:10.1016 / j.cell.2014.04.051. ISSN 1097-4172. PMID 25036629.
- ^ Scheppach, W .; Sommer, H .; Киршнер, Т .; и другие. (1992). «Влияние бутиратных клизм на слизистую толстой кишки при дистальном язвенном колите». Гастроэнтерология. 103 (1): 51–56. Дои:10.1016 / 0016-5085 (92) 91094-К. PMID 1612357.
- ^ Робисон А.Дж., Нестлер Э.Дж. (ноябрь 2011 г.). «Транскрипционные и эпигенетические механизмы зависимости». Nat. Преподобный Neurosci. 12 (11): 623–637. Дои:10.1038 / nrn3111. ЧВК 3272277. PMID 21989194.
- ^ Нестлер EJ (январь 2014 г.). «Эпигенетические механизмы наркомании». Нейрофармакология. 76 Pt B: 259–268. Дои:10.1016 / j.neuropharm.2013.04.004. ЧВК 3766384. PMID 23643695.
- ^ а б Уокер Д.М., Кейтс Х.М., Хеллер Е.А., Нестлер Э.Д. (февраль 2015 г.). «Регуляция состояния хроматина наркотическими средствами». Curr. Мнение. Нейробиол. 30: 112–121. Дои:10.1016 / j.conb.2014.11.002. ЧВК 4293340. PMID 25486626.
- ^ Аджониджебу, округ Колумбия, Аббусси О., Рассел В.А., Мабандла М.В., Дэниелс В.М. (август 2017 г.). «Эпигенетика: связь между зависимостью и социальной средой». Клеточные и молекулярные науки о жизни. 74 (15): 2735–2747. Дои:10.1007 / s00018-017-2493-1. PMID 28255755. S2CID 40791780.
- ^ Legastelois R, Jeanblanc J, Vilpoux C, Bourguet E, Naassila M (2017). «[Эпигенетические механизмы и расстройства, связанные с употреблением алкоголя: потенциальная терапевтическая цель]». Biologie Aujourd'hui (На французском). 211 (1): 83–91. Дои:10.1051 / jbio / 2017014. PMID 28682229.


