Этинодиол - Etynodiol
 | |
| Клинические данные | |
|---|---|
| Другие имена | Этинодиол; 3β-гидроксиноэтистерон; 17α-Этинилэстр-4-ен-3β, 17β-диол |
| Класс препарата | Прогестин; Прогестаген |
| Код УВД | |
| Идентификаторы | |
| |
| Количество CAS | |
| ChemSpider | |
| UNII | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.013.610 |
| Химические и физические данные | |
| Формула | C20ЧАС28О2 |
| Молярная масса | 300.442 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
Этинодиол, или же этинодиол, это стероидный прогестин из 19-нортестостерон группа, которая никогда не продавалась.[1][2][3] А диацилированный производная этинодиола диацетат, используется как гормональный противозачаточный.[1][2] Этинодиол иногда используется как синоним этинодиола диацетат.
Он был запатентован в 1955 году.[4]
Фармакология
Этинодиол - это пролекарство из норэтистерон, и немедленно и полностью превращается в норэтистерон.[5][6][7] Этинодиол - это средний в превращении пролекарства линестренол в норэтистерон.[8]
| Сложный | Типа | PR | AR | ER | GR | МИСТЕР | SHBG | CBG |
|---|---|---|---|---|---|---|---|---|
| Норэтистерон | – | 67–75 | 15 | 0 | 0–1 | 0–3 | 16 | 0 |
| 5α-дигидроноретистерон | Метаболит | 25 | 27 | 0 | 0 | ? | ? | ? |
| 3α, 5α-тетрагидроноретистерон | Метаболит | 1 | 0 | 0–1 | 0 | ? | ? | ? |
| 3α, 5β-тетрагидроноретистерон | Метаболит | ? | 0 | 0 | ? | ? | ? | ? |
| 3β, 5α-Тетрагидроноретистерон | Метаболит | 1 | 0 | 0–8 | 0 | ? | ? | ? |
| Этинилэстрадиол | Метаболит | 15–25 | 1–3 | 112 | 1–3 | 0 | 0.18 | 0 |
| Норэтистерона ацетат | Пролекарство | 20 | 5 | 1 | 0 | 0 | ? | ? |
| Норэтистерона энантат | Пролекарство | ? | ? | ? | ? | ? | ? | ? |
| Норетинодрел | Пролекарство | 6 | 0 | 2 | 0 | 0 | 0 | 0 |
| Этинодиол | Пролекарство | 1 | 0 | 11–18 | 0 | ? | ? | ? |
| Этинодиол диацетат | Пролекарство | 1 | 0 | 0 | 0 | 0 | ? | ? |
| Линестренол | Пролекарство | 1 | 1 | 3 | 0 | 0 | ? | ? |
| Примечания: Значения указаны в процентах (%). Ссылка лиганды (100%) были промегестон для PR, метриболон для AR, эстрадиол для ER, дексаметазон для GR, альдостерон для МИСТЕР, дигидротестостерон за SHBG, и кортизол за CBG. Сноски: а = Активный или неактивный метаболит, пролекарство, или ни один из норэтистерона. Источники: См. Шаблон. | ||||||||
Химия
Этинодиол - производное 19-нортестостерона. По структуре он практически идентичен норэтистерону и линестренол, отличающийся только своим заместителем C3. В то время как норэтистерон имеет кетон у C3 и линестренол не имеет заместителя у C3, этнодиол имеет гидроксильная группа на позиции.
Синтез
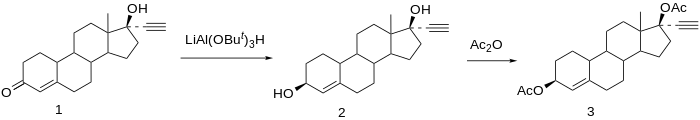
Общество и культура
Родовые имена
Этинодиол это родовое имя препарата и его ГОСТИНИЦА, пока этинодиол это его БАН.[1][2]
Рекомендации
- ^ а б c Ф .. Макдональд (1997). Словарь фармакологических агентов. CRC Press. п. 1454. ISBN 978-0-412-46630-4. Получено 12 мая 2012.
- ^ а б c Index Nominum 2000: Международный справочник лекарственных средств. Тейлор и Фрэнсис США. 2000. с. 422. ISBN 978-3-88763-075-1. Получено 30 мая 2012.
- ^ Шиндлер, Адольф Э; Кампаньоли, Карло; Друкманн, Рене; Хубер, Йоханнес; Паскуалини, Хорхе Р.; Швеппе, Карл В. Тийссен, Джос Х.Х. (2003). «Классификация и фармакология прогестинов». Maturitas. 46: 7–16. Дои:10.1016 / j.maturitas.2003.09.014. ISSN 0378-5122. PMID 14670641.
- ^ Фишер, Джнос; Ганеллин, С. Робин (2006). Открытие лекарств на основе аналогов. Джон Вили и сыновья. п. 478. ISBN 9783527607495.
- ^ Донна Шоуп; Флоренс П. Хазелтин (6 декабря 2012 г.). Контрацепция. Springer Science & Business Media. С. 21–. ISBN 978-1-4612-2730-4.
- ^ Бхаттачарья (1 января 2003 г.). Фармакология, 2 / е. Эльзевир Индия. С. 378–. ISBN 978-81-8147-009-6.
- ^ Рабочая группа МАИР по оценке канцерогенных рисков для человека; Всемирная организация здоровья; Международное агентство по изучению рака (2007 г.). Комбинированные эстроген-прогестагенные контрацептивы и комбинированная эстроген-прогестагеновая терапия менопаузы. Всемирная организация здоровья. С. 146–. ISBN 978-92-832-1291-1.
- ^ Хаммерштейн Дж (1990). «Пролекарства: преимущество или недостаток?». Являюсь. J. Obstet. Гинеколь. 163 (6, п. 2): 2198–203. Дои:10.1016 / 0002-9378 (90) 90561-К. PMID 2256526.
- ^ Климстра, П .; Колтон, Ф. (1967). «Синтез 3β-гидроксиэстр-4-ен-17-она и 3β-гидроксиандрост-4-ен-17-она». Стероиды. 10 (4): 411–424. Дои:10.1016 / 0039-128X (67) 90119-5. PMID 6064262.
- ^ Sondheimer, F .; Клибанский Ю. (1959). «Синтез 3β-гидроксианалогов стероидных гормонов, биологически активного класса соединений». Тетраэдр. 5: 15–26. Дои:10.1016/0040-4020(59)80066-1.
| Эта статья о стероидный препарат это заглушка. Вы можете помочь Википедии расширяя это. |
| Этот препарат, средство, медикамент статья, касающаяся мочеполовая система это заглушка. Вы можете помочь Википедии расширяя это. |
