Катехин - Catechin
 | |
| Имена | |
|---|---|
| Название ИЮПАК (2р,3S) -2- (3,4-дигидроксифенил) -3,4-дигидро-2ЧАС-хромен-3,5,7-триол | |
| Другие имена Цианиданол Цианиданол (+) - катехин D-катехин Катехиновая кислота Катеховая кислота Цианидол Дексцианиданол (2р,3S) -Катехин 2,3-транс-Катехин (2р,3S) -Флаван-3,3 ', 4', 5,7-пентол | |
| Идентификаторы | |
| |
3D модель (JSmol ) | |
| 3DMet | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.005.297 |
| Номер ЕС |
|
| КЕГГ | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C15ЧАС14О6 | |
| Молярная масса | 290.271 г · моль−1 |
| Внешность | Бесцветное твердое вещество |
| Температура плавления | От 175 до 177 ° C (от 347 до 351 ° F, от 448 до 450 K) |
| УФ-видимый (λМаксимум) | 276 нм |
Хиральное вращение ([α]D) | +14.0° |
| Опасности | |
| Главный опасности | Мутагенный для соматических клеток млекопитающих, мутагенный для бактерий и дрожжей |
| Паспорт безопасности | научная лаборатория AppliChem[постоянная мертвая ссылка ] |
| Пиктограммы GHS |  |
| Сигнальное слово GHS | Предупреждение |
| H315, H319, H335 | |
| P261, P264, P271, P280, P302 + 352, P304 + 340, P305 + 351 + 338, P312, P321, P332 + 313, P337 + 313, P362, P403 + 233, P405, P501 | |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза ) | (+) - катехин: 10000 мг / кг у крысы (RTECS) 10000 мг / кг в мыши 3890 мг / кг у крысы (другой источник) |
| Фармакология | |
| Устный | |
| Фармакокинетика: | |
| Моча | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Катехин /ˈkæтɪtʃɪп/ это флаван-3-ол, разновидность природного фенола и антиоксидант. Это растение вторичный метаболит. Он принадлежит к группе флаван-3-олы (или просто флаванолы), часть химического семейства флавоноиды.
Название химического семейства катехинов происходит от катеху, который представляет собой дубильный сок или вареный экстракт Мимоза катеху (Акация катеху L.f).[1]
Химия

Катехин обладает двумя бензольные кольца (называемые A- и B-кольцами) и a дигидропиран гетероцикл (C-кольцо) с гидроксильная группа на углероде 3. Кольцо A похоже на резорцин фрагмент, в то время как кольцо B похоже на катехол часть. Есть два хиральный центрируется на молекуле на атомах углерода 2 и 3. Следовательно, он имеет четыре диастереоизомеры. Два изомера находятся в конфигурация транс и называются катехин а два других находятся в конфигурация цис и называются эпикатехин.
Самый распространенный изомер катехина - (+) - катехин. Другой стереоизомер это (-) - катехин или Ent-катехин. Наиболее распространенным изомером эпикатехина является (-) - эпикатехин (также известный под названиями L-эпикатехин, эпикатехол, (-) - эпикатехин, l-акакатехин, l-эпикатехин, эпикатехин, 2,3-цис-эпикатехин или ( 2р,3р) - (-) - эпикатехин).
Различные эпимеры можно различить с помощью хиральная колоночная хроматография.[2]
Не ссылаясь на какой-либо конкретный изомер, молекулу можно просто назвать катехином. Смеси различных энантиомеров можно назвать (+/-) - катехином или DL-катехином и (+/-) - эпикатехином или DL-эпикатехином.
Катехин и эпикатехин являются строительными блоками проантоцианидины, тип конденсированного танина.
- Галерея диастереоизомеров

(+) - катехин (2р,3S)

(-) - катехин (2S,3р)

(-) - эпикатехин (2р,3р)

(+) - эпикатехин (2S,3S)

Кроме того, гибкость С-образного кольца позволяет использовать два конформационные изомеры, помещая кольцо B либо в псевдоэкваториальное положение (конформер E), либо в псевдоаксиальное положение (конформер A). Исследования подтвердили, что (+) - катехин принимает смесь A- и E-конформеров в водном растворе, и их конформационное равновесие оценивается как 33:67.[3]
Как флавоноиды, катехины могут действовать как антиоксиданты когда в высокой концентрации in vitro, но по сравнению с другими флавоноидами их антиоксидантный потенциал невысок.[4] Способность гасить синглетный кислород, по-видимому, связана с химической структурой катехина, с присутствием катехоловой части в кольце B и присутствием гидроксильной группы, активирующей двойную связь в кольце C.[5]
Окисление
Электрохимические эксперименты показывают, что механизм окисления (+) - катехина протекает в последовательные стадии, связанные с катехол и резорцин группы и окисление зависит от pH. Окисление катехол 3 ', 4'-дигидроксильных электронодонорных групп происходит сначала при очень низких положительных потенциалах и является обратимой реакцией. Было показано, что гидроксильные группы фрагмента резорцина, окисленного впоследствии, подвергаются необратимой реакции окисления.[6]
В лакказа /ABTS система окисляет (+) - катехин до олигомерных продуктов[7] из которых проантоцианидин А2 представляет собой димер.
Спектральные данные

| УФ-видимый | |
|---|---|
| Лямбда-макс: | 276 нм |
| Коэффициент экстинкции (журнал ε) | 4.01 |
| ИК | |
| Основные полосы поглощения | 1600 см−1(бензольные кольца) |
| ЯМР | |
| Протонный ЯМР
| δ : 2,49 (1H, dd, J = 16,0, 8,6 Гц, H-4a), |
| Углерод-13 ЯМР | |
| Другие данные ЯМР | |
| РС | |
| Массы основные фрагменты | ESI-MS [M + H] + m / z: 291,0.
|
Природные явления
(+) - Катехин и (-) - эпикатехин, а также их галловая кислота конъюгаты являются повсеместными составляющими сосудистые растения, и частые компоненты традиционные лечебные травы, Такие как Ункария ринхофилла. Два изомеры в основном встречаются как какао и чай составляющих, а также в Vitis vinifera виноград.[9][10][11]
В еде
Основные диетические источники катехинов в Европе и Соединенные Штаты находятся чай и Pome фрукты.[12][13]
Катехины и эпикатехины содержатся в какао,[14] который, согласно одной базе данных, имеет самое высокое содержание (108 мг / 100 г) катехинов среди проанализированных пищевых продуктов, за которым следует Сливовый сок (25 мг / 100 мл) и бобы стручок (16 мг / 100 г).[15] Масло асаи, полученный из плодов пальмы асаи (Euterpe oleracea), содержит (+) - катехины (67 мг / кг).[16]
Катехины разнообразны среди продуктов питания,[15] из персики[17] к зеленый чай и уксус.[15][18] Катехины содержатся в ячмень зерна, где они являются основным фенольным соединением, ответственным за тесто изменение цвета.[19] Вкус, связанный с мономерным (+) - катехином или (-) - эпикатехином, описывается как слегка вяжущий, но не горький.[20]
Метаболизм
Биосинтез
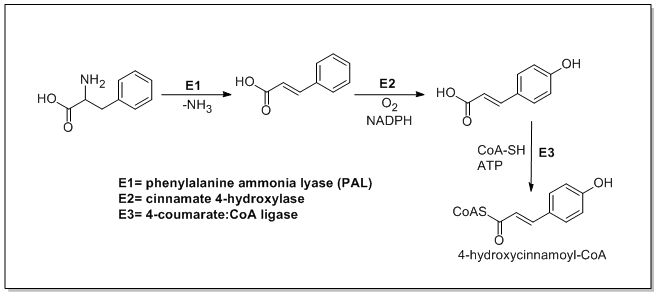
Биосинтез катехина начинается с ма. 4-гидроксициннамоил-КоА стартер, который подвергается удлинению цепи за счет добавления трех малонил-КоА через путь PKSIII. 4-гидроксициннамоил-КоА биосинтезируется из L-фенилаланин через путь Шикимате. L-фенилаланин сначала дезаминируется фенилаланин аммиаклиаза (PAL) образуя коричную кислоту, которая затем окисляется до 4-гидроксикоричная кислота циннамат-4-гидроксилазой. Затем халконсинтаза катализирует конденсацию 4-гидроксициннамоил-КоА и трех молекул малонил-КоА с образованием халкон. Затем халкон изомеризуется в нарингенин халконизомеразой, которая окисляется до эриодиктиол флавоноид-3'-гидроксилазой и далее окисляется до таксифолин флаванон-3-гидроксилазой. Затем таксифолин восстанавливается дигидрофлаванол-4-редуктазой и лейкоантоцианидин редуктаза чтобы получить катехин. Биосинтез катехина показан ниже.[21][22][23]
Лейкоцианидин редуктаза (LCR) использует 2,3-транс-3,4-цис-лейкоцианидин производить (+) - катехин и является первым ферментом в проантоцианидины (PA) -специфический путь. Его активность измерялась в листьях, цветках и семенах бобовых. Medicago sativa, Лотос японский, Lotus uliginosus, Hedysarum sulfurescens, и Робиния псевдоакация.[24] Фермент также присутствует в Vitis vinifera (виноград).[25]

Биоразложение
Катехиноксигеназа, ключевой фермент разложения катехина, присутствует в грибах и бактериях.[26]
Среди бактерий разложение (+) - катехина может быть достигнуто путем Acinetobacter calcoaceticus. Катехин метаболизируется до протокатеховая кислота (PCA) и флороглюцинкарбоновая кислота (PGCA).[27] Это также ухудшается Bradyrhizobium japonicum. Флороглюцинкарбоновая кислота дополнительно декарбоксилированный к флороглюцин, который дегидроксилированный к резорцин. Резорцин гидроксилируется до гидроксихинол. Протокатеховая кислота и гидроксихинол подвергаются интрадиол расщепление насквозь протокатехуат 3,4-диоксигеназа и гидроксихинол 1,2-диоксигеназа формировать β-карбоксицис, цис-муконовая кислота и малеилацетат.[28]
Среди грибов разложение катехина может быть достигнуто путем: Хетомиум купреум.[29]
Метаболизм у человека


Катехины метаболизируются при поглощении из желудочно-кишечный тракт, в частности тощая кишка,[31] и в печень, в результате чего образуются так называемые структурно связанные метаболиты эпикатехина (SREM).[32] Основные метаболические пути для SREM: глюкуронизация, сульфатирование и метилирование из катехол группа по катехол-O-метилтрансфераза, только небольшие количества обнаруживаются в плазме.[33][30] Однако большинство пищевых катехинов метаболизируется микробиом толстой кишки к гамма-валеролактоны и гиппуровая кислота которые проходят дальше биотрансформация, глюкуронизация, сульфатирование и метилирование в печень.[33]
Стереохимическая конфигурация катехинов оказывает сильное влияние на их поглощение и метаболизм, поскольку поглощение является самым высоким для (-) - эпикатехина и самым низким для (-) - катехина.[34]
Исследование

Наночастицы методы находятся в стадии предварительных исследований как потенциальные системы доставки катехинов.[35] Катехины какао проходят предварительные исследования на предмет их способности влиять на риск сердечно-сосудистые заболевания.[36] Один ограниченный мета-анализ показал, что увеличение потребления зеленого чая и его катехинов до семи чашек в день привело к небольшому снижению рак простаты.[37]
Биотрансформация
Биотрансформация (+) - катехина в таксифолин двухступенчатым окислением может быть достигнуто Burkholderia sp.[38]
(+) - Катехин и (-) - эпикатехин трансформируются эндофитным нитчатым грибом Diaporthe sp. в производные 3,4-цис-дигидроксифлавана, (+) -(2R, 3S, 4S) -3,4,5,7,3 ', 4'-гексагидроксифлаван (лейкоцианидин) и (-) - (2R, 3R, 4R) -3,4,5,7,3 ', 4'-гексагидроксифлаван соответственно, тогда как (-) - катехин и (+) - эпикатехин с 2S-фенильной группой сопротивлялись биоокислению.[39]
Лейкоантоцианидин редуктаза (LAR) использует (2р,3S) -катехин, НАДФ+ и H2O для производства 2,3-транс-3,4-цис-лейкоцианидин, НАДФН и Н+. Экспрессия его гена была изучена при выращивании ягод винограда и листьев виноградной лозы.[40]
Гликозиды
- (2R, 3S) -катехин-7-O-β-D-глюкопиранозид может быть изолирован от ячмень (Hordeum vulgare Л.) И солод.[41]
- Эпигеозид (Катехин-3-O-альфа-L-рамнопиранозил- (1-4) -бета-D-глюкопиранозил- (1-6) -бета-D-глюкопиранозид) можно выделить из корневищ Epigynum auritum.[42]
Исследования биоактивности
Сосудистая функция

Столетия назад считалось, что экстракты, содержащие катехин, полезны для лечения сердечных заболеваний,[44][45] а влияние на проницаемость капилляров было показано в 1936 году.[46] Ограниченные данные диетических исследований показывают, что катехины могут влиять на эндотелий -зависимый расширение сосудов что могло бы способствовать нормальному кровоток регуляция у человека.[47][48] Катехины зеленого чая могут повышать артериальное давление, особенно когда систолическое артериальное давление превышает 130 мм рт.[49] Из-за интенсивного метаболизма во время пищеварения судьба и активность метаболитов катехина, ответственных за этот эффект на кровеносные сосуды, а также фактический механизм действия неизвестны.[33][50]
В Европейское агентство по безопасности пищевых продуктов установили, что флаванолы какао влияют на функцию сосудов у здоровых взрослых, сделав вывод: «Флаванолы какао помогают поддерживать эндотелий-зависимую вазодилатацию, что способствует нормальному кровотоку».[51] Данные наблюдательных когортных исследований не показали устойчивой связи между потреблением флаван-3-ола и риском сердечно-сосудистых заболеваний.[43]
А метаанализ также указали, что катехины зеленого чая могут благоприятно влиять на холестерин.[49]
Возможные иммунные эффекты
В зависимости от принятой дозы катехины и их метаболиты могут связываться с эритроцитами и, возможно, вызывать высвобождение аутоантитела, в результате чего гемолитическая анемия и почечная недостаточность.[52] Это привело к отмене катехинсодержащего препарата Катерген, используемого для лечения вирусный гепатит, с европейского рынка в 1985 году.[53][54]
Ботанические эффекты
Катехины, выбрасываемые в землю некоторыми растениями, могут препятствовать росту их соседей, что является одной из форм аллелопатия.[55] Centaurea maculosa, пятнистый василек, часто изучаемый на предмет такого поведения, выделяет катехин изомеры в землю через свои корни, потенциально оказывая влияние как антибиотик или же гербицид. Одна из гипотез состоит в том, что это вызывает активные формы кислорода волна через корень целевого растения, чтобы убить корневые клетки апоптоз.[56] Большинство растений в европейской экосистеме имеют защиту от катехина, но лишь немногие растения защищены от него в экосистеме Северной Америки, где Centaurea maculosa это инвазивный неконтролируемый сорняк.[55]
Катехин в листьях клубники действует как фактор, ингибирующий инфекцию.[57] Эпикатехин и катехин могут предотвратить болезнь кофейных ягод, подавляя администраторский меланизация Colletotrichum kahawae.[58]
Рекомендации
- ^ «Кач и катеху растительного происхождения». Продовольственная и сельскохозяйственная организация Объединенных Наций. 5 ноября 2011 г.
- ^ Ринальдо Д., Батиста Дж. М., Родригес Дж. И др. (Август 2010 г.). «Определение диастереомеров катехина из листьев видов Byrsonima с использованием хиральной HPLC-PAD-CD». Хиральность. 22 (8): 726–33. Дои:10.1002 / chir.20824. PMID 20143413.
- ^ Kríz Z, Koca J, Imberty A, Charlot A, Auzély-Velty R (июль 2003 г.). «Исследование комплексообразования (+) - катехина с β-циклодекстрином с помощью комбинации методов ЯМР, микрокалориметрии и молекулярного моделирования». Орг. Biomol. Chem. 1 (14): 2590–5. Дои:10.1039 / B302935M. PMID 12956082.
- ^ Пиетта, П. Г. (2000). «Флавоноиды как антиоксиданты». Журнал натуральных продуктов. 63 (7): 1035–42. Дои:10.1021 / np9904509. PMID 10924197.
- ^ Tournaire C, Croux S, Maurette MT и др. (Август 1993 г.). «Антиоксидантная активность флавоноидов: Эффективность синглетного кислорода (1Δграмм) закалка ». J. Photochem. Photobiol. B, Биол. 19 (3): 205–15. Дои:10.1016/1011-1344(93)87086-3. PMID 8229463.
- ^ Жанейро, Патрисия; Оливейра Бретт, Ана Мария (2004). «Механизмы электрохимического окисления катехинов». Analytica Chimica Acta. 518 (1–2): 109–115. Дои:10.1016 / j.aca.2004.05.038. HDL:10316/5128.
- ^ Осман, A.M .; Wong, K.K.Y .; Фернихоу, А. (2007). «Система лакказа / ABTS окисляет (+) - катехин до олигомерных продуктов». Ферментные и микробные технологии. 40 (5): 1272–1279. Дои:10.1016 / j.enzmictec.2006.09.018.
- ^ Линь И-Пей; Чен, Тай-Юань; Ценг, Сян-Вэнь; Ли, Мэй-Сянь; Чен, Шуй-Тейн (2009). «Защитные соединения нервных клеток, выделенные из Phoenix hanceana var. Formosana». Фитохимия. 70 (9): 1173–81. Дои:10.1016 / j.phytochem.2009.06.006. PMID 19628235.
- ^ Айзпуруа-Олайзола, Ойер; Ормазабал, Маркел; Вальехо, Азиер; Оливарес, Майтан; Наварро, Патрисия; Etxebarria, Нестор; Усобиага, Арезац (01.01.2015). «Оптимизация последовательного извлечения жирных кислот и полифенолов из отходов винограда Vitis Vinifera в сверхкритических жидкостях». Журнал пищевой науки. 80 (1): E101 – E107. Дои:10.1111/1750-3841.12715. ISSN 1750-3841. PMID 25471637.
- ^ Фройденберг, Карл; Кокс, Ричард Ф. Б.; Браун, Эмиль (1932). "Катехин какао-бобов1". Журнал Американского химического общества. 54 (5): 1913–1917. Дои:10.1021 / ja01344a026.
- ^ «Мичие Цуджимура (1888–1969)». Получено 10 ноября 2015.
- ^ Chun, O.K .; Chung, S.J .; Песня, У. О. (2007). «Расчетное потребление флавоноидов с пищей и основные источники пищи взрослых в США». Журнал питания. 137 (5): 1244–52. Дои:10.1093 / jn / 137.5.1244. PMID 17449588.
- ^ Vogiatzoglou, A; Mulligan, A. A .; Lentjes, M. A .; Luben, R. N .; Spencer, J.P .; Schroeter, H; Khaw, K. T .; Кунле, Г. Г. (2015). «Потребление флавоноидов взрослыми европейцами (от 18 до 64 лет)». PLOS ONE. 10 (5): e0128132. Дои:10.1371 / journal.pone.0128132. ЧВК 4444122. PMID 26010916.
- ^ Квик-Урибе С., Бекташ Р.М. (2008). «Флаванолы какао - измерение, биодоступность и биоактивность» (PDF). Азия Пак Дж Клин Нутр. 17 (Приложение 1): 280–3. PMID 18296356.
- ^ а б c «Полифенолы в настое зеленого чая». Фенол-Эксплорер, версия 3.5. 2014 г.. Получено 1 ноября 2014.
- ^ Пачеко-Паленсия, Л.А., Мертенс-Талкотт С., Талкотт С.Т. (июнь 2008 г.). «Химический состав, антиоксидантные свойства и термическая стабильность фитохимически обогащенного масла из асаи (Euterpe oleracea Mart.)». J. Agric. Food Chem. 56 (12): 4631–6. Дои:10.1021 / jf800161u. PMID 18522407.
- ^ Cheng, Guiwen W .; Крисосто, Карлос Х. (1995). «Потенциал потемнения, фенольный состав и полифенолоксидазная активность буферных экстрактов персика и нектарина кожных тканей» (PDF). Варенье. Soc. Hort. Наука. 120 (5): 835–838. Дои:10.21273 / JASHS.120.5.835. Архивировано из оригинал (PDF) на 2014-05-14. Получено 2012-02-26.
- ^ Гальвес, Мигель Карреро; Баррозу, Кармело Гарсия; Перес-Бустаманте, Хуан Антонио (1994). «Анализ полифенольных соединений различных образцов уксуса». Zeitschrift für Lebensmittel-Untersuchung und -Forschung. 199 (1): 29–31. Дои:10.1007 / BF01192948.
- ^ Quinde-Axtell, Зори; Байк, Бьюнг-Ки (2006). «Фенольные соединения зерна ячменя и их влияние на изменение цвета пищевых продуктов». J. Agric. Food Chem. 54 (26): 9978–9984. Дои:10.1021 / jf060974w. PMID 17177530.
- ^ Килхорн, S; Торнгейт III, Дж. Х (1999). «Оральные ощущения, связанные с флаван-3-олами (+) - катехином и (-) - эпикатехином». Качество еды и предпочтения. 10 (2): 109–116. Дои:10.1016 / S0950-3293 (98) 00049-4.
- ^ Рани, Арти; Сингх, Кашмир; Ахуджа, Paramvir S .; Кумар, Санджай (2012). «Молекулярная регуляция биосинтеза катехинов в чае [чайный куст (Л.) О. Кунце] ». Ген. 495 (2): 205–10. Дои:10.1016 / j.gene.2011.12.029. PMID 22226811.
- ^ Punyasiri, P.A.N .; Abeysinghe, I.S.B .; Кумар, В .; Treutter, D .; Duy, D .; Gosch, C .; Martens, S .; Forkmann, G .; Фишер, Т. К. (2004). «Биосинтез флавоноидов в чайном растении Camellia sinensis: свойства ферментов основных эпикатехиновых и катехиновых путей». Архивы биохимии и биофизики. 431 (1): 22–30. Дои:10.1016 / j.abb.2004.08.003. PMID 15464723.
- ^ Дьюик, Пол М. (2009). Лекарственные натуральные продукты: биосинтетический подход (3-е изд.). Великобритания: John Wiley & Sons. ISBN 978-0-470-74167-2.[страница нужна ]
- ^ Скадхауге, Биргитте; Gruber, Margaret Y .; Томсен, Карл Кристиан; Фон Веттштейн, Дитер (апрель 1997 г.). «Активность лейкоцианидинредуктазы и накопление проантоцианидинов в развивающихся тканях бобовых». Американский журнал ботаники. 84 (4): 494–503. Дои:10.2307/2446026. JSTOR 2446026.
- ^ Може С., Гранье Т., д'Эстенто Б.Л. и др. (Апрель 2010 г.). «Кристаллическая структура и каталитический механизм лейкоантоцианидин редуктазы из Vitis vinifera». J. Mol. Биол. 397 (4): 1079–91. Дои:10.1016 / j.jmb.2010.02.002. PMID 20138891.
- ^ Биоразложение катехина. М. Аруначалам, М. Мохан Радж, Н. Мохан и А. Махадеван, Proc. Индийский natn Sci Acad. B69 № 4 стр. 353–370 (2003) В архиве 2012-03-16 в Wayback Machine
- ^ Аруначалам, М; Mohan, N; Сугадев, Р; Chellappan, P; Махадеван, А (2003). «Разложение (+) - катехина под действием Acinetobacter calcoaceticus MTC 127». Biochimica et Biophysica Acta (BBA) - Общие предметы. 1621 (3): 261–265. Дои:10.1016 / S0304-4165 (03) 00077-1. PMID 12787923.
- ^ Хоппер, Вахита; Махадеван, А. (1997). «Разложение катехина Bradyrhizobium japonicum». Биоразложение. 8 (3): 159–165. Дои:10.1023 / А: 1008254812074.
- ^ Sambandam, T .; Махадеван, А. (1993). «Деградация катехина, очистка и частичная характеристика катехиноксигеназы из Chaetomium cupreum». Всемирный журнал микробиологии и биотехнологии. 9 (1): 37–44. Дои:10.1007 / BF00656513. PMID 24419836.
- ^ а б c d Оттавиани, Дж. И .; Borges, G; Momma, T. Y .; Spencer, J.P .; Keen, C.L .; Крозье, А; Шрётер, H (2016). «Метаболом 2- (14) C (-) - эпикатехина в организме человека: значение для оценки эффективности, безопасности и механизмов действия полифенольных биоактивных веществ». Научные отчеты. 6: 29034. Bibcode:2016НатСР ... 629034O. Дои:10.1038 / srep29034. ЧВК 4929566. PMID 27363516.
- ^ Actis-Goretta, L; Левек, А; Рейн, М; Темл, А; Schäfer, C; Hofmann, U; Ли, Н; Schwab, M; Эйхельбаум, М; Уильямсон, Г. (2013). «Кишечная абсорбция, метаболизм и экскреция (-) - эпикатехина у здоровых людей, оцениваемые с использованием метода перфузии кишечника». Американский журнал клинического питания. 98 (4): 924–33. Дои:10.3945 / ajcn.113.065789. PMID 23864538.
- ^ Оттавиани, Дж. И .; Momma, T. Y .; Kuhnle, G.K .; Keen, C.L .; Шрётер, Х (2012). «Структурно связанные (-) - метаболиты эпикатехина у людей: оценка с использованием de novo химически синтезированных аутентичных стандартов». Свободная радикальная биология и медицина. 52 (8): 1403–12. Дои:10.1016 / j.freeradbiomed.2011.12.010. PMID 22240152.
- ^ а б c «Флавоноиды». Институт Линуса Полинга, Государственный университет Орегона, Корваллис. 2016 г.. Получено 24 июля 2016.
- ^ Оттавиани, Дж. И .; Momma, T. Y .; Heiss, C; Квик-Урибе, К; Schroeter, H; Кин, К. Л. (2011). «Стереохимическая конфигурация флаванолов влияет на уровень и метаболизм флаванолов в организме человека и их биологическую активность in vivo». Свободная радикальная биология и медицина. 50 (2): 237–44. Дои:10.1016 / j.freeradbiomed.2010.11.005. PMID 21074608.
- ^ Ye, J. H; Августин, М.А. (2018). «Нано- и микрочастицы для доставки катехинов: физические и биологические свойства». Критические обзоры в области пищевой науки и питания. 59 (10): 1563–1579. Дои:10.1080/10408398.2017.1422110. PMID 29345975.
- ^ Aprotosoaie, A. C; Мирон, А; Трифан, А; Лука, В. С; Костач, I. I (2016). «Сердечно-сосудистые эффекты полифенолов какао - обзор». Болезни. 4 (4): 39. Дои:10.3390 / болезни4040039. ЧВК 5456324. PMID 28933419.
- ^ Guo, Y; Zhi, F; Чен, П; Чжао, К; Xiang, H; Мао, Q; Ван, Х; Чжан, X (2017). «Зеленый чай и риск рака простаты: систематический обзор и метаанализ». Лекарство. 96 (13): e6426. Дои:10.1097 / MD.0000000000006426. ЧВК 5380255. PMID 28353571.
- ^ Мацуда М., Оцука Ю., Джин С. и др. (Февраль 2008 г.). «Биотрансформация (+) - катехина в таксифолин путем двухступенчатого окисления: первичная стадия метаболизма (+) - катехина новой (+) - разлагающими катехин бактериями, Burkholderia sp. KTC-1, выделенными из тропического торфа» . Biochem. Биофиз. Res. Сообщество. 366 (2): 414–9. Дои:10.1016 / j.bbrc.2007.11.157. PMID 18068670.
- ^ Сибуя Х., Агуста А., Охаши К., Маэхара С., Симанджунтак П. (июль 2005 г.). «Биоокисление (+) - катехина и (-) - эпикатехина в производные 3,4-дигидроксифлавана эндофитным грибком Diaporthe sp., Выделенным из чайного растения». Chem. Pharm. Бык. 53 (7): 866–7. Дои:10.1248 / cpb.53.866. PMID 15997157.
- ^ Богс Дж., Дауни М. О., Харви Дж. С., Эштон А. Р., Таннер Г. Дж., Робинсон С. П. (октябрь 2005 г.). «Синтез проантоцианидина и экспрессия генов, кодирующих лейкоантоцианидинредуктазу и антоцианидинредуктазу, в развивающихся ягодах винограда и листьях виноградной лозы». Физиология растений. 139 (2): 652–63. Дои:10.1104 / стр.105.064238. JSTOR 4281902. ЧВК 1255985. PMID 16169968.
- ^ Фридрих, Вольфганг; Галенса, Рудольф (2002). «Идентификация нового глюкозида флаванола из ячменя (Hordeum vulgare L.) и солода». Европейские исследования в области пищевых продуктов и технологии. 214 (5): 388–393. Дои:10.1007 / s00217-002-0498-x.
- ^ Джин QD, Му QZ (1991). «[Исследование гликозидных составляющих из Epigynum auritum]». Яо Сюэ Сюэ Бао (на китайском языке). 26 (11): 841–5. PMID 1823978.
- ^ а б Vogiatzoglou, A; Mulligan, A. A .; Бханиани, А; Lentjes, M. A .; МакТаггарт, А; Luben, R. N .; Heiss, C; Кельм, М; Merx, M. W .; Spencer, J.P .; Schroeter, H; Khaw, K. T .; Кунле, Г. Г. (2015). «Связь между потреблением флаван-3-ола и риском сердечно-сосудистых заболеваний в норфолкской когорте Европейского проспективного исследования рака (EPIC-Norfolk)». Свободная радикальная биология и медицина. 84: 1–10. Дои:10.1016 / j.freeradbiomed.2015.03.005. ЧВК 4503814. PMID 25795512.
- ^ Шредер, Иоганн (1655). Pharmacopoeia medico-chymica: sive thesaurus pharmologeus. Ulmae Suevorum: Johannis Gerlini.
- ^ Берендс, KAW (1829). Handbuch der praktischen Arzneiwissenschaft oder der speziellen Pathologie und Therapie. Берлин: Энслин.
- ^ Armentano, L; Бенцат, А; Береш, Т; Русняк, ул. Сент-Дьёрдьи, А (1936). "Über den Einfluß von Substanzen der Flavongruppe auf die Permeabilität der Kapillaren. Vitamin P". Deutsche Medizinische Wochenschrift. 62 (33): 1325–1328. Дои:10.1055 / с-0028-1141260.
- ^ Хупер, L; Кей, С; Абдельхамид, А; Kroon, P.A .; Cohn, J. S .; Rimm, E.B .; Кэссиди, А (2012). «Влияние шоколада, какао и флаван-3-олов на здоровье сердечно-сосудистой системы: систематический обзор и метаанализ рандомизированных исследований». Американский журнал клинического питания. 95 (3): 740–51. Дои:10.3945 / ajcn.111.023457. PMID 22301923.
- ^ Эллингер, S; Reusch, A; Stehle, P; Хелфрих, Х. П. (2012). «Эпикатехин, попадающий в организм с какао-продуктами, снижает кровяное давление у людей: модель нелинейной регрессии с байесовским подходом». Американский журнал клинического питания. 95 (6): 1365–77. Дои:10.3945 / ajcn.111.029330. PMID 22552030.
- ^ а б Халези, S; Вс, Дж; Покупок, N; Джамшиди, А; Никбахт-Насрабади, Э; Хосрави-Боружени, H (2014). «Катехины зеленого чая и артериальное давление: систематический обзор и метаанализ рандомизированных контролируемых исследований». Европейский журнал питания. 53 (6): 1299–311. Дои:10.1007 / s00394-014-0720-1. PMID 24861099.
- ^ Schroeter, H; Heiss, C; Balzer, J; Kleinbongard, P; Keen, C.L .; Холленберг, Н. К .; Sies, H; Квик-Урибе, К; Schmitz, H.H .; Кельм, М. (2006). «(-) - Эпикатехин опосредует благотворное влияние какао, богатого флаванолами, на функцию сосудов человека». Труды Национальной академии наук. 103 (4): 1024–9. Bibcode:2006ПНАС..103.1024С. Дои:10.1073 / pnas.0510168103. ЧВК 1327732. PMID 16418281.
- ^ Панель EFSA по диетическим продуктам, питанию и аллергии (NDA) (2012). «Научное заключение по обоснованию заявления о пользе для здоровья в отношении флаванолов какао и поддержания нормальной эндотелий-зависимой вазодилатации в соответствии со Статьей 13 (5) Регламента (ЕС) № 1924/2006». Журнал EFSA. 10 (7): 2809. Дои:10.2903 / j.efsa.2012.2809. Получено 25 июля 2016.
- ^ Martinez SE; Дэвис Н.М.; Рейнольдс Дж. К. (2013). «Токсикология и безопасность флавоноидов». Методы анализа, доклиническая и клиническая фармакокинетика, безопасность и токсикология. Джон Вили и сын. п. 257. ISBN 978-0-470-57871-1.
- ^ Боде, JC (1987). Okolicsányi, Lajos; Чомош, Геза; Крепальди, Гаэтано (ред.). Оценка и лечение гепатобилиарной болезни. Берлин: Springer-Verlag. п. 371. Дои:10.1007/978-3-642-72631-6. ISBN 978-3-642-72631-6.
- ^ "Ruhen der Zulassung für Catergen" (PDF). Deutsches Ärzteblatt. 82 (38): 2706.
- ^ а б Аманда К. Броз и Хорхе М. Виванко (2006). «Вторичные метаболиты и аллелопатия при инвазии растений: пример Centaurea maculosa». Sinauer Associates; Физиология и развитие растений / Под ред. 6; Линкольн Тайз, Эдуардо Зейгер, Ян М. Мёллер и Ангус Мерфи, редакторы.
- ^ Байс ХП, Вепачеду Р., Гилрой С., Каллауэй Р.М., Виванко Дж. М. (сентябрь 2003 г.). «Аллелопатия и инвазия экзотических растений: от молекул и генов до межвидовых взаимодействий». Наука. 301 (5638): 1377–80. Bibcode:2003Наука ... 301.1377B. Дои:10.1126 / science.1083245. PMID 12958360.
- ^ Ямамото М., Накацука С., Отани Х., Кохмото К., Нисимура С. (июнь 2000 г.). «(+) - катехин действует в листьях клубники как фактор, ингибирующий инфекцию». Фитопатология. 90 (6): 595–600. Дои:10.1094 / PHYTO.2000.90.6.595. PMID 18944538.
- ^ Чен З, Лян Дж., Чжан С., Родригес С.Дж. (октябрь 2006 г.). «Эпикатехин и катехин могут предотвратить болезнь кофейных ягод путем подавления аппрессорной меланизации Colletotrichum kahawae». Biotechnol. Латыш. 28 (20): 1637–40. Дои:10.1007 / s10529-006-9135-2. PMID 16955359.
внешняя ссылка
 СМИ, связанные с (+) - Катехин в Wikimedia Commons
СМИ, связанные с (+) - Катехин в Wikimedia Commons




