Тирозингидроксилаза - Tyrosine hydroxylase
Тирозингидроксилаза или же тирозин-3-монооксигеназа это фермент отвечает за катализ превращения аминокислота L-тирозин к L-3,4-дигидроксифенилаланин (L-ДОПА).[5][6] Это делается с помощью молекулярный кислород (O2), а также утюг (Fe2+) и тетрагидробиоптерин в качестве кофакторы. L-ДОПА является предшественником дофамин, который, в свою очередь, является предшественником важных нейромедиаторов норэпинефрин (норадреналин) и адреналин (адреналин). Тирозингидроксилаза катализирует стадию ограничения скорости в этом синтезе катехоламины. У человека тирозингидроксилаза кодируется TH ген,[6] и фермент присутствует в Центральная нервная система (ЦНС), периферические симпатические нейроны и мозговое вещество надпочечников.[6] Тирозингидроксилаза, фенилаланингидроксилаза и триптофангидроксилаза вместе составляют семью гидроксилазы ароматических аминокислот (AAAHs).
Реакция
| тирозин-3-монооксигеназа | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 1.14.16.2 | ||||||||
| Количество CAS | 9036-22-0 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
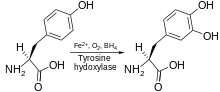
Тирозингидроксилаза катализирует реакция, в которой L-тирозин гидроксилированный в мета положение для получения L-3,4-дигидроксифенилаланин (L-ДОПА). Фермент - это оксигеназа Это означает, что он использует молекулярный кислород для гидроксилирования субстратов. Один из атомов кислорода в O2 используется для гидроксилирования молекулы тирозина для получения L-DOPA, а другой используется для гидроксилирования кофактора. Как и другие гидроксилазы ароматических аминокислот (AAAH), тирозингидроксилаза использует кофактор тетрагидробиоптерин (BH4) в нормальных условиях, хотя другие подобные молекулы также могут работать как кофактор тирозингидроксилазы.[7]
AAAH превращает кофактор 5,6,7,8-тетрагидробиоптерин (BH4) в тетрагидробиоптерин-4a-карбиноламин (4a-BH4). В физиологических условиях 4a-BH4 является обезвоженный в хиноноид-дигидробиоптерин (q-BH2) под действием фермента птерин-4a-карбиноламиндегидраза (PCD), и в этой реакции высвобождается молекула воды.[8][9] Тогда NAD (P) H-зависимый фермент дигидроптеридинредуктаза (DHPR) преобразует q-BH2 назад в BH4.[8] Каждая из четырех субъединиц тирозингидроксилазы координирована с утюг (II) атом представлен в активном центре. В степень окисления этого атома железа важен для каталитического обмена в ферментативной реакции. Если железо окисляется до Fe (III), фермент инактивируется.[10]
Продукт ферментативной реакции, L-ДОПА, может быть преобразован в дофамин с помощью фермента ДОПА декарбоксилаза. Дофамин может превращаться в норэпинефрин под действием фермента. дофамин-β-гидроксилаза, который может быть дополнительно модифицирован ферментом фенилэтанол-N-метилтрансферазой для получения эпинефрина.[11] С L-ДОФА является предшественником нейромедиаторов дофамина, норадреналина и адреналина, поэтому тирозингидроксилаза содержится в цитозоль всех ячеек, содержащих эти катехоламины. Было показано, что эта начальная реакция, катализируемая тирозингидроксилазой, является шаг ограничения скорости в производстве катехоламинов.[11]
Фермент высокоспецифичный, не принимающий индол производные - что необычно, как и многие другие ферменты, участвующие в производстве катехоламинов. Триптофан - плохой субстрат для тирозингидроксилазы, однако он может гидроксилировать L-фенилаланин с образованием L-тирозин и небольшие количества 3-гидроксифенилаланина.[7][12][13] Затем фермент может дополнительно катализировать L-тирозин с образованием L-ДОПА. Тирозингидроксилаза также может участвовать в других реакциях, таких как окислительная L-ДОПА с образованием 5-S-цистеинил-ДОФА или другого L-DOPA производные.[7][14]
Структура
Тирозингидроксилаза - это тетрамер из четырех одинаковых подразделения (гомотетрамер ). Каждая субъединица состоит из трех домены. На карбоксильный терминал пептидной цепи короткое альфа спираль домен, который допускает тетрамеризацию.[15] Центральные ~ 300 аминокислот составляют каталитическое ядро, в котором расположены все остатки, необходимые для катализа, вместе с нековалентно связанным атомом железа.[12] Утюг удерживается двумя гистидин остатки и один глутамат остаток, что делает его негемовым, не содержащим железо-серу железосодержащим ферментом.[16] В аминоконцевой ~ 150 аминокислот составляют регуляторный домен, который, как считается, контролирует доступ субстратов к активный сайт.[17] Считается, что у человека существует четыре различных версии этого регуляторного домена и, следовательно, четыре версии фермента, в зависимости от альтернативное сращивание,[18] хотя ни одна из их структур еще не определена должным образом.[19] Было высказано предположение, что этот домен может быть внутренне неструктурированный белок, который не имеет четко определенного третичная структура, но до сих пор не было представлено никаких доказательств, подтверждающих это утверждение.[19] Однако было показано, что в этом домене редко встречается второстепенные конструкции, что не ослабляет подозрений о неупорядоченной общей структуре.[20] Что касается тетрамеризационного и каталитического доменов, их структура была обнаружена с тирозингидроксилазой крысы с использованием Рентгеновская кристаллография.[21][22] Это показало, насколько его структура очень похожа на структуру фенилаланингидроксилаза и триптофангидроксилаза; вместе трое составляют семью из гомологичный гидроксилазы ароматических аминокислот.[23][24]
Регулирование

Активность тирозингидроксилазы увеличивается в краткосрочной перспективе на фосфорилирование. Регуляторный домен тирозингидроксилазы содержит несколько серин (Ser) остатки, включая Ser8, Ser19, Ser31 и Ser40, которые фосфорилируются различными протеинкиназы.[12][25] Ser40 фосфорилируется цАМФ-зависимая протеинкиназа.[26] Ser19 (и Ser40 в меньшей степени) фосфорилируется кальций-кальмодулин-зависимая протеинкиназа.[27] MAPKAPK2 (протеинкиназа, активируемая митогеном) отдает предпочтение Ser40, но также фосфорилирует Ser19 примерно вдвое меньше, чем Ser40.[28][29] Ser31 фосфорилируется ERK1 и ERK2 (внеклеточные регулируемые киназы 1&2),[30] и увеличивает ферментная активность в меньшей степени, чем фосфорилирование Ser40.[28] Фосфорилирование по Ser19 и Ser8 не оказывает прямого влияния на активность тирозингидроксилазы. Но фосфорилирование по Ser19 увеличивает скорость фосфорилирования по Ser40, что приводит к увеличению активности фермента. Фосфорилирование по Ser19 вызывает двукратное увеличение активности посредством механизма, который требует 14-3-3 белков.[31] Фосфорилирование по Ser31 вызывает небольшое повышение активности, и здесь механизм неизвестен. Тирозингидроксилаза в некоторой степени стабилизируется для тепловой инактивации, когда регуляторные серины фосфорилируются.[28][32]
Тирозингидроксилаза в основном присутствует в цитозоле, хотя в некоторой степени она также обнаруживается в плазматической мембране.[33] Мембранная ассоциация может быть связана с упаковкой катехоламинов в везикулы и экспортом через синаптическую мембрану.[33] Связывание тирозингидроксилазы с мембранами включает N-концевую область фермента и может регулироваться трехсторонним взаимодействием между 14-3-3 белками, N-концевой областью тирозингидроксилазы и отрицательно заряженными мембранами.[34]
Тирозингидроксилаза также может регулироваться ингибированием. Фосфорилирование по Ser40 снимает ингибирование с помощью катехоламинов дофамина, адреналина и норэпинефрина.[35][36] Катехоламины улавливают железо в активном центре в состоянии Fe (III), ингибируя фермент.[7]
Было показано, что на экспрессию тирозингидроксилазы может влиять экспрессия SRY. Снижение регуляции гена SRY в черная субстанция может привести к снижению экспрессии тирозингидроксилазы.[37]
Долгосрочная регуляция тирозингидроксилазы также может опосредоваться механизмами фосфорилирования. Гормоны (например. глюкокортикоиды ), наркотики (например, кокаин ), или же вторые мессенджеры Такие как лагерь увеличить тирозингидроксилазу транскрипция. Повышение активности тирозингидроксилазы за счет фосфорилирования может поддерживаться никотин на срок до 48 часов.[7][38] Активность тирозингидроксилазы регулируется хронически (в днях) синтез белка.[38]
Клиническое значение
А дефицит тирозингидроксилазы приводит к нарушению синтеза дофамин а также адреналин и норэпинефрин. Он представлен прогрессивным энцефалопатия и плохой прогноз. Клинические особенности включают: дистония который минимально или не реагирует на леводопа, экстрапирамидные симптомы, птоз, миоз, и постуральный гипотония. Это прогрессирующее и часто летальное заболевание, которое можно вылечить, но не вылечить леводопой.[39] Ответ на лечение варьируется, а долгосрочный и функциональный результат неизвестен. Чтобы обеспечить основу для улучшения понимания эпидемиологии, корреляции генотип / фенотип и исхода этих заболеваний, их влияния на качество жизни пациентов, а также для оценки диагностических и терапевтических стратегий, некоммерческая организация создала реестр пациентов. Международная рабочая группа по заболеваниям, связанным с нейротрансмиттерами (iNTD).[40] Кроме того, изменения активности фермента тирозингидроксилазы могут быть связаны с такими нарушениями, как Дистония Сегавы, болезнь Паркинсона и шизофрения.[21][41] Тирозингидроксилаза активируется зависимым от фосфорилирования связыванием с белками 14-3-3.[34] Поскольку белки 14-3-3 также могут быть связаны с нейродегенеративными заболеваниями, такими как Болезнь Альцгеймера, Болезнь Паркинсона и болезнь Хантингтона, он косвенно связывает тирозингидроксилазу с этими заболеваниями.[42] Было показано, что активность тирозингидроксилазы в мозге пациентов с болезнью Альцгеймера значительно снижена по сравнению со здоровыми людьми.[43] Тирозингидроксилаза также является аутоантигеном Аутоиммунный полиэндокринный синдром (АПС) типа I.[44]
Постоянная аномалия в болезнь Паркинсона дегенерация дофаминергических нейронов в черная субстанция, что приводит к снижению уровня дофамина в полосатом теле. Поскольку тирозингидроксилаза катализирует образование L-ДОФА, лимитирующая стадия биосинтеза дофамин, дефицит тирозингидроксилазы не вызывает болезнь Паркинсона, но обычно вызывает детский паркинсонизм, хотя спектр расширяется до состояния, напоминающего дофамин-зависимая дистония. Прямая патогенетический также предполагалась роль тирозингидроксилазы, поскольку этот фермент является источником ЧАС2О2 и другие активные формы кислорода (ROS) и мишень для радикально-опосредованного повреждения. Было продемонстрировано, что L-ДОФА эффективно окисляется тирозингидроксилазой млекопитающих, что, возможно, способствует цитотоксический эффекты L-ДОПА.[7] Подобно другим клеточным белкам, тирозингидроксилаза также является возможной мишенью для повреждения изменений, вызванных ROS. Это предполагает, что некоторые из окислительных повреждений тирозингидроксилазы могут быть вызваны самой системой тирозингидроксилазы.[7]
Тирозингидроксилаза может быть ингибирована препаратом α-метил-пара-тирозин (метирозин ). Это ингибирование может привести к истощению запасов дофамина и норэпинеферина в мозге из-за отсутствия предшественника. L-Допа (L-3,4-дигидроксифенилаланин), который синтезируется тирозингидроксилазой. Этот препарат используется редко и может вызвать депрессию, но он полезен при лечении феохромоцитома а также стойкий гипертония. Более старые примеры ингибиторов, упомянутые в литературе, включают: уденон[45] и акваямицин.[46]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000180176 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск ансамбля 89: ENSMUSG00000000214 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Кауфман С (1995). «Тирозингидроксилаза». Достижения в энзимологии и смежных областях молекулярной биологии. Достижения в энзимологии и смежных областях молекулярной биологии. 70. С. 103–220. Дои:10.1002 / 9780470123164.ch3. ISBN 978-0-470-12316-4. PMID 8638482.
- ^ а б c Нагацу Т (1995). «Тирозингидроксилаза: изоформы человека, структура и регуляция в физиологии и патологии». Очерки биохимии. 30: 15–35. PMID 8822146.
- ^ а б c d е ж грамм Хаавик Дж., Тоска К. (июнь 1998 г.). «Тирозингидроксилаза и болезнь Паркинсона». Молекулярная нейробиология. 16 (3): 285–309. Дои:10.1007 / BF02741387. PMID 9626667. S2CID 35753000.
- ^ а б Тейген К., МакКинни Дж.А., Хаавик Дж., Мартинес А. (2007). «Детерминанты селективности и аффинности связывания лиганда с гидроксилазами ароматических аминокислот». Современная лекарственная химия. 14 (4): 455–67. Дои:10.2174/092986707779941023. PMID 17305546.
- ^ Тёни Б., Ауэрбах Г., Блау Н. (апрель 2000 г.). «Биосинтез, регенерация и функции тетрагидробиоптерина». Биохимический журнал. 347, Чт 1 (1): 1–16. Дои:10.1042/0264-6021:3470001. ЧВК 1220924. PMID 10727395.
- ^ Рэмси А.Дж., Хиллас П.Дж., Фицпатрик П.Ф. (октябрь 1996 г.). «Характеристика железа в активном центре тирозингидроксилазы. Редокс-состояния железа». Журнал биологической химии. 271 (40): 24395–400. Дои:10.1074 / jbc.271.40.24395. PMID 8798695.
- ^ а б Нагацу Т., Левитт М., Уденфренд С. (сентябрь 1964 г.). "Тирозингидроксилаза. Начальный этап биосинтеза норэпинефрина". Журнал биологической химии. 239: 2910–7. PMID 14216443.
- ^ а б c Фитцпатрик П.Ф. (1999). «Тетрагидроптерин-зависимые аминокислотные гидроксилазы». Ежегодный обзор биохимии. 68: 355–81. Дои:10.1146 / annurev.biochem.68.1.355. PMID 10872454.
- ^ Фитцпатрик П.Ф. (1994). «Кинетические эффекты изотопов на гидроксилирование кольцевых дейтерированных фенилаланинов тирозингидроксилазой обеспечивают доказательства против разделения промежуточного соединения оксида арена». Журнал Американского химического общества. 116 (3): 1133–1134. Дои:10.1021 / ja00082a046.
- ^ Хаавик Дж., Флэтмарк Т. (октябрь 1987 г.). «Выделение и характеристика продуктов окисления тетрагидроптерина, образующихся в реакции тирозин-3-монооксигеназы (тирозингидроксилазы)». Европейский журнал биохимии / FEBS. 168 (1): 21–6. Дои:10.1111 / j.1432-1033.1987.tb13381.x. PMID 2889594.
- ^ Врана К.Е., Уокер С.Дж., Ракер П., Лю Х (декабрь 1994 г.). «Для образования тетрамера тирозингидроксилазы требуется лейциновая молния на карбоксильных концах». Журнал нейрохимии. 63 (6): 2014–20. Дои:10.1046 / j.1471-4159.1994.63062014.x. PMID 7964718. S2CID 46042840.
- ^ Рэмси AJ, Daubner SC, Ehrlich JI, Fitzpatrick PF (октябрь 1995 г.). «Идентификация лигандов железа в тирозингидроксилазе путем мутагенеза консервативных гистидиниловых остатков».. Белковая наука. 4 (10): 2082–6. Дои:10.1002 / pro.5560041013. ЧВК 2142982. PMID 8535244.
- ^ Daubner SC, Le T, Wang S (апрель 2011 г.). «Тирозингидроксилаза и регуляция синтеза дофамина». Архивы биохимии и биофизики. 508 (1): 1–12. Дои:10.1016 / j.abb.2010.12.017. ЧВК 3065393. PMID 21176768.
- ^ Кобаяси К., Канеда Н., Ичиносе Х., Киши Ф., Накадзава А., Куросава Ю., Фудзита К., Нагацу Т. (июнь 1988 г.). «Структура гена тирозингидроксилазы человека: альтернативный сплайсинг из одного гена позволяет получить четыре типа мРНК». Журнал биохимии. 103 (6): 907–12. Дои:10.1093 / oxfordjournals.jbchem.a122386. PMID 2902075.
- ^ а б Накашима А., Хаяси Н., Канеко Ю.С., Мори К., Саббан Э.Л., Нагатсу Т., Ота А. (ноябрь 2009 г.). «Роль N-конца тирозингидроксилазы в биосинтезе катехоламинов». Журнал нейронной передачи. 116 (11): 1355–62. Дои:10.1007 / s00702-009-0227-8. PMID 19396395. S2CID 930361.
- ^ Обсилова В., Недбалкова Е., Силхан Дж., Бура Е., Герман П., Вечер Дж., Сулк М., Тейзингер Дж., Дайда Ф., Обсил Т. (февраль 2008 г.). «Белок 14-3-3 влияет на конформацию регуляторного домена тирозингидроксилазы человека». Биохимия. 47 (6): 1768–77. Дои:10.1021 / bi7019468. PMID 18181650.
- ^ а б Goodwill KE, Sabatier C, Marks C, Raag R, Fitzpatrick PF, Stevens RC (июль 1997 г.). «Кристаллическая структура тирозингидроксилазы на 2,3 А и ее значение для наследственных нейродегенеративных заболеваний». Структурная биология природы. 4 (7): 578–85. Дои:10.1038 / nsb0797-578. PMID 9228951. S2CID 20007900.
- ^ Goodwill KE, Sabatier C, Stevens RC (сентябрь 1998 г.). «Кристаллическая структура тирозингидроксилазы со связанным аналогом кофактора и железом при разрешении 2,3 A: самогидроксилирование Phe300 и сайта связывания птерина». Биохимия. 37 (39): 13437–45. Дои:10.1021 / bi981462g. PMID 9753429.
- ^ Ledley FD, DiLella AG, Kwok SC, Woo SL (июль 1985 г.). «Гомология между фенилаланином и тирозингидроксилазами выявляет общие структурные и функциональные домены». Биохимия. 24 (14): 3389–94. Дои:10.1021 / bi00335a001. PMID 2412578.
- ^ Grenett HE, Ledley FD, Reed LL, Woo SL (август 1987 г.). «Полноразмерная кДНК для триптофангидроксилазы кролика: функциональные домены и эволюция гидроксилаз ароматических аминокислот». Труды Национальной академии наук Соединенных Штатов Америки. 84 (16): 5530–4. Bibcode:1987PNAS ... 84.5530G. Дои:10.1073 / пнас.84.16.5530. ЧВК 298896. PMID 3475690.
- ^ Haycock JW (июль 1990 г.). «Фосфорилирование тирозингидроксилазы in situ по серину 8, 19, 31 и 40». Журнал биологической химии. 265 (20): 11682–91. PMID 1973163.
- ^ Роскоски Р., Роскоски Л. М. (январь 1987 г.). «Активация тирозингидроксилазы в клетках PC12 с помощью циклических систем передачи GMP и циклических AMP». Журнал нейрохимии. 48 (1): 236–42. Дои:10.1111 / j.1471-4159.1987.tb13153.x. PMID 2878973. S2CID 14759673.
- ^ Lehmann IT, Бобровская L, Gordon SL, Dunkley PR, Dickson PW (июнь 2006 г.). «Дифференциальная регуляция изоформ тирозингидроксилазы человека посредством иерархического фосфорилирования». Журнал биологической химии. 281 (26): 17644–51. Дои:10.1074 / jbc.M512194200. PMID 16644734.
- ^ а б c Dunkley PR, Bobrovskaya L, Graham ME, von Nagy-Felsobuki EI, Dickson PW (декабрь 2004 г.). «Фосфорилирование тирозингидроксилазы: регуляция и последствия». Журнал нейрохимии. 91 (5): 1025–43. Дои:10.1111 / j.1471-4159.2004.02797.x. PMID 15569247. S2CID 24324381.
- ^ Сазерленд С., Альтерио Дж., Кэмпбелл Д.Г., Ле Бурдель Б., Малле Дж., Хаавик Дж., Коэн П. (октябрь 1993 г.). «Фосфорилирование и активация тирозингидроксилазы человека in vitro с помощью митоген-активируемой протеиновой (MAP) киназы и MAP-киназы-активируемых киназ 1 и 2». Европейский журнал биохимии / FEBS. 217 (2): 715–22. Дои:10.1111 / j.1432-1033.1993.tb18297.x. PMID 7901013.
- ^ Haycock JW, Ahn NG, Cobb MH, Krebs EG (март 1992 г.). «ERK1 и ERK2, две связанные с микротрубочками протеин 2 киназы, опосредуют фосфорилирование тирозингидроксилазы по серину-31 in situ». Труды Национальной академии наук Соединенных Штатов Америки. 89 (6): 2365–9. Bibcode:1992PNAS ... 89.2365H. Дои:10.1073 / pnas.89.6.2365. ЧВК 48658. PMID 1347949.
- ^ Ичимура Т., Исобе Т., Окуяма Т., Такахаши Н., Араки К., Кувано Р., Такахаши И. (октябрь 1988 г.). «Молекулярное клонирование кДНК, кодирующей специфический для мозга белок 14-3-3, протеинкиназ-зависимый активатор тирозин- и триптофангидроксилаз». Труды Национальной академии наук Соединенных Штатов Америки. 85 (19): 7084–8. Bibcode:1988PNAS ... 85.7084I. Дои:10.1073 / пнас.85.19.7084. ЧВК 282128. PMID 2902623.
- ^ Ройо М., Фицпатрик П.Ф., Даубнер СК (февраль 2005 г.). «Мутация регуляторных серинов тирозингидроксилазы крыс на глутамат: влияние на стабильность и активность ферментов». Архивы биохимии и биофизики. 434 (2): 266–74. Дои:10.1016 / j.abb.2004.11.007. PMID 15639226.
- ^ а б Чен Р., Вэй Дж, Фаулер С.К., Ву Дж.Й. (2003). «Демонстрация функциональной связи между синтезом дофамина и его упаковкой в синаптические везикулы» (PDF). Журнал биомедицинских наук. 10 (6 Pt 2): 774–81. Дои:10.1159/000073965. HDL:1808/17671. PMID 14631117. S2CID 5950778.
- ^ а б Halskau Ø, Ying M, Baumann A, Kleppe R, Rodriguez-Larrea D, Almås B, Haavik J, Martinez A (ноябрь 2009 г.). «Трехстороннее взаимодействие между белками 14-3-3, N-концевой областью тирозингидроксилазы и отрицательно заряженными мембранами». Журнал биологической химии. 284 (47): 32758–69. Дои:10.1074 / jbc.M109.027706. ЧВК 2781693. PMID 19801645.
- ^ Daubner SC, Lauriano C, Haycock JW, Fitzpatrick PF (июнь 1992 г.). «Сайт-направленный мутагенез серина 40 тирозингидроксилазы крысы. Влияние допамина и цАМФ-зависимого фосфорилирования на активность фермента». Журнал биологической химии. 267 (18): 12639–46. PMID 1352289.
- ^ Рэмси А.Дж., Фицпатрик П.Ф. (июнь 1998 г.). «Эффекты фосфорилирования серина 40 тирозингидроксилазы на связывание катехоламинов: доказательства нового механизма регуляции». Биохимия. 37 (25): 8980–6. Дои:10.1021 / bi980582l. PMID 9636040.
- ^ Dewing P, Chiang CW, Sinchak K, Sim H, Fernagut PO, Kelly S, Chesselet MF, Micevych PE, Albrecht KH, Harley VR, Vilain E (февраль 2006 г.). «Прямая регуляция функции мозга взрослых с помощью мужского фактора SRY». Текущая биология. 16 (4): 415–20. Дои:10.1016 / j.cub.2006.01.017. PMID 16488877. S2CID 5939578.
- ^ а б Бобровская Л., Гиллиган С., Болстер Е.К., Флаэрти Дж.Дж., Диксон П.В., Данкли П.Р. (январь 2007 г.). «Устойчивое фосфорилирование тирозингидроксилазы по серину 40: новый механизм для поддержания синтеза катехоламинов». Журнал нейрохимии. 100 (2): 479–89. Дои:10.1111 / j.1471-4159.2006.04213.x. PMID 17064352. S2CID 20406829.
- ^ Pearl PL, Taylor JL, Trzcinski S, Sokohl A (май 2007 г.). «Детские нейротрансмиттерные расстройства». J Child Neurol. 22 (5): 606–616. Дои:10.1177/0883073807302619. PMID 17690069. S2CID 10689202.
- ^ «Регистр пациентов».
- ^ Тибо Ф., Рибейр Дж. М., Дурмап Н., Мелони Р., Лоран С., Кэмпион Д., Менар Дж. Ф., Дольфус С., Малле Дж., Пети М. (февраль 1997 г.). «Связь полиморфизма ДНК в первом интроне гена тирозингидроксилазы с нарушениями катехоламинергической системы при шизофрении». Исследование шизофрении. 23 (3): 259–64. Дои:10.1016 / s0920-9964 (96) 00118-1. PMID 9075305. S2CID 46062969.
- ^ Штайнакер П., Эйткен А., Отто М. (сентябрь 2011 г.). «14-3-3 белков в нейродегенерации». Семинары по клеточной биологии и биологии развития. 22 (7): 696–704. Дои:10.1016 / j.semcdb.2011.08.005. PMID 21920445.
- ^ Савада М., Хирата Ю., Араи Х, Иидзука Р., Нагацу Т. (март 1987 г.). «Тирозингидроксилаза, триптофангидроксилаза, биоптерин и неоптерин в головном мозге здоровых людей и пациентов с старческой деменцией типа Альцгеймера». Журнал нейрохимии. 48 (3): 760–4. Дои:10.1111 / j.1471-4159.1987.tb05582.x. PMID 2879891.
- ^ Hedstrand H, Ekwall O, Haavik J, Landgren E, Betterle C, Perheentupa J, Gustafsson J, Husebye E, Rorsman F, Kämpe O (январь 2000 г.). «Идентификация тирозингидроксилазы как аутоантигена при аутоиммунном полиэндокринном синдроме I типа». Сообщения о биохимических и биофизических исследованиях. 267 (1): 456–61. Дои:10.1006 / bbrc.1999.1945. PMID 10623641.
- ^ Оно М., Окамото М., Кавабе Н., Умедзава Х., Такеучи Т. (март 1971 г.). «Уденон, новый ингибитор тирозингидроксилазы микробного происхождения». Журнал Американского химического общества. 93 (5): 1285–6. Дои:10.1021 / ja00734a054. PMID 5545929.
- ^ Аюкава С., Такеучи Т., Сезаки М., Хара Т., Умедзава Н. (май 1968 г.). «Ингибирование тирозингидроксилазы акваямицином». Журнал антибиотиков. 21 (5): 350–3. Дои:10.7164 / антибиотики.21.350. PMID 5726288.
дальнейшее чтение
- Массерано Дж. М., Вайнер Н. (1983). «Регуляция тирозингидроксилазы в центральной нервной системе». Молекулярная и клеточная биохимия. 53-54 (1–2): 129–52. Дои:10.1007 / BF00225250. PMID 6137760. S2CID 19361815.
- Мелони Р., Биге Н.Ф., Маллет Дж. (2002). «Постгеномная эра и открытие генов психических заболеваний: есть новое искусство торговли? Пример микросателлита HUMTH01 в гене тирозингидроксилазы». Молекулярная нейробиология. 26 (2–3): 389–403. Дои:10.1385 / МН: 26: 2-3: 389. PMID 12428766. S2CID 8814324.
- Joh TH, Park DH, Reis DJ (октябрь 1978 г.). «Прямое фосфорилирование тирозингидроксилазы мозга циклической АМФ-зависимой протеинкиназой: механизм активации фермента». Труды Национальной академии наук Соединенных Штатов Америки. 75 (10): 4744–8. Bibcode:1978PNAS ... 75.4744J. Дои:10.1073 / pnas.75.10.4744. ЧВК 336196. PMID 33381.
- Haycock JW, Ahn NG, Cobb MH, Krebs EG (март 1992 г.). «ERK1 и ERK2, две связанные с микротрубочками протеин 2 киназы, опосредуют фосфорилирование тирозингидроксилазы по серину-31 in situ». Труды Национальной академии наук Соединенных Штатов Америки. 89 (6): 2365–9. Bibcode:1992PNAS ... 89.2365H. Дои:10.1073 / pnas.89.6.2365. ЧВК 48658. PMID 1347949.
- Haycock JW (июль 1990 г.). «Фосфорилирование тирозингидроксилазы in situ по серину 8, 19, 31 и 40». Журнал биологической химии. 265 (20): 11682–91. PMID 1973163.
- Крейг С.П., Пряжка В.Дж., Ламуру А., Маллет Дж., Крейг I. (1986). «Локализация гена тирозингидроксилазы человека в 11p15: дупликация гена и эволюция метаболических путей». Цитогенетика и клеточная генетика. 42 (1–2): 29–32. Дои:10.1159/000132246. PMID 2872999.
- Грима Б., Ламуру А., Бони С., Жюльен Дж. Ф., Джавой-Аджид Ф., Маллет Дж. (1987). «Один человеческий ген, кодирующий несколько тирозингидроксилаз с различными предсказанными функциональными характеристиками». Природа. 326 (6114): 707–11. Bibcode:1987Натура.326..707Г. Дои:10.1038 / 326707a0. PMID 2882428. S2CID 4314044.
- Канеда Н., Кобаяси К., Ичиносе Х., Киши Ф., Накадзава А., Куросава Ю., Фудзита К., Нагацу Т. (август 1987 г.). «Выделение нового клона кДНК для тирозингидроксилазы человека: альтернативный сплайсинг РНК дает четыре вида мРНК из одного гена». Сообщения о биохимических и биофизических исследованиях. 146 (3): 971–5. Дои:10.1016 / 0006-291X (87) 90742-X. PMID 2887169.
- Кобаяси К., Канеда Н., Ичиносе Х., Киши Ф., Накадзава А., Куросава Ю., Фудзита К., Нагацу Т. (август 1987 г.). «Выделение клона кДНК полной длины, кодирующего тирозингидроксилазу человека 3 типа». Исследования нуклеиновых кислот. 15 (16): 6733. Дои:10.1093 / nar / 15.16.6733. ЧВК 306135. PMID 2888085.
- О'Мэлли К.Л., Анхальт М.Дж., Мартин Б.М., Келсо Дж.Р., Винфилд С.Л., Джиннс Е.И. (ноябрь 1987 г.). «Выделение и характеристика гена тирозингидроксилазы человека: идентификация 5 'альтернативных сайтов сплайсинга, ответственных за множественные мРНК». Биохимия. 26 (22): 6910–4. Дои:10.1021 / bi00396a007. PMID 2892528.
- Ле Бурдель Б., Буларан С., Бони С., Хореллоу П., Дюма С., Грима Б., Малле Дж. (Март 1988 г.). «Анализ 5 'области гена тирозингидроксилазы человека: комбинаторные паттерны сплайсинга экзонов генерируют множественные регулируемые изоформы тирозингидроксилазы». Журнал нейрохимии. 50 (3): 988–91. Дои:10.1111 / j.1471-4159.1988.tb03009.x. PMID 2892893. S2CID 44602622.
- Ginns EI, Rehavi M, Martin BM, Weller M, O'Malley KL, LaMarca ME, McAllister CG, Paul SM (май 1988 г.). «Экспрессия кДНК тирозингидроксилазы человека в клетках беспозвоночных с использованием бакуловирусного вектора». Журнал биологической химии. 263 (15): 7406–10. PMID 2896667.
- Кобаяси К., Канеда Н., Ичиносе Х., Киши Ф., Накадзава А., Куросава Ю., Фудзита К., Нагацу Т. (июнь 1988 г.). «Структура гена тирозингидроксилазы человека: альтернативный сплайсинг из одного гена позволяет получить четыре типа мРНК». Журнал биохимии. 103 (6): 907–12. Дои:10.1093 / oxfordjournals.jbchem.a122386. PMID 2902075.
- Coker GT, Vinnedge L, O'Malley KL (декабрь 1988 г.). «Характеристика генов тирозингидроксилазы крысы и человека: функциональная экспрессия обоих промоторов в нейрональных и ненейрональных типах клеток». Сообщения о биохимических и биофизических исследованиях. 157 (3): 1341–7. Дои:10.1016 / S0006-291X (88) 81022-2. PMID 2905129.
- Vulliet PR, Woodgett JR, Cohen P (ноябрь 1984 г.). «Фосфорилирование тирозингидроксилазы кальмодулин-зависимой мультипротеинкиназой». Журнал биологической химии. 259 (22): 13680–3. PMID 6150037.
- Чжоу QY, Quaife CJ, Palmiter RD (апрель 1995 г.). «Целенаправленное нарушение гена тирозингидроксилазы показывает, что катехоламины необходимы для развития плода мыши». Природа. 374 (6523): 640–3. Bibcode:1995Натура.374..640Z. Дои:10.1038 / 374640a0. PMID 7715703. S2CID 4259663.
- Людеке Б., Бартоломе К. (июнь 1995 г.). «Частый вариант последовательности в гене тирозингидроксилазы человека». Генетика человека. 95 (6): 716. Дои:10.1007 / BF00209496. PMID 7789962. S2CID 1057532.
- Людеке Б., Дворничак Б., Бартоломе К. (январь 1995 г.). «Точечная мутация в гене тирозингидроксилазы, связанная с синдромом Сегавы». Генетика человека. 95 (1): 123–5. Дои:10.1007 / BF00225091. PMID 7814018. S2CID 26870241.
- Knappskog PM, Flatmark T, Mallet J, Lüdecke B, Bartholomé K (июль 1995 г.). «Рецессивно наследуемая L-DOPA-чувствительная дистония, вызванная точечной мутацией (Q381K) в гене тирозингидроксилазы». Молекулярная генетика человека. 4 (7): 1209–12. Дои:10.1093 / hmg / 4.7.1209. PMID 8528210.
внешняя ссылка
- GeneReviews / NIH / NCBI / UW запись о дефиците тирозингидроксилазы, включая тирозингидроксилазу-дефицитную допа-чувствительную дистонию или синдром Сегавы и аутосомно-рецессивный детский паркинсонизм
- Тирозин + гидроксилаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)