Дофамин бета-гидроксилаза - Dopamine beta-hydroxylase
Дофамин бета-гидроксилаза (DBH), также известный как дофамин бета-монооксигеназа, является фермент (ЕС 1.14.17.1 ), который у человека кодируется DBH ген. Дофамин бета-гидроксилаза катализирует превращение дофамина в норэпинефрин.

Три субстраты фермента дофамин, Витамин С (аскорбат) и О2. В товары находятся норэпинефрин, дегидроаскорбат, и ЧАС2О.
DBH представляет собой медьсодержащее вещество 290 кДа. оксигеназа состоит из четырех идентичных субъединиц, и для его работы требуется аскорбат как кофактор.[4]
Это единственный фермент, участвующий в синтезе низкомолекулярных нейротрансмиттеров, который связан с мембраной, что делает норэпинефрин единственным известным медиатором, синтезируемым внутри везикул. Он экспрессируется в норадренергических нейронах центральной нервной системы (т.е. голубое пятно ) и периферической нервной системы (т.е. симпатических ганглиев), а также в хромаффинные клетки из мозговое вещество надпочечников.
Механизм катализа
| дофамин бета-монооксигеназа | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 1.14.17.1 | ||||||||
| Количество CAS | 9013-38-1 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Основываясь на наблюдениях за тем, что происходит, когда нет субстрата или кислорода, следующие шаги, по-видимому, составляют реакцию гидроксилирования.[5][6]
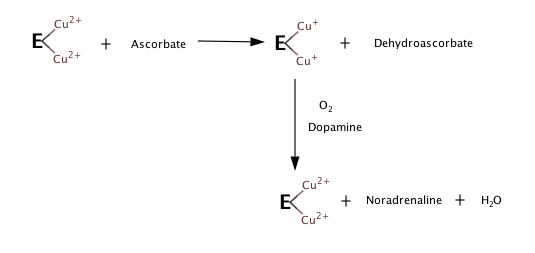
Хотя детали механизма DBH еще не подтверждены, DBH гомологичен другому ферменту, пептидилглицин-α-гидроксилирующей монооксигеназе (PHM). Поскольку DBH и PHM имеют похожие структуры, можно смоделировать механизм DBH на основе того, что известно о механизме PHM.[7]
Специфичность субстрата
Дофамин-бета-гидроксилаза катализирует гидроксилирование не только дофамина, но и других производных фенилэтиламина, если они доступны. Минимальные требования кажутся фенилэтиламин скелет: бензольное кольцо с двухуглеродной боковой цепью, оканчивающейся аминогруппой.[5]
Анализы активности DBH в сыворотке крови человека и спинномозговой жидкости
Активность DBH в сыворотке крови человека можно оценить с помощью спектрофотометрический метод [11] или с помощью сверхвысокопроизводительной жидкостной хроматографии с детектором на фотодиодной матрице (UHPLC-PDA).[12] Чувствительный анализ для определения активности DBH в спинномозговая жидкость с помощью Высокоэффективная жидкостная хроматография с электрохимическим детектором (HPLC-ECD) также был описан ранее.[13]
Локусы количественных признаков экспрессии (eQTL) в локусах DBH
Генетические варианты, такие как однонуклеотидные полиморфизмы (SNP)[14][15] в локусах DBH, как было установлено, связаны с активностью DBH и хорошо известны выражение количественных признаков локусов. Аллель варианты двух регуляторных SNP, а именно rs1611115 [16] и rs1989787 [17] было показано, что они влияют на транскрипцию этого гена. Мутации, идентифицированные в Дефицит дофамин-бета-гидроксилазы [18] и было обнаружено, что несинонимичные SNP, такие как rs6271 в этом гене, вызывают дефектную секрецию белка из эндоплазматического ретикулума.[19]
Клиническое значение
DBH в первую очередь способствует катехоламин и след амина биосинтез. Он также участвует в метаболизме ксенобиотики относящиеся к этим веществам; например, человеческий фермент DBH катализирует бета-гидроксилирование амфетамин и пара-гидроксиамфетамин, производя норэфедрин и пара-гидроксиноэфедрин соответственно.[20][21][22]
DBH считается коррелирующим фактором в условиях, связанных с принятием решений и наркотики, вызывающие привыкание, например, алкоголизм[23] и курение,[24] Синдром дефицита внимания и гиперактивности,[25] шизофрения,[26] и Болезнь Альцгеймера.[27] Неадекватный DBH называется дефицит дофамин-бета-гидроксилазы.
Проксимальный промоутер Было обнаружено, что SNP rs1989787 и rs1611115 связаны с познанием в Шизофрения предметы.[28] Кроме того, эти SNP и вариант дистального промотора 19bp Ins / Del (rs141116007) были важны для Поздняя дискинезия и Шкала позитивных и негативных синдромов (PANSS) баллы по предметам шизофрении.[28]
Структура
Было трудно получить стабильный кристалл дофамин-бета-гидроксилазы. Следовательно, доступна модель гомологии, основанная на первичной последовательности и сравнении с PHM.[29]

Однако в 2016 году была предложена и кристаллическая структура.[30]
Регулирование и торможение
Этот белок может использовать морфеин модель аллостерическая регуляция.[31]
Ингибиторы
| HYD[а] | HP[b] | QCA[c] | IQCA[d] | БИ[e] | IAA[f] | |
|---|---|---|---|---|---|---|
| Конкурентный | Аскорбат | Аскорбат | Аскорбат | Аскорбат | Аскорбат | Аскорбат |
| Неконкурентоспособен | Тирамин | Тирамин | ||||
| Смешанный | Тирамин | Тирамин | Тирамин | Тирамин | ||
| Аскорбат - кофактор; тирамин заменяет дофамин, субстрат тезки DBH | ||||||
DBH ингибируется дисульфирам,[32] трополон,[33] и, наиболее избирательно, непикастат.[34]
DBH обратимо ингибируется гидразоном 1-2H-фталазина (гидралазин; HYD), гидразоном 2-1H-пиридинона (2-гидразинопиридин; HP), 2-хинолинкарбоновой кислотой (QCA), 1-изохинолинкарбоновой кислотой (IQCA), 2 , 2'-би-1H-имидазол (2,2'-биимидазол; BI) и 1H-имидазол-4-уксусная кислота (имидазол-4-уксусная кислота; IAA). HYD, QCA и IAA являются аллостерическими конкурентоспособными.[35]
Номенклатура
В систематическое название этого класса ферментов 3,4-дигидроксифенэтиламин, аскорбат: оксидоредуктаза кислорода (бета-гидроксилирование).
Другие широко используемые имена включают:
- дофамин бета-монооксигеназа
- дофамин бета-гидроксилаза
- мембраносвязанная дофамин-бета-монооксигеназа (MDBH)
- растворимая дофамин-бета-монооксигеназа (SDBH)
- допамин-B-гидроксилаза
- 3,4-дигидроксифенэтиламин бета-оксидаза
- 4- (2-аминоэтил) пирокатехол бета-оксидаза
- допа бета-гидроксилаза
- дофамин бета-оксидаза
- дофамин гидроксилаза
- фениламин бета-гидроксилаза
- (3,4-дигидроксифенэтиламин) бета-моно-оксигеназа
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000123454 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Раш Р.А., Геффен Л.Б. (1980). «Дофамин бета-гидроксилаза в здоровье и болезни». Критические обзоры в клинических лабораторных науках. 12 (3): 241–77. Дои:10.3109/10408368009108731. PMID 6998654.
- ^ а б Кауфман С., Бриджерс В. Ф., Барон Дж. (1968). «Механизм действия дофамин-бета-гидроксилазы». Достижения в химии. 77, глава 73: 172–176. Дои:10.1021 / ba-1968-0077.ch073. ISBN 0-8412-0078-5.
- ^ Фридман С., Кауфман С. (май 1966 г.). «Исследование электронного парамагнитного резонанса 3,4-дигидроксифенилэтиламин бета-гидроксилазы». Журнал биологической химии. 241 (10): 2256–9. PMID 4287853.
- ^ Пригге С.Т., Сеть RE, Эйппер Б.А., Амзель Л.М. (август 2000 г.). «Новые взгляды на монооксигеназы меди и амидирование пептидов: структура, механизм и функции». Клеточные и молекулярные науки о жизни. 57 (8–9): 1236–59. Дои:10.1007 / pl00000763. PMID 11028916. S2CID 12738480.
- ^ Бродли К.Дж. (март 2010 г.). «Сосудистые эффекты следовых аминов и амфетаминов». Фармакология и терапия. 125 (3): 363–375. Дои:10.1016 / j.pharmthera.2009.11.005. PMID 19948186.
- ^ Lindemann L, Hoener MC (май 2005 г.). «Возрождение следовых аминов, вдохновленное новым семейством GPCR». Тенденции в фармакологических науках. 26 (5): 274–281. Дои:10.1016 / j.tips.2005.03.007. PMID 15860375.
- ^ Ван Х, Ли Дж, Донг Дж, Юэ Дж (февраль 2014 г.). «Эндогенные субстраты CYP2D мозга». Европейский журнал фармакологии. 724: 211–218. Дои:10.1016 / j.ejphar.2013.12.025. PMID 24374199.
- ^ Нагацу Т., Удэнфренд С. (1972). «Фотометрический анализ активности дофамин-β-гидроксилазы в крови человека». Клиническая химия. 18 (9): 980–983. Дои:10.1093 / Clinchem / 18.9.980. PMID 5052101.
- ^ Пунчайчира Т.Дж., Дешпанде С.Н., Тельма Б.К. (2018). «Определение активности дофамин-β-гидроксилазы в сыворотке человека с помощью обнаружения UHPLC-PDA». Нейрохимические исследования. 43 (12): 2324–2332. Дои:10.1007 / s11064-018-2653-1. PMID 30357655. S2CID 53024826.
- ^ Мацуи Х., Като Т., Ямамото С., Фудзита К., Нагацу Т. (1981). «Высокочувствительный анализ активности дофамин-бета-гидроксилазы в спинномозговой жидкости человека с помощью высокоэффективной жидкостной хроматографии и электрохимического обнаружения: свойства фермента». Журнал нейрохимии. 37 (2): 289–296. Дои:10.1111 / j.1471-4159.1981.tb00454.x. PMID 7264660. S2CID 42736106.
- ^ Забетиан С.П., Андерсон Г.М., Буксбаум С.Г., Элстон Р.К., Ичиносе Х., Нагатсу Т., Ким К.С., Ким СН, Мэлисон Р.Т., Гелернтер Дж., Кубеллс Дж.Ф. «Количественный анализ активности дофамин-бета-гидроксилазы в плазме крови человека: свидетельство основного функционального полиморфизма в локусе DBH». Американский журнал генетики человека. 68 (2): 515–22. Дои:10.1086/318198. ЧВК 1235285. PMID 11170900.
- ^ Пунчайчира Т.Дж., Прасад С.Н., Дешпанде С.Н., Тельма Б.К. (2016). «Глубокое секвенирование позволяет идентифицировать новые регуляторные варианты в дистальной промоторной области гена дофамин-бета-гидроксилазы». Фармакогенетика и геномика. 26 (7): 311–23. Дои:10.1097 / FPC.0000000000000214. PMID 26959714. S2CID 205601803.
- ^ Чен Й, Вэнь Джи, Рао Ф, Чжан К., Ван Л., Родригес-Флорес Дж. Л., Санчес, А. П., Махата М., Таупенот Л., Сан П., Махата С. К., Тайо Б., Шорк Н. Дж., Зиглер М. Г., Гамильтон Б. А., О ' Коннор Д. Т. (2010). «Регуляторный полиморфизм дофамин-бета-гидроксилазы человека (DBH), который влияет на ферментативную активность, вегетативную функцию и артериальное давление». Журнал гипертонии. 28 (1): 76–86. Дои:10.1097 / HJH.0b013e328332bc87. ЧВК 2860271. PMID 20009769.
- ^ Чен Й, Чжан К., Вен Джи, Рао Ф, Санчес А.П., Ван Л., Родригес-Флорес Дж. Л., Махата М., Махата С.К., Ваален Дж., Зиглер М.Г., Гамильтон Б.А., О'Коннор Д.Т. (2011). «Вариант промотора дофамин-бета-гидроксилазы человека изменяет транскрипцию в хромаффинных клетках, секрецию ферментов и кровяное давление». Американский журнал гипертонии. 24 (1): 24–32. Дои:10.1038 / ajh.2010.186. ЧВК 4906639. PMID 20814407.
- ^ Ким Ч., Люн А., Ха Й., Ян Э, Ким Д. Д., Леблан П., Рю Х, Ким К., Ким Д. В., Гарланд Е. М., Радж С. Р., Бьяджони И., Робертсон Д., Ким К.С. (2011). «Дефицит норэпинефрина вызван комбинированным аномальным процессингом мРНК и дефектным переносом белков дофамин-бета-гидроксилазы». Журнал биологической химии. 286 (11): 9196–204. Дои:10.1074 / jbc.M110.192351. ЧВК 3059068. PMID 21209083.
- ^ Пунчаичира Т.Дж., Дей С.К., Мукхопадхьяй А., Кунду С., Тельма Б.К. (2017). «Характеристика SNP в гене дофамин-бета-гидроксилазы, обеспечивающая новое понимание его взаимосвязи структура-функция». Нейрогенетика. 18 (3): 155–168. Дои:10.1007 / s10048-017-0519-3. PMID 28707163. S2CID 5259134.
- ^ Гленнон Р.А. (2013). «Стимуляторы фенилизопропиламина: вещества, родственные амфетамину». В Lemke TL, Williams DA, Roche VF, Zito W (ред.). Принципы медицинской химии Фуа (7-е изд.). Филадельфия, США: Wolters Kluwer Health / Lippincott Williams & Wilkins. С. 646–648. ISBN 9781609133450. Получено 11 сентября 2015.
Метаболизм аналогов амфетамина в фазе 1 катализируется двумя системами: цитохромом P450 и флавинмонооксигеназой. ... Амфетамин также может подвергаться ароматическому гидроксилированию до п-гидроксиамфетамин. ... Последующее окисление в бензильном положении DA-β-гидроксилазой дает п-гидроксиноэфедрин. В качестве альтернативы прямое окисление амфетамина β-гидроксилазой DA может дать норэфедрин.
- ^ Тейлор КБ (январь 1974 г.). «Дофамин-бета-гидроксилаза. Стереохимический ход реакции» (PDF). J. Biol. Chem. 249 (2): 454–458. PMID 4809526. Получено 6 ноября 2014.
Дофамин-β-гидроксилаза катализирует удаление атома водорода pro-R и образование 1-норэфедрина, (2S, 1R) -2-амино-1-гидроксил-1-фенилпропана из d-амфетамина.
- ^ Хорвиц Д., Александр Р. В., Ловенберг В., Кейзер HR (май 1973 г.). «Дофамин-β-гидроксилаза сыворотки крови человека. Связь с гипертонией и симпатической активностью». Circ. Res. 32 (5): 594–599. Дои:10.1161 / 01.RES.32.5.594. PMID 4713201.
Субъекты с исключительно низким уровнем активности дофамин-β-гидроксилазы в сыворотке показали нормальную сердечно-сосудистую функцию и нормальное β-гидроксилирование введенного синтетического субстрата, гидроксиамфетамина.
- ^ Mutschler J, Abbruzzese E, Witt SH, Dirican G, Nieratschker V, Frank J, Grosshans M, Rietschel M, Kiefer F (август 2012 г.). «Функциональный полиморфизм гена дофамин-β-гидроксилазы связан с повышенным риском побочных эффектов, вызванных дисульфирамом, у пациентов с алкогольной зависимостью». Журнал клинической психофармакологии. 32 (4): 578–80. Дои:10.1097 / jcp.0b013e31825ddbe6. PMID 22760354.
- ^ Элла Е., Сато Н., Нисидзава Д., Кагеяма С., Ямада Х., Курабе Н., Ишино К., Тао Х., Таниока Ф., Нодзава А., Реньин С., Синмура К., Икеда К., Сугимура Х (июнь 2012 г.). «Связь между полиморфизмом дофамин-бета-гидроксилазы rs5320 и курением у пожилых японцев». Журнал генетики человека. 57 (6): 385–90. Дои:10.1038 / jhg.2012.40. PMID 22513716.
- ^ Бхадури Н., Синха С., Чаттопадхьяй А., Гангопадхьяй П.К., Сингх М., Мукхопадхьяй К.К. (февраль 2005 г.). «Анализ полиморфизмов в гене дофамин-бета-гидроксилазы: связь с синдромом дефицита внимания и гиперактивности у индийских детей». Индийская педиатрия. 42 (2): 123–9. PMID 15767706.
- ^ Cubells JF, Sun X, Li W, Bonsall RW, McGrath JA, Avramopoulos D, Lasseter VK, Wolyniec PS, Tang YL, Mercer K, Pulver AE, Elston RC (ноябрь 2011 г.). «Анализ связи активности дофамин-β-гидроксилазы плазмы в семьях больных шизофренией». Генетика человека. 130 (5): 635–43. Дои:10.1007 / s00439-011-0989-6. ЧВК 3193571. PMID 21509519.
- ^ Комбаррос О., Надзиратель Д.Р., Хаммонд Н., Кортина-Борха М., Белбин О., Леманн М.Г., Уилкок Г.К., Браун К., Кехо П.Г., Барбер Р., Кото Е., Альварес В., Делукас П., Гвиллиам Р., Хойн Р., Кёльш Х, Матео И., Улхадж А., Ариас-Васкес А., Шур М., Аульченко Ю.С., Икрам М.А., Бретелер М.М., ван Дуйн С.М., Морган К., Смит А.Д., Леманн Д.Д. (2010). «Полиморфизм дофамин-β-гидроксилазы -1021C / T связан с риском болезни Альцгеймера в проекте« Эпистаз »». BMC Medical Genetics. 11 (161): 162. Дои:10.1186/1471-2350-11-162. ЧВК 2994840. PMID 21070631.
- ^ а б Пунчаичира Т.Дж., Мукхопадхьяй А., Кукшал П., Бхатия Т., Дешпанде С.Н., Тельма Б.К. (2020). «Связь регуляторных вариантов дофамин-β-гидроксилазы с познавательной способностью и поздней дискинезией у лиц с шизофренией». Журнал психофармакологии. 34 (3): 358–369. Дои:10.1177/0269881119895539. ЧВК 7150076. PMID 31913053.
- ^ а б Капур А, Шандиля М, Кунду С (2011). «Структурное понимание дофамин-β-гидроксилазы, лекарственной мишени для сложных признаков, и функциональное значение экзонных однонуклеотидных полиморфизмов». PLOS ONE. 6 (10): e26509. Bibcode:2011PLoSO ... 626509K. Дои:10.1371 / journal.pone.0026509. ЧВК 3197665. PMID 22028891.
- ^ Vendelboe TV, Харрис П., Чжао Ю., Уолтер Т.С., Харлос К., Омари К.Э., Кристенсен Х.М. (2016). «Кристаллическая структура дофамин-β-гидроксилазы человека с разрешением 2,9 Å». Достижения науки. 2 (4): e1500980. Bibcode:2016SciA .... 2E0980V. Дои:10.1126 / sciadv.1500980. ЧВК 4846438. PMID 27152332.
- ^ Селвуд Т., Джаффе Е.К. (март 2012 г.). «Динамические диссоциирующие гомоолигомеры и контроль функции белка». Архивы биохимии и биофизики. 519 (2): 131–43. Дои:10.1016 / j.abb.2011.11.020. ЧВК 3298769. PMID 22182754.
- ^ Goldstein M, Anagnoste B, Lauber E, Mckeregham MR (июль 1964). «Ингибирование дофамин-β-гидроксилазы дисульфирамом». Науки о жизни. 3 (7): 763–7. Дои:10.1016/0024-3205(64)90031-1. PMID 14203977.
- ^ Гольдштейн М., Лаубер Э., Маккреган М.Р. (июль 1964 г.). «Ингибирование дофамин-β-гидроксилазы трополоном и другими хелатирующими агентами». Биохимическая фармакология. 13 (7): 1103–6. Дои:10.1016/0006-2952(64)90109-1. PMID 14201135.
- ^ Стэнли В.К., Ли Б., Бонхаус Д.В., Джонсон Л.Г., Ли К., Портер С., Уокер К., Мартинес Г., Эглен Р.М., Уайтинг Р.Л., Хегде СС (август 1997 г.). «Катехоламиновые модулирующие эффекты непикастата (RS-25560-197), нового, мощного и селективного ингибитора дофамин-бета-гидроксилазы». Британский журнал фармакологии. 121 (8): 1803–9. Дои:10.1038 / sj.bjp.0701315. ЧВК 1564872. PMID 9283721.
- ^ Townes S, Titone C, Rosenberg RC (февраль 1990 г.). «Ингибирование дофамин-бета-гидроксилазы бидентатными хелатирующими агентами». Biochimica et Biophysica Acta (BBA) - Структура белка и молекулярная энзимология. 1037 (2): 240–7. Дои:10.1016 / 0167-4838 (90) 90174-Е. PMID 2306475.
дальнейшее чтение
- Фридман С., Кауфман С. (декабрь 1965 г.). «3,4-дигидроксифенилэтиламин бета-гидроксилаза. Физические свойства, содержание меди и роль меди в каталитической активности». Журнал биологической химии. 240 (12): 4763–73. PMID 5846992.
- Левин Э.Ю., Левенберг Б, Кауфман С (1960). «Ферментативное превращение 3,4-дигидроксифенилэтиламина в норэпинефрин». J. Biol. Chem. 235: 2080–2086. PMID 14416204.
внешняя ссылка
- GeneReviews / NIH / NCBI / UW запись о дефиците дофамин-бета-гидроксилазы
- Допамин + бета-гидроксилаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)




