Высокоэффективная жидкостная хроматография - High-performance liquid chromatography
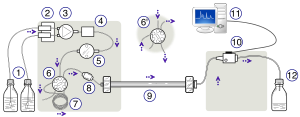
 ВЭЖХ. Слева направо: насосное устройство, создающее градиент двух разных растворителей: колонка, усиленная сталью, и детектор для измерения оптической плотности. | |
| Акроним | ВЭЖХ |
|---|---|
| Классификация | Хроматография |
| Аналиты | Органические молекулы биомолекулы ионы полимеры |
| Другие техники | |
| Связанный | Хроматография Водная нормально-фазовая хроматография Хроматография гидрофильного взаимодействия Ионообменная хроматография Эксклюзионная хроматография Мицеллярная жидкостная хроматография |
| С переносом | Жидкостная хроматография-масс-спектрометрия |

Высокоэффективная жидкостная хроматография (ВЭЖХ), ранее называвшаяся жидкостная хроматография высокого давления, это техника в аналитическая химия используется для разделения, идентификации и количественного определения каждого компонента в смеси. Он полагается на насосы, пропускающие жидкость под давлением. растворитель содержащий образец смеси через колонку, заполненную твердым адсорбирующий материал. Каждый компонент в образце немного по-разному взаимодействует с адсорбирующим материалом, вызывая разную скорость потока для разных компонентов и приводя к разделению компонентов по мере их выхода из колонки.
ВЭЖХ был использован для изготовления (например, в процессе производства фармацевтических и биологических продуктов), юридические (например, обнаружение в моче препаратов для повышения работоспособности), исследования (например, отделяющие друг от друга компоненты сложного биологического образца или аналогичных синтетических химикатов) и медицинские (например, определение уровня витамина D в сыворотке крови) целей.[1]
Хроматография можно описать как массообмен процесс с участием адсорбция. В ВЭЖХ используются насосы для пропускания жидкости под давлением и смеси пробы через колонку, заполненную адсорбентом, что приводит к разделению компонентов пробы. Активный компонент колонки, адсорбент, обычно представляет собой гранулированный материал, состоящий из твердых частиц (например, кремнезем, полимеры и др.) размером 2–50 мкм. Компоненты смеси образцов отделены друг от друга из-за разной степени взаимодействия с частицами адсорбента. Жидкость под давлением обычно представляет собой смесь растворителей (например, вода, ацетонитрил и / или метанол) и называется «подвижной фазой». Его состав и температура играют важную роль в процессе разделения, влияя на взаимодействия, происходящие между компонентами пробы и адсорбентом. Эти взаимодействия имеют физическую природу, такие как гидрофобные (дисперсионные), диполь-дипольные и ионные, чаще всего их сочетание.
ВЭЖХ отличается от традиционной («низкое давление») жидкостная хроматография поскольку рабочее давление значительно выше (50–350 бар), в то время как обычная жидкостная хроматография обычно полагается на силу тяжести для прохождения подвижной фазы через колонку. Из-за небольшого количества образца, отделяемого при аналитической ВЭЖХ, типичные размеры колонки составляют 2,1–4,6 мм в диаметре и 30–250 мм в длину. Также колонки для ВЭЖХ изготавливаются с более мелкими частицами адсорбента (средний размер частиц 2–50 мкм). Это дает ВЭЖХ превосходную разрешающую способность (способность различать соединения) при разделении смесей, что делает ее популярным методом хроматографии.
Схема прибора для ВЭЖХ обычно включает дегазатор, пробоотборник, насосы и детектор. Пробоотборник переносит смесь образцов в поток подвижной фазы, который переносит ее в колонку. Насосы подают через колонку желаемый поток и состав подвижной фазы. Детектор генерирует сигнал, пропорциональный количеству компонента пробы, выходящего из колонки, что позволяет количественный анализ компонентов пробы. Цифровой микропроцессор и программное обеспечение пользователя управляет прибором HPLC и обеспечивает анализ данных. Некоторые модели механических насосов в приборе для ВЭЖХ могут смешивать несколько растворителей вместе в пропорциях, изменяющихся во времени, с образованием композиции. градиент в мобильной фазе. Широко используются различные детекторы, такие как УФ / видимый, фотодиод массив (КПК) или на основе масс-спектрометрии. Большинство приборов для ВЭЖХ также имеют термостат колонок, который позволяет регулировать температуру, при которой выполняется разделение.
Операция
Смесь проб, которую необходимо разделить и проанализировать, вводят в дискретном небольшом объеме (обычно в микролитрах) в поток подвижной фазы, просачивающейся через колонку. Компоненты образца движутся через колонку с разными скоростями, которые зависят от конкретных физических взаимодействий с адсорбентом (также называемого стационарной фазой). Скорость каждого компонента зависит от его химической природы, от природы неподвижной фазы (колонки) и от состава подвижной фазы. Время, в которое конкретный аналит элюируется (выходит из колонки), называется временем его удерживания. Время удерживания, измеренное при определенных условиях, является отличительной характеристикой данного аналита.
Доступно множество различных типов колонок, заполненных адсорбентами, различающимися по размеру частиц и характеру их поверхности («химия поверхности»). Использование упаковочных материалов меньшего размера требует использования более высокого рабочего давления («противодавления») и обычно улучшает хроматографические характеристики. разрешающая способность (степень разделения пиков между последовательными аналитами, выходящими из колонки). Частицы сорбента могут быть гидрофобными или полярными по природе.
Обычно используемые подвижные фазы включают любую смешиваемую комбинацию воды с различными органическими растворителями (наиболее распространены ацетонитрил и метанол ). В некоторых методах ВЭЖХ используются безводные подвижные фазы (см. нормально-фазовая хроматография ниже). Водный компонент подвижной фазы может содержать кислоты (такие как муравьиная, фосфорная или трифторуксусная кислота ) или соли, чтобы помочь в разделении компонентов пробы. Состав подвижной фазы может поддерживаться постоянным («режим изократического элюирования») или изменяться («режим градиентного элюирования») во время хроматографического анализа. Изократическое элюирование обычно эффективно для разделения компонентов пробы, которые сильно различаются по сродству к неподвижной фазе. При градиентном элюировании состав подвижной фазы обычно изменяется от низкой до высокой элюирующей силы. Сила элюирования подвижной фазы отражается временем удерживания аналита с высокой силой элюирования, обеспечивающей быстрое элюирование (= короткое время удерживания). Типичный профиль градиента в обращенно-фазовой хроматографии может начинаться с 5% ацетонитрила (в воде или водном буфере) и линейно прогрессировать до 95% ацетонитрила в течение 5–25 минут. Периоды постоянного состава подвижной фазы могут быть частью любого профиля градиента. Например, состав подвижной фазы может поддерживаться постоянным при 5% ацетонитриле в течение 1–3 мин с последующим линейным изменением до 95% ацетонитрила.

Выбранный состав подвижной фазы (также называемой элюентом) зависит от интенсивности взаимодействий между различными компонентами образца («аналитами») и неподвижной фазой (например, гидрофобные взаимодействия в обращенно-фазовой ВЭЖХ). В зависимости от их сродства к неподвижной и подвижной фазам аналиты распределяются между ними во время процесса разделения, происходящего в колонке. Этот процесс разделения аналогичен тому, который происходит во время жидкость – жидкостная экстракция но непрерывно, а не пошагово. В этом примере при использовании градиента вода / ацетонитрил будет больше гидрофобных компонентов. элюировать (выходят из колонки) поздно, когда подвижная фаза станет более концентрированной в ацетонитриле (т.е., в подвижной фазе с более высокой элюирующей способностью).
Выбор компонентов подвижной фазы, добавок (таких как соли или кислоты) и условий градиента зависит от природы компонентов колонки и пробы. Часто с пробой проводится серия пробных прогонов, чтобы найти метод ВЭЖХ, который дает адекватное разделение.
История и развитие
До ВЭЖХ ученые использовали стандартные методы жидкостной хроматографии. Системы жидкостной хроматографии были в значительной степени неэффективными из-за расхода растворители будучи зависимым от силы тяжести. Разделение занимало много часов, а иногда и дней. Газовая хроматография (GC) в то время был сильнее, чем жидкостная хроматография (ЖХ), однако считалось, что газофазное разделение и анализ очень полярных высокомолекулярных биополимеры было невозможно.[3] ГХ был неэффективен для многих биохимиков из-за термической нестабильности растворенных веществ.[4] В результате были выдвинуты гипотезы об альтернативных методах, которые вскоре приведут к развитию ВЭЖХ.
Следуя основополагающей работе Мартина и Синджа в 1941 году, в 1960-х годах Кэлом Гиддингсом, Йозефом Хубером и другими было предсказано, что ЖХ может работать в высокоэффективном режиме за счет уменьшения диаметра частиц упаковки, существенно ниже типичного ЖХ. (и GC) на уровне 150 мкм и с использованием давления для увеличения скорости подвижной фазы.[3] Эти прогнозы подверглись обширным экспериментам и уточнениям в течение 60–70-х годов. Ранние исследования в области развития позволили улучшить ЖК-частицы, и изобретение Zipax, поверхностно пористой частицы, было многообещающим для технологии ВЭЖХ.[5]
1970-е годы принесли много разработок в области аппаратного и измерительного оборудования. Исследователи начали использовать насосы и инжекторы, чтобы создать элементарную конструкцию системы ВЭЖХ.[6] Насосы газового усилителя были идеальными, потому что они работали при постоянной давление и не требовали герметичных уплотнений или обратных клапанов для стабильного потока и хорошего количественного определения.[4] В Dupont IPD (подразделение промышленных полимеров) были достигнуты вехи в области аппаратного обеспечения, такие как использование градиентного устройства с низким постоянным объемом, а также замена инжектора перегородки на клапан впрыска петли.[4]
Хотя инструментальные разработки были важны, история ВЭЖХ в первую очередь связана с историей и эволюцией технология частиц.[4] После введения частиц пористого слоя наблюдается устойчивая тенденция к уменьшению размера частиц для повышения эффективности.[4] Однако из-за уменьшения размера частиц возникли новые проблемы. Практические недостатки связаны с чрезмерным перепадом давления, необходимым для проталкивания подвижной жидкости через колонну, и трудностью изготовления однородной насадки из чрезвычайно мелких материалов.[7] Каждый раз, когда размер частиц значительно уменьшается, обычно требуется новый цикл разработки прибора, чтобы справиться с давлением.[4]
Типы
Разделительная хроматография

Распределительная хроматография была одним из первых видов хроматографии, разработанных химиками.[8] В Коэффициент распределения принцип был применен в бумажная хроматография, тонкослойная хроматография, газовая фаза и разделение жидкость – жидкость Приложения. 1952 год Нобелевская премия по химии заработал Арчер Джон Портер Мартин и Ричард Лоуренс Миллингтон Синдж за разработку техники, которая использовалась для разделения аминокислоты.[9] В разделительной хроматографии используется остаточный растворитель на поверхности или внутри зерен или волокон «инертной» твердой поддерживающей матрицы, как в случае с бумажная хроматография; или пользуется некоторыми кулоновский и / или донор водорода взаимодействие с неподвижной фазой. Молекулы аналита разделяются между жидкой неподвижной фазой и элюентом. Как и в Хроматография гидрофильного взаимодействия (HILIC; подтехника в рамках ВЭЖХ), этот метод разделяет аналиты на основе различий в их полярности. HILIC чаще всего использует склеенные полярные стационарная фаза и подвижная фаза, сделанная в основном из ацетонитрил с водой в качестве сильного компонента. Разделительная ВЭЖХ исторически использовалась на несвязанных подложках из диоксида кремния или оксида алюминия. Каждый из них эффективен для разделения аналитов по относительной полярности. Фазы, связанные HILIC, имеют преимущество разделения кислый, основной и нейтральные растворенные вещества за один хроматографический цикл.[10]
Полярные аналиты диффундируют в стационарный водный слой, связанный с полярной стационарной фазой, и таким образом удерживаются. Чем сильнее взаимодействия между полярным аналитом и полярной стационарной фазой (по сравнению с подвижной фазой), тем больше время элюирования. Сила взаимодействия зависит от функциональных групп, входящих в молекулярную структуру аналита, с более поляризованными группами (например, гидроксил-) и группы, способные образовывать водородные связи, вызывая большее удерживание. Кулоновский (электростатические) взаимодействия также могут увеличить удержание. Использование более полярных растворителей в подвижной фазе уменьшит время удерживания аналитов, тогда как более гидрофобные растворители имеют тенденцию к увеличению времени удерживания.
Нормально-фазовая хроматография
Нормально-фазовая хроматография была одним из первых видов ВЭЖХ, разработанных химиками. Также известный как ВЭЖХ с нормальной фазой (NP-HPLC), этот метод разделяет аналиты на основе их сродства к полярной неподвижной поверхности, такой как диоксид кремния, следовательно, он основан на способности аналита участвовать в полярных взаимодействиях (например, водородная связь или диполь-диполь тип взаимодействия) с поверхностью сорбента. NP-HPLC использует неполярную неводную подвижную фазу (например, Хлороформ ), и эффективно работает для разделения аналитов, легко растворимых в неполярных растворителях. Аналит связывается с полярной стационарной фазой и удерживается в ней. Адсорбционная сила увеличивается с увеличением полярности аналита. Сила взаимодействия зависит не только от функциональных групп, присутствующих в структуре молекулы аналита, но и от стерические факторы. Влияние стерических препятствий на силу взаимодействия позволяет этому методу разрешить (разделить) структурные изомеры.
Использование более полярных растворителей в подвижной фазе увеличивает время удерживания аналитов, тогда как более гидрофобные растворители имеют тенденцию вызывать более быстрое элюирование (уменьшенное время удерживания). Очень полярные растворители, такие как следы воды в подвижной фазе, имеют тенденцию адсорбироваться на твердой поверхности неподвижной фазы, образуя стационарный связанный (водный) слой, который, как считается, играет активную роль в удерживании. Такое поведение в некоторой степени характерно для нормально-фазовой хроматографии, потому что оно регулируется почти исключительно адсорбционным механизмом (т.е., аналиты взаимодействуют с твердой поверхностью, а не с сольватированным слоем лиганда, прикрепленным к поверхности сорбента; см. также обращенно-фазовую ВЭЖХ ниже). Адсорбционная хроматография по-прежнему широко используется для разделения структурных изомеров как в колоночной, так и в тонкослойной хроматографии на активированных (высушенных) носителях из диоксида кремния или оксида алюминия.
Разделение и NP-HPLC вышли из моды в 1970-х годах с развитием обращенно-фазовый ВЭЖХ из-за плохой воспроизводимости времен удерживания из-за наличия слоя воды или протонного органического растворителя на поверхности диоксида кремния или глинозем хроматографические среды. Этот слой изменяется при любых изменениях состава подвижной фазы (например, уровень влажности), вызывая дрейф времени удерживания.
В последнее время распределительная хроматография снова стала популярной с развитием Hilic связанные фазы, которые демонстрируют улучшенную воспроизводимость и благодаря лучшему пониманию диапазона применимости метода.
Вытесняющая хроматография
Основной принцип вытесняющая хроматография это: молекула с высоким сродством к матрице хроматографии (вытеснитель) будет эффективно конкурировать за сайты связывания и, таким образом, вытесняет все молекулы с меньшим сродством.[11]Между вытеснительной и элюционной хроматографией есть явные различия. В режиме элюирования вещества обычно выходят из колонки в виде узких гауссовых пиков. Для достижения максимальной очистки желательно широкое разделение пиков, предпочтительно до базовой линии. Скорость, с которой любой компонент смеси перемещается по колонке в режиме элюирования, зависит от многих факторов. Но для того, чтобы два вещества перемещались с разной скоростью и, таким образом, растворялись, должны быть существенные различия во взаимодействии между биомолекулами и хроматографической матрицей. Рабочие параметры регулируются для максимального эффекта от этой разницы. Во многих случаях разделение пиков по базовой линии может быть достигнуто только при градиентном элюировании и низкой загрузке колонки. Таким образом, двумя недостатками хроматографии в режиме элюирования, особенно в препаративном масштабе, являются операционная сложность из-за градиентной откачки растворителя и низкая производительность из-за низкой загрузки колонки. Вытеснительная хроматография имеет преимущества перед элюционной хроматографией в том, что компоненты разделяются на последовательные зоны чистых веществ, а не на «пики». Поскольку в процессе используется нелинейность изотерм, более крупное сырье для колонки может быть разделено на данной колонке с очищенными компонентами, извлеченными при значительно более высокой концентрации.
Обращенно-фазовая хроматография (RPC)

ВЭЖХ с обращенной фазой (ОФ-ВЭЖХ) имеет неполярную неподвижную фазу и водную умеренно полярную подвижную фазу. Одной из распространенных неподвижных фаз является кремнезем, поверхность которого модифицирована RMe.2SiCl, где R представляет собой алкильную группу с прямой цепью, такую как C18ЧАС37 или C8ЧАС17. С такими стационарными фазами время удерживания для менее полярных молекул больше, в то время как полярные молекулы элюируются легче (на ранних этапах анализа). Исследователь может увеличить время удерживания, добавив больше воды в подвижную фазу; тем самым повышая сродство гидрофобного аналита к гидрофобной неподвижной фазе по сравнению с теперь более гидрофильной подвижной фазой. Точно так же исследователь может уменьшить время удерживания, добавив к элюенту больше органического растворителя. ОФ-ВЭЖХ настолько широко используется, что ее часто неправильно называют «ВЭЖХ» без дополнительных указаний. Фармацевтическая промышленность регулярно использует RP-HPLC для проверки лекарств перед их выпуском.
ОФ-ВЭЖХ работает по принципу гидрофобных взаимодействий, который проистекает из высокой симметрии диполярной структуры воды и играет важнейшую роль во всех процессах в науке о жизни. ОФ-ВЭЖХ позволяет измерять эти взаимодействующие силы. Связывание аналита с неподвижной фазой пропорционально площади контактной поверхности вокруг неполярного сегмента молекулы аналита при ассоциации с лигандом на неподвижной фазе. Эта сольвофобный В этом эффекте преобладает сила воды для «уменьшения полости» вокруг анализируемого вещества и C18-цепь против их комплекса. Энергия, выделяемая в этом процессе, пропорциональна поверхностное натяжение элюента (вода: 7,3×10−6 J / см², метанол: 2,2×10−6 Дж / см²) и к гидрофобной поверхности анализируемого вещества и лиганда соответственно. Удерживание можно уменьшить, добавив менее полярный растворитель (метанол, ацетонитрил ) в подвижную фазу, чтобы уменьшить поверхностное натяжение воды. Градиентное элюирование использует этот эффект, автоматически снижая полярность и поверхностное натяжение водной подвижной фазы в ходе анализа.
Структурные свойства молекулы аналита играют важную роль в ее удерживающих характеристиках. Как правило, аналит с большей площадью гидрофобной поверхности (C – H, C – C и, как правило, неполярными атомными связями, такими как S-S и др.) Сохраняется дольше, поскольку не взаимодействует со структурой воды. С другой стороны, аналиты с более высокой полярной площадью поверхности (обусловленной наличием полярных групп, таких как -OH, -NH2, COO− или -NH3+ в своей структуре) сохраняются в меньшей степени, поскольку лучше интегрируются в воду. Такие взаимодействия подвержены стерическим эффектам, поскольку очень большие молекулы могут иметь только ограниченный доступ к порам неподвижной фазы, где происходят взаимодействия с поверхностными лигандами (алкильными цепями). Такое поверхностное препятствие обычно приводит к меньшему удержанию.
Время удерживания увеличивается с увеличением гидрофобной (неполярной) площади поверхности. Соединения с разветвленной цепью элюируются быстрее, чем их соответствующие линейные изомеры, потому что общая площадь поверхности уменьшается. Точно так же органические соединения с одинарными связями C – C элюируются позже, чем соединения с тройной связью C = C или C – C, поскольку двойная или тройная связь короче одинарной связи C – C.
Помимо поверхностного натяжения подвижной фазы (организационная сила в структуре элюента), другие модификаторы подвижной фазы могут влиять на удерживание аналита. Например, добавление неорганических солей вызывает умеренное линейное увеличение поверхностного натяжения водных растворов (примерно 1,5×10−7 Дж / см² на моль для NaCl, 2,5×10−7 Дж / см² на моль для (NH4)2ТАК4), и потому что энтропия границы раздела анализируемое вещество-растворитель контролируется поверхностным натяжением, добавление солей приводит к увеличению времени удерживания. Этот метод используется для мягкого разделения и выделения белков и защиты их биологической активности при анализе белков (хроматография гидрофобного взаимодействия, HIC).
Еще один важный фактор - подвижная фаза. pH поскольку он может изменить гидрофобный характер аналита. По этой причине в большинстве методов используется буферный агент, такие как фосфат натрия, чтобы контролировать pH. Буферы служат нескольким целям: контролируют pH, нейтрализуют заряд на поверхности диоксида кремния неподвижной фазы и действуют как ионные пары для нейтрализации заряда аналита. Формиат аммония обычно добавляется в масс-спектрометрию для улучшения обнаружения определенных аналитов путем образования аналита-аммония. аддукты. Летучая органическая кислота, такая как уксусная кислота, или чаще всего Муравьиная кислота, часто добавляется к подвижной фазе, если масс-спектрометрия используется для анализа элюента колонки. Трифторуксусная кислота нечасто используется в масс-спектрометрии из-за его стойкости в детекторе и системе доставки растворителя, но может быть эффективным для улучшения удерживания аналитов, таких как карбоновые кислоты в приложениях, использующих другие детекторы, поскольку это довольно сильная органическая кислота. Действие кислот и буферов зависит от области применения, но обычно улучшает хроматографическое разрешение.
Колонки с обращенной фазой довольно сложно повредить по сравнению с колонками с обычным кремнеземом; однако многие обращенно-фазовые колонны состоят из частиц диоксида кремния, дериватизированного алкилом, и должны никогда использоваться с водным базы поскольку они разрушают лежащую под ним частицу кремнезема. Их можно использовать с водной кислотой, но колонка не должна подвергаться воздействию кислоты слишком долго, поскольку это может вызвать коррозию металлических частей оборудования для ВЭЖХ. После использования колонки для ОФ-ВЭЖХ следует промыть чистым растворителем для удаления остаточных кислот или буферов и хранить в соответствующем составе растворителя. Содержание металла в колонках для ВЭЖХ необходимо поддерживать на низком уровне, чтобы сохранить наилучшую возможную способность разделять вещества. Хорошим тестом на содержание металла в колонке является введение пробы, которая смесь 2,2'- и 4,4'-бипиридин. Поскольку 2,2'-бипи может хелат металла форма пика для 2,2'-бипы будет искажена (хвостатая) при металл ионы присутствуют на поверхности кремнезем.[нужна цитата ]..
Эксклюзионная хроматография
Эксклюзионная хроматография (SEC), также известная как гель-проникающая хроматография или гель-фильтрационная хроматография, разделяет частицы по размеру молекулы (фактически по Радиус Стокса ). Как правило, это хроматография с низким разрешением, и поэтому ее часто оставляют для заключительного, «полирующего» этапа очистки. Это также полезно для определения третичная структура и четвертичная структура очищенных белков. SEC используется в первую очередь для анализа больших молекул, таких как белки или полимеры. SEC работает, улавливая эти более мелкие молекулы в порах частицы. Более крупные молекулы просто проходят через поры, поскольку они слишком велики, чтобы попасть в поры. Следовательно, молекулы большего размера проходят через колонку быстрее, чем молекулы меньшего размера, то есть чем меньше молекула, тем больше время удерживания.
Этот метод широко используется для определения молекулярной массы полисахаридов. SEC - это официальный метод (предложенный Европейской фармакопеей) для сравнения молекулярной массы различных коммерчески доступных низкомолекулярных веществ. гепарины.
Ионообменная хроматография
В ионообменной хроматографии (IC) удерживание основано на притяжении растворенных ионов и заряженных участков, связанных с неподвижной фазой. Ионы растворенного вещества с тем же зарядом, что и заряженные участки на колонке, исключаются из связывания, в то время как ионы растворенного вещества с зарядом, противоположным заряду заряженных участков колонки, остаются на колонке. Ионы растворенного вещества, которые задерживаются на колонке, можно элюировать из колонки, изменив условия растворителя (например, увеличивая ионный эффект системы растворителей за счет увеличения концентрации соли в растворе, увеличения температуры колонки, изменения pH растворителя и т. д.).
Типы ионообменников включают полистирольные смолы, целлюлозу и декстран ионообменники (гели) и стекло с контролируемыми порами или пористый диоксид кремния. Полистирольные смолы допускают поперечные связи, что увеличивает стабильность цепи. Более высокая степень сшивки снижает отклонение, что увеличивает время уравновешивания и, в конечном итоге, улучшает селективность. Ионообменники целлюлозы и декстрана обладают большими размерами пор и низкой плотностью заряда, что делает их пригодными для разделения белков.
Как правило, ионообменники способствуют связыванию ионов с более высоким зарядом и меньшим радиусом.
Увеличение противоион (по отношению к функциональным группам в смолах) концентрация снижает время удерживания. Снижение pH уменьшает время удерживания при катионообмене, тогда как увеличение pH уменьшает время удерживания при анионном обмене. Путем понижения pH растворителя в катионообменной колонке, например, становится доступным больше ионов водорода, которые конкурируют за позиции на анионной неподвижной фазе, тем самым элюируя слабосвязанные катионы.
Эта форма хроматографии широко используется в следующих областях: очистка воды, концентрирование микрокомпонентов, лиганд-обменная хроматография, ионообменная хроматография белков, высокие значения pH. анионообменная хроматография углеводов и олигосахаридов и другие.
Биоаффинная хроматография
Этот хроматографический процесс основан на свойстве биологически активных веществ образовывать стабильные, специфические и обратимые комплексы. В образовании этих комплексов участвуют общие молекулярные силы, такие как Взаимодействие Ван-дер-Ваальса, электростатическое взаимодействие, диполь-дипольное взаимодействие, гидрофобное взаимодействие и водородная связь. Эффективная биоспецифическая связь образуется одновременным и согласованным действием нескольких из этих сил в комплементарных сайтах связывания.
Водная нормально-фазовая хроматография
Водная нормально-фазовая хроматография (ANP) представляет собой хроматографический метод, который охватывает область подвижной фазы между обращенно-фазовой хроматографией (RP) и органической нормальной фазовой хроматографией (ONP). Этот метод используется для достижения уникальной селективности по гидрофильным соединениям, демонстрируя нормальную фазу элюирования с использованием обращенно-фазовых растворителей.[нужна цитата ]Заявки на ANP
Изократическое и градиентное элюирование

Разделение, в котором Мобильная фаза состав остается постоянным на протяжении всей процедуры называется изократический (смысл постоянный состав). (Например, процентное содержание метанола на протяжении всей процедуры будет оставаться постоянным, т.е. 10%). Это слово было придумано Чаба Хорват который был одним из пионеров ВЭЖХ.[нужна цитата ],
Состав подвижной фазы не обязательно должен оставаться постоянным. Разделение, при котором состав подвижной фазы изменяется в процессе разделения, описывается как градиентное элюирование.[12] Один из примеров - градиент от 10%. метанол и заканчивая 90% метанолом через 20 минут. Два компонента подвижной фазы обычно называют «А» и «В»; А «слабый» растворитель, который позволяет растворенному веществу элюироваться очень медленно, в то время как B представляет собой «сильный» растворитель, который быстро элюирует растворенные вещества из колонки. В обращенно-фазовая хроматография, растворитель А часто вода или водный буфер, в то время как B органический растворитель, смешивающийся с водой, такой как ацетонитрил, метанол, THF, или изопропанол.
При изократическом элюировании ширина пика увеличивается с увеличением времени удерживания линейно в соответствии с уравнением для N, числа теоретических тарелок. Это приводит к тому недостатку, что пики с поздним элюированием становятся очень плоскими и широкими. Их форма и ширина могут помешать их распознаванию как вершины.

Градиентное элюирование снижает удерживание компонентов, элюируемых позже, так что они элюируются быстрее, давая более узкие (и более высокие) пики для большинства компонентов. Это также улучшает форму пика для хвостовых пиков, так как возрастающая концентрация органического элюента смещает хвостовую часть пика вперед. Это также увеличивает высоту пика (пик выглядит «острее»), что важно при анализе следа. Программа градиента может включать внезапное «ступенчатое» увеличение процентного содержания органического компонента или разные наклоны в разное время - все в соответствии с желанием оптимального разделения за минимальное время.
При изократическом элюировании селективность не меняется при изменении размеров колонки (длины и внутреннего диаметра), то есть пики элюируются в том же порядке. При градиентном элюировании порядок элюирования может изменяться при изменении размеров или скорости потока.[нужна цитата ]
Движущая сила в обращенно-фазовой хроматографии возникает в высшем порядке структуры воды. Роль органический компонент подвижной фазы заключается в уменьшении этого высокого порядка и, следовательно, снизить замедляющую способность водного компонента.
Параметры
Теоретическая
Разделение ВЭЖХ имеет теоретические параметры и уравнения для описания разделения компонентов на пики сигнала при обнаружении с помощью таких приборов, как УФ-детектор или масс-спектрометр. Параметры в основном получены из двух наборов хроматографической теории: теории пластин (как часть Разделительная хроматография ) и скоростной теории хроматографии / Уравнение Ван Деемтера. Конечно, они могут быть реализованы на практике путем анализа хроматограмм ВЭЖХ, хотя теория скорости считается более точной теорией.
Они аналогичны расчету коэффициент удержания для бумажная хроматография разделение, но описывает, насколько хорошо ВЭЖХ разделяет смесь на два или более компонентов, которые обнаруживаются в виде пиков (полос) на хроматограмме. Параметрами ВЭЖХ являются: коэффициент полезного действия (N), коэффициент удерживания (простое каппа) и коэффициент разделения (альфа). Вместе факторы являются переменными в уравнении разрешения, которое описывает, насколько хорошо пики двух компонентов разделены или перекрывают друг друга. Эти параметры в основном используются только для описания ВЭЖХ обращенно-фазового разделения и ВЭЖХ нормально-фазового разделения, так как эти разделения имеют тенденцию быть более тонкими, чем другие режимы ВЭЖХ (например, ионный обмен и исключение размеров).
Пустой объем - это объем места в колонке, занятой растворителем. Это пространство внутри колонки, которое находится за пределами внутреннего набивочного материала колонки. Объем пустот измеряется на хроматограмме по обнаруженному пику первого компонента, которым обычно является растворитель, присутствующий в смеси образцов; в идеале растворитель пробы протекает через колонку, не взаимодействуя с колонкой, но все же обнаруживается в отличие от растворителя ВЭЖХ. Объем пустот используется как поправочный коэффициент.
Коэффициент полезного действия (N) практически измеряет, насколько резкими являются пики компонентов на хроматограмме, как отношение площади пиков компонента («время удерживания») к ширине пиков в их самой широкой точке (на базовой линии). Высокие, острые и относительно узкие пики указывают на то, что метод разделения эффективно удалил компонент из смеси; высокая эффективность. Эффективность очень зависит от колонки ВЭЖХ и используемого метода ВЭЖХ. Фактор эффективности является синонимом номера тарелки и «количества теоретических тарелок».
Фактор удержания (каппа прайм) измеряет, как долго компонент смеси прилипает к колонке, измеряется по площади под кривой его пика на хроматограмме (поскольку хроматограммы ВЭЖХ являются функцией времени). Каждый пик на хроматограмме будет иметь свой коэффициент удерживания (например, каппа1 для фактора удерживания первого пика). Этот фактор может быть скорректирован за счет пустого объема колонки.
Коэффициент разделения (альфа) представляет собой относительное сравнение того, насколько хорошо были разделены два соседних компонента смеси (т.е., две соседние полосы на хроматограмме). Этот коэффициент определяется как отношение коэффициентов удерживания пары соседних пиков хроматограммы, и его также можно скорректировать с помощью пустого объема колонки. Чем больше значение коэффициента разделения превышает 1,0, тем лучше разделение, примерно до 2,0, при превышении которого метод ВЭЖХ, вероятно, не потребуется для разделения. Уравнения разрешения связывают три фактора, так что высокая эффективность и коэффициенты разделения улучшают разрешение пиков компонентов в разделение ВЭЖХ.
Внутренний диаметр

Внутренний диаметр (ID) колонки для ВЭЖХ является важным параметром, который влияет на чувствительность обнаружения и селективность разделения при градиентном элюировании. Он также определяет количество аналита, которое может быть загружено в колонку. Колонки большего размера обычно используются в промышленных приложениях, таких как очистка лекарственного препарата для последующего использования. Колонки с низким ID обладают повышенной чувствительностью и меньшим расходом растворителя за счет емкости загрузки.
Колонки с большим внутренним диаметром (более 10 мм) используются для очистки пригодных для использования количеств материала из-за их большой вместимости.
Столбцы аналитического масштаба (4,6 мм) были наиболее распространенным типом столбцов, хотя колонки меньшего размера быстро набирают популярность. Они используются в традиционном количественном анализе образцов и часто используют Детектор поглощения UV-Vis.
Колонки с узким проходом (1–2 мм) используются в тех случаях, когда требуется большая чувствительность либо со специальными УФ-детекторами, флуоресценция обнаружения или с другими методами обнаружения, такими как жидкостная хроматография-масс-спектрометрия
Капиллярные колонки (менее 0,3 мм) используются почти исключительно с альтернативными средствами обнаружения, такими как масс-спектрометрии. Обычно их делают из плавленый кварц капилляры, а не трубки из нержавеющей стали, которые используются в более крупных колонках.
Размер частицы
Наиболее традиционная ВЭЖХ выполняется с неподвижной фазой, прикрепленной к внешней стороне небольшого сферического кремнезем частицы (очень мелкие шарики). Эти частицы бывают самых разных размеров, из которых наиболее распространены шарики 5 мкм. Более мелкие частицы обычно обеспечивают большую площадь поверхности и лучшее разделение, но давление, необходимое для оптимальной линейной скорости, увеличивается на величину, обратную квадрату диаметра частиц.[13][14][15]
Это означает, что переход на частицы вдвое меньшего размера при неизменном размере колонки удвоит производительность, но повысит необходимое давление в четыре раза. Более крупные частицы используются в препаративной ВЭЖХ (диаметры колонок от 5 см до> 30 см) и для применений, не связанных с ВЭЖХ, таких как твердофазная экстракция.
Размер пор
Многие неподвижные фазы являются пористыми, чтобы обеспечить большую площадь поверхности. Маленькие поры обеспечивают большую площадь поверхности, в то время как поры большего размера имеют лучшую кинетику, особенно для более крупных аналитов. Например, белок, размер которого лишь немного меньше размера поры, может попасть в пору, но не может легко покинуть ее внутри. Это зависит от четырех факторов: времени, температуры, отношения твердого вещества к жидкости и концентрации NaOH.
Давление насоса
Насосы различаются по допустимому давлению, но их производительность измеряется по их способности давать постоянный и воспроизводимый объемный расход. Давление может достигать 60 МПа (6000фунт-сила / дюйм2 ), или около 600 атмосфер. Современные системы ВЭЖХ были усовершенствованы для работы при гораздо более высоких давлениях и, следовательно, могут использовать частицы гораздо меньшего размера в колонках (<2 мкм). Эти системы «сверхвысокой жидкостной хроматографии» или УВЭЖХ могут работать при давлении до 120 МПа (17 405 фунтов силы / дюйм.2), или около 1200 атмосфер.[16] Термин «UPLC»[17] является товарным знаком Waters Corporation, но иногда используется для обозначения более общей техники УВЭЖХ.
Детекторы
Детекторы ВЭЖХ делятся на две основные категории: универсальные и селективные. Универсальные детекторы обычно измеряют объемные свойства (например, показатель преломления ) путем измерения разницы физическая собственность между подвижной фазой и подвижной фазой с растворенным веществом, в то время как селективные детекторы измеряют свойство растворенного вещества (например, УФ-видимое поглощение ), просто отвечая на физический или химическое свойство растворенного вещества.[18] ВЭЖХ чаще всего использует Детектор поглощения UV-Vis однако множество других детекторы хроматографии может быть использован. Универсальный детектор, который дополняет определение поглощения в УФ-видимом диапазоне, - это Детектор заряженных аэрозолей (CAD). Тип обычно используемых детекторов включает в себя детекторы показателя преломления, которые выдают показания путем измерения изменений показателя преломления элюента при его движении через проточную ячейку. В некоторых случаях можно использовать несколько детекторов, например ЖХМС Обычно УФ-видимое излучение сочетается с масс-спектрометром.
Автосэмплеры
Большое количество образцов можно автоматически вводить в систему ВЭЖХ с помощью автосэмплеров ВЭЖХ. Кроме того, автосэмплеры для ВЭЖХ имеют одинаковый объем и метод впрыска для каждой инъекции, следовательно, они обеспечивают высокую степень точности объема впрыска.
Приложения
Производство
ВЭЖХ имеет множество применений как в лабораторных, так и в клинических науках. Это распространенный метод, используемый при разработке фармацевтических препаратов, так как это надежный способ получения и обеспечения чистоты продукта.[19] Хотя с помощью ВЭЖХ можно получать продукты исключительно высокого качества (чистые), это не всегда основной метод, используемый при производстве нерасфасованных лекарственных материалов.[20] Согласно европейской фармакопее, ВЭЖХ используется только в 15,5% синтезов.[21] Тем не менее, он играет роль в 44% синтезов в фармакопее США.[22] Возможно, это связано с различиями в денежных и временных ограничениях, поскольку ВЭЖХ в больших масштабах может быть дорогостоящим методом. Повышение специфичности, точности и точности, которое происходит с ВЭЖХ, к сожалению, соответствует увеличению стоимости.
Юридический
Этот метод также используется для обнаружения запрещенных наркотиков в моче. Самый распространенный метод обнаружения наркотиков - иммуноферментный анализ.[23] Этот способ намного удобнее. Однако удобство достигается за счет специфики и охвата широкого спектра лекарств. Поскольку ВЭЖХ является методом определения (и, возможно, повышения) чистоты, использование одной ВЭЖХ для оценки концентраций лекарственных средств несколько недостаточно. При этом ВЭЖХ в этом контексте часто выполняется в сочетании с масс-спектрометрии.[24] Использование жидкостной хроматографии вместо газовой в сочетании с МС позволяет обойтись без необходимости получения производных ацетилирующими или алкилирующими агентами, что может быть обременительным дополнительным этапом.[25] Этот метод использовался для обнаружения различных агентов, таких как допинговые агенты, метаболиты лекарств, конъюгаты глюкуронида, амфетамины, опиоиды, кокаин, BZD, кетамин, LSD, каннабис и пестициды.[26][27] Проведение ВЭЖХ в сочетании с Масс-спектрометрии снижает абсолютную потребность в стандартизации экспериментальных прогонов ВЭЖХ.
Исследование
Подобные анализы можно проводить в исследовательских целях, обнаруживая концентрации потенциальных клинических кандидатов, таких как противогрибковые препараты и лекарства от астмы.[28] Очевидно, что этот метод полезен при наблюдении нескольких видов в собранных образцах, но требует использования стандартных решений при поиске информации об идентичности видов. Он используется как метод подтверждения результатов реакций синтеза, так как чистота имеет важное значение в исследованиях этого типа. Однако масс-спектрометрия по-прежнему является более надежным способом идентификации видов.
Медицинское
Медицинское использование ВЭЖХ может включать анализ лекарств, но больше подпадает под категорию анализа питательных веществ. В то время как моча является наиболее распространенной средой для анализа концентраций лекарств, сыворотка крови - это образец, собираемый для большинства медицинских анализов с помощью ВЭЖХ.[29] Другие методы обнаружения молекул, которые можно использовать для клинических исследований, были протестированы с помощью ВЭЖХ, а именно иммуноанализы. В одном из примеров этого тесты конкурентного связывания белков (CPBA) и ВЭЖХ сравнивали на чувствительность при обнаружении витамина D. Было обнаружено, что чувствительность и специфичность этого CPBA полезны для диагностики дефицита витамина D у детей только 40% и 60%. % соответственно от емкости ВЭЖХ.[30] Хотя ВЭЖХ является дорогостоящим инструментом, точность его почти не имеет себе равных.
Смотрите также
- История хроматографии
- Капиллярная электрохроматография
- Колоночная хроматография
- Чаба Хорват
- Ионная хроматография
- Мицеллярная жидкостная хроматография
использованная литература
- ^ Гербер, Ф .; Krummen, M .; Potgeter, H .; Roth, A .; Siffrin, C .; Спендлин, К. (2004). «Практические аспекты быстрой обращенно-фазовой высокоэффективной жидкостной хроматографии с использованием колонок с насадкой 3 мкм и монолитных колонок в фармацевтических разработках и производстве, работающих в соответствии с современной надлежащей производственной практикой». Журнал хроматографии А. 1036 (2): 127–133. Дои:10.1016 / j.chroma.2004.02.056. PMID 15146913.
- ^ Морган, Дэвид Дж. (19 ноября 2003 г.). «Сборщик фракций (сообщение на Flickr)». Flickr. Получено 28 октября 2015.
- ^ а б Каргер, Барри Л. (1997). «ВЭЖХ: ранние и недавние перспективы». Журнал химического образования. 74 (1): 45. Bibcode:1997JChEd..74 ... 45K. Дои:10.1021 / ed074p45.
- ^ а б c d е ж Генри, Ричард А. (1 февраля, 2009 г.) «Первые дни ВЭЖХ в Dupont». Хроматография онлайн. Avanstar Communications Inc.
- ^ Илер, Р.К. (1979) Химия кремнезема. Джон Вили и сыновья. Нью-Йорк.
- ^ Karger, B.L .; Берри, Л. В. (1971). «Быстрое жидкостно-хроматографическое разделение стероидов на колонках, сильно загруженных неподвижной фазой». Clin. Chem. 17 (8): 757–64. PMID 4254537.
- ^ Гиддингс, Дж. Кальвин (1965) Динамика хроматографии, Часть I. Принципы и теория.. Марсель Деккер, Инк., Нью-Йорк. п. 281.
- ^ Эттре, К. (2001). "Вехи в хроматографии: рождение разделенной хроматографии" (PDF). LCGC. 19 (5): 506–512. Получено 2016-02-26.
- ^ Мартин, А. Дж. П.; Synge, Р. Л. М. (1941). «Разделение высших моноаминокислот противоточной жидкостно-жидкостной экстракцией: аминокислотный состав шерсти». Биохимический журнал. 35 (1–2): 91–121. Дои:10.1042 / bj0350091. ЧВК 1265473. PMID 16747393.
- ^ Lindsay, S .; Кили, Д. (1987). Высокоэффективная жидкостная хроматография. Вайли. OSTI 7013902. из обзора Hung, L. B .; Parcher, J. F .; Shores, J.C .; Уорд, Э. Х. (1988). «Теоретические и экспериментальные основы программирования покрытия поверхности в газо-твердотельной хроматографии с адсорбируемым газом-носителем». Варенье. Chem. Soc. 110 (11): 1090–1096. Дои:10.1021 / ac00162a003.
- ^ Вытесняющая хроматография. Sacheminc.com. Проверено 7 июня 2011. В архиве 15 сентября 2008 г. Wayback Machine
- ^ Снайдер, Ллойд Р .; Долан, Джон В. (2006). Высокоэффективное градиентное элюирование: практическое применение модели линейной концентрации растворителя. Wiley Interscience. ISBN 978-0470055519.
- ^ Majors, Рональд Э .. (07.09.2010) Быстрая и сверхбыстрая ВЭЖХ на пористых частицах размером менее 2 мкм - что делать дальше? - LC-GC Европа. Lcgceurope.com. Проверено 7 июня 2011.
- ^ Xiang, Y .; Liu Y .; Ли М.Л. (2006). «Жидкостная хроматография сверхвысокого давления с использованием повышенной температуры». Журнал хроматографии А. 1104 (1–2): 198–202. Дои:10.1016 / j.chroma.2005.11.118. PMID 16376355.
- ^ Horváth, Cs .; Preiss B.A .; Липский С.Р. (1967). «Быстрая жидкостная хроматография. Исследование рабочих параметров и разделение нуклеотидов на пелликулярных ионообменниках». Аналитическая химия. 39 (12): 1422–1428. Дои:10.1021 / ac60256a003. PMID 6073805.
- ^ Четвертичный насос 1290 Infinity. Agilent
- ^ воды. «Торговые марки: Воды». www.waters.com.
- ^ К., Робардс (1994). Принципы и практика современных хроматографических методов. Хаддад П. Р., Джексон П. Э. Амстердам: Elsevier / Academic Press. ISBN 9780080571782. OCLC 815471219.
- ^ Гербер, Фредерик (май 2004 г.). «Практические аспекты быстрой обращенно-фазовой высокоэффективной жидкостной хроматографии с использованием колонок с насадкой 3 мкм и монолитных колонок в фармацевтических разработках и производстве в соответствии с действующей надлежащей производственной практикой». Журнал хроматографии. 1036 (2): 127–33. Дои:10.1016 / j.chroma.2004.02.056. PMID 15146913.
- ^ Сиддики, Масум Раза; AlOthman, Zeid A .; Рахман, Нафисур (2013). «Аналитические методы в фармацевтическом анализе: обзор». Арабский химический журнал. 10: S1409 – S1421. Дои:10.1016 / j.arabjc.2013.04.016.
- ^ Европейская фармакопея, 2002. Четвертое изд., Совет Европы, Страсбург.
- ^ Фармакопея США, 2004. 27 изд. USP Convention Inc., Роквилл, Мэриленд.
- ^ Пеше, Амадео; Розенталь, Мюррей; Уэст, Роберт; Уэст, Кэмерон; Crews, Бриджит; Микель, Чарльз; Алмазан, Перла; Латышев, Сергей (01.06.2010). «Оценка диагностической точности тандемной жидкостной хроматографии и масс-спектрометрии по сравнению с иммуноанализом у пациентов с болью». Врач боли. 13 (3): 273–281. PMID 20495592.
- ^ Цай, И.-Линь; Weng, Te-I .; Tseng, Yufeng J .; Тан, Счастливый Куй-Лок; Сунь, Сяо-Цзюй; Куо, Цзин-Хуа (01.12.2013). «Скрининг и подтверждение 62 наркотических веществ и метаболитов в моче с помощью ультра-высокоэффективной жидкостной хроматографии-квадрупольной времяпролетной масс-спектрометрии». Журнал аналитической токсикологии. 37 (9): 642–651. Дои:10.1093 / jat / bkt083. PMID 24084874.
- ^ Weinmann, W .; Ренц, М .; Vogt, S .; Поллак, С. (01.01.2000). «Автоматическая твердофазная экстракция и двухэтапная дериватизация для одновременного анализа основных запрещенных наркотиков в сыворотке крови с помощью ГХ / МС». Международный журнал судебной медицины. 113 (4): 229–235. Дои:10.1007 / s004149900098. PMID 10929239.
- ^ Колмонен, Марджо; Лейнонен, Антти; Пеландер, Анна; Оянперя, Илкка (28 февраля 2007 г.). «Общий метод скрининга допинговых агентов в моче человека путем твердофазной экстракции и жидкостной хроматографии / времяпролетной масс-спектрометрии». Analytica Chimica Acta. 585 (1): 94–102. Дои:10.1016 / j.aca.2006.12.028. PMID 17386652.
- ^ Пеландер, Анна; Оянперя, Илкка; Лакс, Суви; Расанен, Илпо; Вуори, Эркки (01.11.2003). «Токсикологический скрининг с идентификацией метаболитов на основе формулы с помощью жидкостной хроматографии / времяпролетной масс-спектрометрии». Аналитическая химия. 75 (21): 5710–5718. Дои:10.1021 / ac030162o. PMID 14588010.
- ^ Нобилис, Милан; Наливай, Милан; Сенель, Петр; Павлик, Ян; Кунес, Иржи; Voprsalová, Marie; Коларова, Ленка; Холкапек, Михал (15.06.2007). «Метаболическое профилирование потенциального противогрибкового препарата, 3- (4-бромфенил) -5-ацетоксиметил-2,5-дигидрофуран-2-она, в моче мышей с использованием высокоэффективной жидкостной хроматографии с УФ-фотодиодной матрицей и масс-спектрометрическим детектированием» . Журнал хроматографии B. 853 (1–2): 10–19. Дои:10.1016 / j.jchromb.2007.02.045. PMID 17400036.
- ^ Сундстрём, Мира; Пеландер, Анна; Ангерер, Верена; Хаттер, Мелани; Кнейзель, Стефан; Оянперя, Илкка (01.10.2013). «Метод высокочувствительной жидкостной хроматографии сверхвысокого качества / времяпролетной масс-спектрометрии высокого разрешения (UHPLC-HR-TOFMS) для выявления синтетических каннабиноидов и других наркотиков, вызывающих злоупотребление, в моче». Аналитическая и биоаналитическая химия. 405 (26): 8463–8474. Дои:10.1007 / s00216-013-7272-8. PMID 23954996.
- ^ Захеди Рад, Малихех; Неестани, Тиранг Реза; Никуйе, Бахаре; Шариатзаде, Настаран; Калаи, Али; Халаджи, Нилуфар; Гарави, Азам (01.01.2015). «Конкурентный метод иммуноферментного анализа, основанный на анализе связывания белков, по сравнению с жидкостной хроматографией под высоким давлением, имеет очень низкую диагностическую ценность для обнаружения дефицита витамина D у детей 9–12 лет». Международный журнал профилактической медицины. 6: 67. Дои:10.4103/2008-7802.161069. ЧВК 4542329. PMID 26330983.
дальнейшее чтение
- Л. Р. Снайдер, Дж. Дж. Киркланд и Дж. У. Долан, Введение в современную жидкостную хроматографию, John Wiley & Sons, Нью-Йорк, 2009.
- Донг М.В., Современная ВЭЖХ для практикующих ученых. Wiley, 2006.
- Л. Р. Снайдер, Дж. Дж. Киркланд и Дж. Л. Глайч, Разработка практических методов ВЭЖХ, John Wiley & Sons, Нью-Йорк, 1997.
- С. Ахуджа и Х. Т. Расмуссен (редактор), Разработка метода ВЭЖХ для фармацевтических препаратов, Academic Press, 2007.
- С. Ахуджа и М.В. Донг (редактор), Справочник по фармацевтическому анализу с помощью ВЭЖХ, Elsevier / Academic Press, 2005.
- Ю. В. Казакевич и Р. Ло Брутто (ред.), ВЭЖХ для ученых-фармацевтов, Wiley, 2007.
- У. Д. Ной, Колонки для ВЭЖХ: теория, технология и практика, Wiley-VCH, Нью-Йорк, 1997.
- M.C. McMaster, ВЭЖХ, практическое руководство пользователя, Wiley, 2007.
