Комбинаторная химия - Википедия - Combinatorial chemistry
Комбинаторная химия состоит из химические синтетические методы которые позволяют получать большое количество (от десятков до тысяч или даже миллионов) соединений за один процесс. Эти составные библиотеки могут быть созданы в виде смесей, наборов отдельных соединений или химических структур, созданных компьютерным программным обеспечением.[1] Комбинаторную химию можно использовать для синтеза небольших молекул и пептидов.
Стратегии, позволяющие идентифицировать полезные компоненты библиотек, также являются частью комбинаторной химии. Методы комбинаторной химии применяются и вне химии.
История
Комбинаторная химия была изобретена Фуркой Á (Eötvös Loránd University Budapest, Венгрия), который описал ее принцип, комбинаторный синтез и процедуру деконволюции в документе, нотариально заверенном в 1982 году.[2] Принцип комбинаторного метода заключается в следующем: синтезировать многокомпонентную смесь соединений (комбинаторную библиотеку) за одну пошаговую процедуру и провести ее скрининг, чтобы найти лекарственные препараты-кандидаты или другие виды полезных соединений также в одном процессе. Важнейшим нововведением комбинаторного метода является использование смесей в синтезе и грохочении, что обеспечивает высокую производительность процесса. Мотивы, которые привели к изобретению, были опубликованы в 2002 году.[3]
Вступление
Синтез молекул в комбинаторный мода может быстро привести к появлению большого количества молекул. Например, молекула с тремя точками разнообразия (р1, р2, и р3) может генерировать возможные конструкции, где , , и - количество различных используемых заместителей.[2]
Основной принцип комбинаторной химии - приготовить библиотеки из очень большого количества соединений затем идентифицируют полезные компоненты библиотек.
Хотя комбинаторная химия действительно была занята промышленностью только с 1990-х годов,[4] его корни можно увидеть еще в 1960-х годах, когда исследователь из Рокфеллеровский университет, Брюс Меррифилд начал расследование твердофазный синтез из пептиды.
В своей современной форме комбинаторная химия, вероятно, оказала наибольшее влияние на фармацевтический промышленность.[5] Исследователи, пытающиеся оптимизировать профиль активности соединения, создают "библиотека 'множества различных, но родственных соединений.[нужна цитата ] Достижения в робототехника привели к промышленному подходу к комбинаторному синтезу, позволяющему компаниям регулярно производить более 100 000 новых и уникальных соединений в год.[6]
Чтобы справиться с огромным количеством структурных возможностей, исследователи часто создают `` виртуальную библиотеку '', вычислительное перечисление всех возможных структур данного фармакофор со всеми доступными реагенты.[7] Такая библиотека может состоять из тысяч и миллионов «виртуальных» соединений. Исследователь выберет подмножество «виртуальной библиотеки» для фактического синтеза на основе различных расчетов и критериев (см. ADME, вычислительная химия, и QSAR ).
Полимеры (пептиды и олигонуклеотиды)
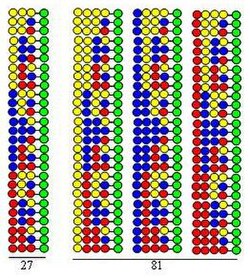
Комбинаторный синтез сплит-микс (сплит и пул)
Комбинаторный синтез сплит-микс (сплит и пул) [8] [9] основан на твердофазный синтез разработан Меррифилд.[10] Если комбинаторная пептидная библиотека синтезируется с использованием 20 аминокислоты (или другие виды строительных блоков) твердая опора в форме борта делится на 20 равных частей. За этим следует присоединение разных аминокислот к каждой части. Третий шаг - смешивание всех порций. Эти три шага составляют цикл. Удлинение пептидных цепей может быть реализовано простым повторением этапов цикла.

Процедура иллюстрируется синтезом дипептид библиотека, использующая те же три аминокислоты в качестве строительных блоков в обоих циклах. Каждый компонент этой библиотеки содержит две аминокислоты, расположенные в разном порядке. Аминокислоты, используемые в соединениях, представлены на рисунке желтыми, синими и красными кружками. Расходящиеся стрелки показывают разделение смолы твердого носителя (зеленые кружки) на равные части, вертикальные стрелки означают связывание, а сходящиеся стрелки обозначают смешивание и гомогенизацию частей носителя.
Из рисунка видно, что в двух синтетических циклах образуется 9 дипептидов. В третьем и четвертом циклах будут образовываться 27 трипептидов и 81 тетрапептид соответственно.
«Синтез сплит-микса» имеет несколько выдающихся особенностей:
- Это очень эффективно. Как показано на рисунке, количество пептидов, образующихся в процессе синтеза (3, 9, 27, 81), увеличивается экспоненциально с количеством выполненных циклов. При использовании 20 аминокислот в каждом синтетическом цикле количество образованных пептидов составляет: 400, 8000, 160 000 и 3 200 000 соответственно. Это означает, что количество пептидов увеличивается экспоненциально с количеством выполненных циклов.
- Все пептидные последовательности образуются в процессе, который может быть выведен комбинацией аминокислот, используемых в циклах.
- Порционирование носителя на равные образцы обеспечивает формирование компонентов библиотеки в почти равных молярных количествах.
- На каждой бусине подложки образуется только один пептид. Это следствие использования только одной аминокислоты на стадиях связывания. Однако совершенно неизвестно, какой пептид занимает выбранную гранулу.
- Метод сплит-микса можно использовать для синтеза органических или любых других библиотек, которые могут быть получены из его строительных блоков в пошаговом процессе.
В 1990 г. три группы описали методы получения пептидных библиотек биологическими методами.[11][12][13] и год спустя Fodor et al. опубликовали замечательный метод синтеза пептидных массивов на небольших предметных стеклах.[14]
Марио Гейзен и его коллеги разработали метод «параллельного синтеза» для получения массивов пептидов.[15] Они синтезировали 96 пептидов на пластиковых стержнях (шпильках), покрытых на концах твердой подложкой. Штифты погружали в раствор реагентов, помещенных в лунки микротитровальный планшет. Метод широко применяется, в частности, с использованием автоматических параллельных синтезаторов. Хотя параллельный метод намного медленнее, чем настоящий комбинаторный, его преимущество состоит в том, что точно известно, какой пептид или другое соединение образуется на каждом штыре.
Были разработаны дополнительные процедуры для объединения преимуществ как раздельного микширования, так и параллельного синтеза. В методе, описанном двумя группами[16][17] твердая подложка была заключена в проницаемые пластиковые капсулы вместе с радиочастотной меткой, несущей код соединения, которое должно быть образовано в капсуле. Процедура проводилась аналогично методу сплит-микса. Однако на стадии разделения капсулы распределяли по реакционным сосудам в соответствии с кодами, считываемыми с радиочастотных меток капсул.
Другой метод для той же цели был разработан Furka et al.[18] называется «струнный синтез». В этом методе на капсулах нет кода. Их нанизывают, как жемчуг в ожерелье, и помещают в реакционные сосуды в виде нитей. Идентификационные данные капсул, а также их содержимое хранятся по их положению на струнах. После каждого шага связывания капсулы перераспределяются между новыми струнами по определенным правилам.
Маленькие молекулы
Эта секция читается как рассмотрение а не энциклопедическое описание предмета. (Июль 2018 г.) |
В процессе открытия лекарств синтез и биологическая оценка маленькие молекулы представляющих интерес, как правило, были долгим и трудоемким процессом. Комбинаторная химия возникла в последние десятилетия как подход к быстрому и эффективному синтезу большого количества потенциальных малых молекул-кандидатов в лекарственные препараты. В типичном синтезе в конце схемы синтеза образуется только одна целевая молекула, причем каждая стадия синтеза дает только один продукт. В комбинаторный синтез, при использовании только одного исходного материала можно синтезировать большую библиотеку молекул с использованием идентичных условий реакции, которые затем могут быть проверены на их биологическая активность. Этот пул продуктов затем разделяется на три равные части, содержащие каждый из трех продуктов, а затем каждый из трех отдельных пулов реагирует с другой единицей реагента B, C или D, производя 9 уникальных соединений из предыдущих 3. Затем этот процесс повторяется до тех пор, пока не будет добавлено желаемое количество строительных блоков, в результате чего будет образовано множество соединений. При синтезе библиотеки соединений посредством многостадийного синтеза должны использоваться эффективные методы реакции, и если традиционные методы очистки используются после каждой стадии реакции, выходы и эффективность будут страдать.
Твердофазный синтез предлагает потенциальные решения, позволяющие избежать типичных стадий гашения и очистки, часто используемых в синтетической химии. Как правило, исходная молекула прикрепляется к твердой подложке (обычно нерастворимый полимер ), затем проводят дополнительные реакции, и конечный продукт очищают, а затем отщепляют от твердого носителя. Поскольку представляющие интерес молекулы прикреплены к твердой подложке, можно сократить очистку после каждой реакции до одной стадии фильтрации / промывки, устраняя необходимость в утомительных стадиях жидкостно-жидкостной экстракции и испарения растворителя, которые включают в себя большинство синтетических химикатов. Кроме того, при использовании гетерогенных реагентов можно использовать избыток реагентов для доведения вялых реакций до завершения, что может дополнительно повысить выходы. Излишки реагентов можно просто смыть без необходимости дополнительных стадий очистки, таких как хроматография.

За прошедшие годы было разработано множество методов для усовершенствования использования твердофазного органического синтеза в комбинаторной химии, включая усилия по упрощению синтеза и очистки, а также нетрадиционные методы для характеристики промежуточных продуктов. Хотя в большинстве описанных здесь примеров будут использоваться гетерогенные реакционные среды на каждой стадии реакции, Бут и Ходжес предоставляют ранний пример использования реагентов на твердой подложке только во время стадии очистки традиционных синтезов в фазе раствора.[19] По их мнению, химия в фазе раствора предлагает преимущества, заключающиеся в предотвращении реакций присоединения и расщепления, необходимых для закрепления и удаления молекул на смолах, а также в устранении необходимости воссоздавать твердофазные аналоги известных реакций в фазе раствора.
Единственная стадия очистки в конце синтеза позволяет удалить одну или несколько примесей, при условии, что химическая структура вредной примеси известна. Хотя использование реагентов на твердой подложке значительно упрощает синтез соединений, многие комбинаторные синтезы требуют нескольких стадий, каждая из которых по-прежнему требует определенной формы очистки. Армстронг и др. описывают однокомпонентный метод создания комбинаторных библиотек, называемый многокомпонентными уплотнениями (MCC).[20] В этой схеме три или более реагентов реагируют таким образом, что каждый реагент включается в конечный продукт за одну стадию, что устраняет необходимость в многостадийном синтезе, который включает множество стадий очистки. В MCC не требуется деконволюция для определения того, какие соединения являются биологически активными, потому что каждый синтез в массиве имеет только один продукт, поэтому идентичность соединения должна быть однозначно известна.
В другом синтезе массивов Стилл создал большую библиотеку олигопептиды путем раздельного синтеза.[21] Недостатком создания многих тысяч соединений является то, что сложно определить структуру образующихся соединений. Их решение состоит в использовании молекулярных меток, где к гранулам прикреплено крошечное количество (1 пмоль / гранула) красителя, и идентичность определенной гранулы может быть определена путем анализа того, какие метки присутствуют на гранулах. Несмотря на то, насколько легко прикрепление меток позволяет идентифицировать рецепторы, было бы совершенно невозможно индивидуально проверить каждое соединение на его способность связывания с рецептором, поэтому краситель был прикреплен к каждому рецептору, так что только те рецепторы, которые связываются с их субстратом, вызывают изменение цвета.
Когда необходимо запустить множество реакций (например, 96 реакций, описанных в одном из массивов MCC Armstrong), некоторые из наиболее утомительных аспектов синтеза могут быть автоматизированы для повышения эффективности. ДеВитт и Чарник подробно описывают метод под названием "ДИВЕРСОМЕР метод, "в котором одновременно протекают многие миниатюрные версии химических реакций.[22] В этом методе используется устройство, которое автоматизирует циклы загрузки смолы и промывки, а также мониторинг и очистку реакционного цикла, и демонстрирует осуществимость своего метода и устройства, используя его для синтеза различных классов молекул, таких как гидантоины и бензодиазепины, в большинстве случаев запускает 40 индивидуальных реакций.
Часто невозможно использовать дорогое оборудование, и Schwabacher и др. описать простой метод комбинирования параллельного синтеза членов библиотеки и оценки целых библиотек соединений.[23] В их методе нить, которая разделена на разные области, оборачивается вокруг цилиндра, где другой реагент затем присоединяется к каждой области, которая имеет только один вид. Затем нить повторно разделяется и наматывается на цилиндр другого размера, после чего этот процесс повторяется. Прелесть этого метода в том, что идентичность каждого продукта может быть определена просто по его расположению вдоль нитки, а соответствующая биологическая активность определяется по Фурье-преобразование сигналов флуоресценции.
В большинстве описанных здесь синтезов необходимо прикреплять и удалять исходный реагент на твердой подложке и с нее. Это может привести к образованию гидроксильной группы, которая потенциально может повлиять на биологическую активность целевого соединения. Эллман использует твердофазные носители в схеме многостадийного синтеза для получения 192 индивидуальных производных 1,4-бензодиазепина, которые являются хорошо известными терапевтическими агентами.[24] Чтобы исключить возможность потенциального вмешательства гидроксильных групп, используется новый метод, основанный на химии силиларила, для связывания молекул с твердой подложкой, которая отщепляется от подложки и не оставляет следов линкера.

При закреплении молекулы на твердом носителе промежуточные соединения нельзя изолировать друг от друга без отщепления молекулы от смолы. Поскольку многие традиционные методы определения характеристик, используемые для отслеживания хода реакции и подтверждения структуры продукта, основаны на растворах, необходимо использовать разные методы. Гель-фазовая 13 C ЯМР-спектроскопия, MALDI-масс-спектрометрия и ИК-спектроскопия использовались для подтверждения структуры и мониторинга хода твердофазных реакций.[25] Гордон и др. Описывают несколько тематических исследований, в которых имины и пептидилфосфонаты используются для создания комбинаторных библиотек малых молекул.[25] Для создания иминной библиотеки аминокислота, связанная со смолой, реагирует в присутствии альдегида. Авторы продемонстрировали использование быстрой 13 C-гель-фазовой ЯМР-спектроскопии и 1 H-ЯМР-спектроскопии с вращением под магическим углом для отслеживания хода реакций и показали, что большинство иминов может быть образовано всего за 10 минут при комнатной температуре, когда триметилортоформиат использовался в качестве растворитель. Образованные имины затем дериватизировали с образованием 4-тиазолидинонов, B-лактамов и пирролидинов.
Использование твердофазных носителей значительно упрощает синтез больших комбинаторных библиотек соединений. Это делается путем прикрепления исходного материала к твердой подложке и последующего проведения последующих реакций до тех пор, пока не будет создана достаточно большая библиотека, после чего продукты отщепляются от подложки. Использование твердофазной очистки также было продемонстрировано для использования в схемах синтеза в растворе в сочетании со стандартными методами очистки экстракцией жидкость-жидкость.
Деконволюция и скрининг
Комбинаторные библиотеки
Комбинаторные библиотеки - это специальные многокомпонентные смеси низкомолекулярных химических соединений, которые синтезируются в одном пошаговом процессе. Они отличаются как от совокупности индивидуальных соединений, так и от ряда соединений, полученных параллельным синтезом. Важной особенностью является то, что в их синтезе используются смеси. Использование смесей обеспечивает очень высокую эффективность процесса. Оба реагента могут быть смесями, и в этом случае процедура будет еще более эффективной. Однако из практических соображений рекомендуется использовать метод раздельной смеси, при котором одна из двух смесей заменяется отдельными строительными блоками (BB). Смеси настолько важны, что не существует комбинаторных библиотек без использования смеси в синтезе, и если смесь используется в процессе, неизбежно образуются комбинаторные библиотеки. Синтез расщепленной смеси обычно осуществляется с использованием твердого носителя, но его можно применять и в растворе. Поскольку он структурирует компоненты, неизвестны методы деконволюции, которые необходимо использовать при скрининге. Одной из наиболее важных особенностей комбинаторных библиотек является то, что всю смесь можно скринировать в одном процессе. Это делает эти библиотеки очень полезными в фармацевтических исследованиях. Также можно синтезировать частичные библиотеки полных комбинаторных библиотек. Некоторые из них можно использовать в деконволюции.[26]
Деконволюция библиотек, отколотых от твердой опоры
Если синтезированные молекулы комбинаторной библиотеки отщепляются от твердого носителя, образуется растворимая смесь. В таком растворе можно найти миллионы различных соединений. Когда был разработан этот синтетический метод, сначала казалось невозможным идентифицировать молекулы и найти молекулы с полезными свойствами. Однако для решения этой проблемы были разработаны стратегии определения полезных компонентов. Все эти стратегии основаны на синтезе и тестировании частичных библиотек. Самая ранняя итеративная стратегия описана в вышеупомянутом документе Furka, нотариально заверенном в 1982 и.[2]Позже метод был независимо опубликован Erb et al. под названием «Рекурсивная деконволюция»[27]
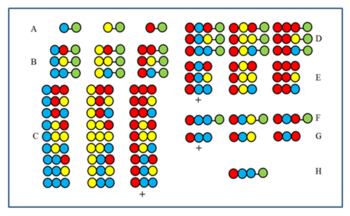
Рекурсивная деконволюция
Методика сделана понятной по рисунку. Пептидная библиотека из 27 членов синтезируется из трех аминокислот. После первого (A) и второго (B) циклов образцы были отложены перед их смешиванием. Продукты третьего цикла (C) перед смешиванием расщепляют, затем проверяют на активность. Предположим, что группа, помеченная знаком +, активна. Все члены имеют красную аминокислоту в последней позиции связывания (CP). Следовательно, активный член также имеет красную аминокислоту на последней CP. Затем красная аминокислота соединяется с тремя образцами, отложенными после второго цикла (B), чтобы получить образцы D. После расщепления образуются три образца E. Если после тестирования образец, помеченный знаком +, является активным, это показывает, что синяя аминокислота занимает вторую CP в активном компоненте. Затем к трем образцам A сначала присоединяется синяя, затем красная аминокислота (F), затем снова тестируется после расщепления (G). Если компонент + оказывается активным, последовательность активного компонента определяется и отображается в H.
Позиционное сканирование
Позиционное сканирование было независимо введено Furka et al.[28] и Pinilla et al.[29] Метод основан на синтезе и тестировании серии подбиблиотек. в которой определенное положение в последовательности занято одной и той же аминокислотой. На рисунке показаны девять подбиблиотек (B1-D3) полной библиотеки пептидных тримеров (A), состоящей из трех аминокислот. В подбиблиотках есть позиция, которую во всех компонентах занимает одна и та же аминокислота. При синтезе подбиблиотеки носитель не разделяется, и только одна аминокислота связывается со всем образцом. В результате одно положение действительно занято одной и той же аминокислотой во всех компонентах. Например, в подбиблиотеке B2 позиция 2 занята «желтой» аминокислотой во всех девяти компонентах. Если в скрининговом тесте эта подбиблиотека дает положительный ответ, это означает, что позиция 2 в активном пептиде также занята «желтой» аминокислотой. Аминокислотная последовательность может быть определена путем тестирования всех девяти (или иногда меньше) подбиблиотек.
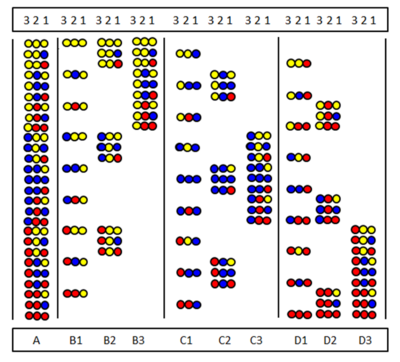
Пропуск библиотеки
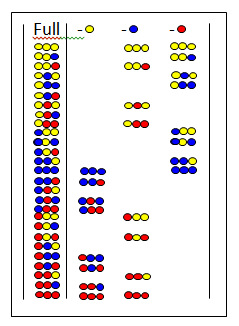
В бездействии библиотеки[30][31] определенная аминокислота отсутствует во всех пептидах смеси. На рисунке показана полная библиотека и три библиотеки пропусков. Вверху показаны пропущенные аминокислоты. Если библиотека пропусков дает отрицательный результат, значит пропущенная аминокислота присутствует в активном компоненте.
Деконволюция привязанных комбинаторных библиотек
Если пептиды не отщепляются от твердой подложки, мы имеем дело со смесью гранул, каждая гранула содержит один пептид. Смит и его коллеги[32] ранее показали, что пептиды можно тестировать и в привязанной форме. Этот подход также использовался при скрининге пептидных библиотек. Библиотеку связанных пептидов тестировали с растворенным целевым белком. Гранулы, к которым был прикреплен белок, были извлечены, белок удален из гранулы, затем связанный пептид идентифицирован путем секвенирования. Несколько иного подхода придерживались Тейлор и Моркен.[33] Они использовали инфракрасную термографию для идентификации катализаторов в библиотеках, не связанных с пептидами. Метод основан на тепле, которое выделяется в шариках, содержащих катализатор, при погружении связанной библиотеки в раствор подложки. Когда шарики исследуются под инфракрасным микроскопом, шарики, содержащие катализатор, выглядят как яркие пятна и их можно различить.
Кодированные комбинаторные библиотеки
Если мы имеем дело с библиотекой непептидных органических библиотек, не так просто определить идентичность содержимого гранулы, как в случае пептидной. Чтобы обойти эту трудность, были разработаны способы прикрепления к шарикам, параллельно с синтезом библиотеки, молекул, которые кодируют структуру соединения, образованного в шарике. Ольмейер и его коллеги опубликовали метод двоичного кодирования.[34] Они использовали смеси из 18 меченых молекул, которые после отделения их от бусинок можно было идентифицировать с помощью электронной газовой хроматографии. Саркар и др. описали хиральные олигомеры пентеновых амидов (COPA), которые можно использовать для создания массово кодируемых библиотек OBOC.[35] Kerr et al. представил инновационный метод кодирования[36] К шарикам прикрепляли ортогонально защищенный съемный бифункциональный линкер. Один конец линкера использовали для присоединения неприродных строительных блоков библиотеки, в то время как с другим концом были связаны триплеты кодирующих аминокислот. Строительными блоками были неприродные аминокислоты, и последовательность их кодирующих триплетов аминокислот может быть определена деградацией по Эдману. Важным аспектом этого типа кодирования была возможность отщепить от бусинок членов библиотеки вместе с прикрепленными к ним тегами кодирования, формируя растворимую библиотеку. Такой же подход использовали Nikolajev et al. для кодирования пептидами.[37] В 1992 году Бреннер и Лернер представили последовательности ДНК для кодирования гранул твердой подложки, что оказалось наиболее успешным методом кодирования.[38] Нильсен, Бреннер и Янда также использовали подход Керра для реализации кодирования ДНК.[39]В последнее время произошли важные достижения в области секвенирования ДНК. Методы следующего поколения позволяют параллельно секвенировать большое количество образцов, что очень важно при скрининге библиотек, кодируемых ДНК. Было еще одно нововведение, которое способствовало успеху кодирования ДНК. В 2000 году Хэлпин и Харбери отказались от твердой основы в синтезе комбинаторных библиотек, кодируемых методом сплит-микса, и заменили ее кодирующими олигомерами ДНК. При твердофазном расщеплении и синтезе пула количество компонентов библиотек не может превышать количество гранул носителя. Благодаря новому подходу авторов это ограничение было полностью снято и позволило получать новые соединения практически в неограниченном количестве. [40] Датская компания Nuevolution, например, синтезировала кодированную ДНК библиотеку, содержащую 40 триллионов! составные части[41]Библиотеки, кодируемые ДНК, являются растворимыми, что позволяет применять эффективное аффинное связывание при скрининге. Некоторые авторы применяют DEL для акромима комбинаторных библиотек, кодируемых ДНК, другие используют DECL. Последнее кажется лучше, так как в этом названии четко выражена комбинаторная природа этих библиотек. В первое десятилетие нынешнего тысячелетия были введены и описаны несколько типов комбинаторных библиотек, кодируемых ДНК. Эти библиотеки очень успешно применяются в исследованиях лекарственных средств.
- ДНК-шаблонный синтез комбинаторных библиотек, описанный в 2001 г. Gartner et al. [42]
- Комбинаторные библиотеки, кодируемые двойной фармакофорной ДНК, изобретенные в 2004 году Mlecco et al. [43]
- Маршрутизация с кодировкой последовательностей, опубликованная Harbury Halpin и Harbury в 2004 году. [44]
- Комбинаторные библиотеки, кодируемые одной фармакофорной ДНК, представленные в 2008 году Manocci et al. [45]
- Комбинаторные библиотеки, кодируемые ДНК, сформированные с использованием реактора в масштабе йоктолитров, опубликованные Hansen et al. в 2009[46]
Подробности об их синтезе и применении можно найти на странице ДНК-кодированная химическая библиотека Растворимые комбинаторные библиотеки, кодируемые ДНК, также имеют недостатки. Во-первых, полностью теряется преимущество использования прочной опоры. Кроме того, полиионный характер цепей, кодирующих ДНК, ограничивает использование неводных растворителей в синтезе. По этой причине многие лаборатории предпочитают разрабатывать ДНК-совместимые реакции для использования в синтезе DECL. Многие из доступных уже описаны[47][48][49]
Материаловедение
Материаловедение применил методы комбинаторной химии к открытию новых материалов. Эта работа была инициирована П.Г. Шульц и другие. в середине девяностых [50] в контексте люминесцентных материалов, полученных путем соосаждения элементов на кремниевой подложке. Его работе предшествовал J. J. Hanak в 1970 г.[51] но компьютерные и робототехнические инструменты не были доступны для распространения этого метода в то время. Работа продолжена несколькими академическими группами.[52][53][54][55] а также компании с крупными программами исследований и разработок (Symyx Technologies, GE, Dow Chemical так далее.). Этот метод широко используется для катализа,[56] покрытия,[57] электроника,[58] и многие другие области.[59] Применение соответствующих инструментов информатики критически важно для обработки, администрирования и хранения огромных объемов производимых данных.[60] Новые виды Дизайн экспериментов также были разработаны методы для эффективного решения больших экспериментальных задач, с которыми можно справиться с помощью комбинаторных методов.[61]
Библиотеки, ориентированные на разнообразие
Несмотря на то, что комбинаторная химия была неотъемлемой частью первых открытий лекарств на протяжении более двух десятилетий, до сих пор только одно химическое соединение, синтезированное de novo, было одобрено для клинического использования FDA (сорафениб, ингибитор мультикиназы, показанный при запущенном раке почек).[62] Было предложено, что анализ низкой успешности подхода связан с довольно ограниченными химическое пространство покрыты продуктами комбинаторной химии.[63] При сравнении свойств соединений в библиотеках комбинаторной химии со свойствами одобренных лекарств и натуральных продуктов Фехер и Шмидт[63] отметил, что библиотеки комбинаторной химии особенно страдают от отсутствия хиральность, а также жесткость конструкции, которые широко рассматриваются как свойства, подобные лекарственным средствам. Хотя натуральный продукт открытие лекарств наверное, не самая модная тенденция в фармацевтической индустрии в последнее время,[нужна цитата ] большая часть новых химических соединений все еще является соединениями природного происхождения,[нужна цитата ] Таким образом, было высказано предположение, что эффективность комбинаторной химии может быть повышена за счет увеличения химического разнообразия библиотек для скрининга.[64] Поскольку хиральность и жесткость являются двумя наиболее важными характеристиками, отличающими одобренные лекарства и натуральные продукты от соединений в библиотеках комбинаторной химии, эти две проблемы подчеркиваются в так называемых библиотеках, ориентированных на разнообразие, то есть коллекциях соединений, которые нацелены на охват химического пространства. просто огромное количество соединений.[нужна цитата ]
Подкласс патентной классификации
В 8-м издании Международная патентная классификация (IPC), вступившей в силу с 1 января 2006 г., создан специальный подкласс для заявки на патенты и патенты относится к изобретения в области комбинаторной химии: «C40B».
Смотрите также
- Комбинаторика
- Хеминформатика
- Комбинаторная биология
- Открытие наркотиков
- Динамическая комбинаторная химия
- Скрининг с высокой пропускной способностью
- Математическая химия
- Молекулярное моделирование
Рекомендации
- ^ Pottel, J .; Муассье, Н. (2017). «Настраиваемое создание синтетически доступных локальных химических подпространств». J. Chem. Инф. Модель. 57 (3): 454–467. Дои:10.1021 / acs.jcim.6b00648. PMID 28234470.
- ^ а б c Furka Á. Tanulmány, gyógyászatilag hasznosítható peptidek szisztematikus felkutatásának lehetőségéről (и Исследование возможности систематического поиска фармацевтически полезных пептидов https://mersz.hu/mod/object.php?objazonosito=matud202006_f42772_i2
- ^ Фурка Б (2002). Комбинаторная химия 20 лет на… Drug DiscovToday 7; 1-4.https://doi.org/10.1016/S1359-6446(02)00001-6
- ^ «КОМБИНАТОРНАЯ ХИМИЯ: ОБЗОР». Июль 2013. Дои:10.13040 / IJPSR.0975-8232.4 (7) .2502-16. Получено 21 июня, 2020.
- ^ Лесни, Марк С. (2002). «Конструирование комбинаторов: химия в разработке лекарств». Получено 19 октября, 2018.
- ^ Джеффри В. Нунан и др. «Развитие параллельного синтеза библиотеки фаз раствора с помощью эффективных методов очистки, количественного определения и характеристики» Журнал автоматизации лабораторий, 48 (1992) 3789.
- ^ Е.В.Гордеева и соавт. «Программа КОМПАС - оригинальный полуэмпирический подход к компьютерному синтезу» Тетраэдр, 48 (1992) 3789.
- ^ Фурка А., Себастьен Ф, Асгедом М., Дибо Г. Рог изобилия пептидов путем синтеза. В основных моментах современной биохимии, Труды 14-го Международного конгресса по биохимии. VSP.Utrecht.1988; 5; п. 47.
- ^ Á. Фурка, Ф. Себастьен, М. Асгедом, Г. Дибо, Общий метод быстрого синтеза многокомпонентных пептидных смесей. Int. J. Peptide Protein Res., 1991, 37, 487-493.
- ^ Меррифилд РБ, 1963 J. Am. Chem. Soc. 85, 2149.
- ^ Scott, J .; Смит, Г. (27 июля 1990 г.). «Поиск пептидных лигандов с помощью библиотеки эпитопов». Наука. Американская ассоциация развития науки (AAAS). 249 (4967): 386–390. Дои:10.1126 / science.1696028. ISSN 0036-8075. PMID 1696028.
- ^ Cwirla, S.E .; Peters, E. A .; Barrett, R.W .; Дауэр, У. Дж. (1 августа 1990 г.). «Пептиды на фаге: обширная библиотека пептидов для идентификации лигандов». Труды Национальной академии наук. 87 (16): 6378–6382. Дои:10.1073 / pnas.87.16.6378. ISSN 0027-8424. ЧВК 54537. PMID 2201029.
- ^ Дж. Дж. Девлин, Л. С. Панганибан и П. Е. Девлин, Science 1990, 249, 404.
- ^ Фодор С.П., Рид Дж.Л., Пиррунг М.К., Страйер Л., Лу А.Т., Солас Д., 1991. Направленный светом, пространственно-адресный параллельный химический синтез. Наука 251, 767-73.
- ^ Х. М. Гейзен, Р. Х. Мелоен, С. Дж. Бартелинг Proc. Natl. Акад. Sci. США 1984, 81, 3998.
- ^ Э. Дж. Моран, С. Саршар, Дж. Ф. Каргилл, М. Шахбаз, А Лио, А. М. М. Мьялли, Р. В. Армстронг, J. Am. Chem. Soc. 1995, 117, 10787.
- ^ К. С. Николау, X –Y. Xiao, Z. Parandoosh, A. Senyei, M. P. Nova Angew. Chem. Int. Эд. Англ. 1995, 36, 2289.
- ^ Á. Furka, J. W. Christensen, E. Healy, H. R. Tanner, H. Saneii J. Comb. Chem. 2000, 2, 220.
- ^ Бут, Р. Джон; Ходжес, Джон К. (1999–2001). «Стратегии реагентов на твердой основе для быстрой очистки продуктов комбинаторного синтеза». Отчеты о химических исследованиях. 32 (1): 18–26. Дои:10.1021 / ar970311n. ISSN 0001-4842.
- ^ Армстронг, Роберт В .; Расчески, Эндрю П .; Tempest, Paul A .; Браун, С. Дэвид; Китинг, Томас А. (1996–2001). "Стратегии многокомпонентной конденсации для комбинаторного библиотечного синтеза". Отчеты о химических исследованиях. 29 (3): 123–131. Дои:10.1021 / ar9502083. ISSN 0001-4842. S2CID 95815562.
- ^ И все же У. Кларк (1996–2001). «Открытие последовательного селективного связывания пептидов синтетическими рецепторами с использованием кодированных комбинаторных библиотек». Отчеты о химических исследованиях. 29 (3): 155–163. Дои:10.1021 / ar950166i. ISSN 0001-4842.
- ^ ДеВитт, Шейла Хоббс; Чарник, Энтони В. (1996–2001). «Комбинаторный органический синтез с использованием метода DIVERSOMER Парка-Дэвиса». Отчеты о химических исследованиях. 29 (3): 114–122. Дои:10.1021 / ar950209v. ISSN 0001-4842.
- ^ Швабахер, Алан В .; Шэнь, Исин; Джонсон, Кристофер В. (1999–2009). «Комбинаторная химия с преобразованием Фурье». Журнал Американского химического общества. 121 (37): 8669–8670. Дои:10.1021 / ja991452i. ISSN 0002-7863.
- ^ Эллман, Джонатан А. (1996–2001). «Дизайн, синтез и оценка библиотек малых молекул». Отчеты о химических исследованиях. 29 (3): 132–143. Дои:10.1021 / ar950190w. ISSN 0001-4842.
- ^ а б Гордон, Э. М .; Галоп, М. А .; Патель, Д. В. (1996–2001). "Стратегия и тактика комбинаторного органического синтеза. Приложения к открытию лекарств". Отчеты о химических исследованиях. 29 (3): 144–154. Дои:10.1021 / ar950170u. ISSN 0001-4842.
- ^ Подбиблиотека А. Фурка. Состав пептидных библиотек. Возможное применение в скрининге. Исследования по разработке лекарств 33, 90-97 (1994).
- ^ Erb E, Janda KD, Brenner S (1994) Рекурсивная деконволюция комбинаторных химических библиотек Proc. Natl Acad Sci.USA 91; 11422-11426.
- ^ Фурка А., Себастьен Ф., WC 93/24517, 1993.
- ^ Pinilla C, Appel JR, Blanc P, Houghten RA (1993) Быстрая идентификация пептидных лигандов с высокой аффинностью с использованием комбинаторных библиотек синтетических пептидов с позиционным сканированием. BioTechniques 13 (6); 901-5.
- ^ Карелл Т.Э., Винтер А., Ребек мл. (1994) Новая процедура синтеза библиотек, содержащих малые органические молекулы, Angew Chem Int Ed Engl 33; 2059-2061.
- ^ Кампиан Э, Петерсон М., Саней Х. Х., Фурка Б, (1998) Деконволюция с помощью библиотек пропусков, Bioorg & [Med Chem Letters 8; 2357-2362.
- ^ J. A. Smith, J. G. R. Hurrel, S. J. Leach. Новый метод определения антигенных детерминант: синтез пептидов и радиоиммуноанализ с использованием одного и того же твердого носителя. Иммунохимия 1977, 14, 565.
- ^ С. Дж. Тейлор, Дж. П. Моркен. Термографический выбор эффективных катализаторов из кодированной полимерной библиотечной науки 1998, 280, 267.
- ^ Ohlmeyer MHJ, Swanson RN, Dillard LW, Reader JC, Asouline G, Kobayashi R, Wigler M, Still WC (1993) Комплексные синтетические химические библиотеки, проиндексированные с помощью молекулярных тегов, Proc Natl Acad Sci USA 90; 10922-10926.
- ^ Sarkar M, Pascal BD, Steckler C, Aquino C., Micalizio GC, Kodadek T., Chalmers MJ (1993) Декодирование комбинаторных библиотек с разделением и объединением с помощью тандемной масс-спектрометрии с диссоциацией электронного переноса, J Am Soc Mass Spectrom 24 (7): 1026- 36.
- ^ Kerr JM, Banville SC, Zuckermann RN (1993) Библиотеки кодированных комбинаторных пептидов, содержащие неприродные аминокислоты, J Am Chem. Soc 115; 2529-2531.
- ^ Николаев В., Стирандова А., Крчнак В., Селигманн Б., Лам К.С., Салмон С.Е., Лебл М. (1993) Пептидное кодирование для определения структуры непоследовательных полимеров в библиотеках, синтезированных и испытанных на твердофазных носителях, Pept Res. 6 (3): 161-70.
- ^ Бреннер С., Лернер Р.А. (1992) Кодированная комбинаторная химия. Proc Natl Acad Sci USA 89; 5381–5383.
- ^ Нильсен Дж., Бреннер С., Янда К.Д. (1993) Синтетические методы реализации закодированной комбинаторной химии. Журнал Американского химического общества, 115 (21); 9812–9813.
- ^ Харбери Д.Р., Халпин Д.Р. (2000) WO 00/23458.
- ^ Б. Хэлфорд. Как библиотеки с кодировкой ДНК революционизируют открытие лекарств. C&EN 2017, 95, выпуск 25.
- ^ Gartner ZJ, Tse BN, Grubina RB, Doyon JB, Snyder TM, Liu DR (2004) ДНК-шаблонный органический синтез и выбор библиотеки макроциклов, Science 305; 1601-1605.
- ^ Melkko S, Scheuermann J, Dumelin CE, Neri D (2004) Закодированные самособирающиеся химические библиотеки Nat Biotechnol 22; 568-574.
- ^ Halpin DR, Harbury PB (2004) Отображение ДНК I. Последовательная маршрутизация популяций ДНК, PLoS Biology 2; 1015-102.
- ^ Mannocci L, Zhang Y, Scheuermann J, Leimbacher M, De Bellis G, Rizzi E, Dumelin C, Melkko S и Neri N (2008). Высокопроизводительное секвенирование позволяет идентифицировать связывающие молекулы, выделенные из химических библиотек, кодируемых ДНК, Proc Natl Acad Sci USA 105; 17670–17675.
- ^ Hansen MH, Blakskjskr P, Petersen LK, Hansen TH, Højfeldt JW, Gothelf KV, HansenNJV (2009) ДНК-реактор йоктолитрового масштаба для эволюции малых молекул (2009) J Am Chem Soc 131; 1322-1327.
- ^ Luk KC, Satz AL (2014) DNA-Compatible Chemistry in: Goodnow Jr. RA Editor A Handbook for DNA-Encoded Chemistry: Theory and Applications for Exploring Chemical Space and Drug Discovery, Wiley, pp 67-98.
- ^ Satz AL, Cai J, Chen Y, §, Goodnow R, Felix Gruber F, Kowalczyk A, Petersen A, Naderi-Oboodi G, Orzechowski L, Strebel Q (2015) Многоступенчатый ДНК-совместимый синтез и его применение в библиотеках с кодировкой ДНК Bioconjugate Chem 26 ; 1623−1632.
- ^ Li Y, Gabriele E, Samain F, Favalli N, Sladojevich F, Scheuermann J, Neri D (2016) Оптимизированные условия реакции для образования амидных связей в ДНК-кодируемых комбинаторных библиотеках, ACS Comb Sci 18 (8); 438–443.
- ^ X. -D. Xiang et al. «Комбинаторный подход к открытию материалов» Наука 268 (1995) 1738
- ^ J.J. Hanak, J. Mater. Sci, 1970, 5, 964-971.
- ^ Комбинаторные методы разработки сенсорных материалов, Springer, 2009. ISBN 978-0-387-73712-6
- ^ В. М. Мирский, В. Куликов, К. Хао, О. С. Вольфбайс. Многопараметрическая высокопроизводительная характеристика комбинаторных химических микрочипов хемочувствительных полимеров. Macromolec. Рэп. Comm., 2004, 25, 253-258
- ^ H. Koinuma et al. «Комбинаторное твердотельное материаловедение и технология» Науки. Technol. Adv. Mater. 1 (2000) 1 бесплатная загрузка
- ^ Андрей Ионут Мардаре и др. «Комбинаторное твердотельное материаловедение и технология» Науки. Technol. Adv. Mater. 9 (2008) 035009 бесплатная загрузка
- ^ Прикладной катализ A, том 254, выпуск 1, страницы 1-170 (10 ноября 2003 г.)
- ^ J. N. Cawse et. др., Progress in Organic Coatings, Volume 47, Issue 2, August 2003, Pages 128-135.
- ^ Комбинаторные методы для высокопроизводительного материаловедения, MRS Proceedings Volume 1024E, осень 2007 г.
- ^ Комбинаторные методы и методы искусственного интеллекта в материаловедении II, MRS Proceedings Volume 804, осень 2004 г.
- ^ QSAR и комбинаторная наука, 24, номер 1 (февраль 2005 г.)
- ^ J. N. Cawse, Ed., Экспериментальный дизайн для разработки комбинаторных и высокопроизводительных материалов, Джон Уайли и сыновья, 2002.
- ^ Д. Ньюман и Г. Крэгг «Натуральные продукты как источники новых лекарств за последние 25 лет» Джей Нат Прод 70 (2007) 461
- ^ а б М. Фехер и Дж. М. Шмидт "Распределение свойств: различия между лекарствами, натуральными продуктами и молекулами из комбинаторной химии" J. Chem. Инф. Comput. Наук, 43 (2003) 218
- ^ Су QB, Билер А.Б., Лобковский Е., Порко Дж. А., Панек Дж. С. «Стереохимическое разнообразие посредством циклодимеризации: синтез поликетидоподобных макродиолидов». Org Lett 2003, 5: 2149-2152.
внешняя ссылка
- Английская версия документа 1982 г.
- «Скрытая сторона истории комбинаторной химии»
- «Глоссарий терминов, используемых в комбинаторной химии» ИЮПАК
- ACS комбинаторная наука (ранее Журнал комбинаторной химии )
- Обзор комбинаторной химии
- Молекулярное разнообразие
- Комбинаторная химия и высокопроизводительный скрининг
- Комбинаторная химия: онлайн-журнал
- SmiLib - бесплатное программное обеспечение с открытым исходным кодом для комбинаторного перечисления библиотек
- GLARE - бесплатное программное обеспечение с открытым исходным кодом для комбинаторного проектирования библиотек.




