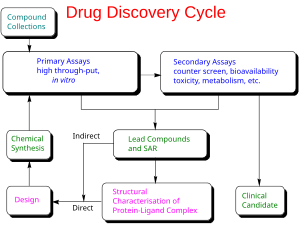
Открытие наркотиков - Drug discovery
В полях лекарство, биотехнология и фармакология, открытие лекарств это процесс, с помощью которого новый кандидат лекарства обнаружены.[1]
Исторически сложилось так, что лекарства были открыты путем идентификации активного ингредиента из традиционных средств или счастливый открытие как с пенициллином. В последнее время, химические библиотеки синтетических маленькие молекулы, натуральные продукты или же выдержки были проверены в интактных клетках или целых организмах для выявления веществ, которые имели желаемый терапевтический эффект в процессе, известном как классическая фармакология. После последовательность действий из человеческий геном позволяли быстрое клонирование и синтез больших количеств очищенных белков, стало обычной практикой использовать грохочение с высокой пропускной способностью больших библиотек соединений против изолированных биологические мишени которые, как предполагается, изменяют болезнь в процессе, известном как обратная фармакология. Попадания с этих экранов затем проверяются на клетках, а затем на животных на предмет эффективность.[2]
Открытие современных лекарств предполагает выявление результатов скрининга, медицинская химия и оптимизация этих обращений для увеличения близость, избирательность (для уменьшения возможности побочных эффектов), эффективность /потенция, метаболический стабильность (для увеличения период полураспада ) и устные биодоступность. После того, как соединение, отвечающее всем этим требованиям, было идентифицировано, процесс разработка лекарств можно продолжить. В случае успеха клинические испытания разработаны.[3]
Таким образом, открытие современных лекарств обычно капиталоемкий процесс, который включает в себя большие инвестиции к фармацевтическая индустрия корпораций, а также национальных правительств (которые предоставляют гранты и кредитные гарантии ). Несмотря на достижения в области технологий и понимание биологических систем, открытие лекарств по-прежнему является длительным, «дорогим, сложным и неэффективным процессом» с низким уровнем новых терапевтических открытий.[4] В 2010 г. исследования и разработки стоимость каждого новый молекулярный объект составила около 1,8 миллиарда долларов США.[5] в 21-го века фундаментальные исследования финансируются в основном правительствами и благотворительными организациями, тогда как разработки на поздних стадиях финансируются в основном фармацевтическими компаниями или венчурными капиталистами.[6] Чтобы получить разрешение на выпуск на рынок, лекарства должны пройти несколько успешных фаз клинических испытаний и пройти новый процесс утверждения лекарств, называемый Заявка на новый препарат В Соединенных Штатах.
Обнаружение лекарств, которые могут иметь коммерческий успех или успех в области общественного здравоохранения, требует сложного взаимодействия между инвесторами, промышленностью, научным сообществом, патентным законодательством, исключительными правами регулирующих органов и т.д. маркетинг и необходимость сбалансировать секретность с общением.[7] Между тем, для расстройств, редкость которых означает, что нельзя ожидать большого коммерческого успеха или воздействия на общественное здоровье, орфанный препарат процесс финансирования гарантирует, что люди, страдающие этими расстройствами, могут иметь некоторую надежду на фармакотерапевтический достижения.
История
Идея о том, что действие лекарства в организме человека опосредуется специфическими взаимодействиями молекулы лекарства с биологическими макромолекулами, (белки или же нуклеиновые кислоты в большинстве случаев) привели ученых к выводу, что для биологической активности лекарства необходимы отдельные химические вещества. Это сделано для начала современной эпохи в фармакология, как чистые химические вещества, вместо сырых экстрактов лекарственные растения, стали стандартными препаратами. Примеры лекарственных соединений, выделенных из сырых препаратов: морфий, активный агент в опиуме, и дигоксин, стимулятор сердца, полученный из Дигиталис ланата. Органическая химия также привела к синтезу многих натуральные продукты изолирован из биологических источников.
Исторически сложилось так, что вещества, будь то сырые экстракты или очищенные химические вещества, проверялись на биологическую активность без знания биологическая мишень. Только после того, как было идентифицировано активное вещество, предпринимались попытки идентифицировать цель. Этот подход известен как классическая фармакология, вперед фармакология,[8] или открытие фенотипических лекарств.[9]
Позже были синтезированы небольшие молекулы, специально нацеленные на известный физиологический / патологический путь, избегая массового скрининга банков сохраненных соединений. Это привело к большому успеху, например, работа Гертруда Элион и Джордж Х. Хитчингс на метаболизм пуринов,[10][11] работа Джеймс Блэк[12] на бета-блокаторы и циметидин, и открытие статины к Акира Эндо.[13] Еще одним сторонником подхода к разработке химических аналогов известных действующих веществ был Сэр Дэвид Джек у Аллена и Хэнбери, позже Glaxo, который первым изобрел ингаляционный селективный бета2-адренергический агонист при астме, первый ингаляционный стероид при астме, ранитидин в качестве преемника циметидина и способствовал развитию триптанов.[14]
Гертруда Элион, работая в основном с группой менее 50 человек над аналогами пуринов, внесла свой вклад в открытие первого антивирусного препарата; первый иммунодепрессант (азатиоприн ), разрешившие трансплантацию органов человека; первый препарат, вызывающий ремиссию детской лейкемии; основные противораковые методы лечения; противомалярийное средство; антибактериальный; и лечение подагры.
Клонирование человеческих белков сделало возможным скрининг больших библиотек соединений против конкретных мишеней, которые, как считается, связаны с конкретными заболеваниями. Этот подход известен как обратная фармакология и сегодня это наиболее часто используемый подход.[15]
Цели
«Мишень» производится в фармацевтической промышленности.[6] Как правило, «мишенью» является существующая в природе клеточная или молекулярная структура, вовлеченная в представляющую интерес патологию, на которую должно действовать разрабатываемое лекарственное средство.[6] Однако различие между «новой» и «установленной» целью может быть проведено без полного понимания того, что такое «цель». Это различие обычно проводится фармацевтическими компаниями, занимающимися открытием и разработкой терапевтических средств.[6] По оценке 2011 года, 435 продуктов генома человека были определены как терапевтические мишени для одобренных FDA лекарств.[16]
«Установленные цели» - это те, для которых существует хорошее научное понимание, подкрепленное длительной историей публикаций, того, как мишень функционирует в нормальной физиологии и как она участвует в патологии человека.[2] Это не означает, что механизм действия лекарств, которые, как считается, действуют через определенную установленную цель, полностью изучены.[2] Скорее, «установленный» относится непосредственно к количеству базовой информации, доступной по цели, в частности функциональной информации. В общем, «новые цели» - это все те цели, которые не являются «установленными целями», но которые были или являются предметом усилий по открытию лекарств. Большинство целей, выбранных для разработки новых лекарств, - это белки, такие как Рецепторы, связанные с G-белком (GPCR) и протеинкиназы.[17]
Показ и дизайн
Процесс поиска нового лекарства против выбранной мишени для конкретного заболевания обычно включает: высокопроизводительный скрининг (HTS), где большие библиотеки химических веществ тестируются на их способность модифицировать мишень. Например, если цель - роман GPCR, соединения будут проверяться на их способность ингибировать или стимулировать этот рецептор (см. антагонист и агонист ): если целью является протеинкиназа, химические вещества будут проверены на их способность подавлять эта киназа.[нужна цитата ]
Еще одна важная функция HTS - показать, насколько селективны соединения для выбранной цели, поскольку нужно найти молекулу, которая будет мешать только выбранной цели, но не другим связанным целям.[нужна цитата ] С этой целью будут выполнены другие прогоны скрининга, чтобы увидеть, будут ли «попадания» по выбранной цели мешать другим связанным целям - это процесс перекрестного скрининга.[нужна цитата ] Перекрестный скрининг важен, потому что чем больше несвязанных целей поражает соединение, тем больше вероятность, что это не цель. токсичность произойдет с этим соединением, как только оно попадет в клинику.[нужна цитата ]
Маловероятно, что идеальный кандидат на лекарство появится в результате этих ранних этапов скрининга. Одним из первых шагов является поиск соединений, которые вряд ли будут превращены в лекарства; например, соединения, которые встречаются практически во всех анализах, классифицируются медицинскими химиками как "комплексные интерференционные соединения ", удаляются на этом этапе, если они еще не были удалены из химической библиотеки.[18][19][20] Часто наблюдается, что некоторые соединения обладают некоторой степенью Мероприятия, и если эти соединения имеют общие химические свойства, одно или несколько фармакофоры затем можно развить. На этой точке, химики-медики попытается использовать отношения между структурой и деятельностью (SAR) для улучшения некоторых функций соединение свинца:
- увеличить активность против выбранной цели
- снизить активность против несвязанных целей
- улучшить склонность к наркотикам или же ADME свойства молекулы.
Этот процесс потребует нескольких итеративных прогонов скрининга, во время которых, как ожидается, свойства новых молекулярных объектов улучшатся и позволят предпочтительным соединениям перейти к in vitro и in vivo тестирование активности в выбранной модели болезни.
Среди физико-химический свойства, связанные с абсорбцией лекарственного средства, включают ионизацию (pKa) и растворимость; проницаемость можно определить по ПАМПА и Како-2. PAMPA привлекательна в качестве раннего скрининга из-за низкого потребления лекарственного средства и низкой стоимости по сравнению с такими тестами, как Caco-2, желудочно-кишечный тракт (GIT) и Гематоэнцефалический барьер (BBB), с которым существует высокая корреляция.
Ряд параметров может использоваться для оценки качества соединения или ряда соединений, как предлагается в Правило пяти Липинского. К таким параметрам относятся рассчитанные свойства, такие как cLogP для оценки липофильности, молекулярный вес, площадь полярной поверхности и измеренные свойства, такие как активность, измерение ферментных оформление и т.д. Некоторые дескрипторы, такие как эффективность лиганда[21] (LE) и липофильная эффективность[22][23] (LiPE) объединить эти параметры для оценки склонность к наркотикам.
Хотя HTS является широко используемым методом открытия новых лекарств, это не единственный метод. Часто можно начать с молекулы, которая уже обладает некоторыми из желаемых свойств. Такая молекула может быть извлечена из натурального продукта или даже быть лекарством на рынке, которое может быть улучшено (так называемые препараты «я тоже»). Другие методы, такие как виртуальный высокопроизводительный скрининг, где скрининг выполняется с использованием компьютерных моделей и попытки «прикрепить» виртуальные библиотеки к цели, также часто используются.[нужна цитата ]
Еще один важный метод открытия лекарств - de novo дизайн препарата, в котором предсказывается, какие химические вещества могут (например) вписаться в активный сайт целевого фермента. Например, виртуальный просмотр и компьютерный дизайн лекарств часто используются для идентификации новых химических групп, которые могут взаимодействовать с целевым белком.[24][25] Молекулярное моделирование[26] и молекулярная динамика моделирование можно использовать в качестве руководства для улучшения эффективности и свойств новых лекарственных препаратов.[27][28][29]
В сообществе разработчиков лекарств также произошла смена парадигмы, чтобы отойти от УТВ, что дорого и может охватывать только ограниченное количество химическое пространство, до скрининга небольших библиотек (максимум несколько тысяч соединений). К ним относятся обнаружение потенциальных клиентов на основе фрагментов (FBDD)[30][31][32][33] и белок-направленная динамическая комбинаторная химия.[34][35][36][37][38] Лиганды в этих подходах обычно намного меньше, и они связываются с целевым белком слабее. связывающая аффинность чем хиты, идентифицированные по HTS. Дальнейшие модификации через органический синтез в соединения свинца часто требуются. Такие модификации часто определяются белком. Рентгеновская кристаллография комплекса белок-фрагмент.[39][40][41] Преимущества этих подходов заключаются в том, что они обеспечивают более эффективный скрининг, а библиотека соединений, хотя и небольшая, обычно охватывает большое химическое пространство по сравнению с HTS.
Фенотипические исследования также предоставили новые химические отправные точки в открытии лекарств.[42][43] Было использовано множество моделей, включая дрожжи, рыбок данио, червей, иммортализованные клеточные линии, первичные клеточные линии, полученные от пациентов клеточные линии и целые животные модели. Эти скрининг предназначены для поиска соединений, которые обращают вспять фенотип заболевания, такой как смерть, агрегация белка, экспрессия мутантного белка или пролиферация клеток, в качестве примеров в более целостной модели клетки или организма. Для этих грохотов часто используются меньшие грохоты, особенно когда модели дороги или требуют много времени для эксплуатации.[44] Во многих случаях точный механизм действия попаданий от этих экранов неизвестен, и для его выяснения могут потребоваться обширные эксперименты по деконволюции цели.
После того, как будет создана серия ведущих соединений с достаточной целевой эффективностью и селективностью и благоприятными лекарственными свойствами, тогда будет предложено одно или два соединения для разработка лекарств. Лучшее из них обычно называют соединение свинца, а другой будет обозначен как «резервный».[нужна цитата ] Эти важные решения обычно поддерживаются инновациями в области вычислительного моделирования. [45][46][47]
Природа как источник
Традиционно многие лекарства и другие химические вещества, обладающие биологической активностью, были обнаружены путем изучения химических веществ, которые организмы создают для воздействия на активность других организмов в целях выживания.[48]
Несмотря на рост комбинаторной химии как неотъемлемой части процесса открытия потенциальных клиентов, натуральные продукты по-прежнему играют важную роль в качестве исходного материала для открытия лекарств.[49] Отчет за 2007 год[50] обнаружили, что из 974 новых химических соединений с небольшими молекулами, разработанных в период с 1981 по 2006 год, 63% были природного происхождения или полусинтетические производные натуральных продуктов. По некоторым направлениям терапии, таким как противомикробные препараты, противоопухолевые препараты, гипотензивные и противовоспалительные препараты, цифры были выше.[нужна цитата ] Во многих случаях эти продукты использовались традиционно в течение многих лет.[нужна цитата ]
Натуральные продукты могут быть полезны как источник новых химических структур для современных методов разработки антибактериальной терапии.[51]
Растительного происхождения
Много вторичные метаболиты производимые растениями обладают потенциальными терапевтическими лечебными свойствами. Эти вторичные метаболиты содержат, связываются и изменяют функцию белков (рецепторов, ферментов и т. Д.). Следовательно, полученные из растений натуральные продукты часто использовались как отправная точка для открытия лекарств.[52][53][54][55]
История
До эпоха Возрождения, подавляющее большинство наркотиков в западных лекарство мы растение -производные экстракты.[56] Это привело к накоплению информации о потенциале видов растений как важных источников исходных материалов для открытия лекарств.[57] Ботанические знания о разных метаболиты и гормоны которые образуются в разных анатомических частях растения (например, корнях, листьях и цветках), имеют решающее значение для правильного определения биоактивных и фармакологических свойств растения.[57][58] Выявление новых лекарств и их утверждение для продажи оказалось жестким процессом из-за правил, установленных национальными лекарственными средствами. регулирующие органы.[59]
Жасмонаты
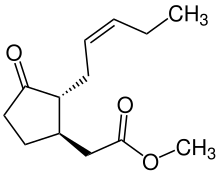
Жасмонаты важны в ответах на повреждение и внутриклеточные сигналы. Они вызывают апоптоз [60][61] и белковый каскад через ингибитор протеиназы,[60] имеют защитные функции,[62] и регулировать реакцию растений на различные биотические и абиотические стрессы.[62][63] Жасмонаты также могут напрямую воздействовать на митохондриальный мембраны, вызывая деполяризацию мембраны за счет высвобождения метаболиты.[64]
Производные жасмоната (JAD) также важны для реакции раны и ткани регенерация в клетках растений. Они также были идентифицированы как против старения воздействие на человека эпидермальный слой.[65] Есть подозрение, что они взаимодействуют с протеогликаны (PG) и гликозаминогликан (GAG) полисахариды, которые необходимы внеклеточный матрикс (ECM) компоненты, помогающие модернизировать ECM.[66] Открытие JAD для восстановления кожи вызвало новый интерес к эффектам этих растительных гормонов в терапевтических медицинских целях.[65]
Салицилаты

Салициловая кислота (SA), a фитогормон, первоначально был получен из коры ивы и с тех пор был идентифицирован у многих видов. Это важный игрок в иммунитет растений, хотя его роль до сих пор до конца не изучена учеными.[67] Они участвуют в болезнях и иммунных ответах в тканях растений и животных. У них есть белки, связывающие салициловую кислоту (SABP), которые, как было показано, влияют на несколько тканей животных.[67] Первые открытые лечебные свойства изолированного соединения были связаны с обезболиванием и лихорадкой. Они также играют активную роль в подавлении пролиферации клеток.[60] У них есть способность вызывать смерть в лимфобластный лейкемия и другие раковые клетки человека.[60] Одним из наиболее распространенных препаратов на основе салицилатов является аспирин, также известная как ацетилсалициловая кислота, с противовоспалительным и жаропонижающий характеристики.[67][68]
Микробные метаболиты
Микробы конкурируют за жизненное пространство и питательные вещества. Чтобы выжить в этих условиях, многие микробы развили способности предотвращать размножение конкурирующих видов. Микробы - основной источник противомикробных препаратов. Изоляты Streptomyces были настолько ценным источником антибиотиков, что их назвали лекарственной плесенью. Классический пример антибиотика, обнаруженного в качестве защитного механизма против другого микроба: пенициллин в бактериальных культурах, загрязненных Пенициллий грибы в 1928 г.[нужна цитата ]
Морские беспозвоночные
Морская среда является потенциальным источником новых биоактивных веществ.[69] Арабиноза нуклеозиды обнаруженный у морских беспозвоночных в 1950-х годах, впервые продемонстрировал, что части сахара, отличные от рибозы и дезоксирибозы, могут давать биоактивные нуклеозидные структуры. Только в 2004 году был одобрен первый препарат морского происхождения.[нужна цитата ][сомнительный ] Например, токсин конусной улитки зиконотид, также известный как Приалт, лечит сильную невропатическую боль. Несколько других агентов морского происхождения сейчас проходят клинические испытания по показаниям, таким как рак, противовоспалительное применение и боль. Один из классов этих агентов: бриостатин -подобные соединения, исследуемые в качестве противораковой терапии.[нужна цитата ]
Химическое разнообразие
Как упоминалось выше, комбинаторная химия была ключевой технологией, позволяющей эффективно создавать большие скрининговые библиотеки для нужд высокопроизводительного скрининга. Однако теперь, после двух десятилетий комбинаторной химии, было отмечено, что, несмотря на возросшую эффективность химического синтеза, увеличения количества свинца или кандидатов в лекарственные препараты достигнуто не было.[50] Это привело к анализу химических характеристик продуктов комбинаторной химии по сравнению с существующими лекарствами или натуральными продуктами. В химиоинформатика понятие химического разнообразия, изображенное как распределение соединений в химическое пространство основанный на их физико-химических характеристиках, часто используется для описания разницы между библиотеками комбинаторной химии и натуральными продуктами. Синтетические комбинаторные библиотечные соединения, по-видимому, охватывают лишь ограниченное и довольно однородное химическое пространство, тогда как существующие лекарства и особенно натуральные продукты демонстрируют гораздо большее химическое разнообразие, более равномерно распределяясь в химическом пространстве.[49] Наиболее заметные различия между натуральными продуктами и соединениями в библиотеках комбинаторной химии - это количество хиральных центров (намного выше в природных соединениях), жесткость структуры (выше в природных соединениях) и количество ароматических фрагментов (выше в библиотеках комбинаторной химии). Другие химические различия между этими двумя группами включают природу гетероатомов (O и N, обогащенные натуральными продуктами, а атомы S и галогена чаще присутствуют в синтетических соединениях), а также уровень неароматической ненасыщенности (выше в натуральных продуктах). Как жесткость конструкции, так и хиральность являются общепризнанными факторами медицинская химия известно, что они повышают специфичность и эффективность соединений в качестве лекарственного средства, поэтому было высказано предположение, что натуральные продукты выгодно отличаются от сегодняшних библиотек комбинаторной химии в качестве потенциальных ведущих молекул.
Скрининг
Существуют два основных подхода к обнаружению новых биологически активных химических соединений из природных источников.
Первый иногда называют случайным сбором и просмотром материала, но сбор далеко не случайный. Биологические (часто ботанические) знания часто используются для выявления многообещающих семей. Этот подход эффективен, потому что только небольшая часть биоразнообразия Земли когда-либо тестировалась на предмет фармацевтической деятельности. Кроме того, организмам, живущим в богатой видами окружающей среде, необходимо развивать защитные и конкурентные механизмы, чтобы выжить. Эти механизмы могут быть использованы при разработке полезных лекарств.
Сбор образцов растений, животных и микробов из богатых экосистем потенциально может вызвать новые виды биологической активности, которые стоит использовать в процессе разработки лекарств. Одним из примеров успешного использования этой стратегии является скрининг противоопухолевых агентов Национальный институт рака, который начался в 1960-х гг. Паклитаксел был идентифицирован по тихоокеанскому тису Taxus brevifolia. Паклитаксел проявил противоопухолевую активность благодаря ранее не описанному механизму (стабилизация микротрубочек) и в настоящее время одобрен для клинического применения для лечения рака легких, груди и яичников, а также для лечения рака. Саркома Капоши. В начале 21 века Кабазитаксел (сделан Санофи, французская фирма), еще один родственник таксол была доказана эффективность против рак простаты также потому, что он работает, предотвращая образование микротрубочек, которые разделяют хромосомы в делящихся клетках (например, раковых). Другие примеры: 1. Camptotheca (Камптотецин · Топотекан · Иринотекан · Рубитекан · Белотекан ); 2. Подофиллум (Этопозид · Тенипозид ); 3а. Антрациклины (Акларубицин · Даунорубицин · Доксорубицин · Эпирубицин · Идарубицин · Амрубицин · Пирарубицин · Валрубицин · Зорубицин ); 3b. Anthracenediones (Митоксантрон · Pixantrone ).
Второй основной подход включает этноботаника, изучение общего использования растений в обществе, и этнофармакология, область внутри этноботаники, которая специально ориентирована на использование в медицине.
Артемизинин, противомалярийное средство из сладкого червя Полынь однолетняя, используемый в китайской медицине с 200 г. до н.э., является одним из препаратов, используемых в комбинированная терапия для мультирезистентных Плазмодий falciparum.
Структурное разъяснение
Выяснение химической структуры имеет решающее значение, чтобы избежать повторного открытия химического агента, который уже известен своей структурой и химической активностью. Масс-спектрометрии это метод, в котором отдельные соединения идентифицируются на основе их отношения массы / заряда после ионизации. Химические соединения существуют в природе в виде смесей, поэтому сочетание жидкостной хроматографии и масс-спектрометрии (ЖХ-МС) часто используется для разделения отдельных химических веществ. Доступны базы данных масс-спектров известных соединений, которые можно использовать для определения структуры неизвестного масс-спектра. Спектроскопия ядерного магнитного резонанса является основным методом определения химической структуры природных продуктов. ЯМР дает информацию об отдельных атомах водорода и углерода в структуре, позволяя детально реконструировать архитектуру молекулы.
Заявка на новый препарат
Когда лекарство разработано с доказательствами на протяжении всей истории исследований, чтобы показать, что оно безопасно и эффективно для предполагаемого использования в Соединенных Штатах, компания может подать заявку - Заявка на новый препарат (NDA) - коммерциализация и доступность препарата для клинического применения.[70] Статус NDA позволяет FDA изучить все представленные данные о лекарстве, чтобы принять решение о том, одобрять или не одобрять лекарство-кандидат на основе его безопасности, специфичности действия и эффективности доз.[70]
Смотрите также
- Antitarget
- Биоинформатика
- Биомедицинская информатика
- Хеминформатика
- Открытие лекарств привело к успеху
- Метаболизм лекарств
- Открытие лекарств на основе фрагментов
- Скрининг высокого содержания
- Фармакогенетика
- Фармакогнозия
- Фармакокинетическое моделирование на физиологической основе
- Доклиническая разработка
- Белковая динамическая комбинаторная химия
- Открытие и разработка ингибиторов протонной помпы
- Открытие и разработка агонистов рецепторов мелатонина
- Открытие и разработка нуклеозидных и нуклеотидных ингибиторов обратной транскриптазы
- Открытие и разработка ингибиторов тирозинкиназы Bcr-Abl
- Открытие и разработка антиандрогенов
- Открытие и разработка цефалоспоринов
- Дизайн ретрометаболических препаратов
Рекомендации
- ^ «Процесс разработки лекарств». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. 4 января 2018 г.. Получено 18 декабря 2019.
- ^ а б c «Процесс разработки лекарств: Шаг 1: Открытие и разработка». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. 4 января 2018 г.. Получено 18 декабря 2019.
- ^ «Процесс разработки лекарства: Шаг 3: Клинические исследования». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. 4 января 2018 г.. Получено 18 декабря 2019.
- ^ Энсон Д., Ма Дж., Хе Дж. К. (1 мая 2009 г.). «Выявление кардиотоксических соединений». Новости генной инженерии и биотехнологии. TechNote. 29 (9). Мэри Энн Либерт. С. 34–35. ISSN 1935-472X. OCLC 77706455. Архивировано из оригинал 21 сентября 2012 г.. Получено 25 июля 2009.
- ^ Пол С.М., Мителка Д.С., Данвидди К.Т., Персингер С.К., Мунос Б.Н., Линдборг С.Р., Шахт А.Л. (март 2010 г.). «Как повысить продуктивность НИОКР: великая задача фармацевтической отрасли». Обзоры природы. Открытие наркотиков. 9 (3): 203–14. Дои:10.1038 / nrd3078. PMID 20168317. S2CID 1299234.
- ^ а б c d Текущая модель финансирования разработки лекарств: от идеи до утверждения. Институт медицины (США), Форум по открытию, разработке и переводу лекарственных средств, National Academies Press, Вашингтон (округ Колумбия). 2009 г.
- ^ Уоррен Дж (апрель 2011 г.). «Открытие лекарств: уроки эволюции». Британский журнал клинической фармакологии. 71 (4): 497–503. Дои:10.1111 / j.1365-2125.2010.03854.x. ЧВК 3080636. PMID 21395642.
- ^ Такенака Т. (сентябрь 2001 г.). «Классическая фармакология против обратной в открытии лекарств». BJU International. 88 Дополнение 2: 7–10, обсуждение 49–50. Дои:10.1111 / j.1464-410X.2001.00112.x. PMID 11589663.
- ^ Ли Дж.А., Улик М.Т., Моксхэм К.М., Томандл Д., Салл Д.Д. (май 2012 г.). «Открытие современных фенотипических лекарств - это жизнеспособная неоклассическая фармацевтическая стратегия». Журнал медицинской химии. 55 (10): 4527–38. Дои:10.1021 / jm201649s. PMID 22409666.
- ^ Элион ГБ (1993). «В поисках лекарства». Ежегодный обзор фармакологии и токсикологии. 33: 1–23. Дои:10.1146 / annurev.pa.33.040193.000245. PMID 8494337.
- ^ Элион ГБ. «Пуриновый путь к химиотерапии. Нобелевская лекция 1988 г.».
- ^ Блэк Дж. «Лекарства из выхолощенных гормонов: принципы синоптического антагонизма. Нобелевская лекция 1988 г.». Получено 28 февраля 2014.
- ^ Эндо А. «Открытие статинов и их разработка». Получено 28 февраля 2014.
- ^ Уоттс Джи (2012).«Некролог: сэр Дэвид Джек». Ланцет. 379 (9811): 116. Дои:10.1016 / S0140-6736 (12) 60053-1. S2CID 54305535.
- ^ Суинни, округ Колумбия, Энтони Дж (июль 2011 г.). «Как были открыты новые лекарства?». Обзоры природы. Открытие наркотиков. 10 (7): 507–19. Дои:10.1038 / nrd3480. PMID 21701501. S2CID 19171881.
- ^ Раск-Андерсен М., Альмен М.С., Шёт HB (август 2011 г.). «Тенденции в использовании новых мишеней для наркотиков». Обзоры природы. Открытие наркотиков. 10 (8): 579–90. Дои:10.1038 / nrd3478. PMID 21804595. S2CID 3328752.
- ^ Джейкобсон, Кеннет А. (2015). «Новые парадигмы в открытии лекарств GPCR». Биохимическая фармакология. 98 (4): 541–555. Дои:10.1016 / j.bcp.2015.08.085. ISSN 0006-2952. ЧВК 4967540. PMID 26265138.
- ^ Бейкер М (9 января 2017 г.). «Обманчивый куркумин - поучительная история для химиков». Природа. 541 (7636): 144–145. Дои:10.1038 / 541144a. PMID 28079090.
- ^ Далин Дж. Л., Уолтерс М. А. (июль 2014 г.). «Важнейшая роль химии в высокопроизводительной сортировке по скринингу». Медицинская химия будущего. 6 (11): 1265–90. Дои:10.4155 / fmc.14.60. ЧВК 4465542. PMID 25163000.
- ^ Baell JB, Holloway GA (апрель 2010 г.). «Новые фильтры субструктуры для удаления соединений, мешающих анализу (PAINS), из скрининговых библиотек и для исключения их из биологических анализов». Журнал медицинской химии. 53 (7): 2719–40. CiteSeerX 10.1.1.394.9155. Дои:10.1021 / jm901137j. PMID 20131845.
- ^ Хопкинс А.Л., Жених С.Р., Алекс А. (май 2004 г.). «Эффективность лиганда: полезный показатель для выбора лида». Открытие наркотиков сегодня. 9 (10): 430–1. Дои:10.1016 / S1359-6446 (04) 03069-7. PMID 15109945.
- ^ Рикманс Т., Эдвардс М.П., Хорн В.А., Коррейя А.М., Оуэн Д.Р., Томпсон Л.Р., Тран И., Тутт М.Ф., Янг Т. (август 2009 г.). «Быстрая оценка новой серии селективных агонистов CB (2) с использованием протоколов параллельного синтеза: анализ липофильной эффективности (LipE)». Письма по биоорганической и медицинской химии. 19 (15): 4406–9. Дои:10.1016 / j.bmcl.2009.05.062. PMID 19500981.
- ^ Leeson PD, Springthorpe B (ноябрь 2007 г.). «Влияние лекарств на принятие решений в медицинской химии». Обзоры природы. Открытие наркотиков. 6 (11): 881–90. Дои:10.1038 / nrd2445. PMID 17971784. S2CID 205476574.
- ^ Rester U (июль 2008 г.). «От виртуальности к реальности - виртуальный скрининг при обнаружении и оптимизации потенциальных клиентов: перспектива медицинской химии». Текущее мнение в области открытия и разработки лекарств. 11 (4): 559–68. PMID 18600572.
- ^ Роллингер Дж. М., Ступпнер Х, Лангер Т. (2008). «Виртуальный скрининг для открытия биологически активных натуральных продуктов». Природные соединения как лекарства Том I. Прогресс в исследованиях лекарств. 65. С. 211, 213–49. Дои:10.1007/978-3-7643-8117-2_6. ISBN 978-3-7643-8098-4. ЧВК 7124045. PMID 18084917.
- ^ Барселлос, Б. Б., Паули I, Касерес Р. А., Тиммерс Л. Ф., Диас Р., де Азеведо В. Ф. (декабрь 2008 г.). «Молекулярное моделирование как инструмент открытия лекарств». Текущие цели в отношении лекарств. 9 (12): 1084–91. Дои:10.2174/138945008786949388. PMID 19128219.
- ^ Даррант Дж. Д., Маккаммон Дж. А. (октябрь 2011 г.). «Моделирование молекулярной динамики и открытие лекарств». BMC Биология. 9: 71. Дои:10.1186/1741-7007-9-71. ЧВК 3203851. PMID 22035460.
- ^ Borhani DW, Shaw DE (январь 2012 г.). «Будущее моделирования молекулярной динамики в открытии лекарств». Журнал компьютерного молекулярного дизайна. 26 (1): 15–26. Дои:10.1007 / s10822-011-9517-у. ЧВК 3268975. PMID 22183577.
- ^ Ciemny M, Kurcinski M, Kamel K, Kolinski A, Alam N, Schueler-Furman O, Kmiecik S (май 2018 г.). «Белок-пептидный докинг: возможности и проблемы». Открытие наркотиков сегодня. 23 (8): 1530–1537. Дои:10.1016 / j.drudis.2018.05.006. PMID 29733895.
- ^ Эрлансон Д.А., Макдауэлл Р.С., О'Брайен Т. (июль 2004 г.). «Открытие лекарств на основе фрагментов». Журнал медицинской химии. 47 (14): 3463–82. Дои:10.1021 / jm040031v. PMID 15214773.
- ^ Folkers G, Jahnke W, Erlanson DA, Mannhold R, Kubinyi H (2006). Фрагментные подходы в открытии лекарств (методы и принципы медицинской химии). Вайнхайм: Wiley-VCH. ISBN 978-3-527-31291-7.
- ^ Эрлансон Д.А. (июнь 2011 г.). «Введение в открытие лекарств на основе фрагментов». Открытие лекарств на основе фрагментов и рентгеновская кристаллография. Темы современной химии. 317. С. 1–32. Дои:10.1007/128_2011_180. ISBN 978-3-642-27539-5. PMID 21695633.
- ^ Зартлер Э, Шапиро М (2008). Открытие лекарств на основе фрагментов - практический подход. Вайли.
- ^ Грини М.Ф., Бхат В.Т. (2010). «Глава 2: Белковая динамическая комбинаторная химия». В Миллер Б.Л. (ред.). Динамическая комбинаторная химия: в области открытия лекарств, биоинорганической химии и материаловедения. Нью-Джерси: John Wiley & Sons. С. 43–82.
- ^ Хуанг Р., Люн И.К. (июль 2016 г.). «Белковая динамическая комбинаторная химия: руководство по открытию белковых лигандов и ингибиторов». Молекулы. 21 (7): 910. Дои:10.3390 / молекулы21070910. ЧВК 6273345. PMID 27438816.
- ^ Мондал М., Хирш А. К. (апрель 2015 г.). «Динамическая комбинаторная химия: инструмент для облегчения идентификации ингибиторов белковых мишеней». Обзоры химического общества. 44 (8): 2455–88. Дои:10.1039 / c4cs00493k. PMID 25706945.
- ^ Херрманн А (март 2014 г.). «Динамическая комбинаторная / ковалентная химия: инструмент для чтения, генерации и модуляции биологической активности соединений и смесей соединений». Обзоры химического общества. 43 (6): 1899–933. Дои:10.1039 / c3cs60336a. PMID 24296754.
- ^ Хохгюртель М, Лен Дж. М. (2006). «Глава 16: Динамическое комбинаторное разнообразие в открытии лекарств». В Jahnke W, Erlanson DA (ред.). Фрагментные подходы к открытию лекарств. Вайнхайм: Wiley-VCH. стр.341 –364.
- ^ Калиандро Р., Belviso DB, Aresta BM, de Candia M, Altomare CD (июнь 2013 г.). «Кристаллография белков и дизайн лекарств на основе фрагментов». Медицинская химия будущего. 5 (10): 1121–40. Дои:10.4155 / fmc.13.84. PMID 23795969.
- ^ Чилингарян З., Инь З., Окли А.Дж. (октябрь 2012 г.). «Фрагментный скрининг с помощью кристаллографии белков: успехи и недостатки». Международный журнал молекулярных наук. 13 (10): 12857–79. Дои:10.3390 / ijms131012857. ЧВК 3497300. PMID 23202926.
- ^ Valade A, Urban D, Beau JM (январь – февраль 2007 г.). «Выбор двумя галактозилтрансферазами различных связующих из одной динамической комбинаторной библиотеки на основе уридина». Журнал комбинаторной химии. 9 (1): 1–4. Дои:10.1021 / cc060033w. PMID 17206823.
- ^ Чжэн, Вэй; Торн, Наташа; МакКью, Джон С. (2013). «Фенотипические экраны как новый подход к открытию лекарств». Открытие наркотиков сегодня. 18 (21–22): 1067–1073. Дои:10.1016 / j.drudis.2013.07.001. ЧВК 4531371. PMID 23850704.
- ^ Суинни, Дэвид С .; Энтони, Джейсон (2011). «Как были открыты новые лекарства?». Обзоры природы Drug Discovery. 10 (7): 507–519. Дои:10.1038 / nrd3480. ISSN 1474-1776. PMID 21701501. S2CID 19171881.
- ^ Браун, Дин Дж .; Вобст, Хайке Дж. (18.07.2019). «Возможности и проблемы фенотипического скрининга для исследования нейродегенеративных заболеваний». Журнал медицинской химии. 63 (5): 1823–1840. Дои:10.1021 / acs.jmedchem.9b00797. ISSN 0022-2623. PMID 31268707.
- ^ Маршалл, С. Ф. (2016). «Надлежащая практика в открытии и разработке лекарственных средств на основе моделей: практика, применение и документация». CPT: Фармакометрия и системная фармакология. 5 (3): 93–122. Дои:10.1002 / psp4.12049. ЧВК 4809625. PMID 27069774.
- ^ Маршалл, С. Ф (2019). «Открытие и разработка лекарств на основе моделей: текущая передовая практика в отрасли, нормативные ожидания и перспективы на будущее». CPT: Фармакометрия и системная фармакология. 8 (2): 87–96. Дои:10.1002 / psp4.12372. ЧВК 6389350. PMID 30411538.
- ^ Ван Вейк, Роб С (2020). "Стратегия открытия и разработки лекарств на основе моделей для быстрой разработки комбинаций противотуберкулезных препаратов". Прикладные науки. 10 (2376): 2376. Дои:10.3390 / app10072376.
- ^ Роджер MJ, Рейгоса MJ, Педрол Н., Гонсалес Л. (2006), Аллелопатия: физиологический процесс с экологическими последствиями, Springer, стр. 1, ISBN 978-1-4020-4279-9
- ^ а б Фехер М, Шмидт Дж. М. (2003). «Распределение свойств: различия между лекарствами, натуральными продуктами и молекулами из комбинаторной химии». Журнал химической информации и компьютерных наук. 43 (1): 218–27. Дои:10.1021 / ci0200467. PMID 12546556.
- ^ а б Newman DJ, Cragg GM (март 2007 г.). «Натуральные продукты как источники новых лекарств за последние 25 лет». Журнал натуральных продуктов. 70 (3): 461–77. Дои:10.1021 / np068054v. PMID 17309302.
- ^ фон Нуссбаум Ф., Брэндс М, Хинзен Б., Вейганд С., Хэбих Д. (август 2006 г.). «Антибактериальные натуральные продукты в медицинской химии - исход или возрождение?». Angewandte Chemie. 45 (31): 5072–129. Дои:10.1002 / anie.200600350. PMID 16881035.
Обработка натуральных продуктов обременительна, требует нестандартных рабочих процессов и растянутых сроков. Пересмотр натуральных продуктов с помощью современной химии и биологических инструментов поиска целей (обратная геномика) - один из вариантов их возрождения.
- ^ Ли Дж. У., Ведерас Дж. С. (июль 2009 г.). «Открытие лекарств и натуральные продукты: конец эпохи или бесконечный рубеж?». Наука. 325 (5937): 161–5. Дои:10.1126 / science.1168243. PMID 19589993. S2CID 207777087.
При существующей структуре HTS в основных фармацевтических отраслях и ужесточении правительственных ограничений на одобрение лекарств, возможно, что количество новых лекарств, полученных из натуральных продуктов, может упасть до нуля. Однако это, вероятно, будет временным, поскольку потенциал для новых открытий в долгосрочной перспективе огромен.
- ^ Харви А.Л., Эдрада-Эбель Р., Куинн Р.Дж. (2015). «Возрождение натуральных продуктов для открытия лекарств в эпоху геномики» (PDF). Обзоры природы. Открытие наркотиков. 14 (2): 111–29. Дои:10.1038 / nrd4510. HDL:10072/141449. PMID 25614221. S2CID 12369182.
Здесь мы рассматриваем стратегии скрининга натуральных продуктов, которые используют последние технические достижения, которые снизили [технические барьеры для скрининга натуральных продуктов в высокопроизводительных анализах]. Растущее признание функциональных анализов и фенотипических тестов может еще больше способствовать возрождению интереса к натуральным продуктам для открытия новых лекарств.
- ^ Ньюман ди-джей, Крэгг GM (2016). «Натуральные продукты как источники новых лекарств с 1981 по 2014 годы». Журнал натуральных продуктов. 79 (3): 629–61. Дои:10.1021 / acs.jnatprod.5b01055. PMID 26852623.
... использование натуральных продуктов и / или их новых структур для открытия и разработки окончательного лекарственного препарата все еще живо и хорошо. Например, в области рака за период времени с 1940-х годов до конца 2014 года из 175 одобренных малых молекул 131, или 75%, не являются «S» (синтетическими), причем 85 или 49% - это либо натуральные продукты, либо полученные напрямую из них.
- ^ Торре Б.Г., Альберисио Ф. (2017). «Фармацевтическая промышленность в 2016 году. Анализ одобренных FDA лекарств с точки зрения типа молекулы». Молекулы (Базель, Швейцария). 22 (3): 368. Дои:10.3390 / молекулы 22030368. ЧВК 6155368. PMID 28264468.
Результаты 2016 года указывают на то, что так называемые малые молекулы теряют позиции по сравнению с биологическими препаратами, биомолекулами и другими молекулами, вдохновленными натуральными продуктами.
- ^ Саттон Д. (2007). "Педаниос Диоскорид: Регистрация лекарственного использования растений". В Huxley R (ред.). Великие натуралисты. Лондон: Темза и Гудзон, с Музей естественной истории. С. 32–37. ISBN 978-0-500-25139-3.
- ^ а б Ан К. (март 2017 г.). «Мировая тенденция использования растительных препаратов и стратегии разработки глобальных лекарств». BMB отчеты. 50 (3): 111–116. Дои:10.5483 / BMBRep.2017.50.3.221. ЧВК 5422022. PMID 27998396.
- ^ Wink M (сентябрь 2015 г.). «Способы действия лекарственных растений и вторичных метаболитов растений». Лекарства. 2 (3): 251–286. Дои:10.3390 / лекарства2030251. ЧВК 5456217. PMID 28930211.
- ^ Оиси С., Кимура С.И., Ногучи С., Кондо М., Кондо Ю., Симокава Ю., Ивао Ю., Итаи С. (январь 2018 г.). «Новая методология уменьшения масштаба от коммерческого до лабораторного для оптимизации составов мягких гелевых капсул растительного происхождения в коммерческом масштабе». Международный журнал фармацевтики. 535 (1–2): 371–378. Дои:10.1016 / j.ijpharm.2017.11.029. PMID 29154803.
- ^ а б c d Фингрут О., Флешер Э. (апрель 2002 г.). «Гормоны стресса растений подавляют пролиферацию и вызывают апоптоз в раковых клетках человека». Лейкемия. 16 (4): 608–16. Дои:10.1038 / sj.leu.2402419. PMID 11960340.
- ^ Чжан М., Чжан М.В., Чжан Л., Чжан Л. (2015-07-24). «Метилжасмонат и его потенциал в терапии рака». Сигнализация и поведение растений. 10 (9): e1062199. Дои:10.1080/15592324.2015.1062199. ЧВК 4883903. PMID 26208889.
- ^ а б Тернер Дж. Г., Эллис С., Devoto A (2002). «Путь сигнала жасмоната». Растительная клетка. 14 Suppl (Suppl): S153–64. Дои:10.1105 / tpc.000679. ЧВК 151253. PMID 12045275.
- ^ Ахмад П., Расул С., Гул А., Шейх С.А., Акрам Н.А., Ашраф М., Кази А.М., Гусель С. (2016). «Жасмонат: многофункциональная роль в устойчивости к стрессу». Границы науки о растениях. 7: 813. Дои:10.3389 / fpls.2016.00813. ЧВК 4908892. PMID 27379115.
- ^ Ротем Р., Хейфетс А., Фингрут О., Бликштейн Д., Шаклай М., Флешер Е. (март 2005 г.). «Жасмонаты: новые противораковые агенты, действующие непосредственно и избирательно на митохондрии раковых клеток человека». Исследования рака. 65 (5): 1984–93. Дои:10.1158 / 0008-5472.CAN-04-3091. PMID 15753398.
- ^ а б Мишле Дж. Ф., Олив С., Риэ Э, Фагот Д., Симонетти Л., Гейли Дж. Б., Далко-Чиба М., Бернар Б. А., Перейра Р. (май 2012 г.). «Антивозрастной потенциал нового производного жасмоновой кислоты (LR2412): оценка in vitro с использованием реконструированного эпидермиса Episkin ™». Экспериментальная дерматология. 21 (5): 398–400. Дои:10.1111 / j.1600-0625.2012.01480.x. PMID 22509841.
- ^ Генриет Э., Ягер С., Тран С., Бастьен П., Мишле Дж. Ф., Минондо А. М., Форманек Ф., Далко-Чиба М., Лортат-Якоб Х., Бретон Л., Вивес Р. Р. (сентябрь 2017 г.). «Производное жасмоновой кислоты улучшает заживление кожи и вызывает изменения в экспрессии протеогликанов и структуре гликозаминогликанов». Biochimica et Biophysica Acta (BBA) - Общие предметы. 1861 (9): 2250–2260. Дои:10.1016 / j.bbagen.2017.06.006. PMID 28602514.
- ^ а б c Клессиг Д.Ф., Тиан М., Чой Х.В. (2016-05-26). «Множественные мишени салициловой кислоты и ее производных у растений и животных». Границы иммунологии. 7: 206. Дои:10.3389 / fimmu.2016.00206. ЧВК 4880560. PMID 27303403.
- ^ Пирпойнт WS (1994). «Салициловая кислота и ее производные в растениях: лекарства, метаболиты и молекулы-мессенджеры». В Kuntz M (ред.). Достижения в ботанических исследованиях. 20. С. 163–235. Дои:10.1016 / S0065-2296 (08) 60217-7. ISBN 978-0-12-809447-1.
- ^ Фолкнер DJ, Newman DJ, Cragg GM (февраль 2004 г.). «Исследования морской флоры и фауны островов Палау». Отчеты о натуральных продуктах. 21 (1): 50–76. Дои:10.1039 / b300664f. PMID 15039835.
- ^ а б «Процесс разработки лекарств. Шаг 4: Обзор лекарств FDA». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. 4 января 2018 г.. Получено 18 декабря 2019.
дальнейшее чтение
- Гад SC (2005). Справочник по открытию лекарств. Хобокен, штат Нью-Джерси: Wiley-Interscience / J. Вайли. ISBN 978-0-471-21384-0.
- Мадсен Ю., Крогсгаард-Ларсен П., Лильефорс Т. (2002). Учебник по созданию и открытию лекарств. Вашингтон, округ Колумбия: Тейлор и Фрэнсис. ISBN 978-0-415-28288-8.
- Расмуссен Н (2014). Джин-Жокеи: Наука о жизни и рост биотехнологического предприятия. Балтимор: Издательство Университета Джона Хопкинса. ISBN 978-1-42141-340-2.