Открытие и разработка антиандрогенов - Википедия - Discovery and development of antiandrogens
Эта статья об открытии и развитии антиандрогены, или же рецептор андрогенов (AR) антагонисты.
В 1960-х годах был открыт первый антиандроген. Антиандрогены противодействовать в рецептор андрогенов (AR) и тем самым блокируют биологические эффекты тестостерон и дигидротестостерон (DHT). Антиандрогены важны для мужчин с гормонально-зависимыми заболеваниями, такими как рак простаты, доброкачественная гиперплазия предстательной железы (Л.с.), угревая сыпь, себорея, гирсутизм и андрогенная алопеция. Антиандрогены в основном используются для лечения заболеваний простаты.[1][2][3] Исследования 2010 года показывают, что АР могут быть связаны с прогрессированием заболевания. тройной отрицательный рак груди и карцинома слюнных протоков[4] и что антиандрогены потенциально могут быть использованы для его лечения.[5][6]
По состоянию на 2010 г.[Обновить] антиандрогены маленькие молекулы и может быть либо стероидный или же нестероидный в зависимости от лиганд химия. Стероидные антиандрогены имеют аналогичную стероидную структуру, в то время как нестероидные антиандрогены (NSAA) могут иметь структурно отличительные фармакофоры. Доступно только ограниченное количество соединений для клинический несмотря на то, что было обнаружено и исследовано очень большое количество антиандрогенных соединений.[2]
История
В начале ХХ века отношения между гипофиз, яички и простата был установлен. Американский врач Чарльз Брентон Хаггинс выяснил, что кастрация или же эстроген администрация привела к железистому атрофия у мужчин, которые можно было исправить повторным введением андрогенов. В 1941 году Хаггинс лечил больных раком простаты андрогенной аблацией с кастрацией или терапией эстрогенами; благотворное влияние андрогенной абляции на метастатический Реализован рак простаты, за что ему была присуждена Нобелевская премия по физиологии и медицине в 1966 г.[1]
Стало очевидно, что одной лишь абляции андрогенов недостаточно для лечения пациентов с распространенным раком простаты. В конце 1960-х гг. рецептор андрогенов (AR) был обнаружен и охарактеризован. Показ химические библиотеки для блокаторов AR привело к открытию первого антиандрогена, ципротерон. An ацетат группа затем была добавлена к ципротерону и создана ципротерона ацетат. В 1970-х годах антиандрогены флутамид был открыт. В 1989 году США Управление по контролю за продуктами и лекарствами (FDA) одобрило его использование для лечения рака простаты. В 1995 г. бикалутамид был одобрен, и нилутамид последовал год спустя.[1][7]
Рецептор андрогенов

АР принадлежит стероидный рецептор подсемейство ядерный рецептор надсемейство. Его функция регулируется привязка андрогенов, что инициирует последовательные изменения экстерьера из рецептор что влияет на рецептор-белок и взаимодействия рецептор-ДНК. Эндогенный Андрогены - это в основном тестостерон и ДГТ.[8][9][10][11] AR экспрессируется в клетках широкого спектра тканей по всему телу, за пределами первичных и вторичных половых органов.[12]
AR ген имеет длину более 90 КБ и кодирует белок 919 аминокислоты. У человека был идентифицирован только один ген AR, расположенный на хромосома X. Он состоит из четырех основных регионов, см. Рисунок 1:[2][3][7][8]
- N-концевой домен (NTD), который выполняет модулирующую функцию.
- ДНК-связывающий домен (DBD), который распознает и связывается с элементами ответа андрогена (ARE) в последовательности целевого гена.
- Лиганд-связывающий домен (LBD), который отвечает за распознавание и связывание лиганда.
- Небольшая шарнирная область между DBD и LBD.
В AR были идентифицированы две функции, которые играют критическую роль в регуляции целевого гена. трансактивация, N-концевую функцию активации 1 (AF1) и C-терминал функция активации 2 (AF2). AF1 не зависит от лиганда и играет главную роль в трансактивации целевого гена. AF2 является лиганд-зависимым и выполняет только ограниченную функцию.[8][10]
Механизм действия
Несвязанный AR в основном расположен в цитоплазма, как типичный стероидный рецептор, и связан с комплексом белки теплового шока (HSP) через взаимодействие с LBD. Андрогены, либо агонисты или антагонисты, располагаются в кармане для связывания лиганда (LBP) цитозольный AR и привяжите к LBD, см. Рисунок 2. AR проходит серию конформационный изменения и HSP диссоциируют от AR. Преобразованный AR подвергается димеризация, фосфорилирование и перемещает к ядру. Затем перемещенный рецептор связывается с элементами андрогенного ответа (ARE) на промоутер гена, чувствительного к андрогену, консенсусная последовательность, расположенная выше или ниже сайт начала транскрипции (TSS) генов-мишеней AR. Наем других транскрипция кофакторы (включая коактиваторы и корепрессоры) и общий механизм транскрипции дополнительно обеспечивают трансактивацию регулируемых AR экспрессия гена. Все эти сложные процессы инициируются лиганд-индуцированными конформационными изменениями в LBD. Лиганд-специфический набор корегуляторы может иметь решающее значение для агонистической или антагонистической активности лигандов AR. Связывание ДНК также необходимо для регулируемой AR экспрессии генов, также известной как классическая функция геномных генов AR.[7][8][10]
Разработка антиандрогенов
Ципротерон - это стероидный антиандроген, который конкурентно ингибирует связывание тестостерона или ДГТ с АР. Ципротерон связывается с AR, которые экспрессируются клетками рака простаты, а также с AR, которые экспрессируются в гипоталамус и гипофиз. Таким образом, ципротерон блокирует негативный отзыв андрогенов на гипоталамо-гипофизарном уровне, что приводит к увеличению лютеинизирующий гормон (ЛГ) сывороточные уровни. Это повышение уровня ЛГ вызывает повышение уровня тестостерона в сыворотке и, в конечном итоге, снижает способность ципротерона конкурировать за связывание AR и блокировать андрогенные эффекты. стимуляция.[1][7]
Ципротерона ацетат был разработан для решения этой проблемы. Он образуется путем добавления ацетатной группы к ципротерону, см. Рисунок 3. Ацетат ципротерона имеет двойной механизм действия, поскольку он напрямую конкурирует с DHT за связывание с AR, но также ингибирует гонадотропин секреция. Тем самым он снижает уровни андрогенов, эстрогенов и ЛГ.[1][7] Ципротерона ацетат действует как непосредственно как антиандроген в клетках рака простаты, так и косвенно снижает уровень тестостерона в сыворотке. Последний вызывает ограничения ципротерона ацетата, которые являются центральными эффектами на секрецию андрогенов, с последующей потерей либидо и сексуальная потенция. В нескольких отчетах также говорится, что ацетат ципротерона вызывает печень гиперплазия. Эти побочные эффекты дали фармацевтическим компаниям стимул к поиску альтернативных, «чистых» NSAA, которые не имели бы этих побочных эффектов.[1] Чистые антиандрогены блокируют рецептор андрогенов, не проявляя агонистической или другой гормональной активности.[3]
Флутамид стал первым НПВС, прошедшим клинические испытания. Позднее были разработаны НПВС бикалутамид и нилутамид. Предполагаемые преимущества этих соединений заключались в том, что они не влияли на либидо или потенцию, как другие разрабатываемые соединения центрального действия. гормон, высвобождающий лютеинизирующий гормон (LHRH) агонисты и ацетат ципротерона. Но эта теория не подтвердилась. Эти NSAA в конечном итоге пересекли гематоэнцефалический барьер, как и ацетат ципротерона, что приводит к последующему повышению уровня тестостерона в сыворотке.[1]
Флутамид

Флутамид - это арилпропионамид аналог с чистыми антиандрогенными свойствами, как показано на рисунке 4. Он полностью абсорбируется из желудочно-кишечный тракт после перорального приема и подвергается обширному метаболизм первого прохождения в его активную форму, 2-гидроксифлутамид, и гидролиз продукт, 3-трифторметил-4-нитроанилин.[7][9][10] Гидроксифлутамид является более сильным антагонистом AR, чем флутамид. in vivo, с более высокой аффинностью связывания с AR. Гидроксифлутамид устраняется период полураспада около 8 часов у человека. Гидролиз амидная связь представляет собой основной метаболический путь для этого активного метаболит. Обращая вспять стимулирующий эффект ДГТ на вес вентральной части простаты, флутамид примерно в 2 раза больше мощный чем ципротерона ацетат. Гидроксифлутамид имеет относительно низкую аффинность связывания с AR и поэтому обычно используется в высоких дозах для достижения полной блокады AR в терапии.[9][13]
Нилутамид
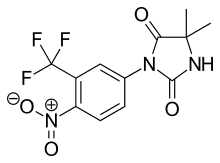
Нилутамид является нитроароматическим гидантоин аналог флутамида, как показано на рисунке 5.[9][10] Нилутамид выводится исключительно путем метаболизма, в основном за счет снижения ароматный нитрогруппа. Хотя гидролиз одного из карбонил были идентифицированы функции имидазолиндиона, он гораздо менее подвержен метаболизму в печени, чем амидная связь в гидроксуфлутамиде. Это приводит к увеличению периода полувыведения нилутамида у людей до 2 дней. Тем не менее, не содержащий нитроанионов радикальный образующийся при нитро восстановлении все еще может быть связан с гепатотоксичность у людей, особенно при использовании относительно высоких доз, используемых для блокировки андрогенов.[9] Нилутамид вызывает побочные эффекты, ограничивающие его использование, например: пневмонит и задержка адаптации к темноте.[7]
Бикалутамид

Бикалутамид представляет собой аналог арилпропионамида, показанный на фиг.6.[9][10] Он заменил флутамид и нилутамид в качестве антиандрогена первого выбора для лечения рака простаты. Бикалутамид не так гепатотоксичен, как флутамид и нилутамид, и имеет более длительный период полувыведения, 6 дней у человека, что позволяет применять его один раз в день в более низкой дозировке. Бикалутамид разделяет структуру амидной связи с флутамидом. Несмотря на это, гидролиз амидной связи был обнаружен у крыс, а не у людей, что может объяснить продолжительный период полураспада бикалутамида у людей.[9]
Бикалутамид имеет циано группа на пара положение вместо нитрогруппы, такой как флутамид и нилутамид. Это изменение в группах позволяет избежать нитро-восстановления, наблюдаемого в нилутамиде. Бикалутамид имеет хиральный углерод в своей структуре (отмечен звездочкой на рисунке 6), который связан с гидроксильной и метильной группами. Поэтому он применяется как рацемат.[9] Расследование после утверждения показало, что его антиандрогенная активность почти полностью связана с (R) -энантиомер. (R) -бикалутамид имеет почти в четыре раза более высокое сродство к AR простаты, чем гидроксифлутамид, и имеет лучший профиль побочных эффектов по сравнению с другими антиандрогенами.[9][10]
Структура и взаимосвязь деятельности
Стероидные антиандрогены
Ципротерона ацетат представляет собой 6-хлор-1,2-метиленовое производное 17α-ацетоксипрогестерона. Он показывает большую антиандрогенную активность вместе с андрогенной активностью. Ципротерона ацетат проявляет высокое сродство к AR у крыс, которое увеличивается, когда 1,2-метиленовая группа удаляется из соединения. Если хлор атом заменяется на метильная группа связывание немного уменьшается, тогда как дальнейшее удаление двойной связи C6 изменяет кинетику связывания, см. рисунок 7.[3]

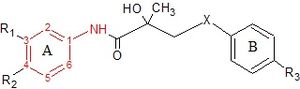

Нестероидные антиандрогены
Гидроксифлутамид и его аналоги бикалутамид и нилутамид имеют общий анилид кольцевая структура. Структуры можно увидеть на рисунке 7, где анилидное кольцо окрашено в красный цвет. Эти три соединения нуждаются в электронно-дефицитном ароматическом кольце для эффективного связывания AR. Замена анилида на алкен дает слабоактивные соединения, что можно объяснить отсутствием внутримолекулярного связывание водорода или к плохой донорной способности водородных связей.[3] Различные комбинации электроноакцепторный замены в анилин кольцо этих препаратов не показало более высокого связывания с рецептором AR по сравнению с соединениями, которые имеют хлор- или трифторметильную группу в мета-позиция (R1) и циано- или азотная группа в пара-положении (R2).[3][14]
Для гидроксифлутамида группа соединений, различающихся ароматическим кольцом, не связывается с AR. Это предполагает, что бис-замещение в гидроксифлутамидном кольце необходимо для высокого сродства связывания AR. Также было продемонстрировано, что гидроксифлутамид требует сильной донорной способности водородной связи третичной гидроксильной группы и фиксированных конформеров, участвующих во внутримолекулярном связывании водорода, для эффективного связывания с AR.[3][14]
Для бикалутамида антиандрогенная активность сульфид и сульфон замены X-связи были протестированы in vitro. Сульфиды показали в большинстве случаев по меньшей мере в 2 раза более высокое сродство к связыванию, чем соответствующие сульфоны. Однако это соотношение изменилось, когда группа R3 была NHSO.2CH3, где аффинность связывания сульфона была в 3 раза выше, чем у сульфида. Эти результаты показывают, что заместители B-кольца в значительной степени определяют влияние X-связи на связывание AR. Исследователи предположили, что третичная гидроксильная группа участвует в прямом взаимодействии с AR, потому что когда ацетил группа вводится в этот гидроксильный фрагмент, аффинность связывания рецептора значительно снижается.[14]
Нилутамид имеет очень низкое сродство к AR при тестировании на простате кастрированных крыс. Такие модификации, как замена атома N3 на кислород, мало влияют на сродство соединения к AR простаты. Заменив кислород атом с сера атом в положении C2 имидазол кольцо и добавление бутиловый спирт к атому N3 рецепторное связывание и биологическая активность соединения увеличиваются в 100 раз по сравнению с NSAA. Также соединение не связывается с другими рецепторами стероидов. Если метильная группа заменена на группу бутилового спирта, соединение проявляет в 3 и 10 раз большую антиандрогенную активность. in vivo чем бикалутамид и нилутамид соответственно.[3]
Синдром отмены антиандрогенов
Антиандрогены, имеющиеся в настоящее время на рынке, особенно полезны для лечения рака простаты на ранних стадиях. Однако рак простаты часто прогрессирует до гормонорефрактерный состояние, при котором рак прогрессирует в присутствии постоянного андрогена абляция или антиандрогенная терапия.[9] Это говорит о том, что длительное использование этих антиандрогенов во время рака простаты может привести к развитию андроген-независимых клеток рака простаты или способности андрогенов надпочечников поддерживать опухоль рост.[8] Это явление называется синдром отмены антиандрогенов (AWS) и является одним из основных недостатков существующих антиандрогенов. AWS определяется как регресс опухоли или облегчение симптомов, наблюдаемое после прекращения антиандрогенной терапии. Механизм этого полностью не изучен, но современные теории включают изменения гена AR, корегуляторные белки и / или пути передачи сигнала. Эта устойчивость к антиандрогенам также может быть связана с относительной слабостью существующих антиандрогенов, поскольку они имеют сродство в 50 или более раз ниже, чем сродство DHT к AR. Это также может объяснить, почему часто наблюдается компенсаторная гиперэкспрессия AR.[7]
Мутации гена рецептора андрогенов
Ген AR мутации в LBD, которые изменяют специфичность и / или функциональную активность лиганда, существуют и, как полагают, способствуют превращению некоторых антагонистов AR в агонисты, что объясняет парадоксальное временное улучшение, иногда наблюдаемое у пациентов после прекращения антиандрогенной терапии.[15] Эти мутации могут иметь большое влияние на антагонистическую активность существующих низкомолекулярных антиандрогенов и делать их менее эффективными в блокировании функции AR посредством косвенной модуляции изнутри LBP. Недавние исследования циркулирующих опухолевых клеток показывают, что частота мутаций выше, чем предполагалось ранее, исходя из опухоли. биопсия.[16]В T877A,[17] W741L и W741C мутации [18] являются примерами известных мутаций AR LBD. В LNCaP рак простаты клеточная линия экспрессирует AR с точечной мутацией T877A, которая вызывает пролиферацию в присутствии гидроксифлутамида и ципротерона ацетата антиандрогенов. Эта мутация также была обнаружена у пациентов с синдромом отмены антиандрогенов, получавших эти соединения.[17] В другом исследовании обработка бикалутамидом клеток LNCaP привела к двум мутациям LBD, W741L и W741C,[18] побуждая бикалутамид приобретать агонистическую активность в отношении обоих мутантных АР.[19] Мутация W741L создает дополнительное пространство, так что сульфонил-связанный фенил кольцо бикалутамида размещается на месте недостающего индол кольцо W741.[20] В немутантном AR присутствие боковой цепи W741, вероятно, вынуждает бикалутамид выступать наружу, что препятствует активному положению H12 на рецепторе AR. Однако гидроксифлутамид действует как антагонист для мутантных AR W741.[18] Это согласуется с теорией, согласно которой флутамид и нилутамид противодействуют AR посредством механизма «пассивного антагонизма», поскольку они имеют более скромный размер, чем бикалутамид.[20] Следовательно, эти препараты могут быть эффективны в качестве терапия второй линии для рефрактерного рака простаты, ранее леченного бикалутамидом.[18]
Текущее состояние
Антагонисты N-концевого домена
Антагонисты N-концевого домена (NTD) AR были предложены для преодоления ограничений существующих антиандрогенов в отношении мутантных AR путем прямого блокирования функции AR с поверхности белка за пределами LBP. Считается, что эта прямая блокада обеспечивает более эффективную стратегию предотвращения или преодоления ненормального действия AR во время AWS, а также обеспечивает большую гибкость при структурной модификации без пространственных ограничений жесткого LBP.[8]
Стероидные рецепторы имеют сходство в последовательностях генов и белковых структурах, что часто приводит к функциональным перекрестным помехам между стероидными рецепторами. Одним из критериев для антагонистов AR NTD является достижение высокой степени специфичности для AR. Однако важно понимать, что специфика AR не обязательно означает in vivo, поскольку антагонисты NTD могут также взаимодействовать с белками-мишенями, отличными от AR.[8]
Лиганд-связывающий домен в качестве целевого сайта
Активация AR требует формирования области функциональной активации 2 (AF2) в AR LBD, которая опосредует взаимодействия между AR и различными транскрипциями. кофакторы. Поэтому большая часть исследований антагонистов NTD AR сосредоточена на пептиды которые могут напрямую блокировать AF2 в AR LBD с поверхности белка. Даже в связанном мутантном AR антагонисты NTD могут блокировать функцию AF2 посредством прямого взаимодействия с поверхностью, независимо от связанного лиганда.[8]
Исследования этих антагонистов NTD обычно проводят путем скрининга аффинности фаговый дисплей библиотеки, которые экспрессируют случайные пептиды, содержащие различные фирменные мотивы. AR, по-видимому, явно предпочитают связывающие мотивы типа «FxxLF» (где F = фенилаланин, L = лейцин, и X = любой аминокислотный остаток), тогда как другие ядерные рецепторы имеют очень похожий механизм связывания для связывающих мотивов типа «LxxLL». Это дает уникальную возможность для разработки AR-специфических пептидов.[8]
Хотя низкомолекулярные антагонисты и антагонисты NTD, нацеленные на поверхность AF2, различаются по сайтам связывания, они оба ингибируют функцию AR, нарушая функцию AF2. Следовательно, механически эти антагонисты NTD можно также классифицировать как «антагонисты AF2».[8]

N-Терминальный домен в качестве целевого сайта
Функционально AR NTD играет основную роль в регуляции активации транскрипции целевого гена и опосредует различные N-концевые и С-концевые взаимодействия рецептор-белок и внутри рецептора. Следовательно, модуляция функции NTD считается эффективной стратегией нацеливания на действие AR. Среди различных функциональных доменов в различных ядерных рецепторах NTD является наименее консервативным и поэтому может стать лучшим сайтом-мишенью для антагонистов NTD для достижения специфичности AR. Однако структурные особенности NTD не определены из-за высокой степени гибкости его конформации. Обе биохимический и спектроскопия кругового дихроизма Анализ показывает, что AR NTD сильно нарушена в естественных условиях, что делает его сложной целью для открытия лекарств.[8]
В 2008 году были сообщения о хлорированном пептиде, синтокамид А, выделенный из морских губок, который эффективно ингибирует транскрипцию репортерного гена, активированного N-концевым доменом AR, см. фигуру 8.[21] Представленных доказательств было недостаточно, чтобы поддержать вывод о том, что синтокамид А напрямую подавляет функцию AR NTD, и механизм действия требует дальнейшего изучения.[8]
Селективные модуляторы рецепторов андрогенов
Доступные сегодня низкомолекулярные антиандрогены обладают нежелательными побочными эффектами, вызванными полным неселективным ингибированием действия AR. Чтобы свести к минимуму эти побочные эффекты, новый класс тканей селективные модуляторы андрогенных рецепторов (SARM) был предложен как новый подход к лечению рака простаты. Эти лиганды должны вести себя как антагонисты в простате без активности или агонистической активности в других тканях-мишенях, чтобы оказывать незначительное влияние или не оказывать никакого воздействия на анаболические ткани или Центральная нервная система (ЦНС). Однако открытие этого нового класса лигандов может быть сложной задачей, поскольку молекулярный механизм действия AR не совсем понятен.[8]
Было предложено несколько механизмов для достижения этой тканевой селективности лигандов AR. Существуют наиболее убедительные доказательства роли 5-альфа редуктаза. 5-альфа-редуктаза экспрессируется только в определенных тканях и, следовательно, может вносить уникальный вклад в тканевую селективность. Специфическое ингибирование фермента 2 типа финастерид блокирует превращение тестостерона в ДГТ в простате.[8]
Несколько подходов могут использовать потенциальное тканеспецифическое преобразование для разработки SARM, в том числе:
- Неактивные исходные соединения, которые активируются 5-альфа-редуктазой 2 типа в простате с образованием антиандрогенов.
- Агонисты AR, которые инактивируются 5-альфа-редуктазой 2 типа в простате.
- Агонисты AR, которые превращаются в антиандрогены только 5-альфа-редуктазой 2 типа в простате.[22]
Другие низкомолекулярные антиандрогены
Статус разработки других низкомолекулярных антиандрогенов, исследованных в 2011 году, можно увидеть в таблице 1.
| Название соединения | Структура | Компания | Стадия развития | Дополнительная информация | |
|---|---|---|---|---|---|
| RU58642 |  | Roussel-Uclaf SA | Доклинические - никаких дальнейших разработок с 1998 г. | Активен при пероральном приеме и более эффективен, чем современные мелкомолекулярные антиандрогены.[23] | |
| LG120907 | 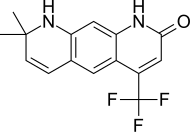 | Ligand Pharmaceuticals | Доклинические | Устно активный, сильный антагонистический деятельность в предстательная железа без повышения уровня в плазме LH и тестостерон.[24] | |
| LG105 |  | Ligand Pharmaceuticals | Доклинические | Доступен перорально, обладает сильным антагонистическим действием на предстательную железу без повышения уровня ЛГ и тестостерона в плазме. Вроде бы мощнее LG120907.[24] | |
| Апалутамид (Эрлеада) |  | Медивация | Одобренный | Высокая аффинность связывания с AR. В отличие от бикалутамид, он не способствует ядерной транслокации и нарушает связывание ДНК с андроген элементы реагирования и набор коактиваторы.[25] | |
| Энзалутамид (Xtandi) |  | Медивация | Одобренный | Высокая аффинность связывания с AR. В отличие от бикалутамида, он не способствует ядерной транслокации и нарушает как связывание ДНК с элементами ответа андрогенов, так и набор коактиваторов.[25] Вызывает опухолевые клетки апоптоз и не агонист Мероприятия.[26] | |
| BMS-641988 | 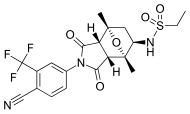 | Бристоль-Майерс Сквибб | Фаза I клиническая - испытание завершено | Показана повышенная эффективность по сравнению с бикалутамидом. Фаза I испытания была прекращена из-за эпилептический припадок у пациента.[27] Это привело к открытиям, что некоторые антиандрогены вызывают связывание нецелевых антагонистов с Рецепторы ГАМК-А.[28] | |
| CH5137291 | 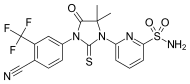 | Chugai Pharmaceutical Co. Ltd. | Доклинические | Полностью подавляет AR-опосредованную трансактивацию и пролиферацию модели ксенотрансплантата CRPC LNCaP-BC2, устойчивой к бикалутамиду.[29][30] |
 Рисунок 9 Атаровая кислота |  Рисунок 10 N-бутилбензолсульфонамид |
Природные антиандрогены
Атрариновая кислота и N-бутилбензолсульфонамид натуральные соединения с антиандрогенными свойствами, очищенные из коры африканского дерева Pygeum africanum см. рисунки 9 и 10.[31] В пробирке анализы показали, что оба они являются селективными агонистами AR и ингибируют пролиферацию нескольких линий клеток рака простаты. Атрариновая кислота также препятствует инвазии внеклеточного матрикса, и оба соединения способны предотвращать андроген-индуцированную ядерную транслокацию AR. В настоящее время синтезируются более сильнодействующие производные в надежде улучшить фармакологический профиль этих двух соединений.[32]
Смотрите также
Рекомендации
- ^ а б c d е ж грамм Denmeade SR, Isaacs JT (май 2002 г.). «История лечения рака простаты». Обзоры природы. Рак. 2 (5): 389–96. Дои:10.1038 / nrc801. ЧВК 4124639. PMID 12044015.
- ^ а б c Гао В. (октябрь 2010 г.). «Рецептор андрогенов как терапевтическая мишень». Расширенные обзоры доставки лекарств. 62 (13): 1277–84. Дои:10.1016 / j.addr.2010.08.002. PMID 20708648.
- ^ а б c d е ж грамм час Сингх С.М., Готье С., Лабри Ф. (февраль 2000 г.). «Антагонисты рецепторов андрогенов (антиандрогены): взаимосвязь структура-активность». Современная лекарственная химия. 7 (2): 211–47. Дои:10.2174/0929867003375371. PMID 10637363.
- ^ Уильямс Л., Томпсон Л.Д., Ситала Р.Р., Вайнреб И., Ассаад А.М., Тулук М., Уд Дин Н., Пургина Б., Лай С., Гриффит С.К., Чиоси С.И. (май 2015 г.). «Карцинома слюнных протоков: преобладание апокринной морфологии, преобладание гистологических вариантов и экспрессия рецепторов андрогенов». Американский журнал хирургической патологии. 39 (5): 705–13. Дои:10.1097 / па.0000000000000413. PMID 25871467. S2CID 24737257.
- ^ Гукальп А., Трэйна Т.А. (январь – февраль 2010 г.). «Тройной негативный рак груди: роль рецептора андрогенов». Журнал рака. 16 (1): 62–5. Дои:10.1097 / PPO.0b013e3181ce4ae1. PMID 20164692. S2CID 6922842.
- ^ Урбан Д., Ришин Д., Ангел С., Д'Коста I, Соломон Б. (март 2015 г.). «Абиратерон при метастатическом раке слюнных протоков». Журнал Национальной комплексной онкологической сети. 13 (3): 288–90. Дои:10.6004 / jnccn.2015.0040. PMID 25736005.
- ^ а б c d е ж грамм час Хендлер Б., Клив А. (апрель 2012 г.). «Последние разработки в области антиандрогенов и селективных модуляторов андрогенных рецепторов». Молекулярная и клеточная эндокринология. 352 (1–2): 79–91. Дои:10.1016 / j.mce.2011.06.002. PMID 21704118. S2CID 36184991.
- ^ а б c d е ж грамм час я j k л м п Гао В. (2010). «Пептидный антагонист рецептора андрогенов». Текущий фармацевтический дизайн. 16 (9): 1106–13. Дои:10.2174/138161210790963850. PMID 20030610.
- ^ а б c d е ж грамм час я j Гао В., Ким Дж., Далтон Дж. Т. (август 2006 г.). «Фармакокинетика и фармакодинамика лигандов нестероидных рецепторов андрогенов». Фармацевтические исследования. 23 (8): 1641–58. Дои:10.1007 / s11095-006-9024-3. ЧВК 2072875. PMID 16841196.
- ^ а б c d е ж грамм Лемке Т.Л., Уильямс Д.А. (2002). Принципы медицинской химии Фуа (5-е изд.). Балтимор [и др.]: Уильямс и Уилкинс. ISBN 978-0-683-30737-5.
- ^ Нараянан Р., Молер М.Л., Бол CE, Миллер Д.Д., Далтон Дж. Т. (2008). «Селективные модуляторы рецепторов андрогенов в доклинических и клинических разработках». Сигнализация ядерного рецептора. 6: e010. Дои:10.1621 / № 06010. ЧВК 2602589. PMID 19079612.
- ^ Гельманн EP (июль 2002 г.).«Молекулярная биология рецептора андрогенов». Журнал клинической онкологии. 20 (13): 3001–15. Дои:10.1200 / jco.2002.10.018. PMID 12089231.
- ^ Пойет П., Лабри Ф (октябрь 1985 г.). «Сравнение антиандрогенной / андрогенной активности флутамида, ципротерона ацетата и мегестрола ацетата». Молекулярная и клеточная эндокринология. 42 (3): 283–8. Дои:10.1016/0303-7207(85)90059-0. PMID 3930312. S2CID 24746807.
- ^ а б c Инь Д., Хе И, Перера М.А., Хонг С.С., Мархефка К., Стоурман Н., Кирковский Л., Миллер Д.Д., Далтон Д.Т. (январь 2003 г.). «Ключевые структурные особенности нестероидных лигандов для связывания и активации рецептора андрогенов». Молекулярная фармакология. 63 (1): 211–23. Дои:10.1124 / моль.63.1.211. ЧВК 2040236. PMID 12488554.
- ^ Миямото Х., Рахман М.М., Чанг С. (январь 2004 г.). «Молекулярные основы синдрома отмены антиандрогенов». Журнал клеточной биохимии. 91 (1): 3–12. Дои:10.1002 / jcb.10757. PMID 14689576. S2CID 5773128.
- ^ Цзян Ю., Пальма Дж. Ф., Агус Д. Б., Ван Й., Гросс МЭ (сентябрь 2010 г.). «Обнаружение мутаций рецептора андрогенов в циркулирующих опухолевых клетках при устойчивом к кастрации раке простаты» (PDF). Клиническая химия. 56 (9): 1492–5. Дои:10.1373 / Clinchem.2010.143297. PMID 20581083.
- ^ а б Сузуки Х, Акакура К., Комия А., Аида С., Акимото С., Симадзаки Дж. (Сентябрь 1996 г.). «Мутация кодона 877 в гене рецептора андрогенов при распространенном раке простаты: связь с синдромом отмены антиандрогенов». Простаты. 29 (3): 153–8. Дои:10.1002 / 1097-0045 (199609) 29: 3 <153 :: aid-pros2990290303> 3.0.co; 2-5. PMID 8827083.
- ^ а б c d Хара Т., Миядзаки Дж., Араки Х., Ямаока М., Канзаки Н., Кусака М., Миямото М. (январь 2003 г.). «Новые мутации рецептора андрогенов: возможный механизм синдрома отмены бикалутамида». Исследования рака. 63 (1): 149–53. PMID 12517791.
- ^ Бол С.Е., Гао В., Миллер Д.Д., Белл С.Е., Далтон Дж. Т. (апрель 2005 г.). «Структурная основа антагонизма и устойчивости бикалутамида при раке простаты». Труды Национальной академии наук Соединенных Штатов Америки. 102 (17): 6201–6. Дои:10.1073 / pnas.0500381102. ЧВК 1087923. PMID 15833816.
- ^ а б Nahleh, Z (2008). «Функциональный и структурный анализ рецепторов андрогенов для открытия противораковых лекарств» (PDF). Лечение рака. 6: 439–444. Архивировано из оригинал (PDF) на 2012-04-24. Получено 2011-09-27.
- ^ Садар, Мэриленд, Уильямс, Мавджи Н.Р., Патрик Б.О., Виканта Т., Часана Э., Ирианто Х.Э., Сост Р.В., Андерсен Р.Дж. (ноябрь 2008 г.). «Синтокамиды от A до E, хлорированные пептиды из губки Dysidea sp., Которые ингибируют трансактивацию N-конца рецептора андрогенов в клетках рака простаты». Органические буквы. 10 (21): 4947–50. Дои:10.1021 / ol802021w. PMID 18834139.
- ^ Гао В., Далтон Дж. Т. (март 2007 г.). «Расширение терапевтического использования андрогенов с помощью селективных модуляторов рецепторов андрогенов (SARM)». Открытие наркотиков сегодня. 12 (5–6): 241–8. Дои:10.1016 / j.drudis.2007.01.003. ЧВК 2072879. PMID 17331889.
- ^ Батманн Т., Бранш С., Бушу Ф, Середе Э, Филибер Д., Губе Ф., Тойч Г., Гайяр-Келли М. (январь 1998 г.). «Фармакологический профиль RU 58642, мощного системного антиандрогена для лечения андрогензависимых расстройств». Журнал стероидной биохимии и молекулярной биологии. 64 (1–2): 103–11. Дои:10.1016 / S0960-0760 (97) 00151-9. PMID 9569015. S2CID 290926.
- ^ а б Хаманн Л.Г., Хигучи Р.И., Чжи Л., Эдвардс Дж. П., Ван XN, Маршке К. Б., Конг Дж. В., Фермер Л. Дж., Джонс Т. К. (февраль 1998 г.). «Синтез и биологическая активность новой серии нестероидных, периферически селективных антагонистов рецепторов андрогенов, полученных из 1,2-дигидропиридоно [5,6-g] хинолинов». Журнал медицинской химии. 41 (4): 623–39. Дои:10.1021 / jm970699s. PMID 9484511.
- ^ а б Тран К., Оук С., Клегг Нью-Джерси, Чен И, Уотсон П.А., Арора В., Вонгвипат Дж., Смит-Джонс П.М., Ю Д., Квон А., Василевска Т., Уэлсби Д., Чен CD, Хигано С.С., Пиво TM, Хунг Д.Т., Scher HI, Jung ME, Sawyers CL (май 2009 г.). «Разработка антиандрогена второго поколения для лечения запущенного рака простаты». Наука. 324 (5928): 787–90. Дои:10.1126 / science.1168175. ЧВК 2981508. PMID 19359544.
- ^ Scher HI, Beer TM, Higano CS, Anand A, Taplin ME, Efstathiou E, Rathkopf D, Shelkey J, Yu EY, Alumkal J, Hung D, Hirmand M, Seely L, Morris MJ, Danila DC, Humm J, Larson S , Флейшер М., Сойерс С.Л. (апрель 2010 г.). «Противоопухолевая активность MDV3100 при кастрационно-резистентном раке простаты: исследование 1-2 фазы». Ланцет. 375 (9724): 1437–46. Дои:10.1016 / S0140-6736 (10) 60172-9. ЧВК 2948179. PMID 20398925.
- ^ Rathkopf D, Liu G, Carducci MA, Eisenberger MA, Anand A, Morris MJ, Slovin SF, Sasaki Y, Takahashi S, Ozono S, Fung NK, Cheng S, Gan J, Gottardis M, Obermeier MT, Reddy J, Zhang S , Vakkalagadda BJ, Alland L, Wilding G, Scher HI (февраль 2011 г.). «Исследование фазы I повышения дозы нового антиандрогена BMS-641988 у пациентов с устойчивым к кастрации раком простаты». Клинические исследования рака. 17 (4): 880–7. Дои:10.1158 / 1078-0432.CCR-10-2955. ЧВК 3070382. PMID 21131556.
- ^ Foster WR, Car BD, Shi H, Levesque PC, Obermeier MT, Gan J, Arezzo JC, Powlin SS, Dinchuk JE, Balog A, Salvati ME, Attar RM, Gottardis MM (апрель 2011 г.). «Безопасность лекарств является препятствием на пути открытия и разработки новых антагонистов рецепторов андрогенов». Простаты. 71 (5): 480–8. Дои:10.1002 / pros.21263. PMID 20878947. S2CID 24620044.
- ^ Кавата Х., Араи С., Накагава Т., Исикура Н., Нисимото А., Йошино Х., Сираиси Т., Татибана К., Накамура Р., Сато Х. (сентябрь 2011 г.). «Биологические свойства чистого антагониста рецепторов андрогенов для лечения устойчивого к кастрации рака простаты: оптимизация от соединения-свинца до CH5137291». Простаты. 71 (12): 1344–56. Дои:10.1002 / pros.21351. PMID 21308717. S2CID 42009977.
- ^ Ёсино Х, Сато Х, Сираиси Т, Татибана К., Эмура Т, Хонма А, Исикура Н., Цуненари Т, Ватанабэ М, Нишимото А, Накамура Р, Накагава Т, Охта М, Таката Н, Фурумото К., Кимура К., Кавата Х (Декабрь 2010 г.). «Разработка и синтез чистого антагониста рецепторов андрогенов (CH5137291) для лечения устойчивого к кастрации рака простаты». Биоорганическая и медицинская химия. 18 (23): 8150–7. Дои:10.1016 / j.bmc.2010.10.023. PMID 21050768.
- ^ Schleich S, Papaioannou M, Baniahmad A, Matusch R (июль 2006 г.). «Экстракты Pygeum africanum и других этноботанических видов с антиандрогенной активностью». Planta Medica. 72 (9): 807–13. Дои:10.1055 / с-2006-946638. PMID 16783690.
- ^ Роэлл Д., Баниахмад А. (январь 2011 г.). «Природные соединения атрариновой кислоты и N-бутилбензолсульфонамида в качестве антагонистов рецептора андрогенов человека и ингибиторов роста клеток рака простаты» (PDF). Молекулярная и клеточная эндокринология. 332 (1–2): 1–8. Дои:10.1016 / j.mce.2010.09.013. PMID 20965230. S2CID 26865620.
