Анилин - Aniline
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Анилин[1] | |||
| Систематическое название ИЮПАК Бензоламин | |||
| Другие имена Фениламин Аминобензол Бензамин | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| 3DMet | |||
| 605631 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.491 | ||
| Номер ЕС |
| ||
| 2796 | |||
| КЕГГ | |||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 1547 | ||
| |||
| |||
| Характеристики | |||
| C6ЧАС7N | |||
| Молярная масса | 93.129 г · моль−1 | ||
| Внешность | От бесцветной до желтой жидкости | ||
| Плотность | 1,0297 г / мл | ||
| Температура плавления | -6,3 ° С (20,7 ° F, 266,8 К) | ||
| Точка кипения | 184,13 ° С (363,43 ° F, 457,28 К) | ||
| 3,6 г / 100 мл при 20 ° C | |||
| Давление газа | 0,6 мм рт. Ст. (20 ° C)[2] | ||
| Кислотность (пKа) |
| ||
| −62.95·10−6 см3/ моль | |||
| Вязкость | 3.71 cP (3.71 мПа · с при 25 ° C) | ||
| Термохимия | |||
Станд. Энтальпия горение (ΔcЧАС⦵298) | -3394 кДж / моль | ||
| Опасности | |||
| Главный опасности | потенциальный профессиональный канцероген | ||
| Паспорт безопасности | Видеть: страница данных | ||
| Пиктограммы GHS |     | ||
| Сигнальное слово GHS | Опасность | ||
| H301, H311, H317, H318, H331, H341, H351, H372, H400 | |||
| P201, P202, P260, P261, P264, P270, P271, P272, P273, P280, P281, P301 + 310, P302 + 352, P304 + 340, P305 + 351 + 338, P308 + 313, P310, P311, P312, P314, P321, P322, P330, P333 + 313, P361 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 70 ° С (158 ° F, 343 К) | ||
| 770 ° С (1420 ° F, 1040 К) | |||
| Пределы взрываемости | 1.3–11%[2] | ||
| Смертельная доза или концентрация (LD, LC): | |||
LDLo (самый низкий опубликованный ) | 195 мг / кг (собака, перорально) 250 мг / кг (крыса, перорально) 464 мг / кг (мышь, перорально) 440 мг / кг (крыса, перорально) 400 мг / кг (морская свинка, перорально)[4] | ||
LC50 (средняя концентрация ) | 175 частей на миллион (мышь, 7 ч)[4] | ||
LCLo (самый низкий опубликованный ) | 250 частей на миллион (крыса, 4 ч) 180 ppm (кошка, 8 ч)[4] | ||
| NIOSH (Пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | TWA 5 частей на миллион (19 мг / м3) [кожа][2] | ||
REL (Рекомендуемые) | Ca [потенциальный профессиональный канцероген][2] | ||
IDLH (Непосредственная опасность) | 100 частей на миллион[2] | ||
| Родственные соединения | |||
Связанный ароматические амины | 1-нафтиламин 2-нафтиламин | ||
Родственные соединения | Фенилгидразин Нитрозобензол Нитробензол | ||
| Страница дополнительных данных | |||
| Показатель преломления (п), Диэлектрическая постоянная (εр), так далее. | |||
Термодинамический данные | Фазовое поведение твердое тело – жидкость – газ | ||
| УФ, ИК, ЯМР, РС | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Анилин является органическое соединение с формула C6ЧАС5NH2. Состоит из фенильная группа прикреплен к аминогруппа, анилин - самый простой ароматический амин. Это промышленно значимый товарный химикат, а также универсальный исходный материал для тонкого химического синтеза. Его основное применение - производство прекурсоров полиуретан, красители и другие промышленные химикаты. Как и большинство летучих аминов, он имеет запах тухлой рыбы. Он легко воспламеняется, горит дымным пламенем, характерным для ароматических соединений.[6]
Химически он считается производным бензола, богатым электронами, и, как следствие, быстро реагирует в электрофильное ароматическое замещение реакции. Точно так же он также склонен к окислению: в то время как свежеочищенный анилин представляет собой почти бесцветное масло, воздействие воздуха приводит к постепенному потемнению образца (до желтого или красного цвета) из-за образования сильно окрашенных окисленных примесей. Анилин можно диазотировать, чтобы получить диазоний соль, которая затем может подвергаться различным реакциям нуклеофильного замещения.
Как и другие амины, анилин является основанием (п.Kах = 4.6) и нуклеофил, хотя это более слабое основание и более бедный нуклеофил, чем структурно схожие алифатические амины.
Структура
Анилин представляет собой слегка пирамидальную молекулу с гибридизацией азота где-то между sp3 и зр2. В результате неподеленная пара азота оказывается в sp.Икс гибридная орбиталь с высоким р-характером. Аминогруппа в анилине более плоская (то есть это «более мелкая пирамида»), чем в алифатическом амине, из-за конъюгации одинокая пара с арил заместитель. Наблюдаемая геометрия отражает компромисс между двумя конкурирующими факторами: 1) стабилизация N неподеленной пары на орбитали со значительным s-характером способствует пирамидализации (орбитали с s-характером имеют меньшую энергию), а 2) делокализация из N неподеленной пары в арильное кольцо способствует планарности (неподеленная пара в чистой p-орбитали дает лучшее перекрытие с орбиталями π-системы бензольного кольца).[7]
В соответствии с этими факторами замещенные анилины с электронодонорными группами более пирамидализированы, в то время как анилины с электроноакцепторными группами более плоские. В исходном анилине неподеленная пара составляет примерно 12% s-символа, соответствующего sp7.3 гибридизация.[7] (Для сравнения, алкиламины обычно имеют неподеленные пары на орбиталях, близкие к sp3.)
Угол пирамидализации между связью C – N и биссектрисой угла H – N – H составляет 142,5 °.[8] (Для сравнения, в более сильно пирамидальном метиламине это значение составляет ~ 125 °, в то время как плоский азот, такой как формамид, имеет угол 180 °.) Расстояние C-N также соответственно короче. В анилине длина связи C − N составляет 1,41 Å,[9] по сравнению с 1,47 Å для циклогексиламина,[10] что указывает на частичную π-связь между N и C.[11]
Производство
Промышленное производство анилина состоит из двух этапов. Первый, бензол является нитрированный с концентрированной смесью азотная кислота и серная кислота при температуре от 50 до 60 ° C для получения нитробензол. Нитробензол тогда гидрогенизированный (обычно при 200–300 ° C) в присутствии металла катализаторы:[12]
Восстановление нитробензола до анилина впервые было выполнено Николай Зинин в 1842 г., используя в качестве восстановителя неорганический сульфид (Зинин реакция ). Восстановление нитробензола до анилина также проводили как часть восстановлений с помощью Антуан Бешан в 1854 г., используя железо в качестве восстановителя (Сокращение Бешампа ).
В качестве альтернативы анилин можно получить из аммиака и фенол полученный из кумольный процесс.[6]
В коммерции различают три марки анилина: анилиновое масло для синего, которое представляет собой чистый анилин; анилиновое масло для красного, смесь эквимолекулярных количеств анилина и орто- и пара-толуидины; и анилиновое масло для сафранин, содержащий анилин и орто-толуидин и получается из дистиллят (échappés) фуксин слияние.[13]
Связанный анилин производные
Известно много аналогов анилина, в которых фенильная группа дополнительно замещена. К ним относятся толуидины, ксилидины, хлоранилины, аминобензойные кислоты, нитроанилины, и много других. Их часто получают нитрованием замещенных ароматических соединений с последующим восстановлением. Например, этот подход используется для преобразования толуол в толуидины и хлорбензол в 4-хлоранилин.[6] В качестве альтернативы, используя подходы сочетания Бухвальда-Хартвига или реакции Ульмана, арилгалогениды можно оживлять водным или газообразным аммиаком. [14]
Реакции
Химический состав анилина богат, потому что это соединение было дешево доступно в течение многих лет. Ниже приведены некоторые классы его реакций.
Окисление
Окисление анилина было тщательно изучено и может приводить к реакциям, локализованным на азоте, или, чаще, к образованию новых связей C-N. В щелочном растворе, азобензол результаты, тогда как мышьяковая кислота производит фиолетово-окрашивающее вещество виоланилин. Хромовая кислота превращает это в хинон, в то время как хлораты, в присутствии некоторых солей металлов (особенно ванадий ), дайте анилин черный. Соляная кислота и хлорат калия дают хлоранил. Перманганат калия в нейтральном растворе окисляет до нитробензол; в щелочном растворе до азобензол, аммиак и Щавелевая кислота; в растворе кислоты до анилинового черного. Хлорноватистая кислота дает 4-аминофенол и параамино дифениламин.[13] Окисление персульфатом дает множество полианилины. Эти полимеры обладают богатыми окислительно-восстановительными и кислотно-основными свойствами.

Электрофильные реакции на углероде
Нравиться фенолы, производные анилина очень чувствительны к электрофильное замещение реакции. Его высокая реакционная способность свидетельствует о том, что это енамин, что увеличивает электронодонорную способность кольца. Например, реакция анилина с серная кислота при 180 ° C производит сульфаниловая кислота, H2NC6ЧАС4ТАК3ЧАС.
Если к анилину добавить бромную воду, бромная вода обесцвечен и белый осадок из 2,4,6-триброманилин сформирован. Для образования монозамещенного продукта требуется защита ацетилхлоридом:
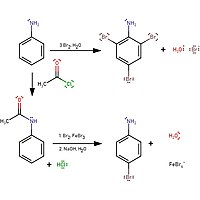
Реакция на форму 4-броманилин заключается в защите амина с помощью ацетилхлорида, а затем в обратном гидролизе с преобразованием анилина.
Самая крупномасштабная промышленная реакция анилина включает его алкилирование формальдегид. Показано идеализированное уравнение:
- 2 С6ЧАС5NH2 + CH2O → CH2(C6ЧАС4NH2)2 + H2О
Образующийся диамин является предшественником 4,4'-МДИ и родственные диизоцианаты.
Реакции на азоте
Основность
Анилин слабый основание. Ароматические амины такие как анилин, как правило, гораздо более слабые основания, чем алифатический амины. Анилин реагирует с сильными кислотами с образованием анилиний (или фениламмоний) ион (C6ЧАС5-NH3+).[15]
Традиционно слабую основность анилина приписывают сочетанию индуктивного эффекта от более электроотрицательных частиц.2 углерод и резонансные эффекты, так как неподеленная пара на азоте частично делокализована в пи-систему бензольного кольца. (см. картинку ниже):

В таком анализе отсутствует рассмотрение сольватации. Анилин, например, более щелочной, чем аммиак в газовой фазе, но в десять тысяч раз меньше в водном растворе.[16]
Ацилирование
Анилин реагирует с ацилхлориды Такие как ацетилхлорид давать амиды. Амиды, образованные из анилина, иногда называют анилиды, например CH3-CO-NH-C6ЧАС5 является ацетанилид. При высоких температурах анилин и карбоновые кислоты реагируют с образованием анилидов.[17]
N-Алкилирование
N-Метилирование анилина метанол при повышенных температурах свыше кислотные катализаторы дает N-метиланилин и диметиланилин:
- C6ЧАС5NH2 + 2 канала3ОН → С6ЧАС5N (CH3)2 + 2H2О
N-Метиланилин и диметиланилин - бесцветные жидкости с точки кипения 193–195 ° С и 192 ° С соответственно. Эти производные очень важны в цветной промышленности. Анилин напрямую соединяется с алкилйодиды с образованием вторичных и третичных аминов.[13]
Производные сероуглерода
Вареные с сероуглерод, дает сульфокарбанилид (дифенилтиомочевина ) (CS (NHC6ЧАС5)2), который может разлагаться на фенил изотиоцианат (C6ЧАС5ЦНС) и трифенил гуанидин (C6ЧАС5N = C (NHC6ЧАС5)2).[13]
Диазотизация
Анилин и его замещенные в кольцо производные реагируют с азотистая кислота формировать соли диазония. С помощью этих промежуточных продуктов анилин можно легко превратить в -ОН, -CN или галогенид через Реакции Сандмейера. Эта соль диазония также может реагировать с NaNO.2 и фенол для производства красителя, известного как бензолазофенол, в процессе, называемом связь.Реакция превращения первичного ароматического амина в соль диазония называется диазотизацией. В этой реакции первичный ароматический амин реагирует с нитрилом натрия и 2 молями HCl, которая известна как ледяная смесь, поскольку используется температура 0,5 ° C и образуется соль бензола и диазония в качестве основного продукта, а также вода и хлорид натрия.
Другие реакции
Он реагирует с нитробензолом с образованием феназин в Воль-Ауэ реакция. Гидрирование дает циклогексиламин.
Будучи стандартным реагентом в лабораториях, анилин используется во многих нишевых реакциях. Его ацетат используется в анилина ацетат тест для углеводов, определение пентозы путем преобразования в фурфурол. Используется для окрашивания нервной РНК синий в Пятно Ниссля.[нужна цитата ]
Использует
Наибольшее применение анилин - это получение метилендианилина и родственных ему соединений путем конденсации с формальдегидом. Диамины конденсируются с фосген давать метилендифенил диизоцианат, предшественник уретановых полимеров.[6]
 Больше всего анилина расходуется на производство метилендианилин, предшественник полиуретанов.
Больше всего анилина расходуется на производство метилендианилин, предшественник полиуретанов.
Другое использование включает резинка обрабатывающие химикаты (9%), гербициды (2%), красители и пигменты (2%).[18] В качестве добавок к резине производные анилина, такие как фенилендиамины и дифениламин, являются антиоксидантами. Примером препаратов, приготовленных из анилина, является парацетамол (ацетаминофен, Тайленол ). Основное применение анилина в красильной промышленности - это прекурсор индиго, синий синие джинсы.[6]

Анилин также используется в меньших масштабах при производстве собственно проводящий полимер полианилин.
Некоторые ранние американские ракеты, такие как Аэроби и WAC капрал, использовали смесь анилина и фурфуриловый спирт в качестве топлива, с азотная кислота как окислитель. Комбинация гиперголичный, воспламеняясь при контакте топлива с окислителем. Он также плотный и может храниться в течение длительного времени.
История
Анилин был впервые выделен в 1826 г. Отто Унвердорбен путем деструктивной перегонки индиго.[19] Он назвал это Crystallin. В 1834 г. Фридлиб Рунге изолировал вещество от каменноугольная смола который приобрел красивый синий цвет при обработке хлорид извести. Он назвал это кианол или же цианол.[20] В 1840 г. Карл Юлиус Фриче (1808–1871) лечил индиго едкий калий и получил масло, которое он назвал анилин, после растения, урожайного индиго, анил (Индигофера суфровидная ).[21][22] В 1842 г. Николай Николаевич Зинин уменьшенный нитробензол и получил базу, которую назвал бензидам.[23] В 1843 г. Август Вильгельм фон Хофманн показали, что это все те же вещества, впоследствии известные как фениламин или же анилин.[24]
Производство синтетических красок
В 1856 г., пытаясь синтезировать хинин, фон Хофманн студент Уильям Генри Перкин обнаруженный лиловый и вошел в промышленность, выпустив первый рекламный ролик синтетический краситель. Затем последовали и другие анилиновые красители, такие как фуксин, сафранин, и снисходительный. На момент открытия мовена анилин был дорогим. Вскоре после этого, применив метод, описанный в 1854 г. Антуан Бешан,[25] его готовили «тоннами».[26] В Сокращение Бешана позволили развить крупную красильную промышленность в Германии. Сегодня имя BASF изначально Badische Anilin- und Soda-Fabrik (Английский: Баден Анилин и Содовая Factory), в настоящее время крупнейшего поставщика химической продукции, перекликается с наследием индустрии синтетических красителей, построенной на анилиновых красителях и расширенной за счет связанных азокрасители. Первый азокраситель был анилиновый желтый.[27]
Развитие медицины
В конце 19 века производные анилина, такие как ацетанилид и фенацетин возник как обезболивающее препараты, подавляющие сердечную побочные эффекты часто противопоставляется кофеин.[28] В течение первого десятилетия 20 века, пытаясь модифицировать синтетические красители для обработки Африканская сонная болезнь, Пол Эрлих - кто придумал термин химиотерапия за его Магическая пуля подход к медицине - не удалось и перешли на доработку Бешан с атоксил, первая органическая мышьяк лекарство, и по счастливой случайности получил лечение от сифилис – сальварсан - первое успешное химиотерапевтическое средство. Микроорганизмы-мишени сальварсана, еще не признанный бактерией, все еще считался паразитом, и медицинские бактериологи, полагая, что бактерии не восприимчивы к химиотерапевтическому подходу, упускали из виду Александр Флеминг доклад 1928 г. о влиянии пенициллин.[29]
В 1932 г. Байер искал медицинские применения своих красителей. Герхард Домагк идентифицирован как антибактериальный красный азокраситель, представленный в 1935 году как первый антибактериальный препарат, пронтозил, скоро найден в Институт Пастера быть пролекарство деградированный in vivo в сульфаниламид - бесцветный промежуточный продукт для многих, очень цветной азокрасители - уже с истекшим сроком действия патента, синтезированные в 1908 году в Вене исследователем Полем Гельмо для его докторских исследований.[29] К 1940-м годам более 500 связанных сульфамидные препараты были произведены.[29] Лекарства, пользующиеся повышенным спросом во время Вторая Мировая Война (1939–45), эти первые чудодейственные препараты, химиотерапия с широкой эффективностью, продвинула американскую фармацевтическую промышленность.[30] В 1939 г. Оксфордский университет, ища альтернативу сульфамидным препаратам, Говард Флори разработал пенициллин Флеминга в первый системный антибиотик препарат, средство, медикамент, пенициллин G. (Грамицидин, разработан Рене Дюбо в Институт Рокфеллера в 1939 г. был первым антибиотиком, но его токсичность ограничивала его актуальный использование.) После Второй мировой войны, Корнелиус П. Роудс представил химиотерапевтический подход к лечению рака.[31]
Ракетное горючие
В 1940-х и начале 1950-х годов анилин использовался с азотная кислота или же тетроксид диазота в качестве ракетного топлива для малых ракет и Аэроби ракета. Два топливных компонента: гиперголичный, вызывая бурную реакцию при контакте. Позже анилин был заменен на гидразин.[32]
Токсикология и тестирование
Анилин токсичен при вдыхании паров, проглатывании или чрескожной абсорбции.[33][34] В МАИР перечисляет это в Группа 3 (не классифицируется по канцерогенности для человека) из-за ограниченности и противоречивости имеющихся данных. Раннее производство анилина привело к увеличению числа случаев рака мочевого пузыря, но теперь эти эффекты приписывают нафтиламины, а не анилины.[6]
Анилин считается одной из возможных причин вымирание леса.[35]
Существует множество методов обнаружения анилина.[36]
Смотрите также
Примечания
- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. С. 416, 668. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
Анилин, для C6ЧАС5-NH2, является единственным названием для первичного амина, оставленным в качестве предпочтительного названия IUPAC, для которого допускается полное замещение в кольце и атоме азота. Это сохраненное имя Типа 2а; правила замены см. в P-15.1.8.2. Замещение ограничивается группами заместителей, указанными в качестве префиксов в соответствии со старшинством функциональных групп, явно выраженным или подразумеваемым в функциональном названии исходного соединения. Название бензоламин может использоваться в общей номенклатуре.
- ^ а б c d е Карманный справочник NIOSH по химической опасности. "#0033". Национальный институт охраны труда и здоровья (NIOSH).
- ^ Vollhardt, P .; Шор, Нил (2018). Органическая химия (8-е изд.). В. Х. Фриман. п. 1031. ISBN 9781319079451.
- ^ а б c «Анилин». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ GOV, Управление реагирования и восстановления NOAA, США. "АНИЛИН | КАМЕО Кемикалс | NOAA". cameochemicals.noaa.gov. Получено 2016-06-16.
- ^ а б c d е ж Каль, Томас; Шредер, Кай-Уилфрид; Лоуренс, Ф. Р .; Marshall, W. J .; Хёке, Хартмут; Jäckh, Рудольф (2007). «Анилин». В Ullmann, Fritz (ред.). Энциклопедия промышленной химии Ульмана. John Wiley & Sons: Нью-Йорк. Дои:10.1002 / 14356007.a02_303. ISBN 978-3-527-20138-9. OCLC 11469727.
- ^ а б Алабугин Игорь Валерьевич (профессор) (2016). Стереоэлектронные эффекты: мост между структурой и реактивностью. Чичестер, Великобритания. ISBN 978-1-118-90637-8. OCLC 957525299.
- ^ 1937-, Кэри, Фрэнсис А. (2008). Органическая химия (7-е изд.). Бостон: Высшее образование Макгроу-Хилла. ISBN 9780073047874. OCLC 71790138.CS1 maint: числовые имена: список авторов (связь)
- ^ Чжан, Хуайюй; Цзян, Сяоюй; Ву, Вэй; Мо, Иронг (28 апреля 2016 г.). «Электронное сопряжение против π-π отталкивания в замещенных бензолах: почему связь углерод-азот в нитробензоле длиннее, чем в анилине». Физическая химия Химическая физика: PCCP. 18 (17): 11821–11828. Дои:10.1039 / c6cp00471g. ISSN 1463-9084. PMID 26852720.
- ^ Raczyńska, Ewa D .; Холлман, Малгожата; Кольчинская, Катаржина; Степневски, Томаш М. (12.07.2010). "О модели гармонического осциллятора индекса делокализации электронов (HOMED) и ее применении к гетероатомным π-электронным системам". Симметрия. 2 (3): 1485–1509. Дои:10.3390 / sym2031485. ISSN 2073-8994.
- ^ Г. М. Вуйчик "Структурная химия анилинов" в анилинах (химия функциональных групп Патая), С. Патай, Под ред. 2007, Wiley-VCH, Weinheim. Дои:10.1002 / 9780470682531.pat0385.
- ^ Каски, Дуглас С.; Чепмен, Дуглас В. (24 апреля 1985 г.), Способ получения арилгидроксиламинов, получено 2016-06-16
- ^ а б c d Чисхолм 1911, п. 48.
- ^ https://www.organic-chemistry.org/synthesis/C1N/amines/anilines.shtm
- ^ Макмерри, Джон Э. (1992), Органическая химия (3-е изд.), Belmont: Wadsworth, ISBN 0-534-16218-5
- ^ Смит, Майкл Б .; Марш, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Карл Н. Уэбб (1941). «Бензанилид». Органический синтез.; Коллективный объем, 1, п. 82
- ^ «Анилин». Репортер химического рынка. Архивировано из оригинал на 2002-02-19. Получено 2007-12-21.
- ^ Отто Унвердорбен (1826). "Ueber das Verhalten der Organischen Körper в höheren Temperaturen" [О поведении органических веществ при высоких температурах]. Annalen der Physik und Chemie. 8 (11): 397–410. Bibcode:1826АнП .... 84..397У. Дои:10.1002 / andp.18260841109.
- ^ Ф. Ф. Рунге (1834) "Ueber einige Produkte der Steinkohlendestillation" (О некоторых продуктах перегонки угля), Annalen der Physik und Chemie, 31: 65–77 (см. стр. 65), 513–524; и 32: 308–332 (см. стр. 331).
- ^ Я. Фриче (1840) "Ueber das Anilin, ein neues Zersetzungsproduct des Indigo" (Об анилине, новом продукте разложения индиго), Бюллетень Scientifique [publié par l'Académie Impériale des Sciences de Saint-Petersbourg], 7 (12): 161–165. Печатается на:
- J. Fritzsche (1840) "Ueber das Anilin, ein neues Zersetzungsproduct des Indigo", Юстус Либигс Аннален дер Хеми, 36 (1): 84–90.
- Я. Фриче (1840) "Ueber das Anilin, ein neues Zersetzungsproduct des Indigo", Journal für praktische Chemie, 20: 453–457. В постскриптуме к этой статье Эрдманн (один из редакторов журнала) утверждает, что анилин и «кристаллин», обнаруженный Унвердорбеном в 1826 году, являются одним и тем же веществом; видеть страницы 457–459.
- ^ синоним Я анил, в конечном итоге от санскритского «нила», темно-синий.
- ^ Н. Зинин (1842). "Beschreibung einiger neuer organischer Basen, dargestellt durch die Einwirkung des Schwefelwasserstoffes auf Verbindungen der Kohlenwasserstoffe mit Untersalpetersäure" (Описание некоторых новых органических оснований, образующихся при действии сероводорода на соединения углеводородной кислоты и азотной кислоты.2N2О3]), Бюллетень Scientifique [publié par l'Académie Impériale des Sciences de Saint-Petersbourg], 10 (18): 272–285. Печатается в: Н. Зинин (1842). "Beschreibung einiger neuer organischer Basen, dargestellt durch die Einwirkung des Schwefelwasserstoffes auf Verbindungen der Kohlenwasserstoffe mit Untersalpetersäure", Journal für praktische Chemie, 27 (1): 140–153. Бензидам упоминается на странице 150. Фрицше, коллега Зинина, вскоре понял, что «бензидам» на самом деле был анилином. См .: Фриче (1842). Бюллетень Scientifique, 10: 352. Перепечатано в виде приписки к статье Зинина в: J. Fritzsche (1842). "Bemerkung zu vorstehender Abhandlung des Hrn. Zinin" (Комментарий к предыдущей статье г-на Зинина), Journal für praktische Chemie, 27 (1): 153.
См. Также: (Anon.) (1842) "Organische Salzbasen, aus Nitronaphtalose und Nitrobenzid mittelst Schwefelwasserstoff entstehend" (Органические основания, происходящие из нитронафталина и нитробензола через сероводород), Annalen der Chemie und Pharmacie, 44: 283–287. - ^ Август Вильгельм Хофманн (1843) "Chemische Untersuchung der Organischen Basen im Steinkohlen-Theeröl" (Химические исследования органических оснований в каменноугольном масле), Annalen der Chemie und Pharmacie, 47: 37–87. На странице 48 Хофманн утверждает, что кристаллин, кианол, бензидам и анилин идентичны.
- ^ А. Бешан (1854 г.) "De l'action des protosels defer sur la nitronaphtaline et la nitrobenzine. Новый метод образования органических оснований зинина" (О действии протосолей железа на нитронафталин и нитробензол. Новый метод образования синтетических органических оснований Зинина.) Анналы химии и тела, 3-я серия, 42: 186 - 196. (Примечание: в случае металла, имеющего два или более различных оксида (например, железо), «протосоль» - устаревший термин для соли, которая получается из оксида, содержащего самую низкую долю кислорода в металл; например, в случае железа, которое имеет два оксида - оксид железа (II) (FeO) и оксид железа (III) (Fe2О3) - FeO - это «протоксид», из которого могут быть получены протосоли. Видеть: Викисловарь: протосоль.)
- ^ Перкин, Уильям Генри. 1861-06-08. "Труды химических обществ: химическое общество, четверг, 16 мая 1861 г." Химические новости и журнал промышленной науки. Проверено 24 сентября 2007.
- ^ Ауэрбах Г., «Азо- и нафтоловые красители», Текстильный колорист, 1880 мая;2(17):137-9, стр.138.
- ^ Wilcox RW, "Лечение гриппа у взрослых", Медицинские новости, 1900 15 декабря;77():931-2, 932 стр..
- ^ а б c D J Th Wagener, История онкологии (Хаутен: Springer, 2009 г.), стр. 150–1.
- ^ Джон Э. Леш, Первые чудодейственные препараты: как сульфамидные препараты изменили медицину (Нью-Йорк: Oxford University Press, 2007), стр. 202–3.
- ^ "Медицина: трофеи войны". TIME.com. 15 мая 1950 г. Архивировано с оригинал 24 июня 2013 г.. Получено 20 ноября 2020.
- ^ Брайан Бернелл. 2016 г. http://www.nuclear-weapons.info/cde.htm#Corporal SSM
- ^ Мьюир, Г. Д. (ред.) 1971, Опасности в химической лаборатории, Королевский институт химии, Лондон.
- ^ Индекс Merck. 10-е изд. (1983), стр.96, Rahway: Merck & Co.
- ^ Краль-Урбан, Б., Папке, Х.Э., Петерс, К. (1988) Упадок лесов: исследование причинно-следственных связей в Соединенных Штатах Северной Америки и Федеративной Республике Германии. Германия: Группа оценки биологии, экологии и энергетики Центра ядерных исследований Юлиха.
- ^ Основы аналитической токсикологии (1995), Р. Дж. Фланаган, С. С. Браун, Ф. А. де Вольф, Р. А. Брейтуэйт, Б. Виддоп: Всемирная организация здравоохранения
Рекомендации
 В эту статью включен текст из публикации, которая сейчас находится в всеобщее достояние: Чисхолм, Хью, изд. (1911), "Анилин ", Британская энциклопедия, 2 (11-е изд.), Cambridge University Press, стр. 47–48.
В эту статью включен текст из публикации, которая сейчас находится в всеобщее достояние: Чисхолм, Хью, изд. (1911), "Анилин ", Британская энциклопедия, 2 (11-е изд.), Cambridge University Press, стр. 47–48.
внешняя ссылка
- Бейнс, Т.С., изд. (1878), , Британская энциклопедия, 2 (9-е изд.), Нью-Йорк: Сыновья Чарльза Скрибнера, стр. 47–48 short = x
- Международная карта химической безопасности 0011
- CDC - Карманный справочник NIOSH по химическим опасностям
- Электрополимеризация анилина
- Анилин в базе данных ChemIDplus