Тиомочевина - Thiourea
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Тиомочевина[1] | |||
| Другие имена Тиокарбамид | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| 605327 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.494 | ||
| 1604 | |||
| КЕГГ | |||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 2811 | ||
| |||
| |||
| Характеристики | |||
| CH4N2S | |||
| Молярная масса | 76,12 г / моль | ||
| Внешность | белое твердое вещество | ||
| Плотность | 1,405 г / мл | ||
| Температура плавления | 182 ° С (360 ° F, 455 К) | ||
| 142 г / л (25 ° С) | |||
| −4.24×10−5 см3/ моль | |||
| Опасности | |||
Классификация ЕС (DSD) (устарело) | Carc. Кот. 3 Repr. Кот. 3 Вредный (Xn) Опасно для окружающей среды (N) | ||
| R-фразы (устарело) | R22, R40, R51 / 53, R63 | ||
| S-фразы (устарело) | (S2), S36 / 37, S61 | ||
| NFPA 704 (огненный алмаз) | |||
| Родственные соединения | |||
Родственные соединения | Мочевина | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Тиомочевина (/ˌθаɪoʊjʊəˈrяə/)[2][3] является сероорганическое соединение с формула SC (NЧАС2)2. Конструктивно похож на мочевина, за исключением того, что кислород атом заменяется на сера атом, но свойства мочевины и тиомочевины существенно различаются. Тиомочевина - это реагент в органический синтез. «Тиомочевины» относятся к широкому классу соединений с общей структурой (R1р2N) (R3р4N) C = S. Тиомочевины относятся к тиоамиды, например RC (S) NR2, где R - метил, этил, так далее.

Структура и склеивание
Тиомочевина - это плоская молекула. Расстояние связи C = S составляет 1,71 Å. Расстояние C-N составляет в среднем 1,33 Å.[4] На ослабление связи C-S за счет пи-связи C-N указывает короткая связь C = S в тиобензофенон, что составляет 1,63 Å.
Тиомочевина встречается в двух таутомерный формы, из которых тионовая форма преобладает в водных растворах. В константа равновесия был рассчитан как Kэкв является 1.04×10−3.[5] Форма тиола, также известная как изотиомочевина, может встречаться в замещенных соединениях, таких как изотиоуроний соли.
Производство
Ежегодное мировое производство тиомочевины составляет около 10 000 тонн. Около 40% производится в Германии, еще 40% в Китае и 20% в Японии. Тиомочевину можно производить из тиоцианат аммония, но чаще он возникает в результате реакции сероводород с цианамид кальция в присутствии углекислый газ.[6]
Приложения
Сама по себе тиомочевина имеет несколько применений. Он в основном употребляется как предшественник диоксид тиомочевины, который является обычным восстановителем в текстильной промышленности.[6]
Другое использование
Другие промышленные применения тиомочевины включают производство огнестойких смол и вулканизация ускорители.
Тиомочевина используется в качестве вспомогательного вещества в диазобумаге, светочувствительной фотокопировальной бумаге и почти во всех других типах копировальной бумаги.
Он также используется для тонирования серебряно-желатиновых фотопринтов.
Тиомочевина используется в процессах блестящего и полусветлого гальванического покрытия Клифтона-Филлипса и Бивера.[7] Он также используется в растворе с хлоридом олова (II) в качестве раствора для химического лужения меди. печатные платы.
Реакции
Материал обладает необычным свойством превращаться в тиоцианат аммония при нагревании выше 130 ° C. После охлаждения соль аммония снова превращается в тиомочевину.[нужна цитата ]
Восстановитель
Тиомочевина восстанавливает пероксиды до соответствующего диолы.[8] Промежуточный продукт реакции - нестабильный эндопероксид.

Тиомочевина также используется в восстановительной терапии озонолиз давать карбонил соединения.[9] Диметилсульфид также является эффективным реагентом для этой реакции, но он очень летуч (точка кипения37 ° С) и имеет неприятный запах, тогда как тиомочевина не имеет запаха и удобно нелетучая (что отражает ее полярность).

Источник сульфида
Тиомочевина используется в качестве источника сульфида, например, для преобразования алкилгалогениды к тиолам. В реакции используется высокая нуклеофильность серного центра и легкий гидролиз промежуточного соединения. изотиоурония соль:
- CS (NH2)2 + RX → RSC (NH
2)+
2Икс− - RSC (NH
2)+
2Икс−
+ 2 NaOH → RSNa + OC (NH2)2 + NaX - RSNa + HCl → RSH + NaCl
В этом примере этан-1,2-дитиол готовится из 1,2-дибромэтан:[10]
- C2ЧАС4Br2 + 2 сбн (NH2)2 → [C2ЧАС4(SC (NH2)2)2] Br2
- [C2ЧАС4(SC (NH2)2)2] Br2 + 2 КОН → С2ЧАС4(SH)2 + 2 OC (NH2)2 + 2 КБр
Как и другие тиоамиды, тиомочевина может служить источником сульфида при реакции с ионами металлов. Например, сульфид ртути формы при обработке солей ртути в водном растворе тиомочевиной:
- Hg2+ + SC (NH2)2 + H2O → HgS + OC (NH2)2 + 2 часа+
Эти реакции сульфидирования, которые применялись для синтеза многих сульфидов металлов, требуют воды и, как правило, некоторого нагрева.[11][12]
Предшественник гетероциклов
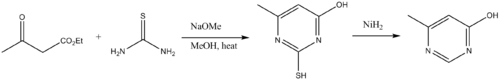
Тиомочевины являются строительным материалом для пиримидин производные. Таким образом, тиомочевины конденсируются с β-дикарбонильными соединениями.[13] Аминогруппа тиомочевины сначала конденсируется с карбонилом с последующей циклизацией и таутомеризацией. Обессеривание дает пиримидин.
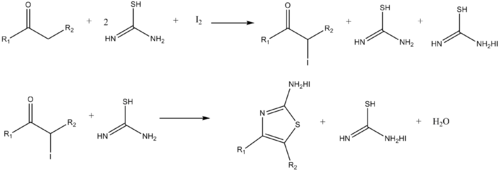
Аналогичным образом аминотиазолы могут быть синтезированы по реакции α-галогена.кетоны и тиомочевина.[14]
Фармацевтические препараты тиобарбитуровая кислота и сульфатиазол готовятся с использованием тиомочевины.[6] 4-амино-3-гидразино-5-меркапто-1,2,4-триазол получается реакцией тиомочевины и гидразин.
Серебряная полировка
Согласно этикетке на потребительском продукте, жидкое чистящее средство TarnX содержит тиомочевину, а моющее средство, и сульфаминовая кислота. А выщелачивающий для выщелачивания золота и серебра можно создать путем селективного окисления тиомочевины, минуя стадии использования цианида и плавки.[15]
Безопасность
В LD50 для тиомочевины 125 мг / кг для крыс (перорально).[16]
А зобогенный об эффекте (увеличение щитовидной железы) сообщалось при хроническом воздействии, что отражает способность тиомочевины препятствовать захвату йодида.[6]
Смотрите также
Рекомендации
- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. С. 98, 864. Дои:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ «Тиомочевина». Оксфордские словари Британский словарь. Oxford University Press. Получено 2016-01-21.
- ^ «Тиомочевина». Словарь Merriam-Webster. Получено 2016-01-21.
- ^ Д. Маллен; Э. Хеллнер (1978). "Простое уточнение распределения плотности связывающих электронов. IX. Распределение плотности связанных электронов в тиомочевине, CS (NH2)2, при 123К ". Acta Crystallogr. B34 (9): 2789–2794. Дои:10.1107 / S0567740878009243.
- ^ Allegretti, P.E; Castro, E.A; Ферлонг, Дж. Дж. П. (март 2000 г.). «Таутомерное равновесие амидов и родственных соединений: теоретические и спектральные доказательства». Журнал молекулярной структуры: ТЕОХИМА. 499 (1–3): 121–126. Дои:10.1016 / S0166-1280 (99) 00294-8.
- ^ а б c d Бернд Мерченк; Фердинанд Бек; Вольфганг Бауэр (2002). «Тиомочевина и производные тиомочевины». Энциклопедия промышленной химии Ульмана. Wiley-VCH. Дои:10.1002 / 14356007.a26_803. ISBN 3527306730.
- ^ "81-е универсальное руководство по обработке металлов". Отделка металлов, выпуск справочника и справочника. Журнал Metal Finishing: 285. Осень 2013. ISSN 0026-0576.
- ^ К. Канеко; А. Сугиморо и С. Танака (1974). "Простой одностадийный синтез СНГ-2-циклопентен и СНГ-2-циклогексен-1,4-диолы из соответствующих циклодиенов ». Синтез. 1974 (12): 876–877. Дои:10.1055 / с-1974-23462.
- ^ Гупта Д., Соман Г. и Дев С. (1982). «Тиомочевина - удобный реагент для восстановительного расщепления продуктов озонолиза олефинов». Тетраэдр. 38 (20): 3013–3018. Дои:10.1016/0040-4020(82)80187-7.CS1 maint: несколько имен: список авторов (связь)
- ^ Speziale, A. J. (1963). «Этанедитиол». Органический синтез.; Коллективный объем, 4, п. 401
- ^ Liang, Y .; и другие. (2016). «Эффективный прекурсор для синтеза различных наноструктур FeS2 с помощью простого метода гидротермального синтеза». CrystEngComm. 18 (33): 6262–6271. Дои:10.1039 / c6ce01203e.
- ^ Bao, N .; и другие. (2007). "Легкий синтез Cd-тиомочевины комплексным термолизом фазо-контролируемых нанокристаллов CdS для фотокаталитического производства водорода в видимом свете". Журнал физической химии C. 111 (47): 17527–17534. Дои:10.1021 / jp076566s.
- ^ Фостер, Х. М., и Снайдер, Х. Р. (1963). «4-Метил-6-гидроксипиримидин». Органический синтез.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 4, п. 638
- ^ Додсон, Р. М. и Кинг, Л. К. (1945). «Реакция кетонов с галогенами и тиомочевиной». Варенье. Chem. Soc. 67 (12): 2242–2243. Дои:10.1021 / ja01228a059. PMID 21005695.
- ^ Энтони Эспозито. «Peñoles, UAM представляет пилотную установку по выщелачиванию тиомочевины Au-Ag - Мексика». Business News Americas (13 июля 2007 г.).
- ^ http://gis.dep.wv.gov/tri/cheminfo/msds1385.txt
дальнейшее чтение
- Патай, С., изд. (1977). Химия функциональных групп с двойной связью. Нью-Йорк, штат Нью-Йорк: John Wiley & Sons. стр.1355 –1496. ISBN 0-471-92493-8.