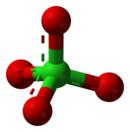
Перхлорат - Perchlorate
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Систематическое название ИЮПАК Перхлорат[1] | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.152.366 | ||
| 2136 | |||
| MeSH | 180053 | ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| ClO− 4 | |||
| Молярная масса | 99,451 г моль−1 | ||
| Конъюгированная кислота | Хлорная кислота | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
А перхлорат это химическое соединение содержащий перхлорат ион, ClO−
4. Большинство перхлоратов - это соли промышленного производства. В основном они используются для пропелленты, используя свойства как мощные окислители и контролировать статичное электричество в упаковка для еды.[2] Загрязнение перхлоратами продуктов питания, воды и других частей окружающей среды было изучено в США из-за его вредного воздействия на здоровье человека. Перхлорат снижает выработку гормонов в щитовидная железа железа.
Большинство перхлоратов представляют собой бесцветные твердые вещества, растворимый в воде. Основной коммерческий интерес представляют четыре перхлората: перхлорат аммония (NH4ClO4), хлорная кислота (HClO4), перхлорат калия (KClO4), и перхлорат натрия (NaClO4). Перхлорат - это анион, образующийся в результате диссоциации хлорной кислоты и ее солей при их растворении в воде. Многие соли перхлоратов растворимы в неводных растворах.[3]
Производство
Соли перхлората производятся промышленным способом окисление водных растворов хлорат натрия электролизом. Этот метод используется для приготовления перхлорат натрия. Основное применение - ракетное топливо.[4] Реакция хлорной кислоты с основаниями, такими как гидроксид аммония, дайте соли. Высоко ценимый перхлорат аммония может быть получен электрохимическим способом.[5]
Любопытно, что перхлорат может образовываться в результате разряда молнии в присутствии хлорида. Перхлорат был обнаружен в пробах дождя и снега из Флорида и Лаббок, Техас.[6] Он также присутствует в Марсианский грунт.
Использует
- В основном перхлораты используются в качестве окислителей в ракетном топливе, фейерверках и автомобильных сигнальных ракетах. Особую ценность представляет композитный пропеллент на основе перхлората аммония как компонент твердого ракетного топлива. В родственном, но меньшем приложении, перхлораты широко используются в пиротехника промышленности и некоторых боеприпасов и для изготовления спичек.[4]
- Перхлорат используется для контроля статичное электричество в пищевой упаковке. Распыленный на контейнеры, он предотвращает прилипание статически заряженных продуктов к пластику или поверхности бумаги / картона.[7]
- Использование ниши включает перхлорат лития, который разлагает экзотермически производить кислород, полезный в кислородные «свечи» на космических кораблях, подводных лодках и в других ситуациях, когда требуется надежная резервная подача кислорода.[8]
- Перхлорат калия в прошлом использовался в терапевтических целях для лечения гипертиреоз в результате Болезнь Грейвса. Он препятствует накоплению йодида в щитовидной железе, что блокирует выработку гормонов щитовидной железы.[9]
Химические свойства
Перхлорат-ион является наименее активным окислителем из всех распространенных хлораты. Перхлорат содержит хлор в самой высокой степени окисления. Таблица восстановительных потенциалов четырех хлораты показывает, что, вопреки ожиданиям, перхлорат является самым слабым окислителем из четырех в воде.[10]
| Ион | Кислая реакция | E° (В) | Нейтральная / основная реакция | E° (В) |
|---|---|---|---|---|
| Гипохлорит | 2 ч+ + 2 HOCl + 2 e− → Cl2(грамм) + 2 H2О | 1.63 | ClO− + H2O + 2 e− → Cl− + 2OH− | 0.89 |
| Хлорит | 6 часов+ + 2 HOClO + 6 e− → Cl2(грамм) + 4 H2О | 1.64 | ClO− 2 + 2 часа2O + 4 e− → Cl− + 4 ОН− | 0.78 |
| Хлорат | 12 часов+ + 2 ClO− 3 + 10 e− → Cl2(грамм) + 6 H2О | 1.47 | ClO− 3 + 3 часа2O + 6 e− → Cl− + 6 ОН− | 0.63 |
| Перхлорат | 16 часов+ + 2 ClO− 4 + 14 e− → Cl2(грамм) + 8 H2О | 1.42 | ClO− 4 + 4 часа2O + 8 e− → Cl− + 8 ОН− | 0.56 |
Эти данные показывают, что перхлорат и хлорат являются более сильными окислителями в кислых условиях, чем в основных условиях.
Измерения теплот реакции в газовой фазе (которые позволяют вычислить ΔЧАСж°) различных оксидов хлора следует ожидаемой тенденции, при которой Cl2О7 имеет наибольшее эндотермическое значение ΔЧАСж° (238,1 кДж / моль), а Cl2O показывает наименьшее эндотермическое значение ΔЧАСж° (80,3 кДж / моль).[11]
Хлор в перхлорат-анионе является закрытая оболочка атом и хорошо защищен четырьмя атомами кислорода.[нужна цитата ] Большинство перхлоратных соединений, особенно соли электроположительный металлы, такие как перхлорат натрия или же перхлорат калия, не окисляйте органические соединения, пока смесь не нагреется.[нужна цитата ] Это свойство полезно во многих приложениях, таких как вспышки, где для инициирования реакции требуется зажигание.[нужна цитата ] Перхлорат аммония стабилен в чистом виде, но может образовывать потенциально взрывоопасные смеси с химически активными металлами или органическими соединениями. В Катастрофа PEPCON разрушил завод по производству перхлорат аммония когда в результате пожара перхлорат аммония, хранящийся на месте, вступил в реакцию с алюминием, из которого были построены резервуары для хранения, и взорвался.
Перхлорат калия имеет самую низкую растворимость среди перхлоратов щелочных металлов (1,5 г в 100 мл воды при 25 ° C).
Биология
Более 40 разнообразных в филогенетическом и метаболическом отношении микроорганизмов, способных к росту за счет снижения содержания перхлоратов.[12] изолированы с 1996 года. Большинство из них происходят из Протеобактерии но другие включают Фирмикуты, Moorella perchloratireducens и Споромуса sp., а Археон Археоглобус фулгидус.[13][14] За исключением A. fulgidus, все известные микробы, которые растут за счет восстановления перхлоратов, используют ферменты перхлоратредуктаза и хлоритдисмутаза, которые вместе превращают перхлорат в безвредный хлорид.[13] В процессе бесплатно кислород (O2) генерируется.[13]
Оксианионы хлора
Хлор может принимать состояния окисления из −1, +1, +3, +5 или +7. Дополнительная степень окисления +4 наблюдается в нейтральном соединении. диоксид хлора, ClO2, имеющий аналогичную структуру. Несколько других оксиды хлора также известны.
| Степень окисления хлора | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| Имя | хлористый | гипохлорит | хлорит | хлорат | перхлорат |
| Формула | Cl− | ClO− | ClO− 2 | ClO− 3 | ClO− 4 |
| Структура |  |  |  |
Природное изобилие
Земное изобилие
Встречающиеся в природе перхлораты в наибольшем количестве можно найти вместе с отложениями нитрата натрия в Пустыня Атакама северного Чили. Эти месторождения активно разрабатывались как источники удобрений на основе нитратов. Чилийский нитрат, по оценкам, является источником около 81 000 тонн (89 000 тонн) перхлората, импортированного в США (1909–1997). Результаты исследований грунтовых вод, льда и относительно нетронутых пустынь были использованы для оценки от 100 000 до 3 000 000 тонн (от 110 000 до 3 310 000 тонн) «глобального запаса» природного перхлората, присутствующего в настоящее время на Земле.[15]
На марсе
Перхлорат обнаружен в марсианской почве на уровне ~ 0,6% по массе. Предполагается, что он существует как смесь 60% Ca (ClO4)2 и 40% Mg (ClO4)2.[16][17][18] Эти соли, образованные из перхлоратов, действуют как антифриз и существенно снизить Точка замерзания воды. Исходя из условий температуры и давления на современном Марсе на Феникс На участке посадки условия позволят раствору перхлоратной соли оставаться стабильным в жидкой форме в течение нескольких часов каждый день в течение лета.[19]
Возможность того, что перхлорат был загрязнителем, принесенным с Земли, исключалась несколькими линиями доказательств. В Феникс ретро-ракеты используются сверхчистые гидразин и пусковое топливо, состоящее из перхлорат аммония. Датчики на борту Феникс не нашел следов аммоний, и поэтому перхлорат в количествах, присутствующих во всех трех образцах почвы, присущ марсианской почве.
В 2006 году был предложен механизм образования перхлоратов, который особенно важен для открытия перхлората на месторождении. Феникс посадочная площадка. Показано, что почвы с повышенным содержанием хлористый превращается в перхлорат в присутствии диоксида титана и солнечного / ультрафиолетового света. Преобразование было воспроизведено в лаборатории с использованием богатых хлоридами почв из Долина Смерти.[20] Другие эксперименты показали, что образование перхлората связано с широкозонными полупроводниковыми оксидами.[21] В 2014 году было показано, что перхлорат и хлорат могут быть получены из хлоридных минералов в марсианских условиях с помощью УФ-излучения, используя только NaCl и силикат.[22]
Дальнейшие открытия перхлората и хлората в марсианском метеорите EETA79001 [23] и Марсом Любопытство Марсоход в 2012-2013 годах поддерживает идею о том, что перхлораты глобально распространены по всей поверхности Марса.[24][25][26] При концентрациях, приближающихся к 0,5% и превышающих токсичные уровни на марсианской почве, марсианские перхлораты представляют серьезную проблему для Человеческое поселение,[27] а также микроорганизмы.[28] С другой стороны, перхлорат может стать удобным источником кислород для населенных пунктов.
28 сентября 2015 года НАСА объявило, что анализ спектральных данных компактного разведывательного спектрометра для Марса (CRISM) на борту Марсианского разведывательного орбитального аппарата из четырех разных мест, где присутствуют повторяющиеся наклонные линии (RSL), обнаружил доказательства наличия гидратированных солей. Гидратированные соли, наиболее соответствующие характеристикам спектрального поглощения, представляют собой перхлорат магния, хлорат магния и перхлорат натрия. Полученные данные убедительно подтверждают гипотезу о том, что RSL образуются в результате современной активности воды на Марсе.[29][30][31][32][33]
Загрязнение окружающей среды
Перхлорат вызывает озабоченность из-за неопределенности относительно токсичности и воздействия на здоровье при низких уровнях питьевой воды, воздействия на экосистемы и путей косвенного воздействия на человека из-за накопления в овощах.[9] Перхлорат растворим в воде, чрезвычайно подвижен в водных системах и может сохраняться в течение многих десятилетий в обычных условиях грунтовых и поверхностных вод.[34] Обнаруженный перхлорат происходит из дезинфицирующих средств, отбеливателей, гербицидов и в основном из ракетных топлив. Перхлорат - побочный продукт при производстве ракетного топлива и фейерверков.[3] Удаление и извлечение перхлоратных соединений из взрывчатых веществ и ракетного топлива включает вымывание водой под высоким давлением, в результате чего образуется водный перхлорат аммония.
В США питьевая вода
Низкие уровни перхлората были обнаружены как в питьевой воде, так и в грунтовые воды в 26 штатах США, по данным Агентство по охране окружающей среды (EPA).[35] Химическое вещество было обнаружено в концентрациях до 5 мкг / л при Объединенная база Кейп-Код (бывшая военная резервация Массачусетса), Массачусетс государственное регулирование 2 мкг / л.[36][37] Фейерверки также являются источником перхлоратов в озерах.[38]
На факельной установке Олин, Морган Хилл, Калифорния Загрязнение перхлоратами под бывшим заводом по производству факелов было впервые обнаружено в 2000 году, через несколько лет после закрытия завода. Завод использовал перхлорат калия в качестве одного из ингредиентов за 40 лет работы. К концу 2003 г. штат Калифорния и Водный район долины Санта-Клара подтвердила наличие шлейфа грунтовых вод, простирающегося в настоящее время на 9 миль через жилые и сельскохозяйственные районы.[нужна цитата ]Калифорнийский региональный совет по контролю качества воды и Водный район долины Санта-Клара помолвлены[когда? ] в рамках крупномасштабной информационно-пропагандистской деятельности испытание скважины на воду Программа реализована для около 1 200 жилых, муниципальных и сельскохозяйственных скважин. В трех коммунальных системах водоснабжения, включая семь муниципальных колодцев с обнаружением перхлоратов, работают большие установки ионообменной очистки. В потенциально ответственные стороны, Olin Corporation и Standard Fuse Incorporated поставляют воду в бутылках почти 800 домам с частными колодцами,[когда? ] а Региональный совет по контролю качества воды следил за мерами по очистке.[39]
Источником перхлората в Калифорнии в основном приписывали двух производителей в юго-восточной части долины Лас-Вегаса в Неваде, где перхлорат производился для промышленного использования.[40] Это привело к выбросу перхлората в Озеро Мид в Неваде и Река Колорадо которые затронули регионы Невады, Калифорнии и Аризона, где вода из этого водохранилища используется для потребления, орошения и отдыха примерно половины населения этих штатов.[3] Озеро Мид был приписан[когда? ] как источник 90% перхлоратов в питьевой воде Южной Невады. По данным выборки, от перхлората страдают 20 миллионов человек, причем самый высокий показатель обнаружен у Техас, Южная Калифорния, Нью-Джерси, и Массачусетс, но интенсивный отбор проб Большие равнины и другие регионы среднего штата могут привести к пересмотренным оценкам с дополнительными затронутыми регионами.[3] Был принят уровень действия 18 мкг / л.[когда? ] несколькими пострадавшими государствами.[34]
В еде
В 2004 году химическое вещество было обнаружено в коровьем молоке в Калифорнии на среднем уровне 1,3. частей на миллиард (ppb, или мкг / л), которые могли проникнуть в коров через кормление культур, подвергшихся воздействию воды, содержащей перхлораты.[41]Исследование 2005 г. грудное молоко имел в среднем 10,5 мкг / л перхлората.[42]
В минералах и других природных явлениях
В некоторых местах нет явного источника перхлората, и он может быть естественным. Природный перхлорат на Земле был впервые обнаружен в земных нитратных месторождениях Пустыня Атакама в Чили еще в 1880-х гг.[43] и долгое время считался уникальным источником перхлоратов. Перхлорат, образовавшийся в результате исторического использования чилийских удобрений на основе нитратов, которые США импортировали сотнями тонн в начале 19 века, все еще можно найти в некоторых странах.[который? ] источники подземных вод США.[44] Недавнее улучшение аналитической чувствительности с использованием методов, основанных на ионной хроматографии, выявило более широкое присутствие природного перхлората, особенно в недрах юго-запада США.[45] солевые эвапориты в Калифорнии и Неваде,[46] Подземные воды плейстоцена в Нью-Мексико,[47] и даже присутствуют в очень удаленных местах, таких как Антарктида.[48] Данные этих и других исследований показывают, что природный перхлорат откладывается на Земле в глобальном масштабе с последующим накоплением и переносом, определяемым местными гидрологическими условиями.
Несмотря на важность этого вещества для загрязнения окружающей среды, конкретный источник и процессы, участвующие в производстве природного перхлората, остаются плохо изученными. Лабораторные эксперименты в сочетании с изотопными исследованиями[49] подразумевали, что перхлорат может производиться на Земле путем окисления разновидностей хлора через пути с участием озона или его фотохимических продуктов.[50] Другие исследования показали, что перхлорат также может быть создан путем активированного молнией окисления хлоридных аэрозолей (например, хлорида в аэрозолях морской соли),[51] и ультрафиолетовое или термическое окисление хлора (например, отбеливающие растворы, используемые в плавательных бассейнах) в воде.[52][53][54]
Из удобрений
Хотя перхлорат как загрязнитель окружающей среды обычно ассоциируется с хранением, производством и испытанием твердотопливных ракетных двигателей,[55] Загрязнение перхлоратом было сосредоточено при использовании удобрений и попадании перхлората в грунтовые воды. Удобрения оставляют перхлорат-анионы, чтобы просачиваться в грунтовые воды и угрожать водоснабжению многих регионов США.[55] Было обнаружено, что одним из основных источников загрязнения перхлоратами при использовании удобрений являются удобрения, полученные из Чили. Caliche (карбонат кальция), потому что Чили имеет богатый источник природного перхлорат-аниона.[56] Перхлорат в твердых удобрениях колеблется от 0,7 до 2,0 мг г.−1, вариация менее чем в 3 раза, и, по оценкам, удобрения из нитрата натрия, полученные из чилийского калише, содержат примерно 0,5–2 мг г−1 перхлорат-аниона.[56] Прямое экологическое воздействие перхлората мало известно; на его воздействие могут влиять такие факторы, как осадки и орошение, разбавление, естественное ослабление, адсорбция почвой и биодоступность.[56] Количественная оценка концентраций перхлоратов в компонентах удобрений с помощью ионной хроматографии показала, что в компонентах садовых удобрений содержание перхлората варьировалось от 0,1 до 0,46%.[34] Концентрация перхлората была самой высокой в чилийском нитрате - от 3,3 до 3,98%.[34]
Очистка
Было много попыток устранить загрязнение перхлоратами. Текущий восстановление Технологии получения перхлората имеют обратную сторону - высокую стоимость и сложность в эксплуатации.[57] Таким образом, был интерес к разработке систем, которые предлагали бы экономические и зеленые альтернативы.[57]
Обработка ex situ и in situ
Некоторые технологии могут удалить перхлорат с помощью лечения ex situ и на месте.
Обработка ex situ включает ионный обмен с использованием перхлорат-селективных или нитрит-специфичных смол, биоремедиация с использованием уплотненного или псевдоожиженного слоя биореакторы, и мембранные технологии через электродиализ и обратный осмос.[58] При обработке ex situ посредством ионного обмена загрязнители притягиваются и прилипают к ионообменной смоле, поскольку такие смолы и ионы загрязняющих веществ имеют противоположный заряд.[59] Когда ион загрязняющего вещества прилипает к смоле, другой заряженный ион вытесняется в обрабатываемую воду, в которой затем ион обменивается на загрязнение.[59] Ионообменная технология имеет преимущества, заключающиеся в том, что она хорошо подходит для обработки перхлоратами и высокой пропускной способностью, но имеет недостаток в том, что она не обрабатывает хлорированные растворители. Кроме того, применяется технология жидкофазной адсорбции углем ex situ, где гранулированный активированный уголь (GAC) используется для устранения низких уровней перхлората, и может потребоваться предварительная обработка при организации GAC для удаления перхлората.[58]
Обработки на месте, такие как биоремедиация с помощью селективных перхлоратов микробов и проницаемого реактивного барьера, также используются для обработки перхлората.[58] Биоремедиация на месте имеет преимущества минимального надземного инфраструктура и его способность обрабатывать хлорированные растворители, перхлораты, нитрат, и Гексоген одновременно. Однако у него есть обратная сторона - это может отрицательно сказаться на качестве вторичной воды. Технология in situ фиторемедиация также могут быть использованы, хотя механизм фиторемедиации перхлоратом еще полностью не разработан.[58]
Также была предложена биовосстановление с использованием бактерий, восстанавливающих перхлорат, которые восстанавливают ионы перхлората до безвредных хлоридов.[60]
Влияние на здоровье
Торможение щитовидной железы
Перхлорат - мощный конкурентный ингибитор щитовидной железы. симпортер йодида натрия.[61] Таким образом, он использовался для лечения гипертиреоз с 1950-х гг.[62] В очень высоких дозах (70 000–300 000ppb ) Введение перхлората калия считалось стандартом лечения в Соединенных Штатах и остается одобренным фармакологическим вмешательством во многих странах.
В больших количествах перхлорат мешает йод принять в щитовидная железа железа. У взрослых щитовидная железа помогает регулировать метаболизм высвобождая гормоны, а у детей щитовидная железа помогает в правильном развитии. НАН в своем отчете за 2005 г. Последствия для здоровья от проглатывания перхлоратов, подчеркнули, что этот эффект, также известный как ингибирование захвата йодида (IUI), не является вредным для здоровья. Однако в январе 2008 года Департамент по контролю за токсичными веществами Калифорнии заявил, что перхлорат становится серьезной угрозой для здоровья человека и водных ресурсов.[63] В 2010 году Управление Генерального инспектора EPA определило, что собственная эталонная доза перхлората в 24,5 частей на миллиард защищает от всех биологических эффектов воздействия на человека. Этот вывод был связан со значительным изменением политики Агентства по охране окружающей среды, основанной на оценке риска не на побочных эффектах, а на неблагоприятных эффектах, таких как ВМИ. Управление генерального инспектора также обнаружило, что, поскольку референсная доза перхлората EPA является консервативной и защищает здоровье человека, дальнейшее снижение воздействия перхлората ниже эталонной дозы не приводит к эффективному снижению риска.[64]
Перхлорат влияет только на гормон щитовидной железы. Потому что он ни хранится, ни метаболизируется, действие перхлората на щитовидную железу обратимо, хотя влияние на развитие мозга из-за недостатка гормона щитовидной железы в плоды, новорожденные, а детей нет.[65]
Токсические эффекты перхлората были изучены в ходе опроса рабочих промышленных предприятий, которые подвергались воздействию перхлората, по сравнению с контрольной группой других рабочих промышленных предприятий, которые не знали о воздействии перхлората. После прохождения нескольких тестов у рабочих, подвергшихся воздействию перхлората, было обнаружено значительное повышение систолического артериального давления по сравнению с рабочими, которые не подвергались воздействию перхлората, а также значительное снижение функции щитовидной железы по сравнению с контрольными рабочими.[66]
Исследование с участием здоровых взрослых добровольцев показало, что при уровнях выше 0,007 миллиграмма на килограмм в день (мг / (кг · сут)) перхлорат может временно подавлять щитовидная железа способность железы поглощать йод из кровоток («ингибирование захвата йодида», таким образом, перхлорат является известным зоб ).[67] EPA преобразовало эту дозу в контрольная доза 0,0007 мг / (кг · сут) путем деления этого уровня на стандартный коэффициент внутривидовой неопределенности 10. Затем агентство рассчитало «эквивалентный уровень питьевой воды» в 24,5 частей на миллиард, предположив, что человек весит 70 кг (150 фунтов) и потребляет 2 L (0,44 имп гал; 0,53 галлона США) питьевой воды в день в течение всей жизни.[68][нуждается в обновлении ]
В 2006 году в исследовании сообщалось о статистической связи между уровнями перхлората в окружающей среде и изменениями гормонов щитовидной железы у женщин с низким содержанием йода. Авторы исследования осторожно отметили, что уровни гормонов у всех испытуемых оставались в пределах нормы. Авторы также указали, что они изначально не нормализовали свои результаты для креатинина, который, по сути, объяснял колебания концентраций разовых образцов мочи, подобных тем, которые использовались в этом исследовании.[69] Когда исследование Блаунта было повторно проанализировано с внесенной поправкой на креатинин, исследуемая популяция была ограничена женщинами репродуктивного возраста, а результаты не были показаны в исходном анализе, любая оставшаяся связь между результатами и потреблением перхлоратов исчезла.[70] Вскоре после того, как было опубликовано пересмотренное исследование Блаунта, Роберт Утигер, врач Гарвардского института медицины, дал показания перед Конгрессом США и заявил: «Я по-прежнему считаю, что эталонная доза, 0,007 миллиграмма на килограмм (24,5 частей на миллиард), которая включает коэффициент 10 для защиты тех, кто может быть более уязвим, вполне достаточно ».[71]
На презентации ранее неопубликованного исследования 2013 года было высказано предположение, что воздействие перхлората в окружающей среде у беременных женщин с гипотиреозом может быть связано со значительным риском низкого IQ у их детей.[72]
Легочная токсичность
Некоторые исследования показывают, что перхлорат также оказывает токсическое действие на легкие. Исследования были проведены на кроликах, которым в трахею вводили перхлорат. Легочная ткань была удалена и проанализирована, и было обнаружено, что легочная ткань, введенная перхлоратом, показала несколько побочных эффектов по сравнению с контрольной группой, которой интратрахеально вводили физиологический раствор. Побочные эффекты включали воспалительные инфильтраты, альвеолярный коллапс, субплевральное утолщение и пролиферацию лимфоцитов.[73]
Апластическая анемия
В начале 1960-х гг. перхлорат калия использованный для лечения болезни Грейвса, был вовлечен в развитие апластическая анемия - условие, при котором Костный мозг не может производить новые кровяные клетки в достаточном количестве - у тринадцати больных, семеро из которых умерли.[74] Последующие исследования показали, что связь между введением перхлората калия и развитием апластической анемии является «в лучшем случае сомнительной», что означает, что польза от лечения, если это единственное известное лечение, превышает риск, и оказалось, что отравление контаминантами 13.[75]
Регулирование в США
Вода
В 1998 году перхлорат был включен в EPA. Список кандидатов на загрязняющие вещества, в первую очередь из-за его обнаружения в питьевой воде Калифорнии.[76][3]
В 2003 г. федеральный окружной суд в Калифорнии обнаружили, что Закон о комплексных экологических мерах, компенсации и ответственности применяется, поскольку перхлорат воспламеняется и, следовательно, является «характерным» опасным отходом.[77]
В 2003 году законодательный орган Калифорнии принял AB 826, Закон о предотвращении загрязнения перхлоратами 2003 года, требующий от Калифорнии Департамент контроля токсичных веществ (DTSC) принять правила, определяющие передовые методы обращения с перхлоратами и перхлоратсодержащими веществами. 31 декабря 2005 г. были приняты «Передовые методы управления хлорфторидом», которые вступили в силу 1 июля 2006 г.[78]
В начале 2006 года EPA выпустило «Руководство по очистке» и рекомендовало Эквивалентный уровень питьевой воды (DWEL) для перхлората 24,5 мкг / л. Как DWEL, так и Руководство по очистке были основаны на обзоре существующих исследований 2005 г. Национальная Академия Наук (NAS).[79]
Не имея федерального стандарта питьевой воды, несколько штатов впоследствии опубликовали свои собственные стандарты содержания перхлоратов, включая Массачусетс в 2006 году.[нужна цитата ] и Калифорния в 2007 году. Другие штаты, включая Аризону, Мэриленд, Неваду, Нью-Мексико, Нью-Йорк и Техас, установили необязательные рекомендательные уровни для перхлората.[нужна цитата ]
В 2008 году EPA выпустило промежуточный рекомендации по здоровью питьевой воды для перхлората и вместе с ним руководство и анализ воздействия на окружающую среду и питьевую воду.[80] Калифорния также выпустила руководство[когда? ] относительно использования перхлората.[81] Оба Министерство обороны и некоторые экологические группы высказали вопросы об отчете NAS,[нужна цитата ] но не появилось ни одной заслуживающей доверия науки, которая могла бы опровергнуть выводы NAS.[нужна цитата ]
В феврале 2008 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США сообщило, что дети младшего возраста в США в среднем получают более половины безопасной дозы EPA только с пищей.[82] В марте 2009 г. Центры по контролю за заболеваниями исследование обнаружило 15 марок детских смесей, загрязненных перхлоратом. В сочетании с существующим загрязнением питьевой воды перхлоратами младенцы могут подвергаться риску воздействия перхлоратов выше уровней, которые Агентство по охране окружающей среды считает безопасными.
11 февраля 2011 г. EPA определило, что перхлорат соответствует Закон о безопасной питьевой воде критерии для регулирования в качестве загрязнителя.[80][83] Агентство обнаружило, что перхлорат может оказывать неблагоприятное воздействие на здоровье людей и, как известно, встречается в общественные системы водоснабжения с частотой и на уровне, представляющем опасность для общественного здравоохранения. С тех пор EPA продолжает определять, какой уровень загрязнения является подходящим. EPA подготовило подробные ответы на представленные комментарии общественности.[84][нужен лучший источник ]
В 2016 г. Совет по защите природных ресурсов подала иск, чтобы ускорить регулирование перхлората EPA. А федеральный окружной суд в Нью-Йорке выпустил указ о согласии изначально требовалось, чтобы EPA выпустило предлагаемое правило в октябре 2018 года, а окончательное правило - в декабре 2019 года.[85] Согласно измененному постановлению суда, EPA должно выпустить предлагаемое правило до 28 мая 2019 г.[86] Администратор EPA Эндрю Р. Уиллер подписало предлагаемое правило 23 мая 2019 г., и предложение было опубликовано 26 июня 2019 г. Агентство предлагает Максимальный уровень загрязнения 0,056 мг / л для общественных систем водоснабжения.[87]
Другой
FDA одобрило использование перхлората в упаковке пищевых продуктов в 2005 году.
Рекомендации
- ^ «Перхлорат - Публичная химическая база данных PubChem». Проект PubChem. США: Национальный центр биотехнологической информации.
- ^ Проект токсикологического профиля для перхлоратов, Агентство регистрации токсичных веществ и заболеваний, Министерство здравоохранения и социальных служб США, сентябрь 2005 г.
- ^ а б c d е Кухаржик, Катажина (2009). «Разработка стандартов питьевой воды на перхлораты в США». Журнал экологического менеджмента. 91 (2): 303–310. Дои:10.1016 / j.jenvman.2009.09.023.
- ^ а б Хельмут Фогт, Ян Балей, Джон Э. Беннетт, Питер Винцер, Саид Акбар Шейх, Патрицио Галлоне «Оксиды хлора и кислородные кислоты хлора» в Энциклопедия промышленной химии Ульмана 2002, Вайли-ВЧ. Дои:10.1002 / 14356007.a06_483
- ^ Дотсон Р.Л. (1993). «Новый электрохимический процесс производства перхлората аммония». Журнал прикладной электрохимии. 23 (9): 897–904. Дои:10.1007 / BF00251024.
- ^ Кэтлин Селлерс, Кэтрин Уикс, Уильям Р. Олсоп, Стивен Р. Клаф, Мэрилин Хойт, Барбара Пью, Джозеф Робб. Перхлорат: экологические проблемы и решения, 2007, стр. 9. Тейлор и Фрэнсис Групп, ООО.
- ^ Макмаллен Дженика, Хассабиан Ахгар, Кон Бренда, Трасанде Леонардо (2017). «Выявление субпопуляций, уязвимых для тироид-блокирующего действия перхлората и тиоцианата». Журнал клинической эндокринологии и метаболизма. 102 (7): 2637–2645. Дои:10.1210 / jc.2017-00046.CS1 maint: несколько имен: список авторов (связь)
- ^ Марковиц, М. М .; Борыта, Д. А .; Стюарт, Харви (1964). "Кислородная свеча с перхлоратом лития. Пирохимический источник чистого кислорода". Промышленная и инженерная химия, исследования и разработки продуктов. 3 (4): 321–330. Дои:10.1021 / i360012a016.
- ^ а б Сусарла Шридхар; Collette C.W .; Гаррисон А. З .; Wolfe N. L .; Маккатчеон С.С. (1999). «Идентификация перхлоратов в удобрениях». Экологические науки и технологии. 33 (19): 3469–3472. Bibcode:1999EnST ... 33.3469S. Дои:10.1021 / es990577k.
- ^ Коттон, Ф. Альберт; Уилкинсон, Джеффри (1988), Продвинутая неорганическая химия (5-е изд.), Нью-Йорк: Wiley-Interscience, стр. 564, г. ISBN 0-471-84997-9
- ^ Wagman, D. D .; Evans, W. H .; Паркер, В. П .; Schumm, R.H .; Halow, I .; Bailey, S.M .; Churney, K. L .; Наттолл, Р. Л. J. Phys. Chem. Ref. Данные Vol. 11 (2); 1982, Американское химическое общество и Американский институт физики.
- ^ Трэш Дж. К., Поллок Дж., Торок Т., Коутс Дж. Д. (2010). "Описание новых перхлоратредуцирующих бактерий Dechlorobacter Hydrogenophilus gen. Nov., Sp. Nov. И Propionivibrio militaris, sp. Nov.". Appl Microbiol Biotechnol. 86 (1): 335–43. Дои:10.1007 / s00253-009-2336-6. ЧВК 2822220. PMID 19921177.CS1 maint: несколько имен: список авторов (связь)
- ^ а б c Джон Д. Коутс; Лори А. Ахенбах (2004). «Уменьшение микробного перхлората: ракетный метаболизм». Обзоры природы Микробиология. 2 (7): 569–580. Дои:10.1038 / nrmicro926. PMID 15197392.
- ^ Мартин Г. Либенштайнер, Мартейн В. Х. Пинсе, Питер Дж. Шаап, Альфонс Дж. М. Стамс, Барт П. Ломанс (5 апреля 2013 г.). «Сокращение архей (пер) хлората при высокой температуре: взаимодействие биотических и абиотических реакций». Наука. 340 (6128): 85–87. Bibcode:2013Научный ... 340 ... 85л. Дои:10.1126 / наука.1233957. PMID 23559251.CS1 maint: несколько имен: список авторов (связь)
- ^ DuBois, Jennifer L .; Охха, Сунил (2015). "Глава 3, раздел 2.2 Естественное изобилие перхлората на Земле"В книге Питера М. Х. Кронека и Марты Э. Соса Торрес (ред.). Поддержание жизни на планете Земля: металлоферменты, усваивающие кислород и другие жевательные газы. Ионы металлов в науках о жизни. 15. Springer. С. 45–87. Дои:10.1007/978-3-319-12415-5_3. ISBN 978-3-319-12414-8. ЧВК 5012666. PMID 25707466.
- ^ Хехт, М. Х., С. П. Кунавес, Р. Куинн; и другие. (2009). «Обнаружение перхлората и растворимого химического состава марсианской почвы на посадочной площадке Phoenix Mars». Наука. 325 (5936): 64–67. Bibcode:2009Наука ... 325 ... 64H. Дои:10.1126 / science.1172466. PMID 19574385.CS1 maint: несколько имен: список авторов (связь)
- ^ Кунавес С.П .; и другие. (2010). «Эксперименты по влажной химии на спускаемом аппарате Phoenix Mars Scout 2007: анализ данных и результаты». J. Geophys. Res. 115 (E3): E00E10. Bibcode:2009JGRE..114.0A19K. Дои:10.1029 / 2008JE003084.
- ^ Кунавес С.П .; и другие. (2014). «Идентификация исходных солей перхлората в месте посадки Феникс Марс и возможные последствия». Икар. 232: 226–231. Bibcode:2014Icar..232..226K. Дои:10.1016 / j.icarus.2014.01.016.
- ^ Шеврие, В.К., Хэнли, Дж., И Алтеиде, Т.С. (2009). «Стабильность гидратов перхлората и их жидких растворов на площадке посадки Феникс, Марс». Письма о геофизических исследованиях. 36 (10): L10202. Bibcode:2009GeoRL..3610202C. Дои:10.1029 / 2009GL037497.CS1 maint: несколько имен: список авторов (связь)
- ^ Миллер, Глен. "Фотоокисление хлорида до перхлората в присутствии пустынных почв и диоксида титана В архиве 2016-09-07 в Wayback Machine ". Американское химическое общество. 29 марта 2006 г.
- ^ Schuttlefield Jennifer D .; Sambur Justin B .; Гелвикс Мелисса; Эгглстон Каррик М .; Паркинсон Б. А. (2011). "Фотоокисление хлорида оксидными минералами: последствия для перхлората на Марсе". Варенье. Chem. Soc. 133 (44): 17521–17523. Дои:10.1021 / ja2064878. PMID 21961793.
- ^ Carrier B. L .; Кунавес С. П. (2015). «Происхождение перхлоратов в марсианской почве». Geophys. Res. Латыш. 42 (10): 3746–3754. Bibcode:2015GeoRL..42.3739C. Дои:10.1002 / 2015GL064290. HDL:10044/1/53915.
- ^ Кунавес С.П .; Carrier B. L .; О'Нил Г. Д .; Стробл С. Т. и Клэр М. В. (2014). «Доказательства марсианского перхлората, хлората и нитрата в марсианском метеорите EETA79001: последствия для окислителей и органических веществ». Икар. 229: 206–213. Bibcode:2014Icar..229..206K. Дои:10.1016 / j.icarus.2013.11.012.
- ^ Адам Манн. "Посмотрите, что мы нашли на Марсе - марсоход Curiosity служит интересной науке ". Сланец (журнал). 26 сентября 2013 г.
- ^ Чанг, Кеннет (1 октября 2013 г.). "Попадание грязи на Марсе". Нью-Йорк Таймс. Получено 2 октября 2013.
- ^ Керр Ричард А. (2013). «Противные перхлораты по всему Марсу». Наука. 340 (6129): 138. Bibcode:2013Научный ... 340Р.138K. Дои:10.1126 / science.340.6129.138-b. PMID 23580505.
- ^ Дэвид, Леонард (13 июня 2013 г.). «Токсичный Марс: астронавты должны иметь дело с перхлоратом на Красной планете». Space.com. Получено 9 мая, 2017.
- ^ Тесты показали, что Марс покрыт токсичными химическими веществами, способными уничтожить живые организмы. Ян Сэмпл, Хранитель. 6 июля 2017.
- ^ Вебстер, Гай; Агл, округ Колумбия; Браун, Дуэйн; Кантильо, Лори (28 сентября 2015 г.). «НАСА подтверждает доказательства того, что жидкая вода течет по сегодняшнему Марсу». Получено 28 сентября 2015.
- ^ Чанг, Кеннет (28 сентября 2015 г.). «НАСА сообщает о признаках течения жидкой воды на Марсе». Нью-Йорк Таймс. Получено 28 сентября 2015.
- ^ Оджа, Луджендра; Вильгельм, Мэри Бет; Murchie, scortt L .; McEwen, Alfred S .; Рэй, Джеймс Дж .; Хэнли, Дженнифер; Массе, Марион; Мэтт Хойнацки (28 сентября 2015 г.). «Спектральные доказательства наличия гидратированных солей в повторяющихся линиях склонов Марса». Природа Геонауки. 8 (11): 829–832. Bibcode:2015НатГе ... 8..829O. Дои:10.1038 / ngeo2546.
- ^ Персонал (28 сентября 2015 г.). "Видеообзор (02:58) - Пресс-конференция НАСА - Свидетельства наличия жидкой воды на сегодняшнем Марсе". НАСА. Получено 30 сентября 2015.
- ^ Персонал (28 сентября 2015 г.). "Видео завершено (58:18) - Пресс-конференция НАСА - Вода, текущая на современном Марсе m". НАСА. Получено 30 сентября 2015.
- ^ а б c d Сусарла Шридхар; Collette T. W .; Гаррисон А. З .; Wolfe N. L .; Маккатчеон С.С. (1999). «Идентификация перхлоратов в удобрениях». Экологические науки и технологии. 33 (19): 3469–3472. Bibcode:1999EnST ... 33.3469S. Дои:10.1021 / es990577k.
- ^ Брандхубер, Филипп; Кларк, Сара; Морли, Кевин (ноябрь 2009 г.). «Обзор наличия перхлоратов в общественных системах питьевой воды» (PDF). Журнал Американской ассоциации водопроводных сооружений. 101 (11): 63–73. Дои:10.1002 / j.1551-8833.2009.tb09991.x.
- ^ Клаузен, Джей (ноябрь 2001 г.). «Перхлораты, источник и распределение в подземных водах в военном заповеднике Массачусетса» (PDF). Презентация на полугодовом заседании Проекта технической поддержки Агентства по охране окружающей среды США, Кембридж, Массачусетс.
- ^ «Максимальные уровни загрязнения неорганическими химическими веществами, требования к мониторингу и аналитические методы» (PDF). Массачусетское управление по вопросам энергетики и окружающей среды. Свод правил Массачусетса (CMR), 310 CMR 22.06. Получено 2017-07-05.
- ^ «Фейерверки связаны с загрязнением озер перхлоратами». Science Daily. Роквилл, Мэриленд. 2007-05-28.
- ^ «Перхлораты на юго-западе Тихого океана: Калифорния». EPA - регион 9. Сан-Франциско, Калифорния: EPA.
- ^ "Перхлорат". Водный район долины Лас-Вегаса. Лас-Вегас, Невада. Получено 2017-07-06.
- ^ Ассошиэйтед Пресс. "В молоке Калифорнии обнаружено токсичное химическое вещество ". Новости NBC. 22 июня 2004 г.
- ^ Макки, Мэгги. "Перхлораты обнаружены в грудном молоке в США ". Новый ученый. 23 февраля 2005 г.
- ^ Эриксен, Г. Э. «Геология и происхождение чилийских месторождений нитратов»; Публикация профессора Геологической службы США 1188; Геологическая служба США: Рестон, Вирджиния, 1981, 37 стр.
- ^ Böhlke J. K .; Hatzinger P. B .; Sturchio N.C .; Gu B .; Abbene I .; Mroczkowski S.J. (2009). «Перхлорат Атакамы как сельскохозяйственный загрязнитель в грунтовых водах: изотопные и хронологические данные из Лонг-Айленда, Нью-Йорк». Экологические науки и технологии. 43 (15): 5619–5625. Bibcode:2009EnST ... 43.5619B. Дои:10.1021 / es9006433. PMID 19731653.
- ^ Rao B .; Андерсон Т. А .; Оррис Г. Дж .; Rainwater K. A .; Rajagopalan S .; Sandvig R.M .; Scanlon B. R .; Стонестром С. А .; Walvoord M. A .; Джексон В. А. (2007). «Широко распространенный натуральный перхлорат в ненасыщенных зонах на юго-западе Соединенных Штатов». Environ. Sci. Technol. 41 (13): 4522–4528. Bibcode:2007EnST ... 41.4522R. Дои:10.1021 / es062853i. PMID 17695891.
- ^ Оррис, Г. Дж .; Харви, Г. Дж .; Tsui, D. T .; Элдридж, Дж. Э. Предварительные анализы перхлората в отобранных природных материалах и продуктах из их производных; Отчет открытого файла USGS 03-314; Геологическая служба США, Типография правительства США: Вашингтон, округ Колумбия, 2003 г.
- ^ Пламмер Л. Н .; Bohlke J. K .; Даутен М. В. (2005). «Перхлораты в подземных водах плейстоцена и голоцена в северо-центральной части штата Нью-Мексико». Environ. Sci. Technol. 40 (6): 1757–1763. Bibcode:2006EnST ... 40.1757P. Дои:10.1021 / es051739h. PMID 16570594.
- ^ Бёльке, Карл Джон, Стурчио Нил К., Гу Баохуа, Хорита Джуске, Браун Гилберт М., Джексон В. Эндрю, Батиста Джакимария, Хатцингер Пол Б. (2005). «Судебная экспертиза изотопов перхлоратов». Аналитическая химия. 77 (23): 7838–7842. Дои:10.1021 / ac051360d. PMID 16316196.CS1 maint: несколько имен: список авторов (связь)
- ^ Рао Б., Андерсон Т. А., Реддер А., Джексон В. А. (2010). "Образование перхлората озонным окислением водных хлор / оксихлорных разновидностей: роль радикалов ClxOy". Environ. Sci. Technol. 44 (8): 2961–2967. Bibcode:2010EnST ... 44.2961R. Дои:10.1021 / es903065f. PMID 20345093.CS1 maint: несколько имен: список авторов (связь)
- ^ Дасгупта П. К .; Мартинеланго П. К .; Джексон В. А .; Андерсон Т. А .; Тиан К .; Tock R.W .; Раджагопалан С. (2005). «Происхождение перхлората природного происхождения: роль атмосферных процессов». Экологические науки и технологии. 39 (6): 1569–1575. Bibcode:2005EnST ... 39.1569D. Дои:10.1021 / es048612x. PMID 15819211.
- ^ Rao B .; Estrada N; Mangold J .; Шелли М .; Gu B .; Джексон В. А. (2012). «Производство перхлората фоторазложением водного раствора хлора». Environ. Sci. Technol. 46 (21): 11635–11643. Bibcode:2012EnST ... 4611635R. Дои:10.1021 / es3015277. PMID 22962844.
- ^ Stanford B.D .; Писаренко А. Н .; Снайдер С. А .; Гордон Г. (2011). «Перхлорат, бромат и хлорат в растворах гипохлорита: Руководство для ЖКХ». Журнал Американской ассоциации водопроводных сооружений. 103 (6): 71. Дои:10.1002 / j.1551-8833.2011.tb11474.x.
- ^ Уильям Э. Моцер (2001). «Перхлорат: проблемы, обнаружение и решения». Экологическая экспертиза. 2 (4): 301–311. Дои:10.1006 / enfo.2001.0059.
- ^ а б Магнусон Мэтью Л .; Урбанский Эдуард Т .; Келти Кэтрин А. (2000). «Определение следов перхлората в питьевой воде методом ионно-парной экстракции с помощью масс-спектрометрии с ионизацией электрораспылением». Аналитическая химия. 72: 25–29. Дои:10.1021 / ac9909204.
- ^ а б c Урбанский Т .; Браун С.К .; Магнусон М.Л .; Келти К.А. (2001). «Уровни перхлоратов в образцах удобрений нитрата натрия, полученных из чилийского калише». Загрязнение окружающей среды. 112 (3): 299–302. Дои:10.1016 / s0269-7491 (00) 00132-9.
- ^ а б «Устранение загрязнения воды побочными продуктами неорганической дезинфекции». Хейзен и Сойер. Хейзен и Сойер. 19 июля 2012 г.
- ^ а б c d "Технические данные - Перхлорат" (PDF). Агентство по охране окружающей среды США. Агентство по охране окружающей среды США. 2013-04-23. Архивировано из оригинал (PDF) 7 июня 2013 г.
- ^ а б «Растворы для загрязнения перхлоратами ARA». Applied Research Associates, Inc. Архивировано из оригинал 29 апреля 2014 г.
- ^ Бардия, Нирмала; Бэ, Джэ-Хо (2011). «Диссимиляционное снижение перхлората: обзор». Микробиологические исследования. 166 (4): 237–254. Дои:10.1016 / j.micres.2010.11.005.
- ^ Браверман, Л. Э .; Он X .; Пино С .; и другие. (2005). «Влияние перхлората, тиоцианата и нитрата на функцию щитовидной железы у рабочих, подвергающихся длительному воздействию перхлората». J Clin Endocrinol Metab. 90 (2): 700–706. Дои:10.1210 / jc.2004-1821. PMID 15572417. Архивировано из оригинал на 2013-05-02. Получено 2012-10-30.
- ^ Годли, А. Ф .; Стэнбери, Дж. Б. (1954). «Предварительный опыт лечения гипертиреоза перхлоратом калия». J Clin Endocrinol Metab. 14 (1): 70–78. Дои:10.1210 / jcem-14-1-70. PMID 13130654.
- ^ "Перхлорат". Департамент контроля токсичных веществ Калифорнии. 26 января 2008 г. Архивировано с оригинал 23 августа 2009 г.. Получено 27 января, 2008.
- ^ Научный анализ перхлората: что мы обнаружили. Офис генерального инспектора (Отчет). EPA. 19 апреля 2010 г.
- ^ Дж. Вольф (1998). «Перхлорат и щитовидная железа». Фармакологические обзоры. 50 (1): 89–105. PMID 9549759.
- ^ Чен Х.Х., Шао Ю.П., Ву Ф.Х., Ли Ю.П., Пэн К.Л. (январь 2013 г.). «[Медицинское обследование рабочих завода на предмет профессионального воздействия перхлората аммония]». Чжунхуа Лао Донг Вэй Шэн Чжи Е Бин За Чжи. 31 (1): 45–7. PMID 23433158.
- ^ Грир, М.А., Гудман, Г., Плейс, Р.С., Грир, С.Э. (2002). «Оценка воздействия на здоровье загрязнения окружающей среды перхлоратами: реакция на дозу для ингибирования захвата тироидного радиоактивного йода у людей» (бесплатно онлайн). Перспективы гигиены окружающей среды. 110 (9): 927–937. Дои:10.1289 / ehp.02110927. ЧВК 1240994. PMID 12204829.CS1 maint: несколько имен: список авторов (связь)
- ^ «Рекомендации по перхлоратам (Меморандум)» (PDF). EPA. 26 января 2006 г.
- ^ Бенджамин С. Блаунт; Джеймс Л. Пиркл; Джон Д. Остерлох; Лиза Валентин-Блазини и Кэтлин Л. Колдуэлл (2006). «Уровни перхлората и тироидного гормона в моче у подростков и взрослых мужчин и женщин, проживающих в Соединенных Штатах». Перспективы гигиены окружающей среды. 114 (12): 1865–71. Дои:10.1289 / ehp.9466. ЧВК 1764147. PMID 17185277.
- ^ Тарон; и другие. (2010). «Эпидемиология воздействия перхлоратов в окружающей среде и функции щитовидной железы: всесторонний обзор». Журнал профессиональной и экологической медицины. 52 (Июнь): 653–60. Дои:10.1097 / JOM.0b013e3181e31955. PMID 20523234.
- ^ «Перхлорат: воздействие нерегулируемого воздействия на здоровье человека и окружающую среду». Конгресс США. Получено 15 апреля 2012.
- ^ «Уровни перхлоратов при беременности связаны с низким детским IQ», Нэнси А. Мелвилл, 22 октября 2013 г.
- ^ Wu F .; Chen H .; Чжоу X .; Zhang R .; Ding M .; Liu Q .; Peng KL. (2013). «Эффект легочного фиброза от воздействия перхлората аммония у кролика». Arch Environ Occup Health. 68 (3): 161–5. Дои:10.1080/19338244.2012.676105. PMID 23566323.
- ^ Национальный исследовательский совет (2005). «Перхлорат и щитовидная железа». Последствия приема перхлоратов для здоровья. Вашингтон, округ Колумбия: Национальная академия прессы. стр.7. ISBN 978-0-309-09568-6. Проверено 3 апреля 2009 г. через Поиск книг Google.
- ^ Кларк, Дж. Дж. Дж. (2000). «Токсикология перхлората». В Урбанском Е.Т. (ред.). Перхлораты в окружающей среде. Нью-Йорк: Kluwer Academic / Plenum Publishers. С. 19–20. ISBN 978-0-306-46389-1. Проверено 3 апреля 2009 г. через Поиск книг Google.
- ^ EPA (1998-03-02). «Объявление списка кандидатов на загрязнение питьевой воды». Федеральный регистр, 63 FR 10274
- ^ Агентство водных ресурсов озера Кастаик против Уиттакера, 272 F. Supp. 2d 1053, 1059–61 (C.D. Cal. 2003).
- ^ "Перхлорат". Управление отходами. Сакраменто, Калифорния: Калифорнийский департамент по контролю за токсичными веществами. Архивировано из оригинал на 2009-08-23. Получено 2017-05-28.
- ^ Комитет по оценке последствий употребления перхлоратов для здоровья, Национальный исследовательский совет (2005 г.). Последствия для здоровья от проглатывания перхлоратов. Вашингтон, округ Колумбия: The National Academies Press. Дои:10.17226/11202. ISBN 978-0-309-09568-6.
- ^ а б «Перхлораты в питьевой воде». Загрязняющие вещества в питьевой воде - стандарты и правила. EPA. 2017-03-31.
- ^ «Перхлораты в питьевой воде». Системы питьевой воды. Сакраменто, Калифорния: Департамент общественного здравоохранения Калифорнии. 2012-12-07. Архивировано из оригинал на 2013-02-06.
- ^ Реннер, Ребекка (2008-03-15). «Перхлораты в пище». Environ. Sci. Technol. 42 (6): 1817. Bibcode:2008EnST ... 42.1817R. Дои:10.1021 / es0870552. PMID 18409597.
- ^ EPA (11 февраля 2011 г.). «Питьевая вода: нормативное определение перхлората». 76 FR 7762
- ^ EPA-HQ-OW-2009-0297 «Docket ID» для EPA
- ^ Совет по защите природных ресурсов против Агентства по охране окружающей среды США и Джина Маккарти, 16 Civ. 1251 (ER). Окружной суд США Южного округа Нью-Йорка. Указ о согласии подан 17 октября 2016 г.
- ^ «Краткий обзор нормативных обновлений». Вашингтон, округ Колумбия: Ассоциация городских агентств водоснабжения. Получено 2019-04-04.
- ^ EPA (26.06.2019). «Национальные правила первичной питьевой воды: перхлораты». Предлагаемое правило. Федеральный регистр. 84 FR 30524.
внешняя ссылка
- Отчет NAS: Влияние перхлората на здоровье
- Критика NRDC отчета NAS
- Отчет по окружающей среде Калифорнии (Резюме со ссылкой на полный текст)
- Мамы-мачо: загрязнитель перхлоратами делает рыбу маскулинизированной: Science News Online, 12 августа 2006 г.
- Новый космический блог ученых: открытие Феникса может быть вредным для жизни на Марсе
- Государство угрожает подать в суд на военных из-за загрязнения воды, Ассошиэйтед Пресс, 19 мая 2003 г.
- Влияние перхлората из отработанной ракеты на здоровье, SpaceDaily.com, 11 июля 2002 г.
- Департамент обороны, Департамент энергетики и Стратегическая программа экологических исследований и разработок Агентства по охране окружающей среды США, Исключение перхлоратных окислителей из пиротехнических факельных композиций, 2009 г.
| HClO4 | Он | ||||||||||||||||
| LiClO4 | Быть (ClO4)2 | B (ClO 4)− 4 B (ClO4)3 | РОКЛО3 | N (ClO4)3 NH4ClO4 NOClO4 | О | FClO4 | Ne | ||||||||||
| NaClO4 | Mg (ClO4)2 | Al (ClO4)3 | Si | п | S | ClO− 4 ClOClO3 Cl2О7 | Ar | ||||||||||
| KClO4 | Ca (ClO4)2 | Sc (ClO4)3 | Ti (ClO4)4 | VO (ClO4)3 VO2(ClO4) | Cr (ClO4)3 | Mn (ClO4)2 | Fe (ClO4)3 | Co (ClO4)2, Co (ClO4)3 | Ni (ClO4)2 | Cu (ClO4)2 | Zn (ClO4)2 | Ga (ClO4)3 | Ge | В качестве | Se | Br | Kr |
| RbClO4 | Sr (ClO4)2 | Y (ClO4)3 | Zr (ClO4)4 | Nb (ClO4)5 | Пн | Tc | RU | Rh (ClO4)3 | Pd (ClO4)2 | AgClO4 | Cd (ClO4)2 | В (ClO4)3 | Sn (ClO4)4 | Sb | TeO (ClO4)2 | я | Xe |
| CsClO4 | Ba (ClO4)2 | Hf (ClO4)4 | Ta (ClO4)5 | W | Re | Операционные системы | Ir | Pt | Au | Hg2(ClO4)2, Hg (ClO4)2 | Tl (ClO4), Tl (ClO4)3 | Pb (ClO4)2 | Bi (ClO4)3 | По | В | Rn | |
| FrClO4 | Ра | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og | |
| ↓ | |||||||||||||||||
| Ла | Ce (ClO4)Икс | Pr | Nd | Вечера | Sm (ClO4)3 | Eu (ClO4)3 | Gd (ClO4)3 | Tb (ClO4)3 | Dy (ClO4)3 | Хо (ClO4)3 | Er (ClO4)3 | Tm (ClO4)3 | Yb (ClO4)3 | Лу (ClO4)3 | |||
| Ac | Th (ClO4)4 | Па | UO2(ClO4)2 | Np | Пу | Являюсь | См | Bk | Cf | Es | FM | Мкр | Нет | Lr | |||