Фенильная группа - Phenyl group

В органическая химия, то фенильная группа или фенильное кольцо это циклический группа атомов с формулой C6ЧАС5. Фенильные группы тесно связаны с бензол и может рассматриваться как бензольное кольцо без водорода, которое может быть заменено каким-либо другим элементом или соединением, чтобы служить в качестве функциональная группа. Фенильные группы имеют шесть атомов углерода, связанных вместе в шестиугольник плоское кольцо, пять из которых связаны с отдельными атомами водорода, а оставшийся углерод связан с заместитель. Фенильные группы обычны в органическая химия.[1] Фенильные группы часто изображаются с чередующимися двойными и одинарными связями. химически ароматический и имеют одинаковую длину связи между атомами углерода в кольце.[1][2]
Номенклатура
Обычно «фенильная группа» является синонимом C6ЧАС5- и является представлен символом Ph или, архаично, Φ. Бензол иногда обозначают как PhH. Фенильные группы обычно присоединены к другим атомам или группам. Например, трифенилметан (Ph3CH) имеет три фенильные группы, присоединенные к одному и тому же углеродному центру. Многие или даже большинство фенильных соединений не описываются термином «фенил». Например, хлорпроизводное C6ЧАС5Cl обычно называют хлорбензол, хотя его можно было бы назвать фенилхлоридом. В особых (и редких) случаях обнаруживаются изолированные фенильные группы: фенильный анион (C6ЧАС5−), фенильный катион (C6ЧАС5+), а фенил радикальный (C6ЧАС5·).
Хотя Ph и фенил однозначно обозначают C6ЧАС5, замещенные производные также описаны с использованием фенильной терминологии. Например, O2NC6ЧАС4 нитрофенил и F5C6 пентафторфенил. Монозамещенные фенильные группы (то есть дизамещенные бензолы) связаны с электрофильное ароматическое замещение реакции и продукты следуют модель замещения арена. Итак, данное замещенное фенильное соединение имеет три изомера, орто (1,2-дизамещение), мета (1,3-дизамещение) и параграф (1,4-дизамещение). Дизамещенное фенильное соединение (тризамещенный бензол) может быть, например, 1,3,5-тризамещенным или 1,2,3-тризамещенным. Существуют более высокие степени замещения, примером которых является пентафторфенильная группа, они названы в соответствии с номенклатурой IUPAC.
Этимология
Фенил происходит от французского слова Фениль, которое, в свою очередь, происходит от греческого пайно: «сияющий», поскольку первые названные фенильные соединения были побочными продуктами изготовление и переработка различный газы, используемые для освещения.[3] По словам Макмерри, «это слово происходит от греческого фен («Я несу свет»), ознаменовывая открытие бензола Майкл Фарадей в 1825 году от маслянистых остатков осветительного газа, используемого в лондонских уличных фонарях ».[4]
Структура, связь и характеристика
Фенильные соединения получают из бензол (C6ЧАС6), по крайней мере, концептуально, а часто и с точки зрения их производства. По своим электронным свойствам фенильная группа относится к виниловая группа. Обычно ее считают индуктивно удаляющейся группой (-я) из-за большей электроотрицательности sp2 атомы углерода и резонансная донорная группа (+M), из-за способности его π-системы отдавать электронную плотность, когда сопряжение возможно.[5] Фенильная группа гидрофобный. Фенильные группы имеют тенденцию сопротивляться окислению и восстановлению. Фенильные группы (как и все ароматические соединения) обладают повышенной стабильностью по сравнению с эквивалентным связыванием в алифатический (неароматические) группы. Эта повышенная стабильность обусловлена уникальными свойствами ароматических молекулярные орбитали.[2]
Длина связи между атомами углерода в фенильной группе составляет примерно 1,4Å.[6]
В 1ЧАС-ЯМР спектроскопия, протоны фенильной группы обычно имеют химические сдвиги около 7,27 частей на миллион. На эти химические сдвиги влияют: ароматический кольцевой ток и может изменяться в зависимости от заместителей.
Подготовка, возникновение и приложения
Фенильные группы обычно вводятся с использованием реагентов, которые действуют как источники фенильного аниона или фенильного катиона. Типичные реагенты включают: фениллитий (C6ЧАС5Ли) и фенилмагний бромид (C6ЧАС5MgBr). Электрофилы атакуют бензол с образованием фенильных производных:
- C6ЧАС6 + E+ → С6ЧАС5E + H+
где E+ («электрофил») = Cl+, НЕТ2+, ТАК3. Эти реакции называются электрофильные ароматические замещения.
- Типичные соединения, содержащие фенильные группы
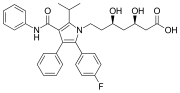
Аторвастатин (липитор), а наркотик-блокбастер с двумя фенилами и одним п-фторфенильные группы. Он используется для снижения уровня холестерина у людей с гиперхолестеринемия.
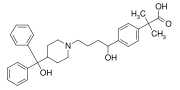
Фексофенадин (Аллегра, Телфаст), еще один препарат-блокбастер, который имеет дифенилметильную группу, а также п-фенилен (C6ЧАС4) группа. Это антигистаминный препарат используется для лечения аллергия.

Фенилаланин, обычная аминокислота.

Бифенил, состоящий из двух фенильных групп. Два кольца не могут быть копланарными.
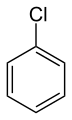
Хлорбензол (или фенилхлорид), растворитель.
Фенильные группы присутствуют во многих органических соединениях, как природных, так и синтетических (см. Рисунок). Наиболее распространенным среди натуральных продуктов является аминокислота фенилаланин, который содержит фенильную группу. Основной продукт нефтехимическая промышленность является "BTX «состоящий из бензола, толуола и ксилола - все они являются строительными блоками для фенильных соединений. полимер полистирол происходит из мономера, содержащего фенил, и своими свойствами он обязан жесткости и гидрофобности фенильных групп. Многие лекарства, а также многие загрязняющие вещества содержат фенильные кольца. Одним из простейших фенилсодержащих соединений является фенол, С6ЧАС5ОЙ. Часто говорят, что резонансная устойчивость фенола делает его более сильным кислота чем у алифатический спирты такие как этиловый спирт (пKа = 10 против 16–18). Однако значительный вклад тем больше электроотрицательность из зр2 альфа-углерод в феноле по сравнению с зр3 альфа-углерод в алифатических спиртах.[7]
использованная литература
- ^ а б Март, Джерри (1992). Продвинутая органическая химия: реакции, механизмы и структура (4-е изд.). Нью-Йорк: Вили. ISBN 978-0-471-60180-7.
- ^ а б «Виртуальный учебник органической химии: ароматичность». Университет штата Мичиган. http://www2.chemistry.msu.edu/faculty/reusch/VirtTxtJml/react3.htm
- ^ «фенил: определение фенила на английском языке по словарям Lexico». Получено 24 июля 2019.
- ^ Макмерри, Джон Э. (2009). Органическая химия, расширенное издание. Cengage Learning. п. 518. ISBN 9781111790042.
- ^ Hansch, Corwin .; Лев, А .; Taft, R. W. (1991-03-01). «Обзор констант заместителей Гаммета, резонансных и полевых параметров». Химические обзоры. 91 (2): 165–195. Дои:10.1021 / cr00002a004. ISSN 0009-2665.
- ^ Хамека, Хендрик Ф. (1987). «Расчет структур фенильного и бензильного радикалов методом УВЧ». Журнал органической химии. 52 (22): 5025–5026. Дои:10.1021 / jo00231a035. ISSN 0022-3263.
- ^ Сильва, Педро Хорхе (2009). «Индуктивные и резонансные эффекты на кислотности фенола, енолов и карбонильных α-атомов водорода». Журнал органической химии. 74 (2): 914–916. Дои:10.1021 / jo8018736. ISSN 0022-3263. PMID 19053615.
внешние ссылки
 СМИ, связанные с Фенильная группа в Wikimedia Commons
СМИ, связанные с Фенильная группа в Wikimedia Commons





