Тиоэстер - Википедия - Thioester
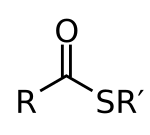
В химии тиоэфиры являются соединениями с функциональная группа R – S – CO – R '. Они аналогичны карбоксилату сложные эфиры при этом сера в сложном тиоэфире играет роль связующего кислорода в сложном эфире карбоксилата. Они являются продуктом этерификация между карбоновая кислота и тиол. В биохимия, самые известные тиоэфиры являются производными коэнзим А, например, ацетил-КоА.[1]
Синтез
Наиболее типичный путь получения тиоэфира включает реакцию хлорангидрид с солью щелочного металла тиола:[1]
- RSNa + R′COCl → R′COSR + NaCl
Другой распространенный путь включает замещение галогенидов солью щелочного металла тиокарбоновая кислота. Например, сложные эфиры тиоацетата обычно получают алкилированием тиоацетат калия:[1]
- CH3COSK + RX → CH3COSR + KX
Аналогичное алкилирование ацетатной соли практикуется редко. Алкилирование можно проводить с использованием оснований Манниха и тиокарбоновой кислоты:
- CH3COSH + R ′2NCH2ОН → СН3COSCH2NR ′2 + H2О
Тиоэфиры можно получить конденсацией тиолов и карбоновых кислот в присутствии дегидратирующих агентов:[2][3]
- RSH + R′CO2H → RSC (O) R ′ + H2О
Типичным агентом дегидратации является DCC.[4] Кислотные ангидриды и немного лактоны также дают тиоэфиры после обработки тиолами в присутствии основания.
Тиоэфиры удобно получать из спиртов с помощью Мицунобу реакция, с помощью тиоуксусная кислота.[5]
Они также возникают через карбонилирование из алкины и алкены в присутствии тиолов.[6]
Реакции
Карбонильный центр в тиоэфирах реагирует с нуклеофилами, даже с водой. Таким образом, сложные тиоэфиры являются обычными промежуточными продуктами превращения алкилгалогенидов в алкилтиолы. Тиоэфиры и амины объединяются, чтобы дать амиды:
В родственной реакции, но с использованием мягкого металла для захвата тиолата, тиоэфиры превращаются в сложные эфиры.[7]Тиоэфиры обеспечивают полезную хемоселективность при синтезе биомолекул.[8]
Уникальной реакцией тиоэфиров является Муфта Фукуяма, в котором тиоэфир соединен с галогенид цинка палладиевым катализатором с получением кетона.

Биохимия

Тиоэфиры являются обычными промежуточными продуктами во многих биосинтетических реакциях, включая образование и разложение жирные кислоты и мевалонат, предшественник стероидов. Примеры включают малонил-КоА, ацетоацетил-КоА, пропионил-КоА, и циннамоил-КоА. Ацетогенез происходит за счет образования ацетил-КоА. Биосинтез лигнин, который составляет значительную часть биомассы суши Земли, происходит через производное тиоэфира кофейная кислота.[9] Эти тиоэфиры возникают аналогично тем, которые получают синтетически, с той разницей, что агент дегидратации представляет собой АТФ. Кроме того, тиоэфиры играют важную роль в маркировке белков убиквитин, который маркирует белок для разложения.
Окисление атома серы в тиоэфирах (тиолактонах) постулируется при биоактивации антитромботических пролекарств тиклопидина, клопидогреля и прасугреля.[10][11]
Тиоэфиры и происхождение жизни
Как утверждается в «Мире тиоэфиров», тиоэфиры являются возможными предшественниками жизни.[12] В качестве де Дюв объясняет:
Показательно, что тиоэфиры являются обязательными промежуточными продуктами в нескольких ключевых процессах, в которых АТФ либо используется, либо восстанавливается. Тиоэфиры участвуют в синтезе всех сложные эфиры, в том числе в сложных липиды. Они также участвуют в синтезе ряда других клеточных компонентов, в том числе пептиды, жирные кислоты, стеролы, терпены, порфирины, и другие. Кроме того, сложные тиоэфиры образуются как ключевые промежуточные соединения в нескольких особенно древних процессах, которые приводят к сборке АТФ. В обоих этих случаях тиоэфир ближе, чем АТФ, к процессу, который использует или дает энергию. Другими словами, тиоэфиры действительно могли играть роль АТФ в «мире тиоэфиров», изначально лишенном АТФ. В конце концов, [эти] тиоэфиры могли способствовать появлению АТФ благодаря своей способности поддерживать образование связей между фосфатные группы.
Однако из-за высокого изменения свободной энергии гидролиза тиоэфиров и, соответственно, их низких констант равновесия маловероятно, что эти соединения могли накапливаться абиотически в какой-либо значительной степени, особенно в условиях гидротермальных источников.[13]
Изомерные соединения: тионоэфиры

Тионоэфиры изомеры с тиоэфирами. В тионоэфире сера замещает карбонильный кислород в сложный эфир. Метилтионобензоат - это C6ЧАС5C (S) OCH3. Такие соединения обычно получают реакцией тиоацилхлорида со спиртом, но их также можно получить реакцией Реактив Лавессона с эфирами.[14]
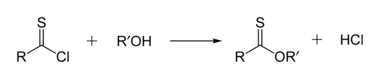
Альтернативный метод синтеза различных тионоэфиров заключается в переэтерификации существующего метилтионоэфира спиртом в условиях, катализируемых основанием.[15]
Смотрите также
Рекомендации
- ^ а б c Маттис Дж. Янссен «Карбоновые кислоты и сложные эфиры» в PATAI's Chemistry of Functional Group: Carboxylic Acids and Esters, Saul Patai, Ed. Джон Вили, 1969, Нью-Йорк: стр. 705–764. Дои:10.1002 / 9780470771099.ch15
- ^ Fujiwara, S .; Камбе, Н. (2005). «Сложные эфиры тио-, селено- и теллуро-карбоновых кислот». Темы современной химии. 251. Берлин / Гейдельберг: Springer. С. 87–140. Дои:10.1007 / b101007. ISBN 978-3-540-23012-0.
- ^ «Синтез тиоэфиров». Портал органической химии.
- ^ Mori, Y .; Секи, М. (2007). «Синтез многофункциональных кетонов посредством реакции связывания Фукуямы, катализируемой катализатором Перлмана: получение этил-6-оксотридеканоата». Органический синтез. 84: 285.; Коллективный объем, 11, п. 281
- ^ Воланте, Р. (1981). «Новый высокоэффективный метод превращения спиртов в тиолэфиры и тиолы». Буквы Тетраэдра. 22 (33): 3119–3122. Дои:10.1016 / S0040-4039 (01) 81842-6.
- ^ Bertleff, W .; Roeper, M .; Сава, X. «Карбонилирование». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a05_217.pub2.
- ^ Ван Кит Чан; С. Масамунэ; Гэри О. Спессард (1983). «Получение сложных эфиров O из соответствующих сложных эфиров тиолов: трет-бутилциклогексанкарбоксилат». Органический синтез. 61: 48. Дои:10.15227 / orgsyn.061.0048.
- ^ McGrath, N.A .; Рейнс, Р. Т. (2011). «Хемоселективность в химической биологии: реакции переноса ацила с серой и селеном». Соотв. Chem. Res. 44 (9): 752–761. Дои:10.1021 / ar200081s. ЧВК 3242736. PMID 21639109.
- ^ Lehninger, A. L .; Nelson, D. L .; Кокс, М. М. (2000). Принципы биохимии (3-е изд.). Нью-Йорк: стоит публикации. ISBN 1-57259-153-6.
- ^ Mansuy, D .; Дансетт, П. М. (2011). «Сульфеновые кислоты как реактивные промежуточные соединения в метаболизме ксенобиотиков». Архивы биохимии и биофизики. 507 (1): 174–185. Дои:10.1016 / j.abb.2010.09.015. PMID 20869346.
- ^ Dansette, P.M .; Rosi, J .; Debernardi, J .; Bertho, G .; Мансуй, Д. (2012). «Метаболическая активация прасугреля: природа двух конкурентных путей, приводящих к открытию его тиофенового кольца». Химические исследования в токсикологии. 25 (5): 1058–1065. Дои:10.1021 / тx3000279. PMID 22482514.
- ^ де Дуве, К. (1995). «Начало жизни на Земле». Американский ученый. 83 (5): 428–437. Bibcode:1995AmSci..83..428M.
- ^ Чандру, Кухан; Гилберт, Алексис; Бутч, Кристофер; Аоно, Масаси; Кливз, Хендерсон Джеймс II (21 июля 2016 г.). "Абиотическая химия производных тиолированного ацетата и происхождение жизни". Научные отчеты. 6 (29883): 29883. Bibcode:2016НатСР ... 629883C. Дои:10.1038 / srep29883. ЧВК 4956751. PMID 27443234.
- ^ Кремлин, Р. Дж. (1996). Введение в химию сероорганических соединений. Чичестер: Джон Уайли и сыновья. ISBN 0-471-95512-4.
- ^ Newton, Josiah J .; Бриттон, Роберт; Friesen, Chadron M. (4 октября 2018 г.). "Катализируемая основанием переэтерификация сложных тионоэфиров". Журнал органической химии. 83 (20): 12784–12792. Дои:10.1021 / acs.joc.8b02260. PMID 30235418.


