Гидразон - Hydrazone
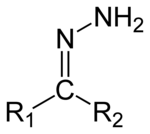
Гидразоны являются классом органические соединения со структурой р
1р
2C=NNH
2.[1] Они связаны с кетоны и альдегиды заменой кислорода на NNH
2 функциональная группа. Они образуются обычно под действием гидразин на кетоны или альдегиды.[2][3]
Использует
Образование производных ароматического гидразона используется для измерения концентрации низкомолекулярных альдегидов и кетонов, например в газовых потоках. Например, динитрофенилгидразин покрытый на кремнезем сорбент является основой адсорбция картридж. Затем гидразоны элюируются и анализируются с помощью ВЭЖХ используя УФ детектор.
Состав карбонил цианид-п-трифторметоксифенилгидразон (сокращенно FCCP) используется для разъединять АТФ синтез и снижение из кислород в окислительного фосфорилирования в молекулярная биология. Фенилгидразин реагирует с редуцирующими сахарами с образованием гидразонов, известных как осазоны, разработанный немецким химиком Эмиль Фишер как тест для дифференциации моносахаридов.[4][5]
Методы связывания на основе гидразона используются в медицинской биотехнологии для связывания лекарств с целевыми антителами (см. АЦП ), например антитела против определенного типа раковых клеток. Связь на основе гидразона устойчива при нейтральном pH (в крови), но быстро разрушается в кислой среде лизосом клетки. Таким образом, лекарство попадает в клетку и выполняет свою функцию.[6]
В водном растворе алифатических гидразонов 102- до 103- кратно более чувствительны к гидролизу, чем аналогичные оксимы.[7]
Реакции
Гидразоны являются реагентами в йодирование гидразона, то Реакция Шапиро и Реакция Бэмфорда-Стивенса к винил соединения. Гидразон является промежуточным звеном в Редукция Вольфа – Кишнера. Гидразоны также могут быть синтезированы Реакция Яппа – Клингеманна через β-кетокислоты или β-кетоэфиры и соли арилдиазония. Недавно механохимический процесс был использован в качестве зеленого для синтеза фармацевтически привлекательных фенолгидразонов.[8] Гидразоны превращаются в азины при использовании в получении 3,5-дизамещенного 1ЧАС-пиразолы,[9] реакция также хорошо известна с использованием гидразингидрат.[10][11] С катализатором на основе переходного металла гидразоны могут реагировать с различными электрофилами.[12]
N,N-диалкилгидразоны
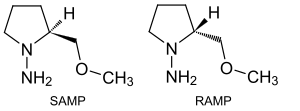
В N,N-диалкилгидразоны[13] связь C = N может быть гидролизована, окислена и восстановлена, связь N-N может быть восстановлена до свободного амина. Атом углерода связи C = N может реагировать с металлоорганическими нуклеофилами. Альфа-атом водорода кислотнее на 10 порядки величины по сравнению с кетоном и, следовательно, более нуклеофильный. Депротонирование, например LDA дает азаенолат который может быть алкилирован алкилгалогенидами, реакция впервые была предложена Элиас Джеймс Кори и Дитер Эндерс в 1978 г.[14][15] В асимметричный синтез SAMP и RAMP - два хиральных гидразина, которые действуют как хиральный вспомогательный с промежуточным хиральным гидразоном.[16][17][18]
Галерея
- Гидразоны

Бензофенон гидразон, иллюстративный гидразон

Гиромитрин (Метилформилгидразон ацетальдегида), токсин

Дигидралазин, антигипертензивный препарат
Смотрите также
Рекомендации
- ^ Марш, Джерри (1985), Продвинутая органическая химия: реакции, механизмы и структура (3-е изд.), Нью-Йорк: Wiley, ISBN 0-471-85472-7
- ^ Аист, Г .; Бенаим, Дж. (1977). «Моноалкилирование α, β-ненасыщенных кетонов через Металлоенамины: 1-бутил-10-метил-Δ1(9)-2-окталон ». Органический синтез. 57: 69.; Коллективный объем, 6, п. 242
- ^ Day, A.C .; Уайтинг, М. К. (1970). «Ацетон гидразон». Органический синтез. 50: 3.; Коллективный объем, 6, п. 10
- ^ Фишер, Эмиль (1908). "Schmelzpunkt des Phenylhydrazins und einiger Osazone". Berichte der Deutschen Chemischen Gesellschaft. 41: 73–77. Дои:10.1002 / cber.19080410120.
- ^ Фишер, Эмиль (1894). "Ueber einige Osazone und Hydrazone der Zuckergruppe". Berichte der Deutschen Chemischen Gesellschaft. 27 (2): 2486–2492. Дои:10.1002 / cber.189402702249.
- ^ Ву, Анна М .; Сентер, Питер Д. (7 сентября 2005 г.). «Вооружение антител: перспективы и проблемы для иммуноконъюгатов». Природа Биотехнологии. 23 (9): 1137–46. Дои:10.1038 / nbt1141. PMID 16151407.
- ^ Kalia, J .; Рейнс, Р. Т. (2008). «Гидролитическая стабильность гидразонов и оксимов». Энгью. Chem. Int. Эд. 47 (39): 7523–6. Дои:10.1002 / anie.200802651. ЧВК 2743602. PMID 18712739.
- ^ Oliveira, P. F. M .; Барон, М .; Chamayou, A .; André-Barrès, C .; Guidetti, B .; Балтас, М. (2014). «Механохимический путь без использования растворителей для зеленого синтеза фармацевтически привлекательных фенол-гидразонов» (PDF). RSC Adv. 4 (100): 56736–56742. Дои:10.1039 / c4ra10489g.
- ^ Ласри, Джамал; Исмаил, Али И. (2018). «Без металлов и FeCl3-каталитический синтез азинов и 3,5-дифенил-1ЧАС-пиразол из гидразонов и / или кетонов под контролем ESI высокого разрешения+-РС". Индийский химический журнал, раздел B. 57B (3): 362–373.
- ^ Утирит, Моха; Лебрини, Муним; Лагрене, Мишель; Бентисс, Фуад (2008). «Новый одностадийный синтез 3,5-дизамещенных пиразолов при микроволновом облучении и классическом нагревании». Журнал гетероциклической химии. 45 (2): 503–505. Дои:10.1002 / jhet.5570450231.
- ^ Чжан, Цзэ; Тан, Я-Джун; Ван, Чунь-Шань; У, Хао-Хао (2014). «Однореакторный синтез 3,5-дифенил-1.ЧАС-пиразолы из халконов и гидразина при механохимической шаровой мельнице ». Гетероциклы. 89 (1): 103–112. Дои:10.3987 / COM-13-12867.
- ^ Wang, H; Дай, X.-J .; Ли, К.-Дж. (2017). «Альдегиды как эквиваленты алкилкарбанионов для добавок к карбонильным соединениям». Химия природы. 9: 374–378. Дои:10.1038 / nchem.2677.
- ^ Лазный, Р .; Нодзевска, А. (2010). «N, N-диалкилгидразоны в органическом синтезе. От простых N, N-диметилгидразонов до хиральных вспомогательных веществ на носителе». Химические обзоры. 110 (3): 1386–1434. Дои:10.1021 / cr900067y. PMID 20000672.
- ^ Кори, Элиас Джеймс; Эндерс, Д. (1976). «Применение N, N-диметилгидразонов для синтеза. Использование для эффективного, позиционно и стереохимически селективного образования связи C_C; окислительный гидролиз до карбонильных соединений». Буквы Тетраэдра. 17 (1): 3. Дои:10.1016 / S0040-4039 (00) 71307-4.
- ^ Кори, Э. Дж .; Эндерс, Д. (1978). "Herstellung und Synthetische Verwendung von Metallierten Dimethylhydrazonen Regio- und Stereoselektive Alkylierung von Carbonylverbindungen". Chemische Berichte. 111 (4): 1337–1361. Дои:10.1002 / cber.19781110413.
- ^ Эндерс, Д .; Эйхенауэр, Х. (1977). «Энантиоселективное алкилирование альдегидов через металлированные хиральные гидразоны». Буквы Тетраэдра. 18 (23): 191–194. Дои:10.1016 / S0040-4039 (01) 92585-7.
- ^ Эндерс, Дитер; Фей, Питер; Киппхардт, Гельмут (1987). "(S) - (-) - 1-амино-2-метоксиметилпирролидин (SAMP) и (р) - (+) - 1-амино-2-метоксиметилпирролидин (RAMP), универсальные хиральные вспомогательные вещества ». Органический синтез. 65: 173.; Коллективный объем, 8, п. 26
- ^ Эндерс, Дитер; Киппхардт, Гельмут; Фей, Питер (1987). «Асимметричный синтез с использованием метода SAMP- / RAMP-гидразона: (S) - (+) - 4-метил-3-гептанон ». Органический синтез. 65: 183.; Коллективный объем, 8, п. 403