Изоцианид - Isocyanide
An изоцианид (также называемый изонитрил или же карбиламин) является органическое соединение с функциональная группа -N≡C. Это изомер связанных нитрил (-C≡N), следовательно, префикс изоциано.[1] Органический фрагмент связан с изоцианидной группой через азот атом, а не через углерод. Они используются в качестве строительных блоков для синтеза других соединений.[2]
Характеристики
Структура и склеивание
Расстояние C-N в изоцианидах составляет 115,8 пм в метилизоцианид. Углы C-N-C составляют около 180 °.[3]
Сродни монооксид углерода, изоцианиды описываются двумя резонансные структуры, один с тройная связь между азотом и углеродом и один с двойная связь между. Π-неподеленная пара азота стабилизирует структуру и отвечает за линейность изоцианидов, хотя реакционная способность изоцианидов отражает некоторый характер карбена, по крайней мере, в формальном смысле. Таким образом, обе резонансные структуры являются полезными представлениями.[4] Они восприимчивы к полимеризация.[4]
Спектроскопия
Изоцианиды демонстрируют сильное поглощение в ИК-спектрах в диапазоне 2165–2110 см.−1.[5]
Электронная симметрия относительно изоцианида 14Ядро N приводит к медленному квадрупольному расслабление так что 13C-14N ядерный спин связь можно наблюдать, с константами связи ок. 5 Гц для изоцианида 13Ядра C и 5–14 Гц для 13Ядро C, к которому присоединена изоцианидная группа.[5]
Запах
Об их неприятном запахе ходят легенды. Цитата из Лике: "Es besitzt einen Penienten, höchst unangenehmen Geruch; das Oeffnen eines Gefässes mit Cyanallyl reicht hin, die Luft eines Zimmers mehrere Tage lang zu verpesten, ..."(Он имеет резкий, крайне неприятный запах; открытия колбы с аллил [изо] цианидом достаточно, чтобы загрязнить воздух в комнате на несколько дней). Обратите внимание, что во времена Лике разница между изоцианидом и нитрилом была не полностью оценен.
Ивар Карл Уги утверждает, что "Развитие химии изоцианидов, вероятно, лишь немного задержалось из-за характерного запаха летучих изонитрилов, который был описан Хофманном и Готье как «очень специфический, почти подавляющий», «ужасный» и «чрезвычайно тревожный». Это правда, что многие потенциальные работники в этой области были отвергнуты запахом, но это в значительной степени перевешивается тем фактом, что изонитрилы могут быть обнаружены даже в следовых количествах, и что большинство путей, ведущих к образованию изонитрилов, были обнаружены через запах этих соединений ".[6] Изоцианиды были исследованы как потенциальные нелетальное оружие.[7]
Некоторые изоцианиды имеют менее неприятный запах, например, солод, натуральный каучук, креозот, мягкая вишня или старая древесина.[8] Нелетучие производные, такие как тозилметилизоцианид не имеют неприятных запахов.[9]
Токсичность
Хотя некоторые изоцианиды (например., циклогексилизоцианид) токсичны, другие «не проявляют заметной токсичности для млекопитающих». Что касается этилизоцианида, токсикологические исследования в 1960-х годах в компании Bayer показали, что «мыши могут переносить пероральные и подкожные дозы 500-5000 мг / кг».[6]
Синтез
Разработано множество способов получения изоцианидов.[2]
Из формамидов
Обычно изоцианиды синтезируются обезвоживание из формамиды. Формамид можно обезвоживать с помощью толуолсульфонилхлорид, оксихлорид фосфора, фосген, дифосген, или Реагент Берджесса в присутствии основания, такого как пиридин или триэтиламин.[10][11][12]
- RNHC (O) H + ArSO2Cl + 2C5ЧАС5N → RNC + [C5ЧАС5NH]+[ArSO3]– + [C5ЧАС5NH]+Cl–
Из дихлоркарбена
в реакция карбиламина щелочное основание (также известное как синтез изоцианида Хофмана) реагирует с хлороформ производить дихлоркарбен. Затем карбен преобразует первичный амины к изоцианидам. Показательным является синтез терт-бутилизоцианид из терт-бутиламин в присутствии каталитический количество катализатор межфазного переноса бензилтриэтиламмонийхлорид.[13]
- Мне3CNH2 + CHCl3 + 3 NaOH → Me3ЧПУ + 3 NaCl + 3 H2О
Поскольку она эффективна только для первичных аминов, эта реакция может быть использована в качестве химический тест за их присутствие.
Путь цианида серебра
Представляющий исторический интерес, но не часто представляющий практическую ценность, первый изоцианид, аллил изоцианид, был получен по реакции аллил йодид и цианид серебра.[14]
- RX + AgCN → RNC + AgX
Другие методы
Другой путь к изоцианидам - депротонирование оксазолы и бензоксазолы в положении 2.[8] Полученное литийорганическое соединение существует в химическое равновесие с 2-изоцианофенолят, который может быть захвачен электрофил например, хлорангидрид.
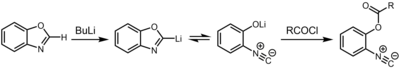
Реакции
Изоцианиды обладают разнообразной реакционной способностью.[2]
Изоцианиды устойчивы к сильному основанию (их часто получают в сильно основных условиях), но они чувствительны к кислоте. В присутствии водной кислоты изоцианиды гидролизуются до соответствующих формамиды:
- RNC + H2О → RN (H) C (O) H
Эта реакция используется для разрушения пахучих смесей изоцианидов. Некоторые изоцианиды могут полимеризоваться в присутствии кислот Льюиса и Бренстеда.[15]
Изоцианиды участвуют во многих многокомпонентные реакции представляет интерес в органический синтез, два из которых: Уги реакция и Реакция Пассерини.
Изоцианиды также участвуют в циклоприсоединение реакции, такие как [4 + 1] циклоприсоединение с тетразинами.[16] В зависимости от степени замещения изоцианида эта реакция превращает изоцианиды в карбонилы или дает стабильные циклодукты.[17] Они также внедряются по связям C – Cl ацилхлоридов в Неф изоцианидная реакция, процесс, который считается согласованным и иллюстрирует их карбеновый характер.
Было также показано, что изоцианиды являются полезным реагентом в реакциях, катализируемых палладием, с широким спектром соединений, образующихся с использованием этого метода.[18]
Α-положение изоцианидов имеет значительную кислотность. Например, бензилизоцианид имеет pKа из 27,4. Для сравнения, бензилцианид имеет pKа 21.9.[19] В газовой фазе CH3NC на 1,8 ккал / моль менее кислотный, чем CH3CN.[20]
Лиганды в координационной химии

Форма изоцианидов координационные комплексы с большинством переходных металлов.[21] Они ведут себя как электронно-богатые аналоги окиси углерода. Например трет-бутилизоцианид формы Fe2(tBuNC)9, аналогичного Fe2(CO)9.[22] Несмотря на то, что аналогичные карбонилы структурно схожи, аналогичные карбонилы различаются по нескольким причинам, в основном потому, что t-BuNC является лучшим донорным лигандом, чем CO.5 легко протонируется, тогда как его аналог Fe (CO)5 не является.[23]
Изоцианиды природного происхождения
Лишь немногие встречающиеся в природе соединения обладают изоцианидной функциональностью. Первый был обнаружен в 1957 году в экстракте плесени. Penicillium notatum. Состав ксантоциллин позже использовался как антибиотик. С тех пор было выделено множество других изоцианидов. Большинство морских изоцианидов являются терпеноидами, в то время как некоторые наземные изоцианиды происходят из α-аминокислот.[24]
 Ксантоциллин редкий натуральный продукт который содержит изоцианидную группу (фактически две).
Ксантоциллин редкий натуральный продукт который содержит изоцианидную группу (фактически две).
Номенклатура
Тогда как в Номенклатура ИЮПАК в большинстве случаев суффикс «нитрил» или «карбонитрил» используется для органических цианиды (R-C≡N),[25] названия изоцианидов имеют префикс «изоциано». Имена ИЮПАК становятся изоцианометан, изоцианоэтан, изоцианопропан и др.
Иногда используемый термин «карбиламин» противоречит систематической номенклатуре. An амин всегда имеет три одинарные связи,[26] тогда как изоцианид имеет только одну простую и одну кратную связь.
В изоцианамид функциональная группа состоит из аминогруппы, присоединенной к изоциано-фрагменту. для номенклатуры используется суффикс изонитрила или префикс изоциано в зависимости от таблицы приоритетов.
Рекомендации
- ^ Золотая книга ИЮПАК изоцианиды
- ^ а б c Патил, Правин; Ахмадиан-Могхаддам, Марьям; Дёмлинг, Александр (29.09.2020). «Изоцианид 2,0». Зеленая химия. Дои:10.1039 / D0GC02722G. ISSN 1463-9270.
- ^ Кесслер, М .; Кольцо, H .; Trambarulo, R .; Горди, В. (1950). «Микроволновые спектры и молекулярные структуры метилцианида и метилизоцианида». Физический обзор. 79 (1): 54–56. Bibcode:1950PhRv ... 79 ... 54K. Дои:10.1103 / PhysRev.79.54.
- ^ а б Ramozzi, R .; Chéron, N .; Braïda, B .; Hiberty, P.C .; Флёрат-Лессар П. (2012). "Взгляд валентной связи на электронную структуру изоцианидов". Новый журнал химии. 36 (5): 1137–1340. Дои:10.1039 / C2NJ40050B.
- ^ а б Stephany, R.W .; де Би, М. Дж. А .; Дрент, В. (1974). "А 13C-ЯМР и ИК исследование изоцианидов и некоторых их комплексов ». Органический магнитный резонанс. 6 (1): 45–47. Дои:10.1002 / mrc.1270060112.
- ^ а б Уги, I .; Fetzer, U .; Eholzer, U .; Knupfer, H .; Офферманн, К. (1965). «Изонитрилсинтез». Angewandte Chemie International Edition. 4 (6): 472–484. Дои:10.1002 / anie.196504721.
- ^ Пиррунг, М. С .; Ghorai, S .; Ибарра-Ривера, Т. Р. (2009). «Многокомпонентные реакции конвертируемых изонитрилов». Журнал органической химии. 74 (11): 4110–4117. Дои:10.1021 / jo900414n. PMID 19408909.
- ^ а б Пиррунг, М. С .; Гораи, С. (2006). «Универсальные, ароматные, конвертируемые изонитрилы». Журнал Американского химического общества. 128 (36): 11772–11773. Дои:10.1021 / ja0644374. PMID 16953613.
- ^ B.E. Hoogenboom, O.H. Oldenziel и A.M. van Leusen "Органический синтез толуолсульфонилметилизоцианида", Coll. Vol. 6, с. 987 (1988).
- ^ Р. Э. Шустер; Дж. Э. Скотт (1966). «Метилизоцианид». Органический синтез. 46: 75. Дои:10.15227 / orgsyn.046.0075.
- ^ Ивар Карл Уги; Р. Мейр (1958). "Neue Darstellungsmethode für Isonitrile". Angewandte Chemie. 70 (22–23): 702–703. Дои:10.1002 / ange.19580702213.
- ^ Шивон Кридон; Х. Кевин Кроули; Дэниел Дж. Маккарти (1998). «Дегидратация формамидов с использованием реагента Берджесса: новый путь к изоцианидам». J. Chem. Soc., Perkin Trans. 1 (6): 1015–1018. Дои:10.1039 / a708081f.
- ^ Г. В. Гокель; Р. П. Видера; В. П. Вебер (1988). «Фазовый перенос реакции карбиламина Гофмана: трет-бутилизоцианид». Органический синтез. 55: 232. Дои:10.15227 / orgsyn.055.0096.
- ^ В. Лике (1859 г.). "Über das Cyanallyl". Annalen der Chemie und Pharmacie. 112 (3): 316–321. Дои:10.1002 / jlac.18591120307.
- ^ Деминг, Т. Дж .; Новак, Б. М. (1993). "Механистические исследования катализируемой никелем полимеризации изоцианидов". Варенье. Chem. Soc. 115: 9101. Дои:10.1021 / ja00073a028.
- ^ Imming, P .; Р. Мор; Э. Мюллер; W. Overheu; Г. Зейтц (1982). «[4 + 1] циклоприсоединение изоцианидов к 1,2,4,5-тетразинам: новый синтез пиразола». Angewandte Chemie International Edition. 21 (4): 284. Дои:10.1002 / anie.198202841.
- ^ Stöckmann, H .; А. Невес; S. Stairs; К. Бриндл; Ф. Липер (2011). «Изучение клик-химии на основе изонитрила для лигирования с биомолекулами». Органическая и биомолекулярная химия. 9 (21): 7303–7305. Дои:10.1039 / C1OB06424J. PMID 21915395.
- ^ Ланг, С. (2013). «Распутывая лабиринт катализируемых палладием реакций с участием изоцианидов». Обзоры химического общества. 42 (12): 4867–4880. Дои:10.1039 / C3CS60022J. PMID 23443313.
- ^ «Таблица Bordwell pKa (Кислотность в ДМСО)». www.chem.wisc.edu. Получено 2018-12-20.
- ^ Филли, Джонатан; DePuy, Charles H .; Бирбаум, Вероника М. (1987-09-01). «Химия метилизоцианида в газовой фазе с отрицательными ионами». Журнал Американского химического общества. 109 (20): 5992–5995. Дои:10.1021 / ja00254a017. ISSN 0002-7863.
- ^ Синглтон, Эрик; Остхейзен, Хестер Э. (1983). «Металлические изоцианидные комплексы». Успехи металлоорганической химии. 22: 209–310. Дои:10.1016 / S0065-3055 (08) 60404-9.
- ^ Bassett, J.M .; Баркер, Г.К .; Грин, М .; Howard, J.A .; Stone, G.A .; Wolsey, W.C. «Химия изоцианидных комплексов низковалентных металлов». J.C.S. Далтон. 1981: 219–227.
- ^ Bassett, J.-M .; Farrugia, L.J .; Стоун, F.G.A. (1980). «Протонирование пентакис (трет-бутилизоцианид) железа». J.C.S. Далтон. 1980: 1789–1790. Дои:10.1039 / DT9800001789.
- ^ Шойер, П. Дж. (1992). «Изоцианиды и цианиды как натуральные продукты». Отчеты о химических исследованиях. 25 (10): 433–439. Дои:10.1021 / ar00022a001.
- ^ Номенклатура органических соединений ИЮПАК (Рекомендации 1993 г.)
- ^ Номенклатура органических соединений ИЮПАК (Рекомендации 1993 г.)

![{ displaystyle left [{ ce {R}} - { overset { oplus} { ce {N}}} { ce {#}} { overset { ominus} { ce {C}} } { ce {: , <-> R - { ddot {N}} = C {:}}} right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/31596ad44ed69b7ad7230333e4059f48ef0d3b65)
