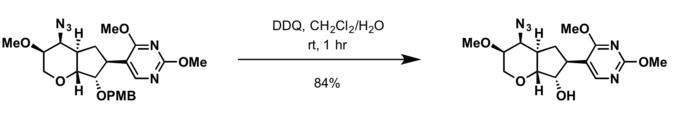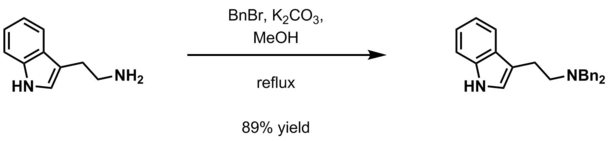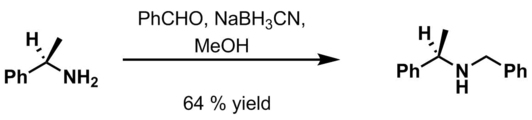Бензильная группа - Benzyl group
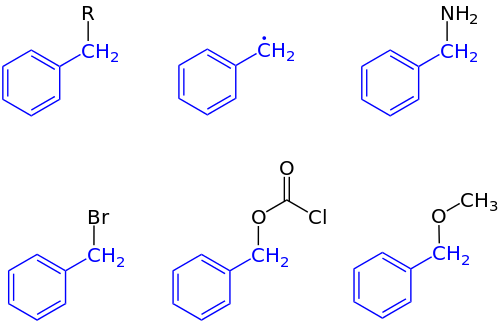
В органическая химия, бензил это заместитель или молекулярный фрагмент, имеющий структуру C6ЧАС5CH2-. Бензил имеет бензол кольцо прикреплено к CH2 группа.[1]
Номенклатура
В номенклатуре ИЮПАК префикс бензил относится к C6ЧАС5CH2 заместитель, например бензилхлорид или же бензилбензоат. Бензил не следует путать с фенил с формулой C6ЧАС5. Период, термин бензиловый используется для описания положения первого углерода, связанного с бензолом или другим ароматный звенеть. Например, (C6ЧАС5) (CH3)2C+ упоминается как «бензильный» карбокатион. Бензил свободный радикал имеет формулу C
6ЧАС
5CH•
2. Бензильный катион или фенилкарбениевый ион является карбокатион с формулой C
6ЧАС
5CH+
2; бензил-анион или фенилметанид-ион является карбанион с формулой C
6ЧАС
5CH−
2. Ни один из этих видов не может образовываться в значительных количествах в фазе раствора при нормальных условиях, но они являются полезными объектами для обсуждения механизмы реакции и может существовать как реакционноспособные промежуточные соединения.
Сокращения
Аббревиатура «Bn» обозначает бензил. Например, бензиловый спирт можно представить как BnOH. Это сокращение не следует путать с "Bz", которое является сокращением для бензоил группа C6ЧАС5C (O) -, или фенильная группа C6ЧАС5, сокращенно «Ph». Как ни странно, в старой литературе «Bz» также использовалось для обозначения бензила.
Реакционная способность бензильных центров
Повышенная реакционная способность бензильных позиций связана с низким энергия диссоциации связи для бензильных связей C − H. В частности, связь C6ЧАС5CH2-H примерно на 10-15% слабее, чем другие типы связей C-H. Соседнее ароматическое кольцо стабилизирует бензильные радикалы. Данные, представленные в таблице ниже, сравнивают бензильную связь C-H с соответствующими прочностями связи C-H.
| Связь | Связь | Связь-диссоциация энергии | Комментарий | |
|---|---|---|---|---|
| (ккал / моль) | (кДж / моль) | |||
| C6ЧАС5CH2-H | бензильная связь C-H | 90 | 377 | сродни аллильным связям C − H такие связи показывают повышенную реактивность |
| ЧАС3C − H | метил Связь C − H | 105 | 439 | одна из самых сильных алифатических связей C − H |
| C2ЧАС5-H | этил Связь C − H | 101 | 423 | немного слабее, чем H3C − H |
| C6ЧАС5-H | фенил Связь C − H | 113 | 473 | сравнимо с виниловым радикалом, редко |
| CH2= CHCH2-H | аллильный Связь C – H | 89 | 372 | такие связи показывают повышенную реактивность |
Слабость связи C-H отражает стабильность бензильного радикала. По связанным причинам бензильные заместители проявляют повышенную реакционную способность, как в окисление, свободнорадикальное галогенирование, или же гидрогенолиз. В качестве практического примера, в присутствии подходящих катализаторов, п-ксилол окисляется исключительно по бензильным позициям с образованием терефталевая кислота:
- CH3C6ЧАС4CH3 + 3 O2 → HO2CC6ЧАС4CO2H + 2 H2О.
Этим методом ежегодно производятся миллионы тонн терефталевой кислоты.[2]
Функционализация по бензильной позиции
В некоторых случаях эти бензильные превращения происходят в условиях, подходящих для условий синтеза. В Реакция Воля-Циглера будет бромировать бензильную связь C – H: (ArCHR2 → ArCBrR2).[3] Любая нетретичная бензильная алкильная группа будет окислена до карбоксильной группы водным перманганатом калия (KMnO4) или концентрированной азотной кислоты (HNO3): (ArCHR2 → ArCOOH).[4] Наконец, комплекс триоксид хрома и 3,5-диметилпиразол (CrO3–Dmpyz) будет избирательно окислять бензильную метиленовую группу до карбонила: (ArCH2R → ArC (O) R).[5] В последнее время, 2-йодоксибензойная кислота в DMSO, как сообщается, выполняет такое же преобразование.[6]
Как защитная группа
Бензильные группы иногда используются в качестве защитных групп в органическом синтезе. Их установка и особенно их удаление требуют относительно суровых условий, поэтому бензил обычно не является предпочтительным для защиты.[7]
Защита от алкоголя
Бензил обычно используется в органическом синтезе в качестве надежной защитной группы для спирты и карбоновые кислоты.
- Обработка спирта сильнодействующим основанием, например порошком гидроксид калия или же гидрид натрия и бензилгалогенид (BnCl или же BnBr )[7][8]
- Монобензилирование диолы может быть достигнуто с помощью Ag2О в диметилформамид (DMF) при температуре окружающей среды и повышенных температурах[9]
- Первичные спирты может быть селективно бензилирован в присутствии фенольных функциональных групп с использованием Cu (acac)2[10]
Методы снятия защиты
Бензиловые эфиры можно удалить при редуктивный условия, окислительный условия, и использование Кислоты Льюиса.[7]
- Удалено с помощью гидрогенолиз[11]
- Одноэлектронный процесс с Na /NH3 или же Ли / NH3
- Бензильные защитные группы могут быть удалены с использованием широкого спектра окислителей, включая:
- CrO3 /уксусная кислота при температуре окружающей среды
- Озон
- N-Бромсукцинимид (NBS)
- N-Йодосукцинимид (Шек.)
- Триметилсилил йодид (Me3SiI) в дихлорметан при температуре окружающей среды (селективность может быть достигнута при определенных условиях)
В п-метоксибензильная защитная группа
п-Метоксибензил (PMB) используется как защитная группа за спирты в органический синтез (4-метоксибензилтиол используется для защиты тиолов).
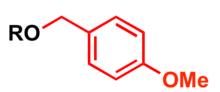
- Сильная основа, например, порошковая гидроксид калия или же гидрид натрия и п-метоксибензилгалогенид (хлорид или бромид)[12][13]
- 4-метоксибензил-2,2,2-трихлорацетимидат можно использовать для установки группы PMB в присутствии:
- Трифлат скандия (III) (Sc (OTf)3) в толуоле при 0 ° C[14]
- Трифторметансульфоновая кислота (TfOH) в дихлорметан при 0 ° C[15]
Методы снятия защиты
- 2,3-Дихлор-5,6-дициано-п-бензохинон (DDQ)[16]
- Условия снятия защиты с бензильной группы применимы для отщепления защитной группы PMB.
Аминная защита
Бензильная группа иногда используется в качестве защитная группа за амины в органический синтез. Существуют и другие методы.[7]
- Водный карбонат калия и бензилгалогенид (BnCl, BnBr ) в метанол[17]
- Бензальдегид, 6 м HCl и NaBH3CN в метанол[18]
Методы снятия защиты
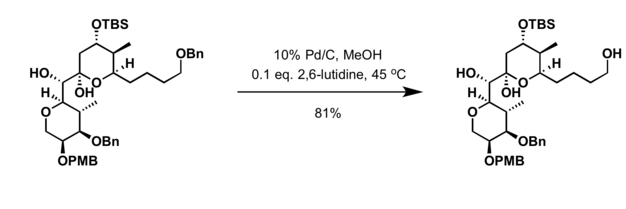
- Гидрирование в присутствии палладий катализатор[19]

Смотрите также
Рекомендации
- ^ Кэри, Ф. А .; Сандберг, Р. Дж. (2008). Продвинутая органическая химия, часть A: структура и механизмы (5-е изд.). Нью-Йорк, штат Нью-Йорк: Спрингер. стр.806 –808, 312–313. ISBN 9780387448978.
- ^ Шиэн, Ричард Дж. «Терефталевая кислота, диметилтерефталат и изофталевая кислота». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a26_193.
- ^ К., Воллхардт, К. Питер (2018-01-29). Органическая химия: структура и функции. Schore, Neil Eric, 1948- (8-е изд.). Нью-Йорк. ISBN 9781319079451. OCLC 1007924903.
- ^ Чандлер), Норман Р. О. К. (Ричард Освальд (1993). Принципы органического синтеза. Коксон, Дж. М. (Джеймс Моррис), 1941- (3-е изд.). Лондон: Blackie Academic & Professional. ISBN 978-0751401264. OCLC 27813843.
- ^ Джонстон, Джеффри Н. (2001), «Оксид хрома (VI) -3,5-диметилпиразол», Оксид хрома (VI) - 3,5-Диметилпиразол, Энциклопедия реагентов для органического синтеза, Американское онкологическое общество, Дои:10.1002 / 047084289x.rc170, ISBN 9780470842898
- ^ Baran, Phil S .; Чжун, Юн-Ли (2001-04-01). «Селективное окисление на углероде, прилегающем к ароматическим системам с IBX». Журнал Американского химического общества. 123 (13): 3183–3185. Дои:10.1021 / ja004218x. ISSN 0002-7863. PMID 11457049.
- ^ а б c d Wuts, Питер Г. М .; Грин, Теодора В. (2006). Защитные группы Грина в органическом синтезе (4-е изд.). Интернет-библиотека Wiley. Дои:10.1002/0470053488. ISBN 9780470053485.
- ^ Фукудзава, Акио; Сато, Хидеаки; Масамунэ, Тадаши (1 января 1987 г.). «Синтез (±) -препинатерпена, бромодитерпена из красной водоросли Ямада». Буквы Тетраэдра. 28 (37): 4303–4306. Дои:10.1016 / S0040-4039 (00) 96491-8.
- ^ Ван Хейфте, Люк; Литтл, Р. Дэниэл (1985-10-01). «Внутримолекулярные реакции улавливания 1,3-диила. Формальный полный синтез (±) -кориолина». Журнал органической химии. 50 (20): 3940–3942. Дои:10.1021 / jo00220a058. ISSN 0022-3263.
- ^ Сиркечиоглу, Окан; Карлига, Бекир; Талинли, Нацие (10 ноября 2003 г.). «Бензилирование спиртов с использованием бис [ацетилацетонато] меди в качестве катализатора». Буквы Тетраэдра. 44 (46): 8483–8485. Дои:10.1016 / j.tetlet.2003.09.106.
- ^ Smith, Amos B .; Чжу, Вэньюй; Шираками, Шохей; Сфуггатакис, Крис; Даути, Виктория А .; Bennett, Clay S .; Сакамото, Ясухару (01.03.2003). «Полный синтез (+) - Спонгистатина 1. Эффективная конструкция второго поколения усовершенствованной соли EF Виттига, объединения фрагментов и окончательной разработки». Органические буквы. 5 (5): 761–764. Дои:10.1021 / ol034037a. ISSN 1523-7060. PMID 12605509.
- ^ Marco, José L .; Уэсо-Родригес, Хуан А. (1988-01-01). «Синтез оптически чистых производных 1- (3-фурил) -1,2-дигидроксиэтана». Буквы Тетраэдра. 29 (20): 2459–2462. Дои:10.1016 / S0040-4039 (00) 87907-1.
- ^ Такаку, Хироши; Камаике, Кадзуо; Цучия, Хиромичи (1 января 1984). «Синтез олигонуклеотидов. Часть 21. Синтез рибоолигонуклеотидов с использованием 4-метоксибензильной группы в качестве новой защитной группы для 2'-гидроксильной группы». Журнал органической химии. 49 (1): 51–56. Дои:10.1021 / jo00175a010. ISSN 0022-3263.
- ^ Трост, Барри М .; Васер, Джером; Мейер, Арндт (2007-11-01). «Полный синтез (-) - псевдолярной кислоты B». Журнал Американского химического общества. 129 (47): 14556–14557. Дои:10.1021 / ja076165q. ISSN 0002-7863. ЧВК 2535803. PMID 17985906.
- ^ Мукаяма, Теруаки; Шиина, Исаму; Ивадаре, Хаято; Сайто, Масахиро; Нисимура, Тошихиро; Окава, Наото; Сако, Хироки; Нисимура, Кодзи; Тани, Ю-ичиро (1999-01-04). «Асимметричный тотальный синтез таксола R». Химия - Европейский журнал. 5 (1): 121–161. Дои:10.1002 / (SICI) 1521-3765 (19990104) 5: 1 <121 :: AID-CHEM121> 3.0.CO; 2-O. ISSN 1521-3765.
- ^ Ханессиан, Стивен; Маркотт, Стефан; Мачаалани, Роджер; Хуан, Гобинь (01.11.2003). "Полный синтез и структурное подтверждение малаямицина А: новый бициклический препарат" C-Нуклеозид из Streptomyces malaysiensis ». Органические буквы. 5 (23): 4277–4280. Дои:10.1021 / ol030095k. ISSN 1523-7060. PMID 14601979.
- ^ Kuehne, Martin E .; Сюй, Фэн (1993-12-01). «Полный синтез алкалоидов стрихнана и аспидосперматана. 3. Полный синтез (±) -стрихнина». Журнал органической химии. 58 (26): 7490–7497. Дои:10.1021 / jo00078a030. ISSN 0022-3263.
- ^ Каин, Кристиан М .; Казинс, Ричард П. К .; Coumbarides, Грег; Симпкинс, Найджел С. (01.01.1990). «Асимметричное депротонирование прохиральных кетонов с использованием хиральных амидных оснований лития». Тетраэдр. 46 (2): 523–544. Дои:10.1016 / S0040-4020 (01) 85435-1.
- ^ Чжоу, Хао; Ляо, Сюэбинь; Кук, Джеймс М. (2004-01-01). «Региоспецифический, энантиоспецифический полный синтез 12-алкокси-замещенных индольных алкалоидов, (+) - 12-метокси-Na-метилвеллозимина, (+) - 12-метоксиаффинизина и (-) - фуксиифолина». Органические буквы. 6 (2): 249–252. Дои:10.1021 / ol0362212. ISSN 1523-7060. PMID 14723540.
- ^ Ронг, Йи; Аль-Харби, Ахмед; Паркин, Жерар (2012). «Сильно изменяющиеся углы связей Zr – CH2 – Ph в тетрабензилцирконии: анализ режимов координации бензиллиганда». Металлоорганические соединения. 31 (23): 8208–8217. Дои:10.1021 / om300820b.
внешняя ссылка
 Химический портал
Химический портал Котировки, связанные с Бензильная группа в Wikiquote
Котировки, связанные с Бензильная группа в Wikiquote