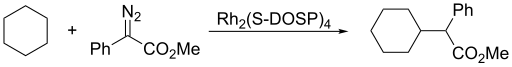Карбен - Carbene

В химия, а карбен это молекула содержащий нейтральный углерод атом с валентность из двух и двух необщих валентные электроны. Общая формула R- (C:) -R 'или R = C: где R представляют заместители или атомы водорода.
Термин «карбен» может также относиться к конкретному соединению H2C:, также называемый метилен, родитель гидрид из которого формально являются производными всех других карбеновых соединений.[1][2] Карбены классифицируются как майки или же тройняшки в зависимости от их электронной структуры. Большинство карбенов очень недолговечны, хотя стойкие карбены [3] известны. Один хорошо изученный карбен - это дихлоркарбен Cl2C:, который может быть сгенерирован на месте из хлороформ и сильный основание.
Структуры и соединения

Два класса карбенов: синглет и триплет карбены. Синглетные карбены связаны спин-парами. На языке теория валентной связи молекула принимает sp2 гибридная структура. Триплетные карбены имеют два неспаренных электрона. Большинство карбенов имеют нелинейное триплетное основное состояние, за исключением тех, которые содержат атомы азота, кислорода или серы, и галогениды, непосредственно связанные с двухвалентным углеродом.
Карбены можно назвать синглетными или триплетными в зависимости от электронного спины они обладают. Триплетные карбены парамагнитный и может наблюдаться спектроскопия электронного парамагнитного резонанса если они сохраняются достаточно долго. Полный спин синглетных карбенов равен нулю, тогда как спин триплетных карбенов равен единице (в единицах ). Углы связи составляют 125–140 ° для триплетного метилена и 102 ° для синглетного метилена (как определено EPR ). Триплетные карбены обычно стабильны в газообразном состоянии, тогда как синглетные карбены чаще встречаются в водных средах.
Для простых углеводородов триплетные карбены обычно имеют энергию 8 ккал /моль (33 кДж / моль) ниже, чем синглетные карбены (см. также Правило максимальной множественности Хунда ), таким образом, в общем случае триплет является более стабильным состоянием ( основное состояние ), а синглет - это возбужденное состояние разновидность. Заместители что может пожертвовать электронные пары может стабилизировать синглетное состояние путем делокализации пары в пустую p-орбиталь. Если энергия синглетного состояния значительно уменьшится, оно фактически станет основным состоянием. Жизнеспособных стратегий для триплетной стабилизации не существует. Карбен называется 9-флуоренилиден было показано, что это быстро уравновешивание смесь синглетных и триплетных состояний с разностью энергий примерно 1,1 ккал / моль (4,6 кДж / моль).[4] Однако остается спорным вопрос о том,арил карбены, такие как флуорен карбены являются настоящими карбенами, потому что электроны могут делокализоваться до такой степени, что они фактически становятся бирадикалы. In silico эксперименты показывают, что триплетные карбены могут быть термодинамически стабилизирован электроположительный гетероатомы, такие как в силил и силилокси карбены, особенно трифторсилилкарбены.[5]
Реактивность

Синглетные и триплетные карбены проявляют дивергентную реакционную способность. Синглетные карбены обычно участвуют в хелетропные реакции как либо электрофилы или же нуклеофилы. Синглетные карбены с незаполненной р-орбиталью должны быть электрофильными. Триплетные карбены можно рассматривать как бирадикалы, и участвуют в ступенчатых радикальных присоединениях. Триплетные карбены должны пройти через средний с двумя неспаренными электронами, тогда как синглетный карбен может реагировать за один согласованный шаг.
Из-за этих двух режимов реакционной способности реакции синглетного метилена являются стереоспецифический тогда как триплетный метилен стереоселективный. Это различие можно использовать для исследования природы карбена. Например, реакция метилена, образующегося из фотолиз из диазометан с СНГ-2-бутен или с транс-2-бутен каждый дает единственный диастереомер 1,2-диметилциклопропанового продукта: СНГ из СНГ и транс из транс, что доказывает, что метилен является синглетом.[6] Если бы метилен был триплетом, можно было бы ожидать, что продукт не будет зависеть от исходной геометрии алкена, а скорее будет почти идентичной смесью в каждом случае.
Реакционная способность конкретного карбена зависит от заместитель группы. На их реактивность могут влиять металлы. Некоторые из реакций, которые могут выполнять карбены: вставки в связи C-H, скелетные перестройки и присоединения к двойным связям. Карбены можно разделить на нуклеофильные, электрофильные или амбифильные. Например, если заместитель может отдавать пару электронов, скорее всего, карбен не будет электрофильным. Алкил карбены вставляются гораздо более избирательно, чем метилен, который не различает первичные, вторичные и третичные связи C-H.
Циклопропанирование

Карбены присоединяются к двойным связям с образованием циклопропаны. Для синглетных карбенов доступен согласованный механизм. Триплетные карбены не удерживают стереохимия в молекуле продукта. Реакции присоединения обычно очень быстрые и экзотермический. В большинстве случаев медленным шагом является образование карбена. Хорошо известным реагентом, используемым для реакций перехода алкена в циклопропан, является Реагент Симмонса-Смита. Этот реагент представляет собой систему медь, цинк, и йод, где активным реагентом считается йодметилцинк йодид. Реагент образует комплекс гидрокси группы такие, что обычно происходит сложение син в такую группу.
C — H вставка
Вставки - еще один распространенный тип карбеновых реакций. Карбен в основном вставляется в существующую связь. Порядок предпочтения обычно следующий: 1. Связи X – H, где X не является углеродом 2. Связь C – H 3. Связь C – C. Вставки могут происходить или не происходить за один шаг.
Внутримолекулярный реакции внедрения представляют новые синтетические решения. Как правило, такие вставки благоприятствуют жестким конструкциям. Когда возможно внутримолекулярное введение, нет межмолекулярный прошивки видны. В гибких структурах образование пятичленного кольца предпочтительнее образования шестичленного кольца. Как внутримолекулярные, так и внутримолекулярные вставки могут быть изменены до асимметричной индукции путем выбора хиральных лигандов на металлических центрах.
 Карбен внутримолекулярная реакция
Карбен внутримолекулярная реакция
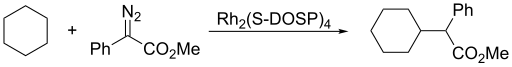 Межмолекулярная реакция карбенов
Межмолекулярная реакция карбенов
Алкилиденкарбены привлекательны тем, что предлагают образование циклопентен фрагменты. Для образования алкилиденкарбена кетон может подвергаться действию триметилсилил диазометан.
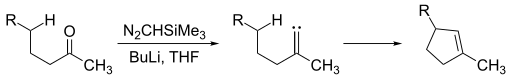 Алкилиден карбен
Алкилиден карбен
Димеризация карбена

Карбены и карбеноид прекурсоры могут пройти димеризация реакции на формирование алкены. Хотя это часто является нежелательной побочной реакцией, ее можно использовать в качестве синтетического инструмента, а прямая димеризация карбена металла была использована в синтезе полиалкинилэтенов.
Стойкие карбены существуют в равновесии со своими соответствующими димерами. Это известно как Равновесие Ванзлика.
Карбеновые лиганды в металлоорганической химии
В металлоорганический виды, комплексы металлов с формулами LпMCRR 'часто описывают как карбеновые комплексы. [7] Однако такие соединения не реагируют как свободные карбены и редко образуются из предшественников карбенов, за исключением стойких карбенов. В карбеновые комплексы переходных металлов могут быть классифицированы по их реакционной способности, причем первые два класса определены наиболее четко:
- Карбены Фишера, в котором карбен связан с металлом, который несет электроноакцепторную группу (обычно карбонил). В таких случаях карбеноидный углерод является умеренно электрофильным.
- Карбены шрока, в котором карбен связан с металлом, который несет электронодонорную группу. В таких случаях карбеноидный углерод является нуклеофильным и напоминает реагент Виттига (который не считается производным карбена).
- Карбеновые радикалы, в котором карбен связан с металлом с открытой оболочкой, причем углерод карбена носит радикальный характер. Карбеновые радикалы имеют черты карбенов Фишера и Шрока, но обычно являются долгоживущими промежуточными продуктами реакции.
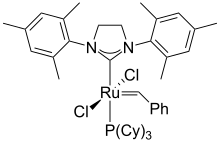
- N-гетероциклические карбены (NHC) [8] получают путем C-депротонирования солей имидазолия или дигидроимидазолия. Они часто развертываются как вспомогательные лиганды в металлоорганическая химия. Такие карбены зрительские лиганды которые обычно являются очень сильными донорами сигма, часто сравнивая их с фосфинами.[9][10] Сами лиганды, особенно когда они изолированы от металла, иногда называют Ардуенго или же Ванзлик карбены.
Генерация карбенов
- Метод, широко применимый к органическому синтезу, - это индуцированное удаление галогениды из гем-дигалогенидов с использованием литийорганические реагенты. Остается неясным, образуются ли в этих условиях свободные карбены или комплекс металл-карбен. Тем не менее эти металлокарбены (или карбеноиды) дают ожидаемые органические продукты.
- р2CBr2 + BuLi → R2CLi (Br) + BuBr
- р2CLi (Br) → R2C + LiBr
- Для циклопропанирования цинк используется в Реакция Симмонса – Смита. В специализированном, но показательном случае соединения альфа-галогенртути можно выделить и отдельно подвергнуть термолизу. Например, «Реагент Сейферта» высвобождает CCl.2 при нагревании.
- C6ЧАС5HgCCl3 → CCl2 + C6ЧАС5HgCl
- Чаще всего карбены образуются из диазоалканы, через фотолитический, термический или переходный металл катализированные маршруты. Катализаторы обычно имеют родий и медь. В Реакция Бэмфорда-Стивенса дает карбены в апротонные растворители и ионы карбения в протонных растворителях.
- Выведение HX из галоформ (CHX3) под условия фазового перехода.
- Фотолиз из диазирины и эпоксиды также могут быть использованы. Диазирины - это циклические формы диазоалканов. Напряжение маленького кольца делает фотовозбуждение легко. Фотолиз эпоксидов дает карбонил соединения в качестве побочных продуктов. С асимметричный эпоксидов потенциально могут образовываться два разных карбонильных соединения. Природа заместителей обычно способствует образованию одного заместителя по сравнению с другим. Одна из связей C-O будет иметь более сильный характер двойной связи и, следовательно, будет прочнее и с меньшей вероятностью разорвется. Можно нарисовать резонансные структуры, чтобы определить, какая часть будет больше способствовать образованию карбонила. Когда один заместитель алкил и другой арил, арилзамещенный углерод обычно выделяется в виде карбенового фрагмента.
- Карбены являются промежуточными продуктами в Перестановка Вольфа
Применение карбенов
Карбены широко применяются в промышленном производстве тетрафторэтилен, предшественник Тефлон. Тетрафторэтилен образуется через посредство дифторкарбен:[11]
- CHClF2 → CF2 + HCl
- 2 CF2 → F2C = CF2
Встраивание карбенов в связи C – H широко используется, например в функционализация полимерных материалов[12] и электроотверждение клеи.[13] Приложения[требуется разъяснение ] полагаться на синтетический 3-арил-3-трифторметилдиазирины,[14][15] предшественник карбена, который может быть активирован при нагревании,[16] свет,[15][16] или же Напряжение.[17][13]
История
Карбены были впервые постулированы Эдуард Бюхнер в 1903 г. в циклопропанирование исследования этилдиазоацетат с толуолом.[18] В 1912 г. Герман Штаудингер [19] также превращал алкены в циклопропаны с диазометан и CH2 как промежуточное звено. Деринг в 1954 г. продемонстрировал дихлоркарбен синтетическая полезность.[20]
Смотрите также
- Карбеновые комплексы переходных металлов
- Атомарный углерод один атом углерода с химической формулой: C:, по сути, двукратный карбен. Также использовался для получения «настоящих карбенов» на месте.
- Карбены в фольге получают свою стабильность от близости двойной связи (то есть их способности образовывать сопряженные системы).
- Аналоги карбенов и карбеноиды
- Ионы карбения, протонированные карбены
- Полимеризация метатезиса с раскрытием цикла
Рекомендации
- ^ Хоффманн, Роальд (2005). Молекулярные орбитали комплексов переходных металлов.. Оксфорд. п. 7. ISBN 978-0-19-853093-0.
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "карбены ". Дои:10.1351 / goldbook.C00806
- ^ Подробные обзоры стабильных карбенов см .: (а) Bourissou, D .; Guerret, O .; Gabbai, F. P .; Бертран, Г. (2000). «Стабильные карбены». Chem. Ред. 100: 39–91. Дои:10.1021 / cr940472u. (б) Melaimi, M .; Soleilhavoup, M .; Бертран, Г. (2010). Энгью. Chem. Int. Эд. 49: 8810–8849. Отсутствует или пусто
| название =(помощь) - ^ Grasse, P. B .; Brauer, B.E .; Zupancic, J. J .; Кауфманн, К. Дж .; Шустер, Г. Б. (1983). «Химические и физические свойства флуоренилидена: уравновешивание синглетных и триплетных карбенов». Журнал Американского химического общества. 105 (23): 6833. Дои:10.1021 / ja00361a014.
- ^ Немировский, А; Шрайнер П. Р. (ноябрь 2007 г.). «Электронная стабилизация основных триплетных карбенов». J. Org. Chem. 72 (25): 9533–9540. Дои:10.1021 / jo701615x. PMID 17994760.
- ^ Скелл, П. С .; Вудворт, Р. К. (1956). «Структура карбена, Ch2». Журнал Американского химического общества. 78 (17): 4496. Дои:10.1021 / ja01598a087.
- ^ Краткое руководство по применению карбеновых лигандов, помимо диаминокарбенов, см. Мунц, Д. (2018). «Выталкивание электронов - какой карбеновый лиганд для какого приложения?». Металлоорганические соединения. 37: 275–289. Дои:10.1021 / acs.organomet.7b00720.
- ^ Для общего обзора с акцентом на применениях с диаминокарбенами см .: Hopkinson, M.N .; Richter, C .; Schedler, M .; Глориус, Ф. (2014). «Обзор N-гетероциклических карбенов». Природа. 510: 485–496. Bibcode:2014Натура.510..485H. Дои:10.1038 / природа13384. PMID 24965649.
- ^ С. П. Нолан "N-Гетероциклические карбены в синтезе" 2006, Wiley-VCH, Weinheim. Распечатать ISBN 9783527314003. В сети ISBN 9783527609451. Дои:10.1002/9783527609451
- ^ Marion, N .; Diez-Gonzalez, S .; Нолан, С. П. (2007). «N-гетероциклические карбены как органокатализаторы». Энгью. Chem. Int. Эд. 46: 2988–3000. Дои:10.1002 / anie.200603380.
- ^ Байзер, В. X. (2004). «Соединения фтора, органические». Энциклопедия химической технологии Кирка-Отмера. Джон Вили и сыновья. Дои:10.1002 / 0471238961.0914201802011026.a01.pub2. ISBN 978-0471238966.
- ^ Ян, Пэн; Ян, Вантай (2013-07-10). «Поверхностное хемоселективное фототрансформация связей C – H на органических полимерных материалах и связанных с ними высокотехнологичных приложениях». Химические обзоры. 113 (7): 5547–5594. Дои:10.1021 / cr300246p. ISSN 0009-2665. PMID 23614481.
- ^ а б Пинг, Цзяньфэн; Гао, Фэн; Чен, Цзянь Линь; Вебстер, Ричард Д .; Стил, Терри В. Дж. (18 августа 2015 г.). «Отверждение клея посредством низковольтной активации». Nature Communications. 6: 8050. Bibcode:2015НатКо ... 6.8050P. Дои:10.1038 / ncomms9050. ISSN 2041-1723. ЧВК 4557340. PMID 26282730.
- ^ Накашима, Хироюки; Хашимото, Макото; Садакане, Ютака; Томохиро, Такенори; Хатанака, Ясумару (01.11.2006). «Простой и универсальный метод мечения фенилдиазириновых фотофоров». Журнал Американского химического общества. 128 (47): 15092–15093. Дои:10.1021 / ja066479y. ISSN 0002-7863. PMID 17117852.
- ^ а б Бленкоу, Антон; Хейс, Уэйн (2005-08-05). «Разработка и применение диазиринов в биологических и синтетических макромолекулярных системах». Мягкая материя. 1 (3): 178. Bibcode:2005Смат .... 1..178Б. Дои:10.1039 / b501989c. ISSN 1744-6848.
- ^ а б Лю, Майкл Т. Х. (1 января 1982 г.). «Термолиз и фотолиз диазиринов». Обзоры химического общества. 11 (2): 127. Дои:10.1039 / cs9821100127. ISSN 1460-4744.
- ^ Элсон, Клайв М .; Лю, Майкл Т. Х. (1 января 1982 г.). «Электрохимическое поведение диазиринов». Журнал химического общества, химические коммуникации (7): 415. Дои:10.1039 / c39820000415. ISSN 0022-4936.
- ^ Buchner, E .; Фельдманн, Л. (1903). "Диазоэссигестер и толуол". Berichte der Deutschen Chemischen Gesellschaft. 36 (3): 3509. Дои:10.1002 / cber.190303603139.
- ^ Staudinger, H .; Купфер, О. (1912). "Über Reaktionen des Methylens. III. Диазометан" (PDF). Berichte der Deutschen Chemischen Gesellschaft. 45: 501–509. Дои:10.1002 / cber.19120450174.
- ^ Фон Э. Деринг, В .; Хоффманн, А. К. (1954). «Добавление дихлоркарбена к олефинам». Журнал Американского химического общества. 76 (23): 6162. Дои:10.1021 / ja01652a087.
внешняя ссылка
 СМИ, связанные с Карбены в Wikimedia Commons
СМИ, связанные с Карбены в Wikimedia Commons