Нитрен - Nitrene

В химия, а нитрен или же имя (R – N) - это азот аналог карбен. Атом азота не заряжен и однозначный,[1] так что всего 6 электроны на уровне своей валентности - два ковалентно связанный и четыре несвязанных электрона. Поэтому считается электрофил из-за неудовлетворенный октет. Нитрен - это реактивный промежуточный продукт и участвует во многих химические реакции.[2][3] Простейший нитрен HN называется имидоген, и этот термин иногда используется как синоним класса нитрена.[4]
Электронная конфигурация
В простейшем случае линейная молекула N – H (имидоген) имеет атом азота sp гибридизированный, с двумя из четырех несвязанных электронов в качестве одинокая пара на космической орбите, а два других занимают выродиться пара p орбитали. В электронная конфигурация согласуется с Правило Хунда: низкоэнергетическая форма - это триплет с одним электроном на каждой из p-орбиталей, а высокоэнергетической формой является синглет с электронной парой, заполняющей одну p-орбиталь, а другую p-орбиталь вакантной.
Как и в случае с карбенами, существует сильная корреляция между плотность вращения на атом азота, который можно вычислить in silico и параметр расщепления нулевого поля D который может быть получен экспериментально из электронный спиновой резонанс.[5] Мелкие нитрены, такие как NH или CF3N имеют значения D около 1,8 см.−1 со спиновыми плотностями, близкими к максимальному значению 2. На нижнем конце шкалы находятся молекулы с низким D (<0,4) значения и спиновая плотность от 1,2 до 1,4, такие как 9-антрилнитрен и 9-фенантрилнитрен.
Формирование
Поскольку нитрены настолько реактивны, они не изолированы. Вместо этого они образуются как реакционноспособные промежуточные продукты во время реакции. Есть два распространенных способа получения нитренов:
- Из азиды к термолиз или же фотолиз, с изгнанием азот газ. Этот метод аналогичен формированию карбены из диазосоединения.
- Из изоцианаты, с изгнанием монооксид углерода. Этот метод аналогичен образованию карбенов из кетены.
Реакции
Нитреновые реакции включают:
- Вставка нитрена C – H. Нитрен легко превращается в углерод до водорода. Ковалентная связь с получением амина или амида. Синглетный нитрен реагирует с сохранение конфигурации. В одном исследовании[6] нитрен, образованный окислением карбамат с персульфат калия, дает реакция вставки в палладий к азотной связи продукта реакции ацетат палладия (II) с 2-фенилпиридин метить N- (2-пиридилфенил) карбамат в каскадная реакция:
- Предполагается, что в этой вставке C – H с участием оксим, уксусный ангидрид ведущий к изоиндол:[7]
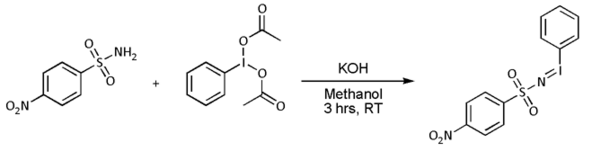
- Циклоприсоединение нитрена. С алкены, нитрены реагируют с образованием азиридины, очень часто с нитреноид предшественники, такие как нозил- или тозилзамещенные [N- (фенилсульфонил) имино] фенилиодинан (PhI = NNs или PhI = NT соответственно)), но известно, что реакция работает непосредственно с сульфонамид в присутствии переходный металл основан катализатор Такие как медь, палладий, или же золото:[8][9][10][11][12]
- Однако в большинстве случаев [N-(п-нитрофенилсульфонил) имино] фенилиодинан (PhI = NNs) получают отдельно следующим образом:
- Перенос нитрена происходит следующим образом:
- В этой конкретной реакции оба СНГ -стильбен иллюстрированный и транс форма (не изображена) приводит к тому же транс-азиридиновый продукт, предполагающий двухступенчатую механизм реакции. Разница в энергии между триплетными и синглетными нитренами в некоторых случаях может быть очень небольшой, что позволяет взаимопревращение при комнатной температуре. Триплетные нитрены термодинамически более стабильны, но реагируют ступенчато, позволяя свободное вращение и, таким образом, создавая смесь стереохимии.[13]
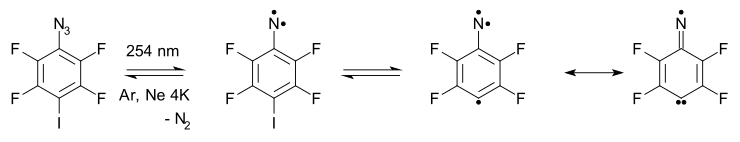
- Расширение и сжатие арилнитренового кольца: Арилнитрены расширяют цикл до 7-членного кольца. кумулены, реакции раскрытия цикла и многократное образование нитрила в сложных реакционных путях. Например азид 2 на схеме ниже[5] в ловушке аргон матрица при 20 К при фотолизе азот выталкивается в триплетный нитрен 4 (наблюдается экспериментально с СОЭ и ультрафиолетовая и видимая спектроскопия ), который находится в равновесии с произведением расширения кольца 6.
- В конечном итоге нитрен превращается в кольцо с открытым кольцом. нитрил 5 сквозь бирадикал средний 7. В высокотемпературной реакции FVT при 500–600 ° C также дает нитрил 5 с доходностью 65%.[14]
Нитрен радикалы
Для нескольких соединений, содержащих как нитреновую группу, так и свободный радикал группы зафиксирован высокоспиновый квартет ЭПР (матрица, криогенные температуры). Один из них имеет оксид амина радикальная группа включена,[15] другая система имеет радикальную группу углерода.[16]
(4 К означает -452,2 ° по Фаренгейту, что равно 4 Кельвинам)
В этой системе один из неспаренных электронов азота делокализован в ароматическом кольце, превращая соединение в трирадикал σ – σ – π. А карбен азотный радикал (имидильный радикал) резонансная структура вносит вклад в общую электронную картину.
В 2019 году Бетли и Ланкастер выделили аутентичный триплетный нитрен, стабилизированный путем координации с медным центром в объемном лиганде.[17]
Рекомендации
- ^ ИЮПАК, Сборник химической терминологии 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "нитрены ". Дои:10.1351 / goldbook.N04145
- ^ Lwowski, W., ed. (1970). Нитрены. Нью-Йорк: Interscience.
- ^ Вентруп, К. (1984). Реактивные промежуточные продукты. Нью-Йорк: Вили.
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "имидогены ". Дои:10.1351 / goldbook.I02951
- ^ а б Кваскофф, Дэвид; Беднарек, Павел; Джордж, Лиза; Waich, Kerstin; Вентруп, Курт (2006). «Нитрены, бирадикалы и илиды. Расширение цикла и раскрытие цикла в 2-хиназолилнитренах». J. Org. Chem. 71 (11): 4049–4058. Дои:10.1021 / jo052541i. PMID 16709043.
- ^ Чт, Хунг-Ят; Ю, Вин-Ю; Че, Чи-Мин (2006). «Межмолекулярное амидирование неактивированных зр.2 и зр3 C – H-связи посредством катализируемого палладием каскадной активации C – H / введения нитрена ». Варенье. Chem. Soc. 128 (28): 9048–9049. Дои:10.1021 / ja062856v. PMID 16834374.
- ^ Savarin, Cécile G .; Гризе, Кристиана; Мерри, Джерри А .; Reamer, Robert A .; Хьюз, Дэвид Л. (2007). «Новая внутримолекулярная реакционная способность оксимов: синтез циклических и спиро-конденсированных иминов». Орг. Lett. 9 (6): 981–983. Дои:10.1021 / ol0630043. PMID 17319674.
- ^ Ли, Зиганг; Дин, Сянъюй; Он, Чуан (2006). «Реакции переноса нитрена, катализируемые комплексами золота». J. Org. Chem. 71 (16): 5876–5880. Дои:10.1021 / jo060016t.
- ^ Эванс, Дэвид А .; Фол, Маргарет М .; Билодо, Марк Т. (1994). "Разработка реакции азиридирования олефинов, катализируемой медью". Варенье. Chem. Soc. 116 (7): 2742–2753. Дои:10.1021 / ja00086a007.
- ^ Брандт, Питер; Содергрен, Микаэль Дж .; Андерссон, Pher G .; Норрби, Пер-Ола (2000). "Механистические исследования азиридинирования алкенов, катализируемого медью". Варенье. Chem. Soc. 122 (33): 8013–8020. Дои:10.1021 / ja993246g.
- ^ Watson, Iain D.G .; Ю, Лили; Юди, Андрей К. (2006). «Достижения в реакциях переноса азота с участием азиридинов». Соотв. Chem. Res. 39 (3): 194–206. Дои:10.1021 / ar050038m. PMID 16548508.
- ^ Реагенты СНГ-стильбен или же транс-стильбен, предшественник нитрена п-нитросульфонамид или нозиламин который окисляется йодозобензолдиацетат. Золотой катализатор основан на терпиридин трезубец лиганд.
- ^ Юдин, Андрей К., изд. (2007). Азиридины и эпоксиды в органическом синтезе. п. 120. ISBN 978-3-527-31213-9.
- ^ В хиназолин готовится из соответствующего бромида и азид натрия. Азид находится в равновесии с тетразол 3.
- ^ Lahti, Paul M .; Эсат, Бурак; Ляо, И; Сервински, Пол; Лан, Цзян; Уолтон, Ричард (30 мая 2001 г.). «Гетероспиновые органические молекулы: нитрен-радикальные связи». Многогранник. 20 (11–14): 1647–1652. Дои:10.1016 / S0277-5387 (01) 00667-2.
- ^ Сандер, Вольфрам; Гроте, Дирк; Коссманн, Симона; Низ, Франк (2008). "2,3,5,6-Тетрафторфенилнитрен-4-ил: электронная парамагнитная резонансная спектроскопическая характеристика квартета нитренрадикала в основном состоянии". Варенье. Chem. Soc. 130 (13): 4396–4403. Дои:10.1021 / ja078171s. PMID 18327939.
- ^ Carsch, K. M .; DiMucci, I.M .; Iovan, D.A .; Ли, А .; Zheng, S.-L .; Titus, C.J .; Ли, С. Дж .; Ирвин, К. Д .; Nordlund, D .; Ланкастер, К. М .; Бетли, Т.А. (2019). «Синтез триплетно-нитренового комплекса на медной основе, подходящего для аминирования, катализируемого медью». Наука. 365 (6458): 1138–1143. Дои:10.1126 / science.aax4423. ЧВК 7256962. PMID 31515388.CS1 maint: несколько имен: список авторов (связь)