Орбитальная гибридизация - Википедия - Orbital hybridisation
В химия, орбитальная гибридизация (или же гибридизация) - понятие смешения атомные орбитали в новый гибридные орбитали (с разными энергиями, формами и т. д., чем составляющие атомные орбитали), подходящие для спаривания электронов с образованием химические связи в теория валентной связи. Например, в атоме углерода, который образует четыре одинарные связи, s-орбиталь валентной оболочки объединяется с тремя p-орбиталями валентной оболочки с образованием четырех эквивалентных sp.3 смеси, которые расположены в четырехгранный расположение вокруг углерода для связи с четырьмя разными атомами. Гибридные орбитали полезны для объяснения молекулярная геометрия и свойства атомной связи и симметрично расположены в пространстве. Обычно гибридные орбитали образуются путем смешивания атомных орбиталей сравнимых энергий.[1]
История и использование
Химик Линус Полинг впервые разработал теорию гибридизации в 1931 году, чтобы объяснить структуру простых молекулы Такие как метан (CH4) с помощью атомные орбитали.[2] Полинг указал, что атом углерода образует четыре связи, используя одну s и три p-орбитали, так что «можно сделать вывод», что атом углерода будет образовывать три связи под прямым углом (используя p-орбитали) и четвертую более слабую связь, используя орбитали в произвольном направлении. На самом деле у метана четыре связи С-Н эквивалентной прочности. Угол между любыми двумя связями равен тетраэдрический валентный угол 109 ° 28 ' [3] (прибл. 109,5 °). Полинг предположил, что в присутствии четырех атомов водорода s- и p-орбитали образуют четыре эквивалентные комбинации, которые он назвал гибридный орбитали. Каждый гибрид обозначается sp3 для обозначения его состава и направлен вдоль одной из четырех связей C-H.[4] Эта концепция была разработана для таких простых химических систем, но позже этот подход стал применяться более широко, и сегодня он считается эффективным. эвристический для рационализации структуры органические соединения. Это дает простую орбитальную картину, эквивалентную Структуры Льюиса.
Теория гибридизации является неотъемлемой частью органическая химия, один из самых ярких примеров - Правила Болдуина. Для рисования механизмов реакции иногда требуется классическая связующая картина с двумя атомами, разделяющими два электрона.[5] Теория гибридизации объясняет связывание алкенов[6] и метан.[7] Количество p-символа или s-символа, которое определяется в основном орбитальной гибридизацией, может использоваться для надежного прогнозирования молекулярных свойств, таких как кислотность или основность.[8]
Обзор
Орбитали - это модельное представление поведения электронов внутри молекул. В случае простой гибридизации это приближение основано на атомные орбитали, аналогично полученным для атома водорода, единственного нейтрального атома, для которого Уравнение Шредингера можно решить точно. В более тяжелых атомах, таких как углерод, азот и кислород, в качестве атомных орбиталей используются 2s и 2p орбитали, аналогичные орбиталям в возбужденном состоянии для водорода.
Предполагается, что гибридные орбитали представляют собой смесь атомных орбиталей, наложенных друг на друга в различных пропорциях. Например, в метан, гибридная орбиталь C, которая образует каждую углерод –водород Связка состоит из символов 25% s и символов 75% p и поэтому описывается как sp3 (читать как с-п-три) гибридизированный. Квантовая механика описывает этот гибрид как sp3 волновая функция вида N (s + √3pσ), где N - константа нормализации (здесь 1/2), а pσ - это p-орбиталь, направленная вдоль оси C-H, чтобы сформировать сигма-облигация. Отношение коэффициентов (в общем обозначается λ) равно √3 в этом примере. Поскольку электронная плотность связанный с орбиталью, пропорционален квадрату волновой функции, отношение p-символа к s-символу равно λ2 = 3. Символ p или вес компонента p равен N2λ2 = 3/4.
Типы гибридизации
зр3

Гибридизация описывает связывание атомов с точки зрения атома. Для тетраэдрически координированного углерода (например, метан CH4), углерод должен иметь 4 орбитали с правильной симметрией, чтобы связываться с 4 атомами водорода.
Углерода основное состояние конфигурация 1 с2 2 с2 2p2 или более легко прочитать:
| C | ↑↓ | ↑↓ | ↑ | ↑ | |
| 1 с | 2 с | 2p | 2p | 2p |
Атом углерода может использовать свои две однократно занятые орбитали p-типа, чтобы образовать две ковалентные связи с двумя атомами водорода, давая синглет метилен CH2, простейший карбен. Атом углерода может также связываться с четырьмя атомами водорода посредством возбуждения (или продвижения) электрона с дважды занятой 2s-орбитали на пустую 2p-орбиталь, создавая четыре однократно занятые орбитали.
| C * | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1 с | 2 с | 2p | 2p | 2p |
Энергия, выделяемая при образовании двух дополнительных связей, более чем компенсирует требуемую энергию возбуждения, энергетически благоприятствуя образованию четырех связей C-H.
Квантово-механически самая низкая энергия получается, если четыре связи эквивалентны, что требует, чтобы они образовывались из эквивалентных орбиталей на углероде. Можно получить набор из четырех эквивалентных орбиталей, которые являются линейными комбинациями волновых функций валентной оболочки (основные орбитали почти никогда не участвуют в связывании) s- и p-волновых функций,[9] которые четыре зр3 гибриды.
| C * | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1 с | зр3 | зр3 | зр3 | зр3 |
Дюйм4, четыре сп3 гибридные орбитали перекрываются водород 1s орбитали, давая четыре σ (сигма) связи (то есть четыре одинарные ковалентные связи) одинаковой длины и прочности.
 переводится в
переводится в 
зр2


Аналогичным образом можно объяснить другие соединения углерода и другие молекулы. Например, этен (C2ЧАС4) имеет двойную связь между атомами углерода.
Для этой молекулы углерод sp2 гибридизируется, потому что один π (пи) связь требуется для двойная связь между атомами углерода и только три σ-связи образуются на атом углерода. В sp2 гибридизация 2s-орбиталь смешана только с двумя из трех доступных 2p-орбиталей, обычно обозначаемых 2pИкс и 2pу. Третий 2p орбитальный (2pz) остается негибридным.
| C * | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1 с | зр2 | зр2 | зр2 | 2p |
формируя в общей сложности три sp2 орбитали с одной оставшейся p-орбиталью. В этилене (этен ) два атома углерода образуют σ-связь, перекрывая одну sp2 орбиталь от каждого атома углерода. Π-связь между атомами углерода, перпендикулярными плоскости молекулы, образована перекрытием 2p – 2p. Каждый атом углерода образует ковалентные связи C – H с двумя атомами водорода по s – sp2 перекрытие, все с углами связи 120 °. Связи водород – углерод имеют одинаковую силу и длину, что согласуется с экспериментальными данными.
зр

Химическая связь в таких соединениях, как алкины с тройные облигации объясняется зр гибридизацией. В этой модели 2s-орбиталь смешана только с одной из трех p-орбиталей,
| C * | ↑↓ | ↑ | ↑ | ↑ | ↑ |
| 1 с | зр | зр | 2p | 2p |
что дает две sp-орбитали и две оставшиеся p-орбитали. Химическая связь в ацетилен (этин) (C2ЧАС2) состоит из sp – sp перекрытия двух атомов углерода, образующих σ-связь, и двух дополнительных π связи образовано p – p перекрытием. Каждый углерод также связывается с водородом в виде перекрытия σ s – sp под углом 180 °.
Гибридизация и форма молекулы

Гибридизация помогает объяснить форма молекулы, поскольку углы между связями примерно равны углам между гибридными орбиталями. Это в отличие от теория отталкивания пар электронов валентной оболочки (VSEPR), который может быть использован для предсказания молекулярной геометрии на основе эмпирических правил, а не на основе валентных связей или орбитальных теорий.[10]
зрИкс гибридизация
Поскольку валентные орбитали элементы основной группы - одна s- и три p-орбитали с соответствующими Правило октета, spИкс гибридизация используется для моделирования формы этих молекул.
| Координационный номер | Форма | Гибридизация | Примеры |
|---|---|---|---|
| 2 | Линейный | sp гибридизация (180 °) | CO2 |
| 3 | Тригональный планарный | зр2 гибридизация (120 °) | BCl3 |
| 4 | Тетраэдр | зр3 гибридизация (109,5 °) | CCl4 |
| Межглазничные углы[11] | |||
зрИксdу гибридизация
Поскольку валентные орбитали переходные металлы пять d, одна s и три p орбитали с соответствующими 18-электронное правило, spИксdу гибридизация используется для моделирования формы этих молекул. Эти молекулы имеют тенденцию иметь несколько форм, соответствующих одной и той же гибридизации из-за различных задействованных d-орбиталей. Квадратный плоский комплекс имеет одну незанятую p-орбиталь и, следовательно, 16 валентных электронов.[12]
| Координационный номер | Форма | Гибридизация | Примеры |
|---|---|---|---|
| 4 | Квадратный плоский | зр2г гибридизация | PtCl42− |
| 5 | Тригональный бипирамидный | зр3г гибридизация | Fe (CO)5 |
| Квадрат пирамидальный | MnCl52− | ||
| 6 | Восьмигранный | зр3d2 гибридизация | Пн (CO)6 |
| 7 | Пятиугольный бипирамидальный | зр3d3 гибридизация | ZrF73− |
| Крытый восьмигранный | Минфин7− | ||
| Крышка тригонально-призматическая | TaF72− | ||
| 8 | Квадратный антипризматический | зр3d4 гибридизация | ReF8− |
| Додекаэдр | Пн (CN)84− | ||
| Двуглавый треугольный призматический | ZrF84− | ||
| 9 | Трехгранный треугольный призматический | зр3d5 гибридизация | ReH92− |
| Квадратный антипризматический колпачок |
SDИкс гибридизация
В определенных переходный металл комплексы с низким d количество электронов, p-орбитали не заняты и sdИкс гибридизация используется для моделирования формы этих молекул.[11][13][12]
| Координационный номер | Форма | Гибридизация | Примеры |
|---|---|---|---|
| 3 | Тригонально-пирамидальный | SD2 гибридизация (90 °) | CrO3 |
| 4 | Тетраэдр | SD3 гибридизация (70,5 °, 109,5 °) | TiCl4 |
| 5 | Квадрат пирамидальный | SD4 гибридизация (65,9 °, 114,1 °) | Ta (CH3)5 |
| 6 | C3в Тригонально-призматический | SD5 гибридизация (63,4 °, 116,6 °) | W (CH3)6 |
| Межглазничные углы[11] | |||
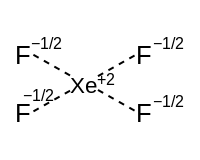
Гибридизация гипервалентных молекул
Расширение октета
В некоторых учебниках по общей химии гибридизация представлена для координационного числа основной группы 5 и выше с использованием схемы «расширенных октетов» с d-орбиталями, впервые предложенной Полингом. Однако в настоящее время такая схема считается некорректной в свете расчетов компьютерной химии.
| Координационный номер | Форма | Гибридизация | Примеры |
|---|---|---|---|
| 5 | Тригональный бипирамидный | зр3г гибридизация | ПФ5 |
| 6 | Восьмигранный | зр3d2 гибридизация | SF6 |
| 7 | Пятиугольный бипирамидальный | зр3d3 гибридизация | ЕСЛИ7 |
В 1990 году Эрик Альфред Магнуссон из Университет Нового Южного Уэльса опубликовал статью, окончательно исключающую роль d-орбитальной гибридизации в связывании в гипервалентных соединениях второго ряда (период 3 ) элементы, положив конец спору и неразберихе. Отчасти путаница происходит из-за того, что d-функции важны в базисных наборах, используемых для описания этих соединений (или иначе возникают необоснованно высокие энергии и искаженная геометрия). Также велик вклад d-функции в волновую функцию молекулы. Эти факты были неправильно истолкованы как означающие, что d-орбитали должны участвовать в связывании.[14][15]
Резонанс
В свете вычислительная химия, лучше было бы вызвать сигма-облигация резонанс в дополнение к гибридизации, что означает, что каждая резонансная структура имеет свою собственную схему гибридизации. Все резонансные конструкции должны подчиняться Правило октета.[16]
| Координационный номер | Резонансные структуры |
|---|---|
| 5 | Тригональный бипирамидный |
 | |
| 6 | Восьмигранный |
 | |
| 7 | Пятиугольный бипирамидальный |
 |
Изовалентная гибридизация
Хотя идеальные гибридные орбитали могут быть полезны, в действительности для большинства связей требуются орбитали промежуточного характера. Это требует расширения для включения гибких весов атомных орбиталей каждого типа (s, p, d) и позволяет количественно описать образование связи, когда молекулярная геометрия отклоняется от идеальных валентных углов. Количество p-символа не ограничивается целыми значениями; т.е. гибридизации типа sp2.5 также легко описываются.
Гибридизация связующих орбиталей определяется Правило Бента: «Атомный характер концентрируется в орбиталях, направленных к электроположительным заместителям».
Молекулы с неподеленными парами
Для молекул с неподеленными парами связывающие орбитали изовалентны spИкс гибриды. Например, две образующие связь гибридные орбитали кислорода в воде можно описать как sp4.0 чтобы получить межглазничный угол 104,5 °.[17] Это означает, что они имеют символ 20% s и символ 80% p и нет подразумевают, что гибридная орбиталь образована из одной s и четырех p-орбиталей на кислороде, поскольку 2p подоболочка кислорода содержит только три p-орбитали. Формы молекул с неподеленными парами следующие:
- Тригонально-пирамидальный
- Три гибрида с изовалентной связью (> 90 °)
- Например, NH3
- Согнутый
- Два гибрида с изовалентной связью (> 90 °)
- Например, SO2, H2О
В таких случаях есть два математически эквивалентных способа представления одиночных пар. Они могут быть представлены орбиталями сигма- и пи-симметрии, подобными теории молекулярных орбиталей, или эквивалентными орбиталями, подобными теории VSEPR.
Гипервалентные молекулы
Для гипервалентных молекул с неподеленными парами схему связывания можно разделить на гипервалентный компонент и компонент, состоящий из изовалентных sp.Икс облигационные гибриды. Гипервалентный компонент состоит из резонансных связей с использованием p-орбиталей. В таблице ниже показано, как каждая форма связана с двумя компонентами и их соответствующими описаниями.
| Количество гибридов с изовалентной связью (отмечено красным) | ||||
|---|---|---|---|---|
| Два | Один | – | ||
| Гипервалентный компонент[16] | Линейная ось (одна орбиталь) | Качели | Т-образный | Линейный |
 |  |  | ||
| Плоский квадратный экватор (две p-орбитали) | Квадрат пирамидальный | Квадратный плоский | ||
 |  | |||
| Пентагональный плоский экватор (две p-орбитали) | Пятиугольная пирамидальная | Пятиугольный плоский | ||
 |  | |||
Дефекты гибридизации
Гибридизация s- и p-орбиталей с образованием эффективных spИкс Гибриды требуют, чтобы они имели сопоставимую радиальную протяженность. В то время как 2p-орбитали в среднем менее чем на 10% больше, чем 2s, отчасти из-за отсутствия радиального узла на 2p-орбиталях, 3p-орбитали, которые имеют один радиальный узел, превышают 3s-орбитали на 20–33%.[18] Разница в протяженности s- и p-орбиталей увеличивается вниз по группе. Гибридизацию атомов в химических связях можно проанализировать, рассматривая локализованные молекулярные орбитали, например, используя естественные локализованные молекулярные орбитали в орбиталь естественной связи (NBO) схема. В метан, CH4, расчетное отношение p / s приблизительно равно 3, что соответствует "идеальному" sp3 гибридизация, тогда как для силан, SiH4, отношение p / s ближе к 2. Аналогичная тенденция наблюдается и для других 2p элементов. Замена водорода на фтор еще больше снижает отношение p / s.[19] Элементы 2p демонстрируют почти идеальную гибридизацию с ортогональными гибридными орбиталями. Для более тяжелых блочных элементов p это предположение об ортогональности не может быть оправдано. Эти отклонения от идеальной гибридизации были названы дефектами гибридизации. Kutzelnigg.[20]
Фотоэлектронные спектры
Одно из заблуждений относительно орбитальной гибридизации состоит в том, что она неверно предсказывает ультрафиолетовые фотоэлектронные спектры многих молекул. Хотя это правда, если Теорема Купманса применяется к локализованным гибридам, квантовая механика требует, чтобы волновая функция (в данном случае ионизированная) подчинялась симметрии молекулы, что подразумевает резонанс в теории валентных связей. Например, в метане ионизированные состояния (CH4+) можно построить из четырех резонансных структур, приписывающих вылетевший электрон каждой из четырех sp3 орбитали. Линейная комбинация этих четырех структур с сохранением числа структур приводит к трехкратно вырожденному T2 состояние и A1 государственный.[21][22] Разница в энергии между каждым ионизированным состоянием и основным состоянием будет энергия ионизации, что дает два значения, согласующиеся с экспериментом.
Локализованные против канонических молекулярных орбиталей
Связывающие орбитали, образованные из гибридных атомных орбиталей, можно рассматривать как локализованные молекулярные орбитали, которые могут быть образованы из делокализованных орбиталей теории молекулярных орбиталей путем соответствующего математического преобразования. Для молекул в основном состоянии это преобразование орбиталей оставляет неизменной полную многоэлектронную волновую функцию. Гибридное орбитальное описание основного состояния, следовательно, эквивалент описанию делокализованных орбиталей для полной энергии основного состояния и плотности электронов, а также геометрии молекулы, которая соответствует минимальному значению полной энергии.
Два локализованных представления
Молекулы с множественными связями или множественными неподеленными парами могут иметь орбитали, представленные в терминах сигма- и пи-симметрии или эквивалентных орбиталей. В разных методах валентных связей используется одно из двух представлений, которые математически эквивалентны полному многоэлектронному волновые функции и связаны унитарное преобразование набора занятых молекулярных орбиталей.
Для кратных связей представление сигма-пи является преобладающим по сравнению с эквивалентным орбитальным (гнутая связь ) представление. Напротив, для нескольких одиночных пар в большинстве учебников используется эквивалентное орбитальное представление. Тем не менее, представление сигма-пи также используется, например, Вайнхольдом и Ландисом в контексте орбитали естественных облигаций, теория локализованных орбиталей, содержащая модернизированные аналоги классических (валентная связь / структура Льюиса) пар связей и неподеленных пар.[23] Для молекулы фтороводорода, например, две неподеленные пары F являются по существу негибридизированными p-орбиталями, а другая - spИкс гибрид орбитальный. Аналогичное соображение применимо и к воде (одна неподеленная пара O находится на чистой p-орбитали, другая - на spИкс гибридная орбиталь).
Смотрите также
- Теория кристаллического поля
- Изовалентная гибридизация
- Теория поля лигандов
- Линейная комбинация атомных орбиталей
- Диаграммы МО
Рекомендации
- ^ Housecroft, Catherine E .; Шарп, Алан Г. (2005). Неорганическая химия (2-е изд.). Пирсон Прентис-Хэл. п. 100. ISBN 0130-39913-2.
- ^ Полинг, Л. (1931), «Природа химической связи. Применение результатов, полученных из квантовой механики и теории парамагнитной восприимчивости, к структуре молекул», Журнал Американского химического общества, 53 (4): 1367–1400, Дои:10.1021 / ja01355a027
- ^ Бриттин, У. Э. (1945). «Угол валентности тетраэдрического атома углерода». J. Chem. Educ. 22 (3): 145. Bibcode:1945JChEd..22..145B. Дои:10.1021 / ed022p145.
- ^ Л. Полинг Природа химической связи (3-е изд., Oxford University Press, 1960) с.111–120.
- ^ Клейден, Джонатан; Гривс, Ник; Уоррен, Стюарт; Уотерс, Питер (2001). Органическая химия (1-е изд.). Издательство Оксфордского университета. п. 105. ISBN 978-0-19-850346-0.
- ^ Органическая химия, Третье издание Мэри Энн Фокс Джеймс К. Уайтселл 2003 ISBN 978-0-7637-3586-9
- ^ Органическая химия 3-е изд. 2001 Паула Юрканис Брюс ISBN 978-0-130-17858-9
- ^ «Кислоты и основания». Orgo Made Simple. Получено 23 июн 2015.
- ^ МакМюррей, Дж. (1995). Аннотированное издание для инструкторов по химии (4-е изд.). Прентис Холл. п. 272. ISBN 978-0-131-40221-8
- ^ Гиллеспи, Р.Дж. (2004), «Обучение молекулярной геометрии с помощью модели VSEPR», Журнал химического образования, 81 (3): 298–304, Bibcode:2004JChEd..81..298G, Дои:10.1021 / ed081p298
- ^ а б c Вайнхольд, Франк; Лэндис, Кларк Р. (2005). Валентность и связь: перспектива орбитального донора-акцептора с естественной связью. Кембридж: Издательство Кембриджского университета. С. 367, 374–376, 381–383. ISBN 978-0-521-83128-4.
- ^ а б Байз, Крейг; Холл, Майкл (1999). «Прогнозирование геометрии полигидридных комплексов простых переходных металлов с помощью анализа симметрии». Варенье. Chem. Soc. 121 (6): 1348–1358. Дои:10.1021 / ja981965 +.
- ^ Каупп, Мартин (2001). ""Не-VSEPR "Структуры и соединения в системах d (0)". Angew Chem Int Ed Engl. 40 (1): 3534–3565. Дои:10.1002 / 1521-3773 (20011001) 40:19 <3534 :: AID-ANIE3534> 3.0.CO; 2- #. PMID 11592184.
- ^ Магнуссон, Э. (1990). «Гиперкоординированные молекулы элементов второго ряда: d-функции или d-орбитали?». Варенье. Chem. Soc. 112 (22): 7940–7951. Дои:10.1021 / ja00178a014.
- ^ Дэвид Л. Купер; Терри П. Каннингем; Джозеф Герратт; Петр Борисович Карадаков; Марио Раймонди (1994). «Химическая связь с гиперкоординированными атомами второго ряда: d Орбитальное участие против демократии». Журнал Американского химического общества. 116 (10): 4414–4426. Дои:10.1021 / ja00089a033.
- ^ а б Ричард Д. Харкорт; Томас М. Клапётке (2003). «Повышенная валентность (качественная валентная связь) описания электронных структур фторсодержащих молекул, богатых электронами». Журнал химии фтора. 123 (1): 5–20. Дои:10.1016 / S0022-1139 (03) 00012-5.
- ^ Френкинг, Гернот; Шайк, Сэсон, ред. (2014). «Глава 3: Взгляд NBO на химическую связь». Химическая связь: фундаментальные аспекты химической связи. Джон Вили и сыновья. ISBN 978-3-527-66471-9.
- ^ Каупп, Мартин (2007). «Роль радиальных узлов атомных орбиталей для химической связи и периодической таблицы». Журнал вычислительной химии. 28 (1): 320–325. Дои:10.1002 / jcc.20522. ISSN 0192-8651. PMID 17143872. S2CID 12677737.
- ^ Каупп, Мартин (2014) [1-е. Паб. 2014]. «Глава 1: Химическая связь элементов основной группы». В Frenking, Gernod & Shaik, Sason (ред.). Химическая связь: химическая связь в периодической таблице. Wiley-VCH. ISBN 978-1-234-56789-7.
- ^ Куцельнигг, В. (август 1988 г.). «Ортогональные и неортогональные гибриды». Журнал молекулярной структуры: ТЕОХИМА. 169: 403–419. Дои:10.1016/0166-1280(88)80273-2.
- ^ Андрей М. Токмачев; Андрей Леонидович Чугреев; Мисуркин Игорь Анатольевич (2001). «Потенциалы ионизации в рамках полуэмпирического антисимметричного продукта строго локализованного геминального подхода». Международный журнал квантовой химии. 85 (3): 109–117. Дои:10.1002 / qua.1060.
- ^ Сэйсон С. Шайк; Филипп К. Хиберти (2008). Справочник химика по теории валентной связи. Нью-Джерси: Wiley-Interscience. С. 104–106. ISBN 978-0-470-03735-5.
- ^ Вайнхольд, Франк; Лэндис, Кларк Р. (2012). Открытие химии с помощью естественных связующих орбиталей. Хобокен, штат Нью-Джерси: Wiley. С. 67–68. ISBN 978-1-118-11996-9.


