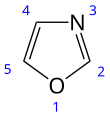
Оксазол - Oxazole
| |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК 1,3-оксазол | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.005.474 | ||
| Номер ЕС |
| ||
| MeSH | D010080 | ||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C3ЧАС3NО | |||
| Молярная масса | 69,06 г / моль | ||
| Плотность | 1.050 г / см3 | ||
| Точка кипения | От 69 до 70 ° C (от 156 до 158 ° F, от 342 до 343 K) | ||
| Кислотность (пKа) | 0,8 (конъюгированной кислоты) [1] | ||
| Страница дополнительных данных | |||
| Показатель преломления (п), Диэлектрическая постоянная (εр), так далее. | |||
Термодинамический данные | Фазовое поведение твердое тело – жидкость – газ | ||
| УФ, ИК, ЯМР, РС | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Оксазол является родительским соединением для обширного класса гетероциклический ароматный органические соединения. Это азолы с кислородом и азотом, разделенными одним углеродом.[2] Оксазолы - это ароматические соединения но в меньшей степени, чем тиазолы. Оксазол - слабое основание; это конъюгированная кислота имеет пKа 0,8, по сравнению с 7 для имидазол.
Подготовка
Классические методы синтеза оксазола в органическая химия находятся
- в Синтез Робинсона-Габриэля дегидратацией 2-ациламинокетонов
- в Синтез оксазола по Фишеру из циангидринов и альдегидов
- в Реакция Бредерека с α-галокетоны и формамид
- в Реакция Ван Лойзена с альдегидами и TosMIC
Другие методы:
- Оксазолины также могут быть получены циклоизомеризацией некоторых пропаргил амиды. В одном исследовании[3] оксазолы были получены с помощью однокамерный синтез состоящий из конденсации пропаргил амин и бензоилхлорид к амид, за которым следует Муфта Соногашира терминала алкин закончить другим эквивалентом бензоилхлорида, и в заключение п-толуолсульфоновая кислота катализированный циклоизомеризация:
- В одном сообщенном синтезе оксазола реагенты представляют собой нитро -замещенный бензоилхлорид и изонитрил:[4][5]
Биосинтез
В биомолекулы, оксазолы возникают в результате циклизации и окисления серин или же треонин нерибосомный пептиды:
 Где X = H, CH
Где X = H, CH
3 для серина и треонина соответственно B = основание.
(1) Ферментативная циклизация. (2) Устранение. (3) [O] = ферментативное окисление.
Оксазолов не так много в биомолекулы как связанный тиазолы с заменой кислорода на атом серы.
Реакции
- Депротонирование оксазолов у C2 часто сопровождается раскрытием цикла до изонитрила.
- Электрофильное ароматическое замещение происходит в C5, требуя активация групп.
- Нуклеофильное ароматическое замещение происходит с уходящими группами в C2.
- Реакции Дильса – Альдера с диенами оксазола может сопровождаться потерей кислорода с образованием пиридины.
- В Корнфортская перестановка 4-ацилоксазолов является термическим реакция перегруппировки с органическим ацильным остатком и заместителем C5, меняющим положения.
- Разные окисление реакции. Одно исследование[6] сообщает об окислении 4,5-дифенилоксазола 3 эквивалентами МОЖЕТ к соответствующему имид и бензойная кислота:
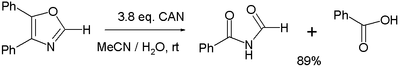
- В сбалансированном полуреакция на каждый эквивалент оксазолина расходуется три эквивалента воды, генерируя 4 протона и 4 электрона (последний получен из CeIV).

Смотрите также
- Изоксазол, аналог с азот атом в позиции 2.
- Имидазол, аналог с кислород заменен азотом.
- Тиазол, аналог с заменой кислорода на серу.
- Бензоксазол, где оксазол конденсирован с другим ароматическим кольцом.
- Пиррол, аналог без атома кислорода.
- Фуран, аналог без атома азота.
- Оксазолин, который имеет одну восстановленную двойную связь.
- Оксазолидин, у которого обе двойные связи восстановлены.
- Оксадиазолы с двумя атомами азота вместо одного (например, фуразан ).
- Оксазолон, аналог с карбонильной группой
Рекомендации
- ^ Золтевич, Дж. А. и Диди, Л. В. Кватернизация гетероароматических соединений. Количественные аспекты. Adv. Гетероцикл. Chem. 22, 71-121 (1978).
- ^ Гетероциклическая химия TL Gilchrist, The Bath press 1985 ISBN 0-582-01421-2
- ^ Новый последовательный трехкомпонентный синтез оксазола с помощью последовательности амидирования-сочетания-циклоизомеризации (ACCI) Ойген Меркул и Томас Дж. Дж. Мюллер Chem. Commun., 2006, 4817 - 4819, Дои:10.1039 / b610839c
- ^ Полностью автоматизированный непрерывный синтез 4,5-дизамещенных оксазолов Маркус Бауман, Ян Р. Баксендейл, Стивен В. Лей, Кристопер Д. Смит и Джеффри К. Транмер Орг. Lett.; 2006; 8 (23), стр. 5231–5234; (Письмо) Дои:10.1021 / ol061975c
- ^ Они вместе реагируют на первой фазе в проточном реакторе непрерывного действия на промежуточный энол а затем во второй фазе в фосфазеновая основа (PS-BEMP) индуцировал циклизацию за счет твердофазный синтез.
- ^ «Нитрат церия-аммония способствует окислению оксазолов», Дэвид А. Эванс, Павел Нагорный и Ришэн Сюй. Орг. Lett.; 2006; 8 (24), стр. 5669–5671; (Письмо) Дои:10.1021 / ol0624530
- ^ Жерар Мойн, Ханс-Петер Хоманн, Роланд Курт, Иоахим Пауст, Вольфганг Хенляйн, Хорст Полинг, Бернд – Юрген Вейманн, Бруно Кеслер (2011). «Витамины, 6. Витамины группы В». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.o27_o09.CS1 maint: использует параметр авторов (связь)