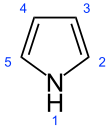
Пиррол - Pyrrole
| |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC 1ЧАС-Пиррол | |||
Другие имена
| |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| 1159 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.003.387 | ||
| Номер ЕС |
| ||
| 1705 | |||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 1992, 1993 | ||
| |||
| |||
| Характеристики | |||
| C4ЧАС5N | |||
| Молярная масса | 67.091 г · моль−1 | ||
| Плотность | 0,967 г см−3 | ||
| Температура плавления | -23 ° С (-9 ° F, 250 К) | ||
| Точка кипения | От 129 до 131 ° C (от 264 до 268 ° F, от 402 до 404 K) | ||
| Давление газа | 7 мм рт. Ст. При 23 ° C | ||
| Кислотность (пKа) | 16,5 (для протона N-H) | ||
| Основность (пKб) | 13,6 (pKa 0,4 для C.A. ) | ||
| -47.6·10−6 см3/ моль | |||
| Вязкость | 0,001225 Па с | ||
| Термохимия | |||
Теплоемкость (C) | 1.903 Дж К−1 моль−1 | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | 108,2 кДж моль−1 (газ) | ||
Станд. Энтальпия горение (ΔcЧАС⦵298) | 2242 кДж моль−1 | ||
| Опасности | |||
| Паспорт безопасности | Данные химической безопасности | ||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 33,33 ° С (91,99 ° F, 306,48 К) | ||
| 550 ° С (1022 ° F, 823 К) | |||
| Пределы взрываемости | 3.1–14.8% | ||
| Родственные соединения | |||
Родственные соединения | Фосфол, стелька, бисмоль, стибола | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Пиррол это гетероциклический ароматный органическое соединение, пятичленное кольцо с формула C4ЧАС4N ЧАС.[2] Это бесцветная летучая жидкость, которая быстро темнеет на воздухе. Замещенные производные также называют пирролами, например, N-метилпиррол, C4ЧАС4NCH3. Порфобилиноген, тризамещенный пиррол, является биосинтетическим предшественником многих природных продуктов, таких как гем.[3]
Пирролы являются компонентами более сложных макроциклов, в том числе порфириногены и продукты, полученные из них, в том числе порфирины из гем, то хлорины, бактериохлорины и хлорофиллы.[4]
Характеристики
Пиррол - бесцветный летучий жидкость, которая легко темнеет при контакте с воздухом и обычно очищается дистилляция непосредственно перед использованием.[5] Пиррол имеет ореховый запах. Пиррол - 5-членный ароматный гетероцикл, как фуран и тиофен. В отличие от фурана и тиофена, он имеет диполь, положительный конец которого находится на стороне гетероатома, с дипольным моментом 1,58D. В CDCl3, он имеет химические сдвиги 6,68 (H2, H5) и 6,22 (H3, H4). Пиррол слабоосновный, с сопряженной кислотой pKа −3,8. Самый термодинамически стабильный катион пирроля (C4ЧАС6N+) образуется протонированием в положении 2. Замена пиррола алкильными заместителями дает более основную молекулу - например, тетраметилпиррол имеет сопряженную кислоту pKа +3,7. Пиррол также является слабокислым в положении N – H с pKа из 16.5. Как кислота Льюиса, связывающая водородные связи, она классифицируется как твердая кислота и Модель ECW перечисляет свои кислотные параметры как EА = 1,38 и CА = 0.68.
История
Пиррол был впервые обнаружен Ф. Ф. Рунге в 1834 г., как составная часть каменноугольная смола.[6] В 1857 году он был выделен из костного пиролизата. Его название происходит от греческого пирр (πυρρός, «Красноватый, огненный»), по реакции, использованной для его обнаружения - красный цвет, который он придает дереву при увлажнении соляная кислота.[7]
Встречаемость в природе

Сам по себе пиррол не встречается в природе, но многие его производные встречаются во множестве кофакторы и натуральные продукты. Обычные природные молекулы, содержащие пирролы, включают: витамин B12, желчные пигменты, такие как билирубин и биливердин, а порфирины из гем, хлорофилл, хлорины, бактериохлорины, и порфириногены.[4] Прочие пирролсодержащие вторичные метаболиты включают PQQ, макалувамин M, рианодин, rhazinilam, ламелларин, продигиозин, мирмикарин и скептрин. Синтезы пирролсодержащего гемина, синтезированного Ганс Фишер был признан Нобелевской премией.
Пиррол входит в состав табачного дыма и может способствовать его токсическому воздействию.[8]
Синтез
Пиррол получают промышленным способом путем обработки фуран с аммиак в присутствии твердой кислоты катализаторы, любить SiO2 и Al2О3.[7]

Пиррол также может быть образован каталитическим дегидрированием пирролидина.
Лабораторные маршруты
Описано несколько синтезов пиррольного кольца.[9]
Синтез пиррола по Ганцу
Синтез пиррола по Ганче представляет собой реакцию β-кетоэфиров (1) с аммиаком (или первичными аминами) и α-галогенкетонами (2) дать замещенные пирролы (3).[10][11]

Синтез пиррола Knorr
Синтез пиррола Knorr включает реакцию α-аминокетона или α-амино-β-кетоэфира с активированным метиленовым соединением.[12][13][14] Метод включает реакцию α-амино-кетон (1) и соединение, содержащее метиленовая группа α к (связан со следующим углеродом) a карбонильная группа (2).[15]

Синтез пиррола Пааля – Кнорра.
В синтезе пиррола Паала-Кнорра 1,4-дикарбонильное соединение реагирует с аммиаком или первичным амином с образованием замещенного пиррола.[16][17]

Реакция Ван Лойзена
Реакция Ван Лойзена может быть использована для образования пирролов путем реакции тозилметилизоцианид (TosMIC) с Enone при наличии базы, в Майкл дополнение. А 5-эндо затем циклизация образует 5-членное кольцо, которое реагирует с удалением тозильной группы. Последний шаг - таутомеризация до пиррола.[нужна цитата ]
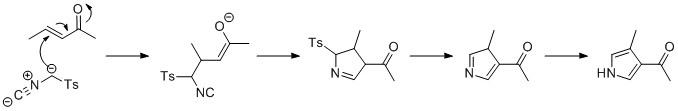
Синтез Бартона – Зарда
Синтез Бартона – Зарда протекает аналогично синтезу Ван Лойзена. Изоцианоацетат реагирует с нитроалкеном в реакции 1,4-присоединения, за которым следует 5-эндо-копать землю циклизация, устранение нитрогруппа, и таутомеризация.[18]

Синтез пиррола Пилоти – Робинсона
Исходные материалы в синтезе пиррола Пилоти – Робинсона, названные в честь Гертруда и Роберт Робинсон и Оскар Пилоти, являются двумя эквивалентами альдегид и гидразин.[19][20] Продукт представляет собой пиррол с заместителями в положениях 3 и 4. Альдегид реагирует с диамином с образованием промежуточного ди-я добываю (R – C = N – N = C – R). На втором этапе [3,3] -сигматропная перестройка происходит между. Добавление соляная кислота приводит к замыканию кольца и потере аммиак с образованием пиррола. В механизм был разработан Робинсонами.
В одной модификации, пропионовый альдегид лечится сначала с гидразин а затем с бензоилхлорид при высоких температурах и с помощью микроволновое облучение:[21]
![Реакция Пилоти – Робинсона [21]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/bd/Piloty-Robinson_reaction.png/400px-Piloty-Robinson_reaction.png)
Маршруты на основе циклоприсоединения
Пирролы, содержащие несколько заместителей, получают по реакции münchnones и алкины. Механизм реакции включает 1,3-диполярное циклоприсоединение с последующей потерей углекислый газ ретро-Дильс – Альдер процесс. Подобные реакции можно проводить с использованием азалактонов.

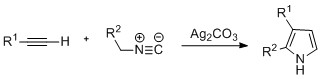
Пирролы можно получить серебро -катализируемая циклизация алкинов с изонитрилы, где R2 электроноакцепторная группа, а R1 представляет собой алкан, арильную группу или сложный эфир. Также было замечено, что примеры дизамещенных алкинов образуют желаемый пиррол со значительным выходом. Предполагается, что реакция протекает через серебряный ацетилид промежуточный. Этот метод аналогичен азид-алкиновый щелкните по химии используется для образования азолов.
Другие методы
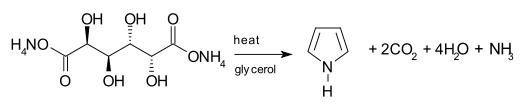
Один из синтетических путей получения пиррола включает декарбоксилирование из слизистый аммоний, аммониевая соль слизевая кислота. Соль обычно нагревают в дистилляция установка с глицерин как растворитель.[22]
Биосинтез пирролов
Биосинтез пиррольных колец de novo начинается с аминолевулиновая кислота (ALA), который синтезируется из глицин и сукцинил-КоА. Дегидратаза ALA катализирует конденсацию двух молекул ALA через Кнорровского типа кольцевой синтез с образованием порфобилиноген (ПБГ). Позже это реагирует на образование, например, макроциклов. гем и хлорофилл.[23]
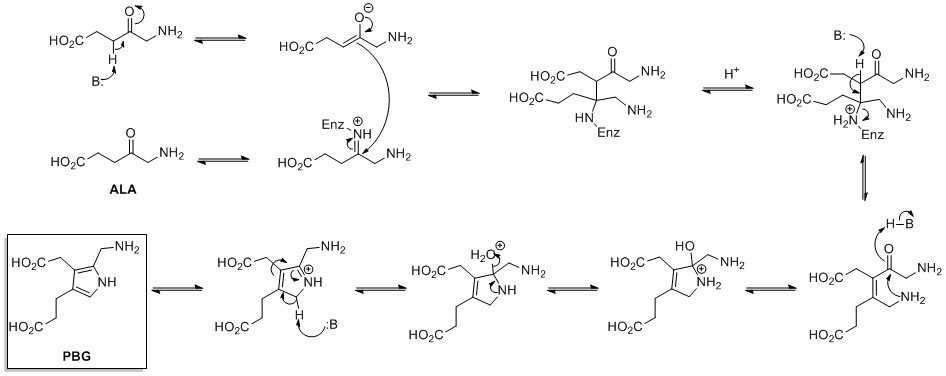
.
Пролин является биосинтетически полученный из аминокислоты L-глутамат. Глутамат-5-полуальдегид сначала сформирован глутамат-5-киназа (АТФ-зависимый) и глутамат-5-полуальдегиддегидрогеназа (который требует НАДН или НАДФН). Затем он может либо спонтанно циклизоваться с образованием 1-пирролин-5-карбоновая кислота, который восстанавливается до пролина пирролин-5-карбоксилатредуктаза (используя НАДН или НАДФН), или превратился в орнитин к орнитинаминотрансфераза с последующей циклизацией орнитинциклодезаминаза с образованием пролина.[24]

Пролин может использоваться как предшественник ароматических пирролов во вторичных природных продуктах, например, в продигиозинах.

Биосинтез продигиозина[25][26] включает конвергентное связывание трех колец пиррольного типа (обозначенных A, B и C на рисунке 1) из L-пролина, L-серина, L-метионина, пирувата и 2-октенала.
Кольцо A синтезируется из L-пролина через путь нерибосомальной пептид-синтазы (NRPS) (рисунок 2), где пирролидиновое кольцо пролина окисляется дважды через FAD + с образованием пиррольного кольца A.
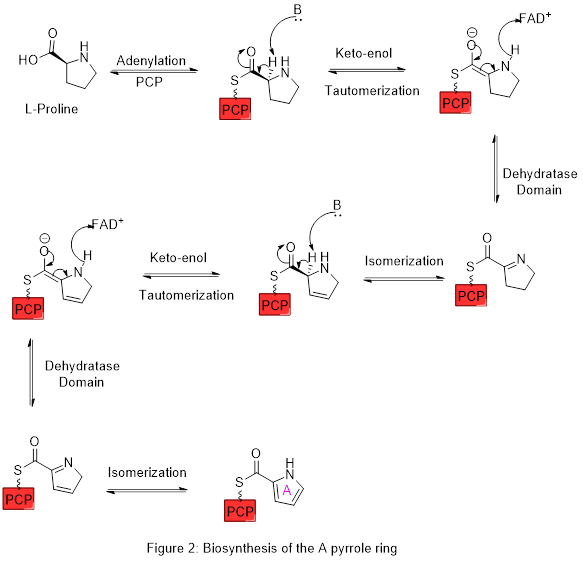
Затем кольцо A расширяется по пути поликетидсинтазы, чтобы включить L-серин в кольцо B (рис. 3). Фрагмент кольца А переносится с пептидильного белка-носителя (PCP) на ацильный белок-носитель (ACP) с помощью домена KS с последующим переносом на малонил-ACP посредством декарбоксилатной конденсации Клайзена. Затем этот фрагмент способен реагировать с замаскированным карбанионом, образованным в результате PLP-опосредованного декарбоксилирования L-серина, который циклизуется в реакции дегидратации с образованием второго пиррольного кольца. Затем этот промежуточный продукт модифицируют метилированием (которое включает метильную группу из L-метионина на спирт в положении 6) и окислением первичного спирта до альдегида с получением ядерных кольцевых структур A-B.

Реакции и реактивность
Из-за своего ароматический характер, пиррол трудно гидрогенизировать, нелегко реагировать как диен в Дильс – Альдер реакции, и не подвергается обычным олефин реакции. Его реакционная способность аналогична реакционной способности бензол и анилин в том смысле, что его легко алкилировать и ацилировать. В кислых условиях пирролы полимеризовать легко, и поэтому многие электрофильный реагенты, которые используются в химии бензола, не применимы к пирролам. Напротив, замещенные пирролы (включая защищенный пирролы) были использованы в широком диапазоне превращений.[9]
Реакция пиррола с электрофилами
Пирролы обычно реагируют с электрофилами в α-положении (C2 или C5) из-за наивысшей степени стабильности протонированного промежуточного соединения.

Пирролы легко реагируют с нитрование (например. HNO3 /Ac2О ), сульфирование (Py · SO3 ), и галогенирование (например. NCS, NBS, Br2, ТАК2Cl2, и KI /ЧАС2О2 ) агенты. Галогенирование обычно дает полигалогенированные пирролы, но можно проводить моногалогенирование. Как типично для электрофильных добавок к пирролам, галогенирование обычно происходит в положении 2, но также может происходить в положении 3 за счет силирования азота. Это полезный метод для дальнейшей функционализации, как правило, менее реактивного 3-положения.[нужна цитата ]
Ацилирование
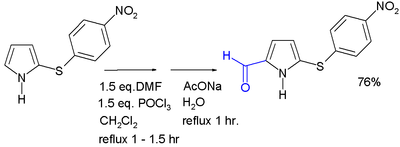
Ацилирование обычно происходит во 2-м положении за счет использования различных методов. Ацилирование с ангидриды кислот и хлорангидриды может происходить без катализатора; в качестве альтернативы Кислота Льюиса может быть использовано. 2-Ацилпирролы также получают в результате реакции с нитрилами Реакция Губена – Хёша. Пирролальдегиды могут быть образованы Реакция Вильсмайера – Хаака. N-Ацилирование простого пиррола не происходит.[нужна цитата ]
Алкилирование
Электрофильное алкилирование простого пиррола встречается редко. Было замечено алкилирование с образованием енонов по C2.[нужна цитата ]
Реакция депротонированного пиррола
Протон NH в пирролах умеренно кислый с пKа из 16,5. Пиррол может быть депротонирован сильными основаниями, такими как бутиллитий и гидрид натрия. Полученный щелочной пирролид представляет собой нуклеофильный. Обработка этой конъюгированной основы электрофилом, например йодметан дает N-метилпиррол. N-Металлический пиррол может реагировать с электрофилами в положениях N или C, в зависимости от координирующего металла. Больше ионных связей азот-металл (например, с Li, Na и K) и большее количество сольватирующих растворителей приводят к N-алкилирование. Нитрофильные металлы, такие как MgX, приводят к алкилированию по C (в основном C2) из-за более высокой степени координации с атомом азота. В случаях N-замещенные пирролы, металлирование атомов углерода более легкое. Алкильные группы могут быть введены в виде электрофилов или путем реакций кросс-сочетания.[нужна цитата ]
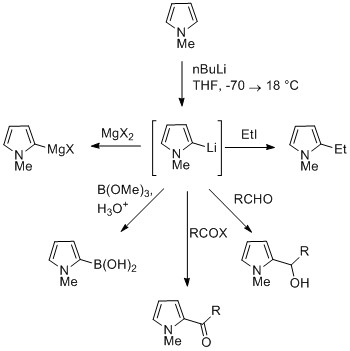
Замена в C3 может быть достигнута за счет использования N-замещенный 3-бромпиррол, который может быть синтезирован бромированием N-силилпиррол с NBS.[нужна цитата ]
Скидки
Пирролы могут снижаться до пирролидины и чтобы пирролины. Например, Сокращение березы сложных эфиров пиррола и амидов образуют пирролины, региоселективность которых зависит от положения электроноакцепторной группы.[нужна цитата ]
Реакции циклизации
Пирролов с N-замена может пройти циклоприсоединение такие реакции, как [4 + 2] -, [2 + 2] - и [2 + 1] -циклизации. Циклизация Дильса-Альдера может происходить с пирролом, действующим как диен, особенно в присутствии электроноакцепторной группы на азоте. Винилпирролы также могут действовать как диены.[нужна цитата ]
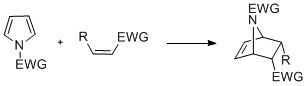
Пирролы могут реагировать с карбены, такие как дихлоркарбен, в [2 + 1] -циклоприсоединении. С участием дихлоркарбен образуется промежуточный дихлорциклопропан, который распадается с образованием 3-хлорпиридин (перегруппировка Чамикана – Денштедта).[27][28][29]
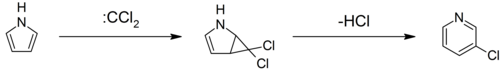
Коммерческое использование
Полипиррол имеет некоторую коммерческую ценность. N-Метилпиррол является предшественником N-метилпирролкарбоновая кислота, строительный блок в фармацевтической химии.[7] Пирролы также содержатся в нескольких лекарствах, в том числе аторвастатин, кеторолак, и сунитиниб. Пирролы используются как светостойкие красный, алый и карминный пигменты.[30][31]
Аналоги и производные
Структурные аналоги пиррола включают:
- Пирролин, частично насыщенный аналог с одной двойной связью
- Пирролидин, насыщенный гидрированный аналог
Производные пиррола включают: индол, производная с слитой бензол звенеть.
Смотрите также
Рекомендации
- ^ Уильям М. Хейнс (2016). CRC Справочник по химии и физике (97-е изд.). Бока-Ратон: CRC Press. С. 3–478. ISBN 978-1-4987-5429-3.
- ^ Лаудон, Марк Г. (2002). «Химия нафталина и ароматических гетероциклов». Органическая химия (4-е изд.). Нью-Йорк: Издательство Оксфордского университета. С. 1135–1136. ISBN 978-0-19-511999-2.
- ^ Кокс, Майкл; Lehninger, Albert L .; Нельсон, Дэвид Р. (2000). Принципы биохимии Ленингера. Нью-Йорк: Worth Publishers. ISBN 978-1-57259-153-0.
- ^ а б Юселиус, Йонас; Сандхольм, Дейдж (2000). «Ароматические пути порфинов, хлоринов и бактериохлоринов» (PDF). Phys. Chem. Chem. Phys. 2 (10): 2145–2151. Дои:10.1039 / b000260g.

- ^ Armarego, Wilfred L.F .; Чай, Кристина Л. Л. (2003). Очистка лабораторных химикатов (5-е изд.). Эльзевир. п. 346.
- ^ Рунге, Ф. Ф. (1834). "Ueber einige Produkte der Steinkohlendestillation" [О некоторых продуктах перегонки угля]. Annalen der Physik und Chemie. 31: 65–78.
 См. Особенно страницы 67–68, где Рунге называет соединение Пиррол (масло для огня) или Ротель (красное масло).
См. Особенно страницы 67–68, где Рунге называет соединение Пиррол (масло для огня) или Ротель (красное масло). - ^ а б c Харреус, Альбрехт Людвиг. «Пиррол». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a22_453.
- ^ Фаулз, Джефферсон; Бейтс, Майкл; Ноитон, Доминик (март 2000 г.). "Химические составляющие сигарет и сигаретного дыма: приоритеты снижения вреда" (PDF). Порируа, Новая Зеландия: Министерство здравоохранения Новой Зеландии. стр. 20, 49–65. Получено 2012-09-23.
- ^ а б Lubell, W .; Saint-Cyr, D .; Dufour-Gallant, J .; Hopewell, R .; Boutard, N .; Kassem, T .; Dörr, A .; Зелли, Р. (2013). "1ЧАС-Pyrroles (Обновление 2013) ". Наука синтеза. 2013 (1): 157–388.
- ^ Hantzsch, A. (1890). "Neue Bildungsweise von Pyrrolderivaten" [Новые методы образования производных пиррола]. Berichte der Deutschen Chemischen Gesellschaft. 23: 1474–1476. Дои:10.1002 / cber.189002301243.

- ^ Файст, Франц (1902). "Studien in der Furan- und Pyrrol-Gruppe" [Исследования фурановой и пиррольной групп]. Berichte der Deutschen Chemischen Gesellschaft. 35 (2): 1537–1544. Дои:10.1002 / cber.19020350263.

- ^ Кнорр, Людвиг (1884). "Synthese von Pyrrolderivaten" [Синтез производных пиррола]. Berichte der Deutschen Chemischen Gesellschaft. 17 (2): 1635–1642. Дои:10.1002 / cber.18840170220.

- ^ Кнорр, Л. (1886). "Synthetische Versuche mit dem Acetessigester" [Эксперименты по синтезу [этилового] эфира ацетоуксусной кислоты]. Annalen der Chemie. 236 (3): 290–332. Дои:10.1002 / jlac.18862360303.

- ^ Knorr, L .; Ланге, Х. (1902). "Ueber die Bildung von Pyrrolderivaten aus Isonitrosoketonen" [Об образовании производных пиррола из изонитроскетонов]. Berichte der Deutschen Chemischen Gesellschaft. 35 (3): 2998–3008. Дои:10.1002 / cber.19020350392.

- ^ Корвин, Алсоф Генри (1950). «Глава 6: Химия пиррола и его производных». В Elderfield, Роберт Кули (ред.). Гетероциклические соединения. 1. Нью-Йорк, штат Нью-Йорк: Wiley. п. 287.
- ^ Паал, К. (1884), "Ueber die Derivate des Acetophenonacetessigesters und des Acetonylacetessigesters", Berichte der Deutschen Chemischen Gesellschaft, 17 (2): 2756–2767, Дои:10.1002 / cber.188401702228

- ^ Кнорр, Людвиг (1884), "Synthese von Furfuranderivaten aus dem Diacetbernsteinsäureester" [Синтез производных фурана из [диэтилового] эфира 2,3-диацетилянтарной кислоты], Berichte der Deutschen Chemischen Gesellschaft, 17 (2): 2863–2870, Дои:10.1002 / cber.188401702254

- ^ Ли, Джи Джек (2013). Гетероциклическая химия в открытии лекарств. Нью-Йорк: Вили. ISBN 9781118354421.
- ^ Пилоты, Оскар (1910). "Synthese von Pyrrolderivaten: Pyrrole aus Succinylobernsteinsäureester, Pyrrole aus Azinen" [Синтез производных пиррола: пиррол из диэтилсукцинилсукцината, пиррол из азинов]. Berichte der Deutschen Chemischen Gesellschaft. 43 (1): 489–498. Дои:10.1002 / cber.19100430182.

- ^ Робинсон, Гертруда Мод; Робинсон, Роберт (1918). «LIV. - Новый синтез тетрафенилпиррола». J. Chem. Soc. 113: 639–645. Дои:10.1039 / CT9181300639.
- ^ а б Милграм, Бенджамин С .; Эскилдсен, Катрин; Рихтер, Стивен М .; Scheidt, W. Robert; Шайдт, Карл А. (2007). "Пилотный синтез Робинсона с помощью микроволнового излучения 3,4-дизамещенных пирролов" (Примечание). J. Org. Chem. 72 (10): 3941–3944. Дои:10.1021 / jo070389 +. ЧВК 1939979. PMID 17432915.
- ^ Фогель (1956). Практическая органическая химия (PDF). п. 837.
- ^ Уолш, Кристофер Т .; Гарно-Цодикова, Сильви; Ховард-Джонс, Анналейз Р. (2006). «Биологическое образование пирролов: логика природы и ферментативный механизм». Отчеты о натуральных продуктах. 23 (4): 517. Дои:10.1039 / b605245m.
- ^ Lehninger, Albert L .; Нельсон, Дэвид Л .; Кокс, Майкл М. (2000). Принципы биохимии (3-е изд.). Нью-Йорк: У. Х. Фриман. ISBN 1-57259-153-6..
- ^ Walsh, C.T .; Гарно-Цодикова, С .; Ховард-Джонс, А. Р. (2006). «Биологическое образование пирролов: логика природы и ферментативный механизм». Nat. Prod. Представитель. 23: 517–531. Дои:10.1039 / b605245m.
- ^ Ху, Деннис X. (2016). «Структура, химический синтез и биосинтез натуральных продуктов продигинина». Химические обзоры. 116: 7818–7853. Дои:10.1021 / acs.chemrev.6b00024. ЧВК 5555159. PMID 27314508.
- ^ Ciamician, G.L .; Деннштедт, М. (1881). "Ueber die Einwirkung des Chloroforms auf die Kaliumverbindung Pyrrols" [О реакции хлороформа с калиевым соединением пиррола]. Berichte der Deutschen Chemischen Gesellschaft. 14: 1153–1162. Дои:10.1002 / cber.188101401240.
- ^ Корвин, Алсоф Генри (1950). Элдерфилд, Роберт Кули (ред.). Гетероциклические соединения. 1. Нью-Йорк, штат Нью-Йорк: Wiley. п. 309.
- ^ Мошер, Х.С. (1950). Элдерфилд, Роберт Кули (ред.). Гетероциклические соединения. 1. Нью-Йорк, штат Нью-Йорк: Wiley. п. 475.
- ^ «Пигменты DPP, пигменты дикетопирролопиррола, оптовый торговец пигментами DPP, поставщики пигментов дикетопирролопиррола». dyes-pigments.standardcon.com.
- ^ Каур, Матиндер; Чхве, Дон Хун (2015). «Дикетопирролопиррол: флуоресцентные зонды на основе красителя с блестящим красным пигментом и их применение». Обзоры химического общества. 44: 58–77. Дои:10.1039 / C4CS00248B.
дальнейшее чтение
- Джонс, Р. Джонс, изд. (1990). Пиррол. Часть I. Синтез и физико-химические аспекты пиррольного кольца.. Recueil des Travaux Chimiques des Pays-Bas. Химия гетероциклических соединений. 48. Чичестер: Джон Уайли и сыновья. п. 351. Дои:10.1002 / recl.19911100712. ISBN 978-0-471-62753-1.
- Жоликер, Бенуа; Chapman, Erin E .; Томпсон, Элисон; Любелл, Уильям Д. (2006). «Пиррольная защита». Тетраэдр. 62 (50): 11531–11563. Дои:10.1016 / j.tet.2006.08.071.