Волатильность (химия) - Википедия - Volatility (chemistry)

В химии, непостоянство это качество материала, которое описывает, насколько легко вещество испаряется. При данной температуре и давлении вещество с высокой летучестью с большей вероятностью существует в виде пара, а вещество с низкой летучестью с большей вероятностью будет жидким или твердым. Летучесть также может описывать тенденцию пара конденсироваться в жидкость или твердое тело; менее летучие вещества легче конденсируются из пара, чем легколетучие.[1] Различия в летучести можно наблюдать, сравнивая скорость испарения группы веществ (или возгонки в случае твердых веществ) при воздействии атмосферы. Легколетучие вещества, например медицинский спирт (изопропиловый спирт ) будет быстро испаряться, в то время как вещества с низкой летучестью, такие как растительное масло останется сжатым.[2] В целом твердые вещества гораздо менее летучие, чем жидкости, но есть некоторые исключения. Твердые тела, которые возвышенный (переход прямо из твердого состояния в пар), например, сухой лед (твердый углекислый газ ) или же йод при стандартных условиях может испаряться с такой же скоростью, что и некоторые жидкости.[3]
Описание
Сама по себе летучесть не имеет определенного числового значения, но часто описывается с помощью давления пара или точек кипения (для жидкостей). Высокое давление паров указывает на высокую летучесть, в то время как высокие температуры кипения указывают на низкую летучесть. Давление паров и точки кипения часто представлены в таблицах и диаграммах, которые можно использовать для сравнения интересующих химических веществ. Данные о волатильности обычно получают экспериментальным путем в широком диапазоне температур и давлений.
Давление газа
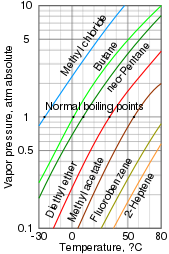
Давление газа является мерой того, насколько легко конденсированная фаза образует пар при данной температуре. Вещество, заключенное в герметичный сосуд, изначально находящееся под вакуумом (без воздуха внутри), быстро заполнит любое пустое пространство паром. После того, как система достигает равновесия и больше не образуется пара, это давление пара можно измерить. Повышение температуры увеличивает количество образующегося пара и, следовательно, давление пара. В смеси каждое вещество вносит вклад в общее давление паров смеси, при этом более летучие соединения вносят больший вклад.
Точка кипения
Точка кипения - это температура, при которой давление пара жидкости равно окружающему давлению, в результате чего жидкость быстро испаряется или закипает. Это тесно связано с давлением пара, но зависит от давления. Нормальная точка кипения - это точка кипения при атмосферном давлении, но она также может указываться при более высоком или более низком давлении.[3]
Способствующие факторы
Межмолекулярные силы

Важным фактором, влияющим на летучесть вещества, является сила взаимодействия между его молекулами. Силы притяжения между молекулами - это то, что удерживает материалы вместе, а материалы с более прочным межмолекулярные силы, такие как большинство твердых веществ, обычно не очень летучие. Этиловый спирт и диметиловый эфир, два химических вещества с одинаковой формулой (C2ЧАС6O), имеют разную летучесть из-за различных взаимодействий, которые происходят между их молекулами в жидкой фазе: молекулы этанола способны к водородная связь а молекулы диметилового эфира - нет.[4] Результатом является более сильная сила притяжения между молекулами этанола, что делает его менее летучим веществом из двух.
Молекулярный вес
В целом волатильность имеет тенденцию к снижению с увеличением молекулярная масса, хотя другие факторы, такие как структура и полярность, играют значительную роль. Влияние молекулярной массы можно частично изолировать, сравнивая химические вещества схожей структуры (например, сложные эфиры, алканы и т. Д.). Например, линейный алканы демонстрируют снижение летучести по мере увеличения количества атомов углерода в цепи.
Приложения
Дистилляция

Информация о летучести часто бывает полезной при отделении компонентов от смеси. Когда смесь конденсированных веществ содержит несколько веществ с разными уровнями летучести, ее температурой и давлением можно управлять так, чтобы более летучие компоненты превращались в пар, в то время как менее летучие вещества оставались в жидкой или твердой фазе. Затем вновь образовавшийся пар можно выбросить или сконденсировать в отдельном контейнере. Когда пары собираются, этот процесс известен как дистилляция.[5]
Процесс переработка нефти использует технику, известную как фракционная перегонка, что позволяет разделить несколько химикатов с разной летучестью за одну операцию. Сырая нефть поступление на нефтеперерабатывающий завод состоит из многих полезных химикатов, которые необходимо отделить. Сырая нефть поступает в дистилляционную колонну и нагревается, что позволяет более летучим компонентам, таким как бутан и керосин испариться. Эти пары поднимаются по башне и, в конечном итоге, контактируют с холодными поверхностями, что приводит к их конденсации и накоплению. Наиболее летучие химические вещества конденсируются в верхней части колонны, а наименее летучие химические вещества для испарения конденсируются в самой нижней части.[1] Справа - изображение, иллюстрирующее дизайн дистилляционная башня.
Разница в летучести между водой и этанолом традиционно использовалась при уточнении употребление алкоголя. Для увеличения концентрации этиловый спирт в продукте производители спирта нагревают исходную спиртовую смесь до температуры, при которой большая часть этанола испаряется, а большая часть воды остается жидкой. Затем пары этанола собираются и конденсируются в отдельном контейнере, в результате чего получается гораздо более концентрированный продукт.[6]
Духи
Волатильность - важный фактор при создании духи. Люди обнаруживают запахи когда ароматические пары контактировать с рецепторами в носу. Ингредиенты, которые быстро испаряются после нанесения, будут выделять ароматные пары на короткое время, прежде чем масло испарится. Медленно испаряющиеся ингредиенты могут оставаться на коже в течение недель или даже месяцев, но могут не выделять достаточно паров для получения сильного аромата. Чтобы предотвратить эти проблемы, дизайнеры парфюмерии тщательно учитывают летучесть эфирных масел и других ингредиентов в своих ароматах. Соответствующие скорости испарения достигаются путем изменения количества используемых легколетучих и нелетучих ингредиентов.[7]
Смотрите также
- Соотношение Клаузиуса – Клапейрона
- Дистилляция
- Фракционная перегонка
- Частичное давление
- Закон Рауля
- Относительная волатильность
- Парожидкостное равновесие
- Летучие органические соединения
Рекомендации
- ^ а б Фелдер, Ричард (2015). Элементарные принципы химических процессов. Джон Вили и сыновья. С. 279–281. ISBN 978-1-119-17764-7.
- ^ Корецкий, Мило Д. (2013). Инженерная и химическая термодинамика. Джон Вили и сыновья. С. 639–641.
- ^ а б Зумдал, Стивен С. (2007). Химия. Хоутон Миффлин. стр.460 -466. ISBN 978-0-618-52844-8.
- ^ Аткинс, Питер (2013). Химические принципы. Нью-Йорк: W.H. Фримен и компания. С. 368–369. ISBN 978-1-319-07903-1.
- ^ Армарего, Уилфред Л. Ф. (2009). Очистка лабораторных химикатов. Эльзевир. стр.9 -12. ISBN 978-1-85617-567-8.
- ^ Кваален, Эрик. «Дистилляция алкоголя: основные принципы, оборудование, взаимосвязь производительности и безопасности». Purdue.
- ^ Продай, Чарльз (2006). Химия ароматов. Великобритания: Королевское химическое общество. стр.200 -202. ISBN 978-0-85404-824-3.

